Milan Sikirica
e-Kemija 2
Digitalni udžbenik za znatiželjne
učenike
2. razreda srednjih škola
Predgovor
Prošlo je više od godinu dana od kad nas je zahvatila pošast u obliku korona virusa, COVID-19. Jedna jedina čestica, skup molekula, na granici živog i mrtvog, prisilila nas je na promjenu svih uobičajenih navika, pa tako i na rad od kuće i školu na daljinu. Velika je vjerojatnost da ćemo morati nastaviti živjeti zajedno s ovim virusom koji stalno evoluira. Stoga i škole, nastavni programi, metode, oblici rada i sadržaji đačke torbe moraju evoluirati. Evolucija je zakon.
Unatoč svemu, školska je godina 2020./21. uspješno završila. Nedostajalo je samo „druženje u živo“ koje se ničim ne može zamijeniti. Pokazalo se da učenici srednjih škola i viših razreda osnovne škole „teoretske“ nastavne sadržaje mogu bez teškoća svladati uz „on line“ pomoć koju su dobivali od nastavnika. Preostao je samo problem praktičnog rada i stjecanja vještina. Stoga ograničeno vrijeme koje će uz koronu učenici provoditi u školama treba iskoristiti za rad u radionicama i laboratorijima. Uz nastavu na daljinu, digitalizirane udžbenike i druge digitalizirane nastavne materijale, suvremena škola ne treba “razrede” u kojima će učenici sjediti “u potiljak” a nastavnici docirati. Suvremena škola treba laboratorije, radionice, sportske dvorane ali i sportske terene, gdje će učenici znanja, vještine i sposobnosti stjecati vlastitom aktivnošću. Ne smijemo zaboraviti da izvođenjem kemijskih pokusa učenici stječu znanje, razvijaju vještine te uče promatrati i donositi zaključke na temelju rezultata vlastitih opažanja ili mjerenja. To je kao u sportu. Jedno je gledati braću Sinković
, a nešto sasvim drugo sjesti u čamac i veslati. Tomu u prilog ide i Odluka o donošenju kurikuluma za nastavni predmet Kemije za osnovne škole i gimnazije u Republici Hrvatskoj u kojoj se kaže:"Učenje i poučavanje Kemije temelji se na znanstveno-istraživačkom pristupu u čijoj je osnovi pokus. Učenički pokus omogućuje da učenik do spoznaja dolazi aktivnim metodama učenja i pritom svoje sposobnosti razvija praktičnim, perceptivnim i misaonim djelovanjem. Pokusi koji se izvode u pravilu su jednostavni i ne zahtijevaju rijetke ili skupe kemikalije, što učiteljima daje veliku slobodu u odabiru pokusa, kao i kemikalija potrebnih za njihovo izvođenje. Isti pokus može služiti kao polazište za ostvarivanje više različitih odgojno-obrazovnih ishoda. U izvedbi pokusa treba obratiti pozornost na razvijanje sposobnosti opažanja i njihove prezentacije, čime se razvijaju vještine potrebne u svim prirodnim znanostima, ali i jezične kompetencije.
Budući da do svih spoznaja nije moguće doći pokusima, učenike u istraživanju treba uputiti i na druge izvore znanja (internet, stručna literatura, enciklopedije i sl.), te ih poticati na kritičko procjenjivanje informacija."
Ovaj se udžbenik temelji na upravo spomenutim načelima. Gdje god je bilo potrebno ili moguće, navedeni su pokusi koje učenici mogu samostalno izvoditi, ali im to treba i omogućiti. Nadalje, ovaj digitalni udžbenik sadržava velik broj poveznica prema internetskim sadržajima kojima se može odmah pristupiti. To je velika prednost u odnosu na tiskani udžbenik. Učeniku je prepušteno na volju. Može se zadovoljiti onim što piše u digitalnom udžbeniku, ali u svakom trenutku može posegnuti za sadržajima navedenim pod "doznajte više". Digitalnim udžbenicima ne treba sječa šuma i zagađenje voda proizvodnjom papira i boja. Neke novine i mnogi znanstveni časopisi danas su dostupni samo u digitalnom obliku. Digitalnim udžbenicima čuva se okoliš i olakšavaju đačke torbe.
U Zagrebu, ljeto 2021.
Autor
1. SMJESE
Većina tvari koje nalazimo u prirodi, koristimo u tehnologiji, laboratoriju ili svakodnevnom životu jesu smjese. To su mješavine dva ili više sastojaka. Treba razlikovati kemijski spoj i smjesu. Kemijski spoj ima stalan sastav pa stoga i stalna fizička i kemijska svojstva. Smjesa ima promjenjiv kemijski sastav. Svaki sastojak smjese zadržava svoja fizička i kemijska svojstva. Smjese se mogu fizičkim metodama rastaviti na sastojke: sedimentacijom, centrifugiranjem, filtriranjem, destilacijom, sublimacijom, kristalizacijom i dr. Kemijski spoj se samo kemijskim postupcima može razložiti na kemijske elemente od kojih je sastavljen. Smjese mogu biti heterogene i homogene.
Heterogene smjese su one u kojima se golim okom, povećalom ili mikroskopom mogu uočiti sastojci međusobno odvojeni vidljivom granicom. Svaki dio heterogene smjese jest čestica, zrnce, kristalić, kapljica ili mjehurić neke tvari. Čestice heterogene smjese međusobno se razlikuju po fizičkim svojstvima i kemijskom sastavu. Kao primjer prirodne heterogene smjese može se spomenuti granit (lat. granum − zrno). U granitu se već golim okom mogu uočiti bijela zrnca kremena, SiO2, crvenkasta zrnca ortoklasa, KAlSi3O8, čija boja potječe od primjesa željezova(III) oksida, te drugih alumosilikata. Granitom se popločuju ulice i oblažu pročelja zgrada.

Slika 1.1. Granit je heterogena smjesa minerala nastalih kristalizacijom magme.
Homogene smjese u svakom svom dijelu imaju isti kemijski sastav i ista fizička svojstva. Kad se dvije tvari miješaju tako da se atomi ili molekule jedne tvari ravnomjerno raspodijele među atome ili molekule druge tvari, kaže se da se te tvari otapaju i da nastaje prava otopina. Čestice u otopinama ne mogu se uočiti mikroskopom.
Heterogene smjese i prave otopine (homogene smjese) dva su krajnja slučaja između kojih postoji niz prijelaza kao što je navedeno u tablici 1.1.
Tablica 1.1. Ovisnost fizičkih svojstava smjese o veličini dispergiranih čestica
|
Vrsta disperznog sustava |
Veličina čestica |
Karakteristična svojstva |
Primjeri |
|
Grubodisperzni sustav |
Veće od 500 nm |
Vidljivo optičkim mikroskopom, ne prolazi kroz filtrirni papir |
Zrnca pijeska, suspenzija čestica gline u vodi (zamućena voda), crvena krvna zrnca. |
|
Koloidno disperzni sustav (koloidna otopina) |
1 nm do 500 nm |
Vidljivo elektronskim mikroskopom, prolazi kroz filtrirni papir, ne prolazi kroz pergament i celofan, raspršuje svjetlost (Tyndallov efekt) |
Mlijeko, maslac, majoneza, zaštitna krema za sunčanje, magla, smog. |
|
Molekularno disperzni sustav (prava otopina) |
Manje od 1 nm |
Nevidljivo elektronskim mikroskopom, prolazi kroz pergament i celofan, optički prozirno |
Otopina soli ili šećera u vodi, alkoholna pića. |
Posljednjih desetak i više godina slušamo o nanotehnologiji i njezinoj primjeni. Nanotehnologija uključuje istraživanje svojstava i primjenu čestica na nanometarskoj razini (nanorazini), što znači čestica veličine između 1 i 100 nm. Nanotehnologija zadire u sva područja ljudske djelatnosti, od računala i elektronike, do robotike, tekstilne industrije, građevinarstva, i iznalaženja novih lijekova. Primjerice, aluminij je postojan na zraku. No ako se taj isti aluminij usitni na veličinu nanočestica postaje eksplozivan i stoga prikladan za gorivo u raketama. Nanočestice cinkova oksida, ZnO, i rutila, jedne od tri kristalne modifikacije titanijeva dioksida, TiO2, odavno se rabe kao dodatak kremama za sunčanje. Takve kreme za sunčanje prozirne su za vidljivu svjetlost, pa stoga oku nevidljive, ali odbijaju ili apsorbiraju ultraljubičasto zračenje. Nanotehnologija se ponajviše rabi u izradi sklopova za računala i mobilne telefone. Tvrtka TSMC već proizvodi čipove u 5-nanometarskom procesu (tehnologija nosi kodno ime N5) s 171,3 milijuna tranzistora po kvadratnom milimetru. No neki proizvođači već najavljuju razvoj 2 nm procesora. (Razmak između atoma silicija u kristalu iznosi 0,154 nm.)
1.2. Iskazivanje sastava smjesa
U praktičnom radu uobičajilo se više načina iskazivanja sastava homogenih smjesa. Fizičke veličine kojima se iskazuje sastav homogenih smjesa, kao i otopina, dane su pregledno u tablici 1.2.
Tablica 1.2. Fizičke veličine kojima se izražava sastav smjesa i otopina (oznaka A odnosi se na otapalo, a oznaka B na otopljenu tvar).
|
Fizička veličina |
Simbol |
Definicija |
SI jedinica |
Uobičajeno |
|
|
Omjeri |
|
|
|
|
|
|
Maseni omjer |
ζ(B,A) |
ζ(B,A) = m(B) / m(A) |
1 |
|
|
|
Volumni omjer |
ψ(B,A) |
ψ(B,A) = V(B) / V(A) |
1 |
|
|
|
Množinski omjer* |
r(B,A) |
r(B,A) = n(B) / n(A) |
1 |
|
|
|
Udjeli |
|
|
|
|
|
|
Maseni udjel |
w(B) |
w(B) = m(B) / (m(A) + m(B)) |
1 |
|
|
|
Volumni udjel |
φ(B) |
φ(B) = V(B) / (V(A) + V(B)) |
1 |
|
|
|
Množinski udjel* |
x(B) |
x(B) = n(B) / (n(A) + n(B)) |
1 |
|
|
|
Koncentracije |
|
|
|
|
|
|
Masena koncentracija |
γ(B) |
γ(B) = m(B) / V |
kg m−3 |
g dm−3 |
|
|
Volumna koncentracija |
σ(B) |
σ(B) = V(B) / V |
1 |
|
|
|
Množinska koncentracija* |
c(B) |
c(B) = n(B) / V |
mol m−3 |
mol dm−3 |
|
|
Brojčana koncentracija |
C(B) |
C(B) = N(B) / V |
m−3 |
cm−3 |
|
|
Molalnost |
|
|
|
|
|
|
Molalnost |
b(B) |
b(B) = n(B) / m(A) |
mol kg−1 |
|
|
* V.
Lopac, Kilogram i mol u novome ruhu – o korjenitim promjenama u Međunarodnom
sustavu jedinica (SI), Kem. Ind. 69 (7-8) (2020) 407–414,
Mol,
znak mol, jedinica je sustava SI za množinu (količinu) tvari.
Jedan mol sadržava točno 6,022 140 76 ∙ 1023 elementarnih
jedinki. Taj je broj fiksna numerička vrijednost Avogadrove konstante NA
kad je izražena u jedinici mol−1 i zove se Avogadrov broj.
(Elementarna jedinka može biti atom, molekula, ion, elektron ili bilo koja
druga čestica ili zadana skupina čestica.)
Vidi
na interntu: Kilogram i mol u Međunarodnom sustavu jedinica (SI).pdf
Rješenje: Množinski udjel sastojaka smjese jednak je omjeru množine pojedinog sastojka prema množini svih sastojaka. Prema Avogadrovu zakonu jednaki volumeni različitih plinova pri istoj temperaturi i tlaku sadržavaju jednak broj čestica. Odavde proizlazi da su množinski udjeli sastojaka zraka jednaki njihovim volumnim udjelima.
Rješenje: Maseni omjer elemenata u kemijskom spoju jednak je omjeru relativne atomske mase pojedinog elementa prema relativnoj molekulskoj masi spoja:
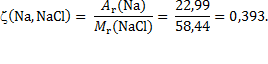
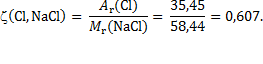
Rješenje: Da bismo doznali formulu spoja moramo masene omjere preračunati u množinske omjere elemenata u spoju. To ćemo učiniti tako da mase elemenata u spoju podijelimo njihovim molarnim masama.
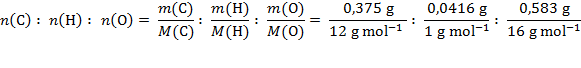
Pomalo neuobičajena formula, ali dijeljenjem s najmanjim članom morali bismo dobiti bolji omjer elemenata u spoju, pa slijedi:
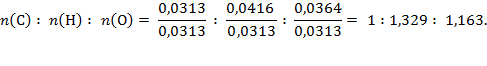
Rješenje: Molekula limunske kiseline sadržava tri karboksilne skupine, −COOH. Tri formulske jedinke natrijeva hidrogenkarbonata reagiraju s jednom formulskom jedinkom limunske kiseline prema jednadžbi:
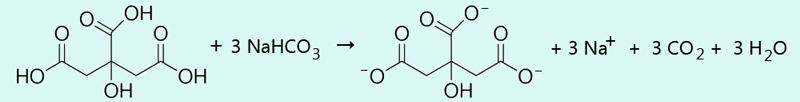
Množine limunske kiseline i natrijeva hidrogenkarbonata treba uzeti u omjeru njihovih stehiometrijskih koeficijenata u jednadžbi, tj. 1:3. Molarna masa limunske kiseline je 192 g mol−1, a natrijeva hidrogenkarbonata 84 g mol−1. Odatle proizlazi:
m(C6H8O7)/m(NaHCO3)
= M(C6H8O7)/3M(NaHCO3)
= 192 g mol−1/252 g mol−1
= 192 g / 252 g.
Nabrojite nekoliko primjera heterogenih i homogenih smjesa.
Proučite najvažnije industrijske postupke razdvajanja heterogenih smjesa. (Flotacija − odvajanje rudnih minerala bakra, cinka, olova i dr. od jalovine.)
Služeći se internetom proučite metode razdvajanja sastojaka nafte frakcijskom destilacijom.
Odaberite bilo koji organski ili anorganski spoj i iskažite njegov sastav masenim udjelima.
Izradite plakat, PowerPoint prezentaciju, snimite video, održite predavanje u razredu, organizirajte raspravu, pišite u školskom listu ili pokrenite neku aktivnost u vezi odabrane teme.
2. OTOPINE
U najširem smislu riječi, otopine mogu biti tekuće i krute. Plinovi se miješaju u svakom omjeru pa nije uobičajeno kazati plinovita otopina, već se kaže smjesa plinova.
Kao primjer tekuće otopine može se uzeti bistra pitka voda. U vodi se ne mogu nikakvim mikroskopom uočiti molekule otopljena kisika, ugljikova dioksida i različitih soli iako ih pitka voda sadržava.
Kao primjer krutih otopina mogu se uzeti neke slitine, primjerice zlata sa srebrom. Zlato i srebro miješaju se u svakom omjeru te čine krutu otopinu. Zlato i srebro, kao i njihove slitina bilo kojeg sastava kristaliziraju po tipu kubne plošno centrirane rešetke (FCC − Face Centred Cubic Lattice) u kojoj su atomi zlata i srebra nasumično raspoređeni. Ipak, većina slitina sastoji se od smjesa krutih otopina ili smjesa krutih otopina i intermetalnih spojeva.
Heterogene smjese i prave otopine (homogene smjese) dva su krajnja slučaja. Između njih se nalazi niz prijelaza. Smjese koje čine prijelaz između heterogenih smjesa i pravih otopina zovu se koloidne otopine i nanostrukture. Majoneza i mlijeko su primjeri koloidnih otopina. Iako su na prvi pogled mlijeko i majoneza homogeni sustavi, pod mikroskopom se mogu uočiti sitne kapljice ulja i masti raspršenih u vodi.
U otopinama valja razlikovati otapalo i otopljenu tvar. Otapalom se najčešće naziva onaj sastojak kojeg u otopini ima više. Otopine u kojima je otapalo voda zovu se vodene otopine. Otopine koje sadržavaju relativno velike količine otopljene tvari zovu se koncentrirane, a one koje sadržavaju malo otopljene tvari, razrijeđene.
Iskustvo nas uči da se neke tekućine međusobno miješaju u svakom omjeru, a neke se uopće ne miješaju. Različita topljivost tvari proistječe iz različite građe njihovih molekula. Molekule vode su polarne, pa možemo očekivati da će se u vodi dobro otapati sve tvari čije se molekule mogu polarizirati. Naprotiv, molekule ugljikovodika (loživog i motornog ulja, benzina i sl.) su nepolarne, pa se benzin i drugi naftni derivati ne miješaju s vodom. No ugljikovodici se međusobno neograničeno miješaju jer među njihovim nepolarnim molekulama djeluju slične privlačne sile. Vrijedi jednostavno pravilo − slično se otapa u sličnom.
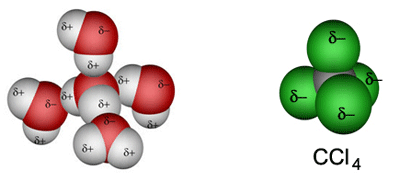
Slika 2.1. a) Kisik je elektronegativniji od vodika pa zajednički elektronski parovi više pripadaju kisiku nego vodiku. Zato se na atomu kisika javlja mali negativan, a na atomima vodika mali pozitivan naboj. Molekule vode su zbog toga dipoli, a voda polarno otapalo. b) Model molekule ugljikova tetraklorida. Klor je elektronegativniji od ugljika pa zajednički elektronski parovi više pripadaju atomima klora nego atomu ugljika. No ugljikov tetraklorid je nepolarno otapalo jer zbog simetrije njegove molekule težišta pozitivnog i negativnog naboja padaju na isto mjesto. Voda i ugljikov tetraklorid međusobno se ne miješaju.
2.1. Priprema otopine poznatog sastava
U praktičnom radu valja poznavati sastav otopina. Kemičari sastav otopina najčešće iskazuju množinskom koncentracijom, c(B), tj. omjerom množine otopljene tvari, n(B), i volumena otopine, V.
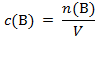
SI jedinica množinske koncentracije je mol m−3, ali se u praksi najčešće rabi mol L−1 i mmol mL−1. Brojčane vrijednosti koncentracije izražene u mol L−1 i mmol mL−1 jednake su.
Rješenje: Potrebna množina natrijeva karbonata izračuna se tako da se zadana koncentracija otopine pomnoži volumenom otopine koju treba pripremiti:
Molarna masa natrijeva karbonata izračuna se tako da se zbroje molarne mase svih atoma u formulskoj jedinki Na2CO3. Slijedi: M(Na2CO3) = 105,99 g mol−1, pa je masa natrijeva karbonata potrebna za pripremanje zadane otopine jednaka:
Rješenje: Razrjeđivanjem otopine ne mijenja se množina otopljene tvari pa vrijedi jednostavno pravilo:
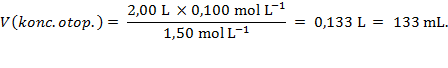
Za pripremu 2,00 L otopine koncentracije c2(Na2CO3) = 0,100 mol L−1 treba uzeti 133 mL otopine koncentracije c1(Na2CO3) = 1,50 mol L−1 i nadopuniti do volumena 2,00 L.
Rješenje: Množinska i masena koncentracija otopine natrijeva karbonata povezane su odnosom:
Pribor i kemikalije: Precizna vaga, lađica za vaganje ili satno staklo, lijevak, odmjerna tikvica od 1000 mL, boca štrcaljka, bezvodni natrijev karbonat.
Postupak
- Izračunajte masu natrijeva karbonata potrebnu za pripremu 1000 mL otopine koncentracije c(Na2CO3) = 0,05 mol L−1. (Rješenje: m ≈ 5,3 g)
- Pripremite odmjernu tikvicu od 1000 mL i prikladan stakleni lijevak. Postavite lijevak na tikvicu.
- Plastičnu lađicu za vaganje ili satno staklo stavite na vagu i pritisnite tipku "Tara". Vaga će pokazati 0,0000 g.
- U plastičnu lađicu za vaganje ili na satno staklo žličicom dodajte oko 5 grama bezvodnoga natrijeva karbonata prethodno osušenog u sušioniku pri 105 °C. Vaga će pokazati primjerice 5,5555 g. Zapište masu uzetoga bezvodnoga natrijeva karbonata.
- Pažljivo prespite sav odvagani natrijeva karbonat u lijevak na odmjernoj tikvici. Bocom štrcaljkom isperite ostatke natrijeva karbonata sa satnog stakla i lijevka u odmjernu tikvicu.
- Tikvicu dopunite do ¾ volumena vodom. Miješajte sadržaj tikvice kružnim pokretima dok se sav natrijev karbonat ne otopi.
- Bistru otopinu, ohlađenu na sobnu temperaturu, dopunite vodom do 0,5 cm ispod marke na vratu tikvice. Začepite tikvicu, vrat tikvice uhvatite rukom a čep pridržavajte kažiprstom. Promiješajte otopinu okretanjem tikvice gore−dolje.
- Postavite tikvicu na stol, odčepite i kapljicu otopine zaostale na čepu "obrišite" na grlu tikvice. Pričekajte da se otopina ocijedi sa stijenke. Čistom kapalicom dodajite kap po kap vode dok donji rub meniskusa ne dodirne oznaku na tikvici.
- Promiješajte dobivenu otopinu višestrukim okretanjem tikvice gore−dolje.
- Izračunajte koncentraciju otopine. (Rješenje: c(Na2CO3) = 0,0524 mol/L.)
Vidi na internetu: To prepare a Standard Solution of Sodium Carbonate
Pribor i kemikalije: menzura od 20 mL, lijevak, laboratorijska boca od 1000 mL s ubrušenim čepom, menzura od 500 ili 1000 mL, 18-postotna klorovodična kiselina za kućanstva.
Postupak
- U kućanstvu se za čišćenje "kamenca" rabi 18-postotna klorovodična kiselina. Koliko ćete kiseline upotrijebiti za pripremu 1 L otopine koncentracije c(HCl) ≈ 0,1 mol L−1? Gustoća 18-postotne klorovodične kiseline je 1,09 g mL−1. (Rješenje: ≈ 20 mL.)
- U laboratorijsku bocu od 1000 mL ulijte litru destilirane vode i oko 20 mL 18 %−tne klorovodične kiseline. Kružnim pokretima promiješajte otopinu.
- Pomoću standardne otopine natrijeva karbonata, pripremljene u pokusu 2.1., standardizirajte pripremljenu otopinu klorovodične kiseline.
Pribor i kemikalije: Željezni stalak s hvataljkom za birete, bireta od 50 mL, pipeta od 20 mL, stakleni lijevak, Erlenmeyerova tikvica od 200 mL, čaša od 100 ili 200 mL, otopina klorovodične kiseline c(HCl) ≈ 0,1 mol L−1 pripremljena u pokusu 2.2., standardna otopina natrijeva karbonata pripremljena u pokusu 2.1., otopina metil−oranža (indikator).
Postupak
- Čistu suhu biretu učvrstite hvataljkom za birete na željezni stalak. Ispod birete postavite bijelu porculansku pločicu ili podlogu od bijelog papira.
- U suhu čašu od 100 ili 200 mL ulijte oko 70 mL otopine klorovodične kiseline c(HCl) ≈ 0,1 mol L−1 pripremljene u pokusu 2.2. Ako bireta, pipeta ili čaša nisu suhe morate ih tri puta isprati malom količinom standardnih otopina.
- Zatvorite pipac na bireti. Postavite mali lijevak na biretu. Kiselinom iz čaše napunite biretu do visine oko 4 − 5 cm iznad oznake "0 mL".
- Podmetnite bilo kakvu čašu ispod birete. Naglo otvorite pa zatvorite pipac na bireti tako da kiselina istisne sav zrak iz kapilarnog nastavka birete.
- Po potrebi dopunite biretu. Pažljivo ispuštajte kap po kap klorovodičnu kiselinu dok donji rub meniskusa ne dotakne oznaku "0 mL". Obrišite kap koja je zaostala na kapilarnom nastavku birete.
- U Erlenmeyerovu tikvicu sa širokim grlom suhom pipetom dodajte 20 mL standardne otopine natrijeva karbonata, c(Na2CO3) = 0,0524 mol/L, pripremljene u pokusu 2.1. Dolijte oko 50 do 100 mL destilirane vode i kap dvije otopine metiloranža.
- Titrirajte otopinu natrijeva karbonata klorovodičnom kiselinom do prijelaza boje iz žute u crvenu. Zagrijte otopinu do vrenja i po potrebi dodajte koju kap otopine klorovodične kiseline do prijelaza boje iz žute u crvenu. Očitajte i zapišite volumen utrošene klorovodične kiseline. Ponovite titraciju tri puta. Kao utrošak otopine klorovodične kiseline uzmite srednju vrijednost tri mjerenja.
- Napišite jednadžbu reakcije i izračunajte koncentraciju klorovodične kiseline.

Slika 2.2. Pri očitavanju volumena pipetu, menzuru ili biretu postavite tako da se meniskus nalazi u visini očiju. a) Donji rub meniskusa mora doticati oznaku na vratu pipete. b) Pri pogledu odozgo očitava se veći volumen. c) Razina tekućine u menzuri nalazi se u nivou očiju pa se očitava ispravan volumen. d) Pri pogledu odozdo očitat ćete manji volumen. e) Schelbachova bireta ima mliječno bijelu pozadinu čijom sredinom prolazi plava crta. Volumen otopine očitava se na mjestu suženja plave crte na meniskusu.
Rješenje: Napišimo najprije jednadžbu neutralizacije:
2 HCl + Na2CO3 → 2 NaCl + H2O + CO2.
Za titraciju smo uzeli 20 mL otopine natrijeva karbonata koncentracije c(Na2CO3) = 0,0524 mol L−1. Izračunajmo najprije množinu natrijeva karbonata u 20 mL standardne otopine:
n(Na2CO3) = V × c = 0,020 L × 0,0524 mol L−1 = 1,048 × 10−3 mol.
Iz jednadžbe reakcije vidimo da je za neutralizaciju 2 mola HCl potreban jedan mol Na2CO3. Odavde proizlazi:
n(HCl) / n(Na2CO3) = 2 / 1,
n(HCl) = 2 n(Na2CO3) = 2 × 1,048 × 10−3 mol = 2,096 × 10−3 mol.
Kako je n = V × c, proizlazi da je koncentracija klorovodične kiseline:
c(otop.HCl) = n(HCl) / V(otop.HCl) = 2,096 × 10−3 mol / 19,55 × 10−3 L,
c(otop.HCl) = 0,1072 mol L−1.
Vidi na internetu: Titration to Standardise a Hydrochloric Acid Solution
2.2. Gustoća otopina
Gustoća otopina razlikuje se od gustoće čistoga otapala. Vodene otopine soli, kiselina i lužina imaju veću gustoću od gustoće vode. Vodene otopine alkohola (alkoholna pića) imaju manju gustoću od gustoće vode.
Gustoća tekućina najčešće se mjeri areometrom. Areometar je zataljena staklena cijev sa širokim donjim dijelom − trbuhom, i vrlo uskim gornjim dijelom − vratom, u kojem se nalazi skala. Najdonji dio areometra ispunjen je olovnom sačmom. Laboratorijski areometri obično dolaze u kompletu koji sadržava univerzalni areometar sa širokim vratom i skalom koja obuhvaća cijelo mjerno područje kompleta areometara. Mjerenje se temelji na Arhimedovu zakonu, a izvodi se tako da se odabere suh i širok stakleni cilindar ili menzura visine veće od duljine areometra. Držeći cilindar u kosom položaju puni ga se istraživanom tekućinom ulijevanjem po stijenki tako da ne nastanu mjehurići zraka. U tekućinu bez zračnih mjehurića univerzalni areometar polagano se uroni dok se ne osjeti slab uzgon. To znači da areometar može sam plivati. Areometar se nikad ne smije ispustiti u tekućinu tako da udari u dno staklenog cilindra jer će se razbiti. Što je gustoća tekućine veća to će areometar manje potonuti. Kad se univerzalnim areometrom odredi približna vrijednost gustoće, tad se iz kompleta odabere odgovarajući precizniji areometar s tankim vratom. Areometar mora slobodno plivati u tekućini i ne smije doticati stijenke niti dno cilindra. Laganim pritiskom prsta na vrh vrata areometar se malo uroni u tekućinu i pričeka minutu da se tekućina ocijedi. Ispravnu vrijednost gustoće pokazuje donja granica meniskusa, osim u slučaju kad na areometru stoji oznaka "GORE". To znači da ispravnu vrijednost pokazuje gornja granica meniskusa. Takav se način očitanja rabi za mjerenje gustoće mutnih i obojenih tekućina. Temperatura tekućine mora biti jednaka temperaturi označenoj na areometru. Za većinu tekućina (vodu, alkohol, mlijeko, pivo ...) postoje tablice pomoću kojih se očitane vrijednosti gustoće mogu korigirati u odnosu na temperaturu. Zato areometri imaju i termometar.

Slika 2.3. Areometar s termometrom
U priručnicima se često daju podatci o masenim udjelima otopljene tvari u otopinama i pripadnim gustoćama otopina najvažnijih kiselina, baza i soli. Kako se masa otopljene tvari u otopini, m(B), može izraziti kao produkt mase otopine, m(ot.B), i masenog udjela tvari u otopini, w(B), izraz kojim je definirana masena koncentracija otopljene tvari, γ(B), može se pisati u obliku:
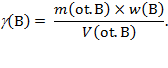
Omjer mase i volumena otopine daje gustoću te otopine, pa slijedi da su masena koncentracija otopljene tvari B, gustoća otopine, ρ (ot.B), i maseni udio tvari B u otopini međusobno povezani odnosom:
Kako se navedene veličine upotrebljavaju u praktičnom radu najbolje se može pokazati na primjerima.
Napomena: U laboratoriju se uvijek nose zaštitne naočale. Sve se kiseline razrjeđuju tako da se koncentrirana kiselina u tankom mlazu uz miješanje ulijeva u vodu. Pri tom se otopina ugrije. To naročito dolazi do izražaja pri razrjeđivanju koncentrirane, 96-postotne sumporne kiseline. Kad bismo postupili obratno, ulijevali vodu u koncentriranu kiselinu, zbog razvijanja topline voda bi trenutno isparila pri čemu bi se kapljice vode i kiseline raspršile na sve strane.
Rješenje: Množine ili mase sumporne kiseline u razrijeđenoj i koncentriranoj otopini moraju biti jednake.
Masa sumporne kiseline u traženoj otopini je:
Za masu sumporne kiseline u 96-postotnoj otopini dobivamo:
Razrjeđivanjem se ne mijenja množina i masa sumporne kiseline pa vrijedi:
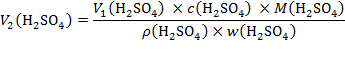
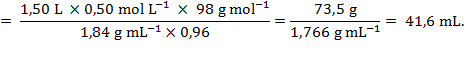
Za pripremu 1,50 L otopine sumporne kiseline koncentracije. c(H2SO4) = 0,50 mol L−1 treba odmjeriti 41,6 mL 96-postotne sumporne kiseline i u tankom mlazu uz miješanje uliti u 1 L hladne vode. Kad se otopina ohladi dopuniti do 1,50 L.
Rješenje: Masa čiste sumporne kiseline u 2 L "akumulatorske kiseline" iznosi:
Za koncentriranu sumpornu kiselinu vrijedi:
Odavde proizlazi:
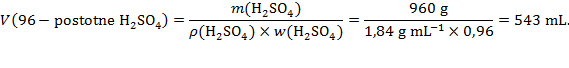
Za pripremu 2 L "akumulatorske kiseline" treba uzeti 543 mL 96-postotne sumporne kiseline i u tankom mlazu uz miješanje ulijevati u 1400 mL destilirane vode. Kad se otopina ohladi treba je dopuniti destiliranom vodom do volumena od 2 L.
Rješenje: Masena koncentraciju sumporne kiseline u otopini dobiva se tako da se gustoća otopine pomnoži masenim udjelom sumporne kiseline u otopini:
Množinska koncentracija sumporne kiseline je omjer njezine masene koncentracije i molarne mase:
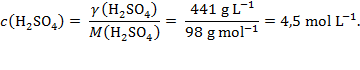
2.3. Otapanje soli u vodi
Svojstvo vode da dobro otapa soli uvjetovano je polarnošću njezinih molekula, tj. velikom relativnom permitivnošću vode. Privlačna ili odbojna sila, F, između dvaju električnih naboja obrnuto je proporcionalna relativnoj permitivnosti prostora u kojemu naboji djeluju jedan na drugoga (Coulombov zakon):
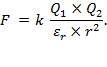
U ovoj je jednadžbi:
Q1 − naboj jednog tijela (ili iona),
Q2 − naboj drugog tijela (ili iona),
r − razmak među tijelima (ili ionima),
εr − konstanta proporcionalnosti, tj. relativna permitivnost tvari.
Pri sobnoj temperaturi zrak ima relativnu permitivnost oko 1, a voda 81. To znači da se dva suprotna električna naboja u vodi međusobno privlače 81 puta manjom silom nego u zraku.
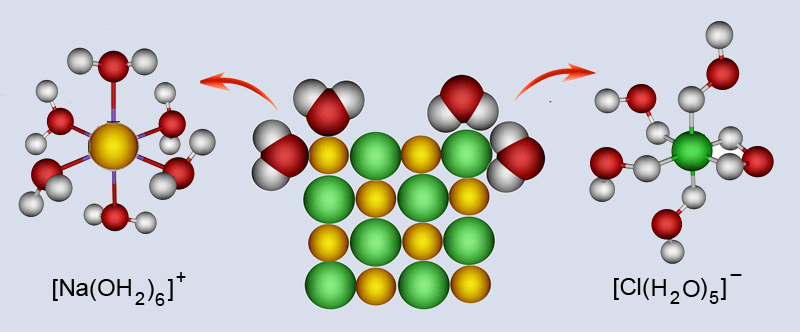
Slika 2.4. Shematski prikaz otapanja kristala natrijeva klorida u vodi.
Kad se kristal natrijeva klorida nađe u vodi, ioni Cl− i Na+ mnogo se lakše otkidaju s površine kristala nego što bi se to dogodilo na zraku. Svojim pozitivnim krajem molekule vode se naslanjaju na negativno nabijene ione Cl−, a negativnim krajem na pozitivno nabijene ione Na+. Time se slabe privlačne sile između iona na površini i iona u unutrašnjosti kristala. Potpomognute toplinskim gibanjem, molekule vode "otkidaju" ione s površine kristala. Postojeći ioni u kristalnoj strukturi otapanjem se razdvajaju, pa se kaže da tvari s ionskom građom pri otapanju disociraju (lat. dissociare − rastaviti).
Kao što smo već kazali, privlačna sila između iona Na+ i Cl− u vodi je 81 puta manja nego u vakuumu. Zato je mala vjerojatnost da će se ioni iz otopine vraćati na površinu kristala sve dok je otopina nezasićena. Tek se u zasićenoj otopini uspostavlja dinamička ravnoteža, tj. kad broj iona koji s površine kristala prelaze u otopinu postaje jednak broju iona koji se iz otopine vraćaju na površinu kristala. Otopina je zasićena kad se nalazi u dinamičkoj ravnoteži s viškom neotopljene krute tvari.
Vidi na internetu: Dissolution of Ionic Compounds
U vodenoj otopini ioni se okružuju molekulama vode. Svaki negativno nabijeni ion, tj. anion, privlači pozitivno nabijene krajeve molekula vode te ih nastoji zadržati oko sebe. Kationi su manji od aniona pa većom silom privlače molekule vode i čvrsto ih vežu. Nastaju hidratizirani ioni (slika 2.5.).
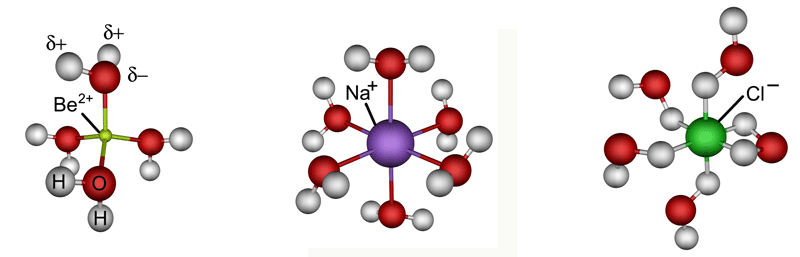
Slika 2.5. Shematski prikaz strukture hidratiziranih iona: [Be(OH2)4]2+, ili Be2+(aq), [Na(OH2)6]+ ili Na+(aq) i [Cl(H2O)6]− ili Cl−(aq)
Broj molekula vode koje okružuju kation, koordinacijski broj kationa, ovisi o njegovoj veličini. Oko malenih kationa, Li+ i Be2+, mogu se smjestiti samo četiri molekule vode pa oni čine tetrahidrate [Li(OH2)4]+ i [Be(OH2)4]2+. Nešto veći kationi, primjerice Mg2+, Al3+, Fe3+, čine heksahidrate: [Mg(OH2)6]2+, [Al(OH2)6]3+, [Fe(OH2)6]3+. Molekule vode neposredno vezane na kation ili anion nazivamo prvom koordinacijskom sferom. Molekule vode iz prve koordinacijske sfere vodikovim vezama vežu sljedeći sloj molekula vode koje čine drugu koordinacijsku sferu. No molekule u drugoj koordinacijskoj sferi uglavnom ne utječu na kemijska svojstva hidratiziranih iona. Anioni su veći pa slabijom silom privlače molekule vode. Primjerice, 5,5 je prosječan hidratacijski broj kloridnog iona, a to je prosječan broj molekula vode koje okružuju kloridne ione u razrijeđenoj otopini.
Privlačne sile između molekula vode i kationa mogu biti tako jake da mnogi kationi zadržavaju oko sebe sloj molekula vode i u kristalima. Za takve se kristale kaže da sadržavaju kristalizacijsku vodu. U kristalima BeCl2·4H2O, BeSO4·4H2O i BeCO3·4H2O četiri molekule vode okružuju katione berilija. U kristalima MgCl2·6H2O, AlCl3·6H2O, FeCl3·6H2O šest molekula vode okružuje katione Mg2+, Al3+ i Fe3+. U kristalima stipse, KAl(SO4)2·12H2O, šest molekula vode okružuje ione Al3+, a drugih šest molekula vode okružuje ione K+.
2.4. Krivulja topljivosti
Koncentracija zasićene otopine, topljivost tvari, najčešće se izražava maksimalnom masom bezvodne tvari koja se može otopiti u 100 g otapala. No topljivost tvari najčešće raste porastom temperature. Zato uvijek treba navesti temperaturu pri kojoj se navedena količina tvari otapa u 100 g otapala.
Promjena topljivosti tvari s promjenom temperature prikazuje se krivuljom topljivosti. Na apscisu se nanosi temperatura, a na ordinatu masa bezvodne tvari koja se otapa u 100 g otapala.
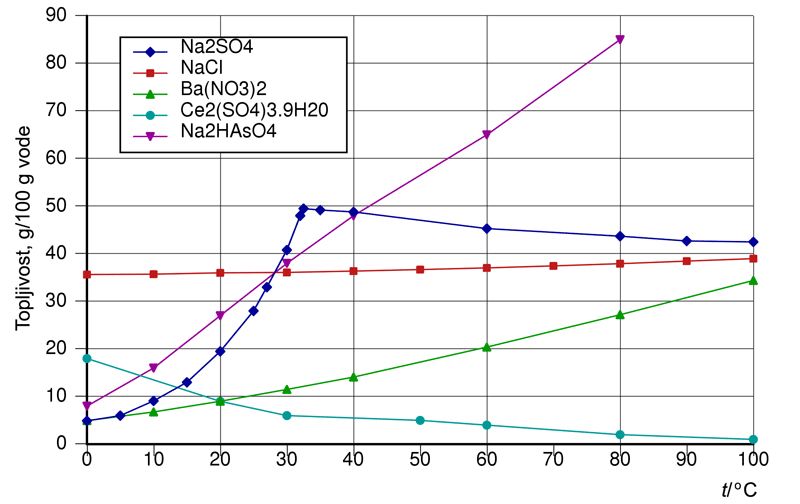
Slika 2.6. Krivulje topljivosti
nekih soli u odnosu na temperaturu otopine.
Slika izvor: https://hr.wikipedia.org/wiki/Topljivost
Pribor i kemikalije: Epruveta, termometar, plamenik, menzura od 10 mL, kalijev nitrat.
Postupak
- U čistu, suhu epruvetu odvažite 8 g kalijeva nitrata i dodajte 5 mL destilirane vode.
- Zagrijavajte sadržaj epruvete dok se sva sol ne otopi. Epruvetu s otopinom postavite u stalak. Uronite termometar u otopinu i pustite da se otopina spontano hladi.
- Postavite crni papir iza epruvete. Kad primijetite da se iz otopine izlučuju kristali, zabilježite temperaturu. Pri toj temperaturi u 5 mL vode otapa se 8 g kalijeva nitrata. Otopina je zasićena.
- Dodajte još tri puta po 5 mL vode, i nakon svakog dodatka vode odredite temperaturu pri kojoj iz dobivene razrijeđene otopine počinje izlučivanje kristala.
- Iz dobivenih podataka izračunajte topljivost kalijeva nitrata u vodi, izrazite je omjerom 100 × m(KNO3)/m(H2O) te nacrtajte krivulju topljivosti.
- Upotrijebite milimetarski papir. Na ordinatu nanesite topljivost kao 100 × m(KNO3)/m(H2O), a na apscisu pripadnu temperaturu, t/°C.
- Nakon provedenih pokusa otopinu i kristale kalijeva nitrata spremite u za tu svrhu pripremljenu bocu. Uparavanjem razrijeđene otopine iskristalizirat će kalijev nitrat koji se može ponovo upotrijebiti za iste pokuse.
Vidi na Internetu: Determining the Solubility of a Solid (Potassium Chlorate)
Vidi na Internetu: e-Kemija: Sikirica - Prezasićena otopina natrijeva acetata
Vidi na internetu: e-Kemija: Sikirica - Prezasicena otopina limunske kiseline
Pribor i kemikalije: stalak s epruvetama, plamenik, natrijev tiosulfat pentahidrat, Na2S2O3·5H2O, destilirana voda.
Postupak
- Čistu epruvetu napunite do polovine natrijevim tiosulfatom pentahidratom. Dodajte 4 do 5 kapi vode te rukom osjetite grije li se sadržaj epruvete ili hladi.
- Sadržaj epruvete pažljivo zagrijavajte najviše do 60 °C, dok se sva sol ne otopi. Ako se sva sol ne otopi dodajte još jednu kap vode.
- Stavite epruvetu u stalak i pustite da se otopina spontano ohladi. Možete je ohladiti i pod tekućom vodom, ali tako da tijekom hlađenja otopinu ne potresate.
- Kad se otopina ohladi ubacite u nju kristalić natrijeva klorida. Događa li se što? U istu epruvetu ubacite kristalić natrijeva tiosulfata pentahidrata. Je li se pritom sadržaj epruvete ugrijao ili ohladio? Objasnite pojave.
- Sačuvajte epruvetu s kristalima natrijeva sulfata pentahidrata. Pokus možete više puta ponoviti s istim uzorkom soli.
Topljivost natrijeva tiosulfata raste porastom temperature. Pri oko 40 do 50 °C natrijev tiosulfat praktično se otapa u vlastitoj kristalizacijskoj vodi. Ako se zasićena otopina polagano hladi može nastati prezasićena otopina. U prezasićenoj otopini nalazi se više otopljene tvari nego što odgovara ravnotežnom stanju. Takva je otopina nestabilna pa i najmanje zrnce prašine ili potresanje otopine može izazvati kristalizaciju. Ako se u otopinu ubaci kristalić natrijeva klorida obično se ne događa ništa. Kristalna struktura natrijeva klorida razlikuje se od kristalne strukture natrijeva tiosulfata pentahidrata. Zato kristalić natrijeva klorida ili neke druge soli neće potaknuti kristalizaciju. Naprotiv, kristalići natrijeva tiosulfata djeluju kao centri kristalizacije, tj. na njima počinje kristalizacija te kristali rastu u dubinu otopine. Pritom se sustav ugrije što se može osjetiti rukom.
Vidi na
Internetu:
e-Kemija: Sikirica - Prezasicena otopina limunske k
Hot ice (sodium acetate) beautiful science experiment
Fun with sodium acetate: ''hot ice''
2.5. Topljivost plinova u vodi
Kad hladnu pitku vodu (iz vodovodne mreže) ostavimo da stoji u staklenoj čaši pri sobnoj temperaturi, primjećujemo da se na stijenkama čaše skupljaju sitni mjehurići plina. Taj plin je zrak koji je bio otopljen u vodi. Kad otvorimo bocu mineralne vode čuje se šištanje jer je ugljikov dioksid u boci pod tlakom. Kad se tlak u boci smanji, u vodi se izlučuju mjehurići ugljikova dioksida. Možemo zaključiti: Topljivost plinova u vodi smanjuje se povišenjem temperature i sniženjem tlaka.
Zbog uporabe vode za hlađenje industrijskih postrojenja dolazi do zagrijavanja prirodnih vodenih tokova, a to uzrokuje manju topljivosti kisika u vodi rijeka i jezera. Primjerice, temperatura Save za niska vodostaja poraste i za 4 °C zbog hlađenja nuklearne elektrane Krško. Pojava je naročito izražena u mirnim jezerskim vodama. Topla voda ima manju gustoću od hladne pa se zadržava na površini. Topljivost kisika manja je u toploj nego u hladnoj vodi. Sloj tople vode na površini sprječava prodiranje kisika u niže hladne slojeve što dovodi do gušenja svakog oblika života za koji je potreban kisik – i riba se može u vodi utopiti!
Drugi uzrok smanjenju koncentracije kisika u rijekama i jezerima jesu otpadne organske tvari koje industrija i gradovi ispuštaju u riječne tokove. Zato svako industrijsko postrojenje ili grad mora imati uređaj za pročišćavanje otpadnih voda. Na rijekama se kojiput grade i umjetni vodopadi kako bi voda došla u bolji doticaj sa zrakom.
Množina plina otopljenog u tekućini pri određenoj temperaturi proporcionalna je parcijalnom tlaku toga plina iznad tekućine. (W. Henry, 1775. − 1836.).
Poveća li se tlak kisika iznad vode dva puta, i množina kisika koji se otapa u vodi povećat će se dva puta. Ta zakonitost vrijedi samo za plinove koji kemijski ne reagiraju s vodom. Topljivost takvih plinova je mala. Tako pri temperaturi 0 °C i tlaku 1 bar, 1 L vode otapa samo 48,9 mL kisika. Poveća li se tlak na 2 bara, volumen otopljenog kisika bit će opet jednak 48,9 mL, ali zbog dvostruko većeg tlaka množina otopljenog kisika dvostruko je veća. Smanji li se tlak, otopljeni kisik će se izlučiti u obliku mjehurića.
Plinovi koji kemijski reagiraju s vodom (Cl2, HF, HCl, H2S, SO2, SO3, CO2, NH3 i drugi) ne pokoravaju se Henryjevu zakonu. Njihova je topljivost u vodi vrlo velika.
Povećana topljivost plinova pri povišenom tlaku može biti uzrokom nezgoda. Primjerice, ronilac na dubini od 50 m udiše zrak pod tlakom od oko 5 bara. Pri tom je tlaku topljivost kisika i dušika u krvi pet puta veća nego na površini. Ako ronilac prenaglo izroni, otopljeni dušik u krvnim žilama će se izlučiti u obliku mjehurića, koji će poput pjene zatvoriti žile (zračna embolija) i tako usmrtiti ronioca. Zato se, prije nego izrone, ronioci zadržavaju neko vrijeme na zadanim dubinama. Da bi se skratilo vrijeme dekompresije, tj. zadržavanje na zadanim dubinama, profesionalnim se roniocima boce s komprimiranim "zrakom" pune smjesom helija i kisika (TRIMIX). Topljivost helija u krvi upola je manja nego dušika, pa se vrijeme izranjanja skraćuje na polovinu. Tako se sprječavaju dekompresijske bolesti.
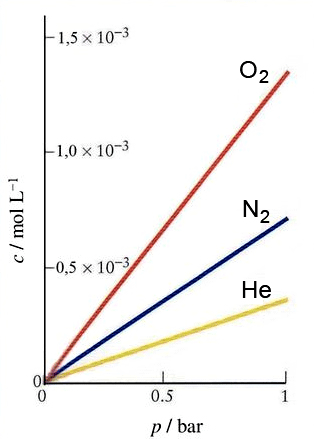
Slika 2.7. Topljivosti kisika, dušika i helija u vodi raste povišenjem tlaka. Uočite da je topljivost plina proporcionalna tlaku.
Zanimljivo je svojstvo didušikova oksida, N2O, da se otapa u slatkom vrhnju. Bočice sa slatkim vrhnjem punjene su didušikovim oksidom pod tlakom. Kad se tlak smanji, didušikov oksid se izluči u obliku mjehurića pa se dobije šlag. To je dobra ilustracija procesa koji se događaju u krvi i tjelesnim tekućinama pri nagloj dekompresiji. Didušikov oksid nije otrovan. Što više, koriste ga kao anestetičko sredstvo u smjesi s drugim plinovima pri totalnoj anesteziji. Nažalost, u posljednje vrijeme došlo je do zloporabe didušikova oksida.
2.6. Ekstrakcija
Različita topljivosti tvari u otapalima iskorištava se u industrijskim razmjerima, primjerice za ekstrakciju (lat. extrahere − izvući) aromatičnih ulja iz tvari biljnog podrijetla ili za ekstrakciju rijetkih metala iz njihovih ruda. Krutu smjesu najprije valja usitniti u fini prah a zatim dobro izmućkati s malom količinom otapala u kojem se željena tvar dobro otapa. Filtriranjem se odvoji otapalo od krute faze, koja se ponovo izmućka s malom količinom svježega otapala. Taj se proces ponavlja više puta, uvijek sa svježim otapalom, sve dok se željena tvar potpuno ne ekstrahira.
Ako tvar treba ekstrahirati iz tekuće otopine, tada treba odabrati takvo otapalo koje se ne miješa s otopinom iz koje se ekstrahira. U laboratoriju se ekstrakcija najčešće provodi tako da se otopina stavi u lijevak za odjeljivanje te se doda mala količina otapala u kojemu je željena tvar bolje topljiva. Smjesa se dobro promućka i pusti da se slojevi (faze) odijele zbog razlike u gustoći. Donji sloj se ispusti iz lijevka u tikvicu. Postupak se ponavlja više puta sa svježim otapalom. Tako se svaki put veći dio tvari ekstrahira u ono otapalo u kojem je bolje topljiva. Tvar se raspodjeljuje između dvije tekuće faze tako da je omjer koncentracija tvari u obje faze stalan:
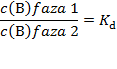
Taj se omjer naziva Nernstov zakon razdjeljenja. (W. Nernst, 1864. − 1941.) Kad se otopljena tvar pri konstantnoj temperaturi raspodijeli između dvije faze koje se ne miješaju, tada je omjer njezinih koncentracija u dvije faze konstantan. Konstanta Kd je konstanta ravnoteže. Ona ne ovisi o koncentraciji tvari već samo o temperaturi. Taj zakon vrijedi samo u slučaju kad se tvar u oba otapala nalazi u istom molekulskom obliku.
Detaljan opis laboratorijskog postupka ekstrakcije pogledajte na internetu: Liquid-Liquid Extraction (separation) and drying agent
Pribor i kemikalije: Erlenmeyerova tikvica od 100 mL, epruveta, jod, ugljikov tetraklorid (CCl4), pluteni čep za epruvetu.
Postupak
- Zrnce joda stavite u Erlenmeyerovu tikvicu od 100 mL i dodajte oko 50 mL vode. Zagrijte skoro do vrenja dok otopina ne poprimi svjetložutu boju. (Pripremljena količina otopine dovoljna je za desetak učenika.)
- Ulijte u čistu epruvetu oko 5 mL ohlađene otopine joda u vodi. Dolijte u istu epruvetu oko 0,5 mL ugljikova tetraklorida, CCl4, začepite plutenim čepom i snažno promućkajte.
- Odložite epruvetu u stalak i pustite da se slojevi odijele. Gustoća ugljikova tetraklorida veća je od gustoće vode, pa će se slojevi ubrzo odijeliti. Usporedite boju izvorne vodene otopine s bojom vodene otopine u epruveti (gornji sloj) i ugljikova tetraklorida (donji sloj).
- Obrazložite opažanja. Zašto je topljivost joda veća u ugljikovu tetrakloridu nego u vodi?
- Nakon provedenog pokusa sadržaj epruvete izlijte u posebno pripremljenu bocu za otpadna otapala.
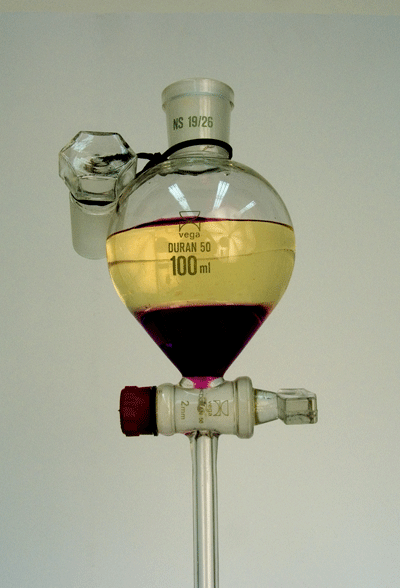
Slika 2.8. Otapala koja se ne miješaju razdvajaju se u lijevku za odjeljivanje u zasebne slojeve
Što je frakcijska kristalizacija? Na čemu se temelji i gdje se primjenjuje?
Nađite primjere industrijske primjene ekstrakcije.
Soxletov aparat.
Proučite sastav smjesa koje se rabe pri ronjenju. Što je uzrok i kako se liječi dekompresijska bolest?
Izradite plakat, PowerPoint prezentaciju, snimite video, održite predavanje u razredu, organizirajte raspravu, pišite u školskom listu ili pokrenite neku aktivnost u vezi odabrane teme.
3. KOLIGATIVNA SVOJSTVA OTOPINA
Četiri svojstva razrijeđenih otopina nehlapljivih tvari u hlapljivom otapalu nazivaju se koligativna svojstva. To su:
1. Sniženje tlaka para otopina,
2. Povišenje temperature vrelišta otopina,
3. Sniženje točke skrućivanja otopina,
4. Osmotski tlak.
Ta se svojstva nazivaju koligativnim, što znači da ovise o broju čestica otopljene tvari a ne o njihovim kemijskim svojstvima.
3.1. Tlak para otopina
Pribor i kemikalije: staklenka za konzerviranje povrća od 800 mL s pripadajućim poklopcem, staklenka od 100 mL, koncentrirana otopina natrijeva klorida.
Postupak
- U veću staklenku ulijte 20 do 40 mL vode. Dodajte kap-dvije tinte, tek toliko da voda bude obojena.
- U manju staklenku ulijte oko 40 mL koncentrirane otopine natrijeva klorida. Vodootpornim flomasterom zabilježite razinu otopine.
- Staklenku s otopinom natrijeva klorida, pomoću pincete ili kliješta za lončiće, pažljivo spustite u veću staklenku te zatvorite pripadajućim poklopcem.
- Uređaj postavite na mirno ali toplije mjesto i oboružajte se strpljenjem. Nakon dvadesetak ili više dana, ovisno o temperaturi okoline, zamijetit ćete da se razina otopine u maloj staklenki povisila. Nakon dva ili tri mjeseca sva će voda s dna veće staklenke prijeći na višu razinu, u staklenku s otopinom natrijeva klorida. Na dnu veće staklenke ostat će samo plava boja koja potječe od tinte.

Slika 3.1 U zatvorenom sustavu, prikazanom na slici, voda prelazi s niže razine u staklenki na višu razinu u čaši. Čudo! Voda sama od sebe teče uzbrdo! Kako je to moguće?
Rezultat provedenog pokusa može se objasniti razlikom tlaka para vode obojene tintom i koncentrirane otopine natrijeva klorida. Otopina uvijek ima niži tlak para nego čisto otapalo. U otopini čestice otopljene tvari, koja ne isparava, zauzimaju dio površine otopine čime se smanjuje udio molekula otapala koje mogu napustiti površinu. Stoga je pri istoj temperaturi tlak para vode iznad koncentrirane otopine natrijeva klorida manji od tlaka para vode obojene tintom na dnu staklenke. S površine vode na dnu staklenke uvijek isparava više molekula vode nego što ih se vraća na površinu. Istodobno na površinu koncentrirane otopine natrijeva klorida neprestano dolazi više molekula vode nego što ih odlazi s površine. Tako malo po malo sve molekule vode s dna staklenke prijeđu u staklenku s koncentriranom otopinom natrijeva klorida. Ravnoteža će se uspostaviti tek kad se koncentracije otopina izjednače, tj. kad gotovo sva voda s dna staklenke prijeđe na višu razinu u čašu s otopinom natrijeva klorida.
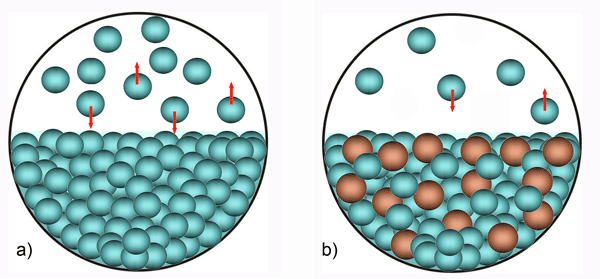
Slika 3.2. a) U čistom otapalu molekule mogu napustiti bilo koji dio i vratiti se na bilo koji dio površine. b) Kad je u otopini prisutna tvar koja ne isparava molekule se mogu vratiti na bilo koji dio, ali je ne mogu napustiti s bilo kojeg dijela površine. Površina otopine djelomično je zauzeta molekulama otopljene tvari. Zato je tlak para otopine manji od tlaka para čistog otapala.
F. M. Raoult (1830. − 1901.) našao da je tlak para otapala iznad otopine proporcionalan omjeru broja čestica otapala prema ukupnom broju čestica u otopini. Za tvari koje ne disociraju u otopini vrijedi Raoultov zakon: Tlak para otapala proporcionalan je množinskom udjelu otapala u otopini:
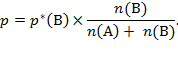
U ovom je izrazu p tlak para otopine, p*(B) tlak para čistog otapala, n(B) množina otapala B, n(A) množina otopljene tvari A.
Rješenje: Otopina sadržava ukupno 21 mol tvari, pa je tlak para otopine:
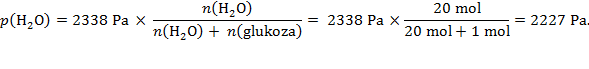
Raoultov zakon točno vrijedi samo za idealne otopine, a takvih nema. Vrlo razrijeđene otopine dosta dobro slijede Raoultov zakon, dok u koncentriranim otopinama dolazi do većih odstupanja.
Rješenje: Natrijev klorid disocira na ione Na+ i Cl−. To znači da od jednog mola NaCl u otopini nastaju dva mola čestica. Stoga otopina sadržava ukupno 22 mola čestica. Za tlak para zadane otopine dobivamo:
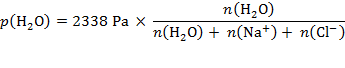
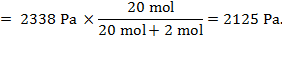
3.2. Povišenje vrelišta otopina
Pokusom se može pokazati da je vrelište otopine kuhinjske soli u vodi uvijek više od vrelišta čiste vode. Prisjetimo se da je vrelište tekućine ona temperatura pri kojoj je njezin tlak para jednak normalnom atmosferskom tlaku, 101 325 Pa. Tlak para otapala iznad otopine, koja sadržava nehlapljivu tvar, uvijek je manji od tlaka para čistog otapala pri istoj temperaturi. Odavde proizlazi da vrelište otopine mora biti više od vrelišta čistog otapala te da povišenje vrelišta slijedi istu proporcionalnost kao i tlak para:
∆Tb = i × Kb × b.
U ovoj je
jednadžbi:
∆Tb − povišenje vrelišta
otopine,
i − broj čestica na koje disocira
otopljena tvar,
Kb − ebulioskopska konstanta otapala (K kg mol−1)
(indeks "b" potječe od engl. boiling point),
b − molalnost otopine
(množina otopljene tvari/masa otapala).
Uzmemo li kod pripremanja otopina uvijek 1000 g nekog otapala, tad svaki put uzimamo isti broj čestica tog otapala. Kad se u 1000 g otapala otopi 1 mol neke tvari, koja ne disocira, vrelište te otopine bit će za Kb °C više od vrelišta čistog otapala. Ebulioskopska (lat. ebullire = ključati + skopija) konstanta, Kb, ovisi o vrsti otapala. Tako je za vodu Kb(H2O) = 0,512 K kg mol−1, za benzen Kb(C6H6) = 2,53 K kg mol−1, za octenu kiselinu Kb(CH3COOH) = 3,22 K kg mol−1, za kloroform Kb(CHCl3) 3,63 K kg mol−1, za etanol Kb(C2H5OH) 1,07 K kg mol−1 itd. Svako otapalo ima drukčiju, njemu svojstvenu konstantu povišenja vrelišta. Povišenje vrelište otopine ovisi o broju čestica, a ne ovisi o kemijskim svojstvima otopljene tvari.
Rješenje: Najprije treba izračunati molalnost otopine natrijeva klorida:
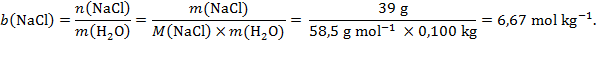
U vodenoj otopini natrijev klorid disocira na iona Na+ i Cl−, tj. i =2, pa slijedi:
![]()
Vrelište zadane otopine natrijeva klorida bit će pri 106,8 °C.
Za kemičare s kraja 18. stoljeća koligativna svojstva otopina mnogo su značila, jer su na temelju njih došli do zaključka o disocijaciji soli u otopinama.
3.3. Sniženje ledišta (krutišta) otopina
Ledište (krutište) i talište čiste tvari ista je temperatura. Pri toj su temperaturi tlakovi para tekuće i krute faze jednaki. Isto vrijedi i za otopine. Otopina će se skrutnuti pri onoj temperaturi pri kojoj su tlakovi para tekuće i krute faze jednaki. No otopine uvijek imaju manji tlak para od tlaka para čistog otapala. Stoga će se otopina skrutnuti pri nižoj temperaturi, tj. onda kad tlakovi para tekuće i krute faze budu jednaki. Sniženje ledišta proporcionalno je omjeru broja čestica otapala prema ukupnom broju čestica u otopini. Stoga i za sniženje ledišta otopina vrijedi Raoultov zakon:
∆Tf = i × Kf × b.
U ovoj je
jednadžbi:
∆Tf − sniženje ledišta
(krutišta) otopine,
i − broj čestica na koje disocira
otopljena tvar,
Kf − krioskopska konstanta otapala (K kg mol−1)
(indeks "f" dolazi od engl. freezing−point − ledište),
b − molalnost otopine
(množina otopljene tvari/masa otapala).
Krioskopska konstanta za vodu iznosi: Kf(H2O) = 1,86 K kg mol−1, za octenu kiselinu Kf(CH3COOH) = 3,63 K kg mol−1, za benzen Kf(C6H6) = 5,07, K kg mol−1, za tetraklormetan Kf(CCl4) = 29,8 K kg mol−1 itd. Dobro je upamtiti da iz otopine kristalizira čisto otapalo. Tako zaleđivanjem morske vode nastaje slatka voda.
Rješenje: i = 2 jer natrijev klorid disocira na ione Na+ i Cl−:
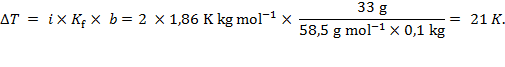
Zasićena vodena otopina natrijeva klorida mrzne se pri −21 °C. Kad se zaleđene prometnice pospu solju led se otopi, ali samo ako je temperatura viša od −21 °C. No zasipanje prometnica solju nije najpametnije rješenje jer ta sol u proljeće dospije u vodotokove, a poljoprivredne površine ne mogu se navodnjavati vodom iz zasoljenih rijeka.
U 19. stoljeću snižavanje tališta se koristilo za određivanje relativne molekulske mase organskih spojeva. Kao otapalo se ponajviše rabio kamfor, zbog tri razloga: (1) zato što se u njemu organski spojevi lako otapaju, (2) zbog visokog tališta (179 oC) i, najvažnije, zbog visoke krioskopske konstante Kf(kamfor) = 40 K kg mol−1.
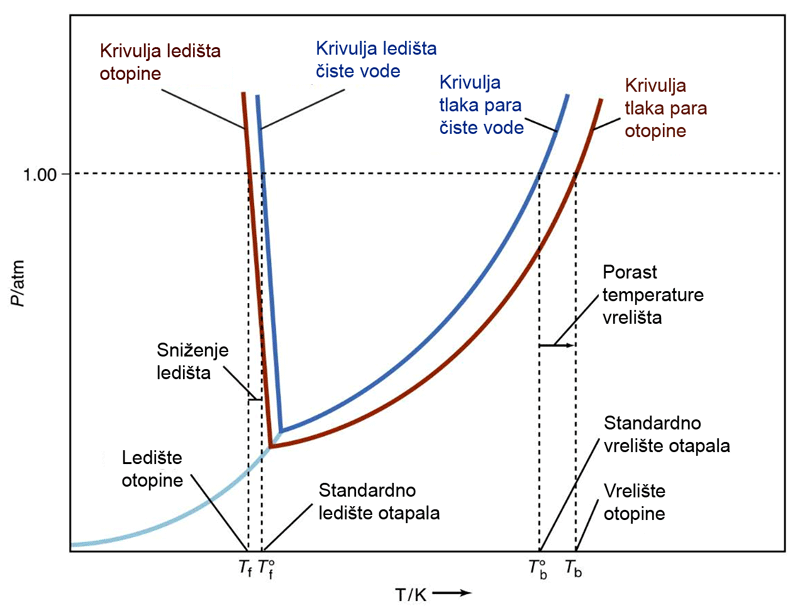
Slika 3.3 Tlak para čiste vode (plava linija) i vodene otopine nehlapljive tvari (smeđa linija) raste porastom temperature. Manji tlak para otapala iznad otopine uzrokuje povišenje vrelišta i sniženje ledišta otopine.Slika izvor.
3.4. Osmoza i osmotski tlak
Kad se dvije otopine različitih koncentracija odijele semipermeabilnom (lat. semi = pola + permeare − prolaziti kroz) ili polupropusnom membranom, otapalo kroz takvu membranu prelazi iz otopine manje koncentracije u otopinu veće koncentracije. Prolaženje otapala kroz polupropusnu membranu zove se osmoza. Molekule otapala prelazit će iz područja manje u područje veće koncentracije otopljene tvari sve dok se koncentracije otopljene tvari s obje strane polupropusne membrane ne izjednače ili dok hidrostatski tlak ne postane jednak osmotskom tlaku. Kad se dostigne ravnoteža, izjednači se broj molekula vode koje u oba smjera prolaze kroz membranu. Ako se hidrostatski tlak poveća toliko da postane veći od osmotskog tlaka, otapalo će prolaziti kroz polupropusnu membranu iz otopine veće koncentracije u otopinu manje koncentracije. Ta se pojava zove reverzna osmoza te se primjenjuje za dobivanje pitke vode iz morske vode. U uređajima za reverznu osmozu morska se voda nalazi pod tlakom većim od njezina osmotskog tlaka (26 bara pri 15 °C).
Pribor: čaša, kokošje jaje, kuhinjski ocat, kuhinjska sol ili šećer.
Postupak
- Uzmite dva podjednako velika kokošja jaja. Jedno će jaje služiti za usporedbu (etalon) a drugo za pokus.
- Prikladnu čašu napunite do polovine kuhinjskim octom. Uronite jaje u ocat i ostavite preko noći, tj. dok se ljuska ne otopi.
- Jaje bez ljuske uronite u veću čašu s običnom vodom. Idućih dan ili dva promatrajte povećanje obujma jajeta. Poželjno je povremeno promijeniti vodu.
- Pripremite koncentriranu otopinu šećera ili kuhinjske soli. Isto nabubreno jaje uronite u čašu s koncentriranom otopinom. Idućih nekoliko dana promatrajte smanjenje obujma jajeta. Obrazložite opažene promjene.

Slika 3.4. a) Kad se jaje bez ljuske uroni u čašu s čistom vodom, zbog razlike osmotskih tlakova molekule vode kroz polupropusnu membranu ulaze u jaje pa ono nabubri. Voda će ulaziti u jaje sve dok hidrostatski tlak unutar jajeta ne postane jednak osmotskom tlaku. b) Kad se jaje uroni u koncentriranu otopinu kuhinjske soli ili šećera molekule vode kroz polupropusnu membranu izlaze iz jajeta pa se ono smežura.
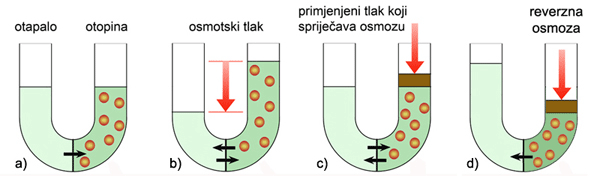
Slika 3.5. Shematski prikaz osmoze. a) Kroz polupropusnu membranu prolazi više molekula otapala u otopinu nego iz otopine u čisto otapalo. b) Razina čistog otapala u U−cijevi snizi se, a na strani otopine povisi. Kad hidrostatski tlak postane jednak osmotskom tlaku uspostavi se ravnoteža, tj. broj molekula otapala koje prolaze kroz polupropusnu membranu jednak je u oba smjera. c) Ako se na strani otopine primjeni tlak jednak osmotskom tlaku izjednačit će se broj molekula otapala koje prolaze kroz polupropusnu membranu u oba smjera. d) Ako se na strani otopine primjeni tlak veći od osmotskog tlaka, molekule otapala prelazit će iz otopine u čisto otapalo. Ta se pojava naziva reverzna osmoza. Primjenjuje se za desalinaciju morske vode.
Osmotski tlak proporcionalan je koncentraciji otopine:
Π = i c RT.
U ovoj je jednadžbi:
Π − osmotski tlak, Pa,
i − broj čestica koje nastaju disocijacijom jedne formulske jedinke tvari,
c − množinska koncentracija otopine, mol m−3,
R − plinska konstanta jednaka 8,314 J K−1 mol−1,
T − termodinamička temperatura, K.
Jednostavnije rečeno, osmotski tlak jednak je tlaku koje bi imale čestice otopljene tvari da se nalaze u stanju idealnog plina. Izvedite navedenu jednadžbu iz jednadžbe idealnog plina, PV = nRT !
Rješenje:
U ovom je zadatku zadan podatak o koncentraciji otopljenih čestica, a ne formulskih jedinki ili molekula koje disociraju. Zato se za i uzima da je jednak 1, pa slijedi:
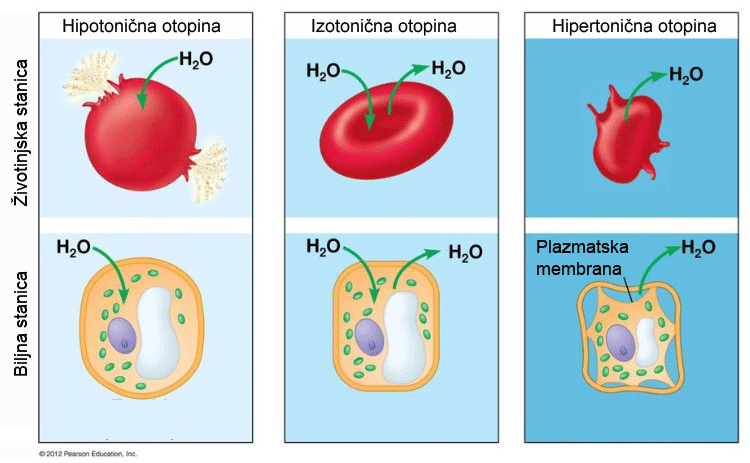
Slika 3.6. Shematski prikaz utjecaja hipotoničnih i hipertoničnih otopina na životinjske i biljne stanice. Slika izvor: https://geteducationskills.com/hypotonic−solution/
Osmotski tlak je izuzetno važan za živa bića. Membrane crvenih krvnih tjelešaca, eritrocita, su polupropusne. Ako se crvena krvna tjelešca stave u čistu vodu ona bubre. Voda prolazi kroz membranu i ulazi u tjelešca zbog veće koncentracije otopljenih tvari unutar crvenog krvnog tjelešca. Membrane se ne mogu neograničeno širiti pa pucaju, a tjelešca u čistoj vodi propadaju. Obratno, ako crvena krvna tjelešca dospiju u otopinu u kojoj je koncentracija otopljenih tvari veća nego unutar membrane, tjelešca gube vodu i zbog toga propadaju. Zato otopine koje se daju intravenoznom infuzijom ili injekcijama moraju imati isti osmotski tlak kao i stanična tekućina. Kad dvije otopine imaju isti osmotski tlak za njih se kaže da su izotonične (grč. isos − isti + tonos − napetost). Otopina u kojoj je maseni udio natrijeva klorida 0,9 %, ili glukoze 5,3 %, izotonična je sa staničnom tekućinom u ljudskom organizmu. Sve otopine koje se klinički upotrebljavaju kao različite vrste injekcija moraju biti izotonične sa staničnom tekućinom.
Upoznajte postupak hemodijalize.
Proučite postupke desalinacije morske vode.
Što bi vlade pojedinih država trebale činiti da se spriječi zagađivanje, prodaja i gubitak izvora pitke vode?
Što se u svezi s očuvanjem izvora pitke vode događa u Hrvatskoj?
Izradite plakat, PowerPoint prezentaciju, snimite video, održite predavanje u razredu, organizirajte raspravu, pišite u školskom listu, pokrenite neku aktivnost u vezi očuvanja izvora pitke vode, aktivirajte se u nekoj od ekoloških udruga itd.
4. KOLOIDNE OTOPINE
Škotski kemičar Thomas Graham (1805. − 1869.) opazio je oko 1860. godine da iz otopine koja sadržava šećer i škrob, kroz membrane načinjene od pergamenta prolazi samo šećer. Primjerice, ako se načini vrećica od celofana u koju se stavi otopina želatine i šećera te vrećica uroni u tekuću vodu, šećer će kroz stijenke celofana brzo prijeći u vodu, a želatina će zaostati u vrećici. Taj se pojava zove dijaliza. Graham je tvari koje je mogao dobiti u kristaliziranom stanju, primjerice šećer i sol, a to su one koje prolaze kroz membranu od pergamenta ili celofana, nazvao kristaloidima. Tvari kao što su škrob i želatina, koje nije mogao iskristalizirati iz otopina i koje nisu prolazile kroz membrane od pergamenta, nazvao je koloidima (prema grč. kollao − tutkalo).
Dijaliza se rabi za odvajanje otpadnih tvari iz krvi osoba s oštećenjem bubrega. Radom bubrega iz krvi se uklanja urea i druge otpadne tvari. Ako bubrezi ne rade dovoljno efikasno u krvi se poveća koncentracija uree i drugih kristaloida, što ugrožava život bolesnika. Takvi se bolesnici podvrgavaju hemodijalizi. Krvotok se skrene iz tijela i propušta kroz dijalizator koji sadržava šuplja vlakna kroz koja protječe krv. Oko snopa od tisuća tih vlakana, koja služe kao polupropusna membrana za dijalizu, u suprotnom smjeru struji sterilna otopina u kojoj je koncentracija svih za život važnih kristaloida jednaka koncentraciji istih kristaloida u krvi. Tako se otpadne tvari difuzijom kroz polupropusnu membranu polagano uklanjaju iz krvi bolesnika. Shematski prikaz postupka hemodijalize pogledajte na adresi: hr.wikipedia/Hemodijaliza
4.1. Vrste koloidnih otopina
Koloidni sustavi sastoje od najmanje dvije faze od kojih je jedna homogeno disperzno sredstvo u kojem je druga, tj. dispergirana faza, raspršena u obliku koloidnih čestica. Razlike u svojstvima pravih i koloidnih otopina uzrokovane su veličinom čestica. Prava otopina sadržava zasebne molekule ili ione promjera manjeg od nanometra (10−9 m), dok koloidna otopina sadržava čestice promjera od 10−9 do 10−6 m. No molekule mogu biti tako velike da se njihove otopine mogu smatrati koloidnima. Takve su otopine želatine i drugih polimera. Čestice veće od 10−7 m, vide se pod optičkim mikroskopom, pa se svrstavaju u grubo disperzne sustave.
Najčešći koloidni sustavi jesu oni u kojima je kruta faza dispergirana u tekućoj. Takav se koloidni sustav (otopina) naziva sôl. Mnogobrojni industrijski prehrambeni i kozmetički proizvodi su koloidni sustavi, primjerice mlijeko i majoneza, šamponi, kreme za sunčanje, boje i lakovi. Neki najvažniji koloidni sustavi navedeni su u tablici 4.1.
4.1 Primjeri nekih koloidnih sustava
|
Disperzno sredstvo |
Dispergirana faza |
Naziv sustava |
Primjer |
|
plin |
tekućina |
magla |
magla, smog |
|
plin |
krutina |
aerosol |
smog, dim |
|
tekućina |
plin |
pjena |
sapunica |
|
tekućina |
tekućina |
emulzija |
mlijeko, majoneza |
|
tekućina |
krutina |
sôl, gel |
boje, lakovi |
|
krutina |
plin |
kruta pjena |
plovućac |
|
krutina |
tekućina |
kruta emulzija |
opal, biser |
|
krutina |
krutina |
kruti sôl |
crni kvarc, obojeni dijamanti |
Koloidne su otopine stabilne zbog električnog naboja ili zbog ovojnice molekula otapala oko koloidne čestice. Ovisno o naboju iona adsorbiranih na površini, koloidne čestice u električnom polju putuju prema katodi ili anodi. Kad se električni naboj čestica neutralizira dodatkom iona suprotnog naboja koji će se adsorbirati na njihovu površinu, čestice će se slijepiti pa će koloidno disperzni sustav prijeći u grubo disperzni. Primjerice, za pročišćavanje zamućene vode upotrebljava se otopina aluminijeva sulfata. Na negativno nabijene čestice gline adsorbiraju se ioni Al3+(aq) te tako neutraliziraju njihov naboj. Električki neutralne koloidne čestice gline međusobno se sljepljuju u veće, grubo disperzne, pa se talože. Kaže se da je došlo do koagulacije koloidno disperznog sustava. Dobro je poznata upotreba stipse (alauna), kalijeva aluminijeva sulfata dodekahidrata, KAl(SO4)2·12H2O, kao štapića za zaustavljanje krvarenja pri brijanju. Koloidne čestice proteina u krvi imaju negativan naboj. Kad stipsa dođe u doticaj s krvi, ioni Al3+(aq) adsorbiraju se na koloidne čestice, neutraliziraju njihov negativni naboj čime pomažu zgrušavanju krvi.
Koloidni su sustavi u prirodi, a posebno u onoj živoj, vrlo rašireni. S obzirom na interakciju s otapalom koloidi se dijele na liofilne i liofobne, tj. one koji privlače otapalo i one koji ga odbijaju. Ako je otapalo voda tad je riječ o hidrofilnim i hidrofobnim sôlovima. Hidrofilni sôlovi najsličniji su otopinama. Velike molekule u ljudskom tijelu, kao što su enzimi i antitijela, hidrofilne su koloidne čestice. Stabilnost duguju električnom naboju i interakciji s vodom. Te su čestice naime građene tako da su nepolarne skupine okrenute prema njihovoj unutrašnjosti, dok se na površini nalaze polarne skupine koje sadržavaju kisik i dušik. Površina tako građenih čestica hidrofilna jer se molekule vode vodikovim vezama vežu na polarne skupine. Hidrofilni sôlovi ne talože se ako im se doda manja količina elektrolita. Postaju nestabilni te se flokuliraju tek kad se ošteti ili odstrani ovojnica otapala. To se može postići dodatkom većih količina elektrolita ili organskih tekućina koje se miješaju s vodom. Upamtite! Izbijanje naboja koloidnih čestica zove se koagulacija, a rast skoro neutralnih čestica u veće nakupine (flokule) zove se flokulacija.
Pribor i kemikalije: čaša od 400 mL, menzura od 50 mL, stakleni štapić, željezni tronožac, staklokeramička pločica, plamenik, otopina željezova(III) klorida, w(FeCl3) ≈ 2 %, otopina natrijeva sulfata, w(Na2SO4) ≈ 5 %, destilirana voda.
Postupak
- U čašu s 200 mL kipuće destilirane vode uz miješanje dodajte 10 do 20 mL 2−postotne otopine željezova(III) klorida. Nastavite sa zagrijavanjem još nekoliko minuta. Uočite i obrazložite promjene.
- U dobivenu koloidnu otopinu željezova(III) hidroksida uz snažno miješanje staklenim štapićem dodajte nekoliko mililitara otopine natrijeva sulfata. Uočite i obrazložite promjene.

Slika 4.1. a) Pozitivni sôl željezova(III) hidroksida. b) Dodavanjem natrijeva sulfata koloidna otopina prelazi u grubo disperzni sustav.
U vrlo razrijeđenoj vodenoj otopini ioni Fe3+(aq) podliježu hidrolizi pri čemu nastaje pozitivno nabijeni sôl željezova(III) hidroksida. Ioni s višestrukim negativnim nabojem, kao što je ion SO42─, adsorbiraju se na površini koloidno dispergiranih čestica i neutraliziraju njihov naboj. Zbog toga sôl više nije stabilan pa nastaje pahuljasti talog željezova(III) hidroksida. Doda li se previše otopine natrijeva sulfata može doći do promjene naboja koloidnih čestica pa neće doći do taloženja.
Hidrofobni sôlovi mogu se stabilizirati adsorpcijom iona na površinu. Čestice istoimenog električnog naboja međusobno se odbijaju. Stoga se ne sudaraju, ne postaju veće i ne talože se. Hidrofobne čestice u vodenoj otopini mogu se stabilizirati i dodatkom hidrofilnih molekula koje će se adsorbirati na njihovu površinu. Uzmimo za primjer majonezu. Ako smjesu ulja i vode snažno izmiješamo, primjerice štapnim mikserom, nastat će emulzija ulja u vodi. No čestice ulja za čas će se spojiti u veće kapljice i isplivati na površinu vode. Stoga se majoneza, tj. emulzija ulja u vodi, stabilizira dodatkom jajeta. Molekule proteina jajeta adsorbiraju se na površinu koloidno dispergiranih čestica ulja tako da svoje hidrofobne dijelove okrenu prema ulju, a hidrofilne prema vodi. Time hidrofobne čestice ulja, čija je površina zamaskirana molekulama proteina, postaju hidrofilne, a majoneza stabilan koloidno-disperzni sustav. Na sličan način molekule proteina u mlijeku stabiliziraju raspršene čestice masti: tučenje maslaca proces je flokulacije!
Pribor: čaša od 250 mL, stakleni štapić, 2 epruvete, kapaljka, etanol, kolofonij ili borova smola.
Postupak
- Stavite u epruvetu komadić kolofonija ili borove smole, ne veći od dva zrna riže.
- Dodajte 3 do 5 mL etanola i mućkajte dok se kolofonij ili borova smola ne otopi.
- Napunite čašu običnom vodom. Neprekidno miješajući staklenim štapićem dokapavajte u vodu otopinu kolofonija u alkoholu dok ne zamijetite da voda u čaši opalescira.
- Napunite epruvetu dobivenom otopinom i ostavite da stoji nekoliko dana. Je li se otopina razbistrila? Objasnite promjenu.
Dvije su temeljne metode priprave koloidnih sustava: kondenzacija i disperzija. U prethodnom pokusu primijenjena je metoda kondenzacije. Kolofonij je kruta smjesa različitih smolastih tvari koje preostaju nakon destilacije borove smole. Dobro je topljiv u etanolu, ali potpuno netopljiv u vodi. Kad se otopina kolofonija izlije u vodu, voda se zamuti. Alkohol iz otopine s kolofonijem "pobjegne" u vodu, a molekule smolastih tvari, koje sačinjavaju kolofonij, skupljaju se u vrlo sitne krute čestice. Nastaje koloidna otopina. Voda je tekuće disperzno sredstvo, a kolofonij kruta dispergirana faza. Kao što smo već kazali, takav se sustav naziva sôl. Kolofonij je u vodi netopljiv pa se kaže da je nastao hidrofobni sôl (grč. hydor − voda + fobeo − bojim se). Zbog termičkoga gibanja koloidne čestice kolofonija se sudaraju, međusobno sljepljuju u veće i padaju na dno posude. Zato se nakon nekog vremena koloidna otopina kolofonija razbistri.
Uljane boje i lakovi također su koloidni sustavi. Pripremaju se dugotrajnim mljevenjem smjese lanenog ulja i anorganskog pigmenta, primjerice rutila, TiO2, za bijelu boju. Laneno ulje je tekuće disperzno sredstvo, a pigment kruta dispergirana faza. Uljana je boja također hidrofobni sôl. (Napomena: Titanijev dioksid kristalizira u tri modifikacije kao rutil, anatas i brukit, od kojih rutil ima najbolja optička svojstva. Zato se rabi kao pigment za bijelu boju. Sastojak je pilula mnogih lijekova, paste za zube, krema za sunčanje i dr.)
Pribor: stalak s epruvetama, otopina c(AgNO3) = 0,01 mol L−1, otopina c(NaCl) = 0,01 mol L−1, 3 menzure ili graduirane pipete ili injekcione štrcaljke od 10 mL, želatina, čaša od 100 mL.
Postupak
- U čašu od 100 mL ulijte oko 20 mL destilirane vode i dodajte 0,1 g želatine. Pustite da želatina bubri oko pola sata, a zatim zagrijte tako da dobijete bistru otopinu. U međuvremenu pripremite četiri epruvete.
- U prvu epruvetu odmjerite 5, a u ostale epruvete po 1 mL otopine srebrova nitrata. Nastojte što točnije odmjeriti zadani volumen otopine.
- Čistom injekcionom štrcaljkom u prvu epruvetu dodajte 9 u drugu 13 a u treću 9 mL destilirane vode. U četvrtu epruvetu dodajte 13 mL mlačne otopine želatine. Ne miješajte sadržaj epruveta.
- Upotrijebite čistu injekcionu štrcaljku. U prvu i drugu epruvetu dodajte po 1 mL, u treću 5, a u četvrtu 1 mL otopine natrijeva klorida. Začepite epruvete i promiješajte njihov sadržaj tako da epruvete okrenete gore − dolje 5 puta. Tijekom sljedećih petnaestak minuta promatrajte kako se mijenja zamućenje u pojedinim epruvetama.
- Nakon što ustanovite razlike u zamućenju otopina ispitajte što se događa s otopinama ako ih se izloži jakoj Sunčevoj ili umjetnoj svjetlosti. Nakon 5 ili najviše 10 minuta uočit ćete da su otopine u pojedinim epruvetama različito potamnile.

Slika 4.2. Izgled koloidnih otopina srebrova klorida
4.1. Sastav smjesa u epruvetama
|
Epruveta |
Volumen otopine AgNO3 |
Volumen destilirane vode |
Volumen otopine želatine |
Volumen otopine NaCl |
|
1. |
5 |
9 |
− |
1 |
|
2. |
1 |
13 |
− |
1 |
|
3. |
1 |
9 |
− |
5 |
|
4. |
1 |
− |
13 |
1 |
U sve četiri epruvete nastala je jednaka količina srebrova klorida. Različito zamućenje (opalescenciju) pripremljenih koloidnih otopina lako je objasniti. Prva epruveta sadržava višak srebrova nitrata. Zato se na površini čestica srebrova klorida adsorbiraju ioni Ag+ pa čestice dobiju pozitivan električni naboj. Kako se čestice istoimenog električnog naboja međusobno odbijaju koloidna otopina ostaje dugo stabilna.
U drugoj epruveti natrijev klorid i srebrov nitrat trebali bi biti u ekvivalentnom omjeru. Stoga treba pažljivo odmjerili jednake volumene otopina jednakih koncentracija srebrova nitrata i natrijeva klorida. U tom slučaju čestice srebrova klorida ne će imati električni naboj i ne će se odbijati. Potpomognute toplinskim gibanjem te će se čestice sudarati i nakupljati (aglomerirati) u veće. Veće čestice jače raspršuju svjetlost pa se čini da je u toj epruveti nastalo više taloga. Takva koloidna otopina relativno brzo prijeđe u grubodisperzni sustav.
U trećoj se epruveti višak iona Cl− adsorbira na površinu koloidnih čestica i daje im negativni električni naboj. Čestice istoimenog električnog naboja međusobno se odbijaju te će zato koloidna otopina ostati dugo stabilna.
No četvrta epruveta sadržava srebrov nitrat i natrijev klorid u ekvivalentnom omjeru. Očekivali bismo da će se sadržaj ove epruvete zamutiti jednako brzo kao u drugoj epruveti. No otopina u četvrtoj epruveti pokazuje najslabiju opalescenciju, iako je količina srebrova klorida u svim epruvetama jednaka. Otopina ostaje dugo stabilna stoga što sadržava želatinu koja sama tvori hidrofilni sôl. Želatina se adsorbira na površinu hidrofobnih čestica srebrova klorida i tako ih učini hidrofilnima. Kaže se da želatina djeluje kao zaštitni koloid.
Kad se pripremljene koloidne otopine izlože jakoj svjetlosti sadržaj prve epruvete najviše potamni, a druge i četvrte nešto manje. Sadržaj treće epruvete gotovo ne mijenja boju. Djelovanjem svjetlosti srebrov klorid se raspada na elementarno srebro i klor. Pojava je najizraženija u prvoj epruveti gdje su ioni Ag+ adsorbirani na površini koloidnih čestica AgCl. U trećoj epruveti na površini koloidnih čestica adsorbirani su ioni Cl− i zato svjetlost na njih najmanje djeluje.
Opisana svojstva koloidnih čestica srebrova klorida nalaze primjenu u fotografiji. Svi fotografski filmovi sadržavaju koloidne čestice srebrovih halogenida u želatini. Djelovanjem svjetlosti dolazi do raspada srebrova halogenida na površini koloidnih čestica na srebro i halogen. (U tom procesu i sama želatina ima određenu ulogu.) Tako nastaje latentna slika koja se sastoji od nakupina od po desetak atoma srebra koji djeluju kao centri kristalizacije srebra tijekom procesa „razvijanja“. Jače osvijetljena čestica sadržava više takvih centara i brže se reducira u elementarno srebro. Neosvijetljene čestice sporo se reduciraju u elementarno srebro. Tako se dobije negativ. Ono što je u naravi svijetlo, na negativu je zatamnjeno, i obratno, ono što je u naravi tamno na negativu je svijetlo.
4.3. Optička svojstva koloidnih otopina
J. Tyndall (1820. − 1893.) i M. Faraday (1791. − 1867.) otkrili su 1857. da se pri prolazu kroz koloidne otopine svjetlost raspršuje. Ta se pojava zove Tyndallov efekt, a dobro je uočljiva ako se promatra u smjeru okomitom na smjer širenja svjetlosti. Na koloidnim česticama jače se raspršuje svjetlost manje valne duljine (plavi dio spektra) nego svjetlost veće valne duljine (crveni dio spektra).

Slika 4.3. Prava je otopina optički prozirna. Laserska zraka svjetlosti rasprši se na koloidnim česticama srebrova klorida i česticama "dima" od amonijeva klorida.
Plava boja neba potječe od Sunčeve svjetlosti raspršene na molekulama dušika i kisika i česticama prašine u atmosferi. Kad je Sunce u zenitu svjetlost prolazi kroz tanji sloj atmosfere. Pritom se plavi dio spektra jače raspršuje od crvenog. Stoga je nebo plavo. Pri izlasku i zalasku Sunca svjetlost prolazi kroz deblji sloj atmosfere. Pritom se još više plave svjetlosti rasprši pa do nas neposredno dopire narančasti i crveni dio spektra.
4.4. Hidrofilni gel
Želatina i agar−agar bubre, a u toploj se vodi i otapaju. Dobivenu koloidnu otopinu također svrstavamo u hidrofilni sôl jer sadržava vrlo velike molekule proteina, dakle krute čestice dispergirane u vodi. Kad se otopina želatine ili agar−agara ohladi nastaje gel. Pri višoj temperaturi, u sôlu, molekule proteina kreću se slobodno, neovisno jedna o drugoj. Kad se sôl želatine ili agar−agara ohladi, velike molekule proteina čine mrežastu strukturu unutar koje su uklopljeni grozdovi molekula vode. Zato gel ne teče.
Pribor i kemikalije: čaša od 200 mL, laserski pokazivač, staklokeramička pločica, tronožac, plamenik, stakleni štapić, želatina, destilirana voda.
Postupak
- Ulijte u čašu oko 100 mL destilirane vode i dodajte 2 g želatine kakva se rabi u domaćinstvu. Promiješajte i pustite da želatina buri najmanje pola sata.
- Nabubrenu želatinu lagano zagrijavajte, najbolje u vodenoj kupelji, dok se ne otopi.
- Laserskim snopom ispitajte svojstva dobivene otopine. Je li to prava ili koloidna otopina?
- Pustite da se želatina spontano ohladi. Otopina će se skrutnuti u gel, masu sličnu hladetini, koja ne teče kada čašu okrenute otvorom prema dolje. Ispitajte laserom svojstva dobivenog gela. Obrazložite opažanja.

Slika 4.4. Ohlađena otopina želatine tvori hidrofilni gel velike viskoznosti
Polaganim hlađenjem otopina želatine prelazi u polukruto stanje koje nazivamo gel. U gelu su dugačke molekule proteina međusobno povezane vodikovim vezama u trodimenzijsku mrežu unutar koje su uklopljeni grozdovi molekula vode. Ako hidrofilni gel želatine ugrijemo opet ćemo dobiti sôl. Trodimenzijska mreža može nastati zbog kemijskih veza i fizikalnih interakcija između molekula. Gel može biti mekan poput hladetine i krut poput silikagela. Silikagel se najčešće rabi kao sredstvo za sušenje.
Metode dobivanja koloidnih sustava. Liofilni i liofobni koloidi.
Metode pročišćavanja koloidnih sustava. Ultrafiltracija, dijaliza, elektrodijaliza.
Optička i električna svojstva koloida.
Fotografija temeljena na fotoosjetljivosti srebrovih halogenida.
Koloidne otopine u medicini.
Koloidni sustavi u kozmetici.
Koloidni sustavi u prehrambenoj industriji.
Izradite plakat, PowerPoint prezentaciju, snimite video, održite predavanje u razredu, organizirajte raspravu, pišite u školskom listu ili pokrenite neku aktivnost u vezi odabrane teme.
5. KEMIJSKA PROMJENA I ENERGIJA
Pri svakoj kemijskoj i fizičkoj promjeni uvijek dolazi do izmjene energije između promatranog sustava i okoline. Ta se izmjena energije najčešće očituje u oslobađanju ili vezanju topline. Neke kemijske reakcije moguće je provesti tako da se umjesto topline dobiju ili troše drugi oblici energije, primjerice svjetlost ili električna energija. Kemijska ili fizička promjena pri kojoj se energija oslobađa zove se egzotermna promjena (grč. exo − van + thermos − topao). Fizička ili kemijska promjena pri kojoj se energija izvana (iz okoline) dovodi u reakcijski sustav naziva se endotermna promjena (grč. endo = unutra). Pod sustavom kemičar uvijek razumije reakcijsku posudu, epruvetu, čašu ili tikvicu s reaktantima. Okolina može biti sve ono što nije sustav: zrak, čaša s vodom u koju je uronjena epruveta, čaša ili tikvica s reaktantima.
Pribor i kemikalije: epruveta, plamenik, kapalica, štipaljka za epruvete, limunska kiselina.
Postupak
- Uspite u epruvetu toliko limunske kiseline da dobijete stupac visine oko 4 cm.
- Kapalicom postepeno dodajte kap po kap vode tako da kristali limunske kiseline budu samo potopljeni. Rukom ili termometrom ustanovite je li se smjesa vode i limunske kiseline ugrijala ili ohladila.
- Zagrijavajte sadržaj epruvete uz neprekidno potresanje dok se svi kristali ne otope.
- Epruvetu s otopinom ohladite pod tekućom vodom (bez potresanja) ili je stavite u stalak za epruvete da se spontano hladi. Uočite jesu li se pojavili kristali limunske kiseline.
- Protresite sadržaj epruvete. Postoji vjerojatnost da će nakon potresanja doći do izlučivanja kristala. Ako se ni nakon potresanja sadržaja epruvete ne pojave kristalići, a to se najčešće događa, ubacite u otopinu samo jedan kristalić limunske kiseline. Protresite sadržaj epruvete i prema svjetlu promatrajte pojavljivanje sjajnih kristalića limunske kiseline.
- Rukom ili termometrom uočite promjenu temperature do koje dolazi tijekom kristalizacije limunske kiseline.
- Nakon provedenog pokusa epruvetu s limunskom kiselinom spremite. S istim uzorkom limunske kiseline pokus se može više puta ponoviti.

Slika 5.1. Endotermna i egzotermna promjena. Otapanje i kristalizacija prezasićene otopine limunske kiseline
Limunska je kiselina jako topljiva u vodi. Pri 22 °C u 100 g vode otapa se čak 133 g limunske kiseline. Kad se u epruvetu s limunskom kiselinom doda malo vode dio kristala se otopi. Pritom se snizi temperatura što se može osjetiti rukom. Dakle, otapanje limunske kiseline u vodi je endotermna promjena. Naprotiv, tijekom kristalizacije temperatura se povisi. Prema tome kristalizacija limunske kiseline iz prezasićene otopine je egzotermna promjena.
Razmotrimo, korak po korak, što se događalo u epruveti tijekom izvođenja pokusa. Već znamo da ioni i molekule u kristalnoj strukturi mogu samo titrati oko ravnotežnih položaja na kojima ih održavaju jake elektrostatske privlačne sile. S druge strane čestice u otopini gibaju se nasumično dok među njima djeluju slabije elektrostatske privlačne i odbojne sile. Ukupnost svih gibanja i svih interakcije u reakcijskom sustavu naziva se unutarnjom energijom sustava i označava znakom U. Unutarnja energija sustava ovisi o tlaku i temperaturi te o broju i vrsti jedinki koje se nalaze u sustavu. Ona je određena stanjem sustava, a ne načinom na koji je to stanje postignuto. Nema načina kojim bismo mogli izmjerili ukupnu unutarnju energiju nekog sustava, ali moguće je izmjeriti promjenu unutarnje energije, ΔU, tijekom kemijske ili fizičke promjene, jer ona ovisi o početnoj i konačnoj temperaturi sustava:
ΔU = Ukonačno - Upočetno
Na temelju provedenog pokusa (5.1.) i kvalitativnih opažanja možemo doći do važnih zaključaka.
- U prvom koraku kristali limunske kiseline i voda imali su jednaku, tj. sobnu temperaturu.
- Kad smo na kristale dodali malo vode rukom smo mogli osjetiti da se sadržaj epruvete ohladio. Zašto je to tako? Kao prvo, pri otapanju tvari treba savladati elektrostatske privlačne sile koje molekule ili ione drže u kristalu. Za taj je proces potrebno utrošiti energiju. Nadalje, prijelazom u otopinu čestice dobivaju kinetičku energiju. Kako nema dovođenja energije (topline) izvana, mora doći do preraspodjele energije unutar sustava. Zato se smanjuje prosječna kinetička energija čestica, što se očituje sniženjem temperature otopine. (Prisjetimo se: Prema zakonu o očuvanju energije zbroj svih oblika energije u izoliranom ili zatvorenom sustavu je konstantan. Energija se ne može stvoriti ni iz čega niti uništiti. Može samo prelaziti iz jednog oblika u drugi.)
- U trećem smo koraku sadržaj epruvete zagrijavali, tj. izvana dovodili energiju. Dovedena se toplina trošila na savladavanje elektrostatskih privlačnih sila u preostalim kristalima te na povećanje kinetičke energije čestica u otopini. Povećala se unutarnja energija sustava jer smo izvana doveli toplinu.
- U četvrtom smo koraku epruvetu postavili u stalak i pustili da se spontano hladi. Toplina uvijek prelazi s toplijeg na hladnije tijelo sve dok se temperature oba tijela ne izjednače. Unutarnja energija sustava se snizila, ali sustav još nije u ravnoteži. Nastala je metastabilna prezasićena otopina.
- U petom smo koraku u prezasićenu otopinu ubacili kristalić limunske kiseline te potaknuli kristalizaciju. Kinetička energija čestica u kristalu manja je nego u otopini. Kako je zbroj svih oblika energije u izoliranom ili zatvorenom sustavu konstantan, moralo je doći do povećanja kinetičke energije čestica u otopini. To se očitovalo povišenjem temperature.
Vidi na Internetu: e-Kemija: Sikirica - Endotermna promjena
5.1. Kalorimetar
Odvija li se neka kemijska reakcija uz oslobađanje ili vezanje topline, tj. je li reakcija egzotermna ili endotermna, mjeri se kalorimetrom. Kalorimetar je reakcijska posuda, čaša ili tikvica, toplinski dobro izolirana od okoline tako da se spriječi prijenos topline između okoline i kalorimetra. Slika 5.2. shematski prikazuje konstrukciju laboratorijskog kalorimetra s bombom. Sastoji se od vanjske i unutarnje posude s vodom. Unutarnja posuda je dobro toplinski izolirana od vanjske posude te sadržava određenu količinu vode koja se tijekom pokusa miješa miješalicom.
Slika 5.2. Shematski prikaz laboratorijskog kalorimetra kakav se rabi za mjerenje topline izgaranja uzoraka. Uzorak se pali električnim putem.
Bitan dio kalorimetra je kalorimetarska bomba, tj. posuda debelih stijenki izrađena od nehrđajućeg čelika koja se može hermetički zatvoriti. Odvagani uzorak za spaljivanje stavi se u kalorimetarsku bombu i hermetički zatvori. "Bomba" se potom napuni kisikom pod visokim tlakom (30 bar). Pripremljena "bomba" uroni se u vodu u unutarnjoj posudi kalorimetra. Kad se ustali temperatura vode u unutarnjoj posudi kalorimetra, električnom strujom zapali se uzorak i izmjeri prirast temperature vode. (Prethodno je potrebno odrediti toplinski kapacitet kalorimetra, tj. toplinu koju je potrebno dovesti u kalorimetar da se njegova temperatura povisi za 1 °C. Toplinski kapacitet kalorimetra može se odrediti primjerice spaljivanjem uzorka čiste tvari čija je toplina izgaranja poznata.) Na temelju poznatog toplinskog kapaciteta kalorimetra i izmjerenog prirasta temperature izračuna se koliko se topline oslobodilo ili vezalo tijekom kemijske ili fizičke promjene.
Pribor i kemikalije: Plastična čaša od 100 mL (unutarnja čaša kalorimetra), Plastična čaša od 150 mL (vanjska čaša kalorimetra), kartonski poklopac s rupom za termometar, termometar od 0 do 100 °C, 2 injekcijske štrcaljke od 20 mL, otopina magnezijeva klorida, c(MgCl2) = 1 mol L−1, otopina natrijeva karbonata, c(Na2CO3) = 1 mol L−1. Pripremljene otopine ostavite stajati preko noći kako bi poprimile sobnu temperaturu.
Postupak
- Pripremite jednostavan kalorimetar kakav je prikazan na slici 5.3.
- Odmjerite injekcionom štrcaljkom 20 mL otopine natrijeva karbonata i ulijte u posudu kalorimetra.
- Poklopite kalorimetar kartonskim poklopcem s rupicom. Kroz rupicu provucite termometar. Miješajte otopinu termometrom i svakih pola minute odčitajte i zabilježite temperaturu tijekom 3 minute. Nemojte strugati termometrom po dnu čaše.
- Otklopite na trenutak kalorimetar te injekcijskom štrcaljkom dolijte 20 mL otopine magnezijeva klorida. Poklopite kalorimetar i miješajte reakcijsku smjesu termometrom. Nastavite odčitavati i bilježiti temperaturu reakcijske smjese svakih 15 sekundi i to tijekom sljedećih 3 do 4 minute.
- Odredite korigirani skok temperature kalorimetra tako da na milimetarskom papiru na apscisu nanesete vrijeme u minutama (1 cm = 1 minuta), a na ordinatu temperaturu u °C (1 cm = 1 °C). Spojite točke kako biste dobili krivulju promjene temperature tijekom pokusa. Povucite pravac kroz one točke na grafikonu koje pokazuju temperaturu otopine u vremenu do 3 minute. Drugi pravac povucite kroz točke za koje pokazuju linearni pad temperature nakon dodavanja magnezijeva klorida.
- Odčitajte razliku ordinata na mjestu gdje su površine između krivulje i lijevo i desno od pravca paralelnog s ordinatom jednake. Dobivena vrijednost odgovara korigiranom skoku temperature kalorimetra. (Vidi sliku 5.4.)
- Napišite jednadžbu reakcije iona Mg2+(aq) s ionima CO32−(aq) pri čemu nastaje talog magnezijeva karbonata, MgCO3(s).
- Pretpostavite da se sva toplina troši samo na
zagrijavanje otopine. Uzmite da je gustoća otopine natrijeva karbonata 1,10 g
mL−1, a magnezijeva
klorida 1,07 g mL−1.
Pretpostavite da je specifični toplinski kapacitet otopine
jednak specifičnom toplinskom kapacitetu vode, cp(H2O)
= 4,187 J g−1 K−1. Izračunajte toplinu, qp, koja se
je oslobodila u kalorimetru prema jednadžbi:
qp = m(otop.) × cp(H2O) × ΔT.

Slika 5.3. Jednostavan kalorimetar. Jednom rukom pridržavajte vanjsku posudu kalorimetra a drugom pridržavajte termometar i kartonski poklopac te kružnim pokretima miješajte reakcijsku smjesu u čaši. Ne stružite termometrom po stijenkama čaše već samo miješajte reakcijsku smjesu.
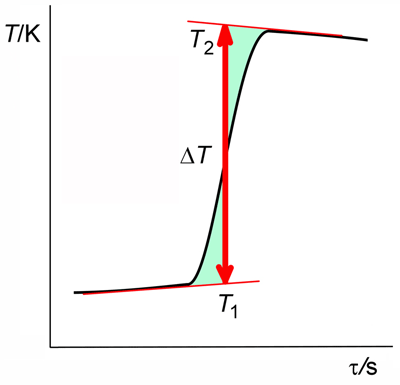
Slika 5.4. Određivanje korigiranog skoka temperature kalorimetra
5.2. Toplinski kapacitet
Toplinski kapacitet pri stalnom tlaku, Cp, nekog uzorka iskazuje se kao omjer apsorbirane topline, qp, i prirasta temperature, ΔT, tog uzorka:
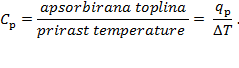
Jedinica toplinskog kapaciteta je J K−1. Nije svejedno mjeri li se toplinski kapacitet pri stalnom tlaku ili pri stalnom volumenu. Razlike toplinskog kapaciteta pri stalnom tlaku ili stalnom volumenu kod krutina i tekućina neznatne su, ali su kod plinova značajne. Kad se neka fizička veličina izmjeri pri stalnom tlaku tad se iza njezina simbola stavlja donji indeks (subskript) „p“. Ako je ista fizička veličina izmjerena pri stalnom volumenu, tad se iza njezina simbola stavlja indeks „V“. U prethodnom primjeru za toplinski kapacitet upotrijebljen je simbol Cp, što znači da se do tog rezultata došlo mjerenjem pri stalnom tlaku. Većina mjerenja u kemijskom laboratoriju izvodi se pri stalnom, tj. atmosferskom tlaku, jer je to jednostavnije. Kalorimetrom na slici 5.2. mjeri se toplina koja se oslobodi pri stalnom volumenu.
Iskazani toplinski kapacitet, Cp, odnosi se na točno određeni predmet, sustav ili kalorimetar. Ne zanima nas od čega je predmet ili kalorimetar načinjen, kolika je njegova masa ili volumen. Želimo samo znati koliko je topline potrebno dovesti tom predmetu ili kalorimetru da se njegova temperatura povisi za 1 K.
Kemičari mnogo češće rabe specifični toplinski kapacitet. To je toplina potrebna da se jednom gramu neke tvari temperatura povisi za 1 K. Tako je pri sobnoj temperaturi i atmosferskom tlaku specifični toplinski kapacitet vode cp(H2O) = 4,187 J g−1 K−1, olova cp(Pb) = 0,126 J g−1 K−1, aluminija cp(Al) = 0,896 J g−1 K−1.
Molarni toplinski kapacitet, Cp,m, jest toplina koju je potrebno utrošiti da se jednom molu tvari temperatura povisi za 1 K. Molarni toplinski kapacitet vode pri sobnoj temperaturi i atmosferskom tlaku iznosi Cp,m(H2O) = 75,42 J K−1 mol−1, olova Cp,m(Pb) = 26,08 J K−1 mol−1, aluminija Cp,m (Al) = 24,19 J K−1 mol−1. Toplinski kapacitet raste porastom temperature.
Rješenje: Molarni toplinski kapacitet natrijeva klorida dobijemo tako da specifični toplinski kapacitet pomnožimo molarnom masom natrijeva klorida:
![]()
5.3. Rad i toplina
Zatvoreni sustav može energiju razmjenjivati s okolinom samo na dva načina, kao rad, w, i kao toplinu, q. Kad sustav dobiva energiju iz okoline, unutarnja energije sustava poraste. Prirast unutarnje energije, ΔU, jednak je:
ΔU = Ukonačno - Upočetno = q + w. (5.1.)
Ovdje je q toplina koja je ušla u sustav, a w rad koji je izvršen na sustavu. Veliko grčko slovo Δ označava prirast. Pozitivna vrijednost q i w znači da je energija ušla u sustav, što znači njegov dobitak. Kad promatrani sustav predaje energiju okolini, to je za njega gubitak, pa q i w imaju negativan predznak. Primjerice, djelovanjem klorovodične kiseline na kalcijev karbonat razvija se plinoviti ugljikov dioksid:
CaCO3(s) + 2 HCl(aq) → CaCl2(aq) + CO2(g) + H2O(l).
Razvijeni plin vrši rad nad okolinom jednak produktu tlaka, p, i prirasta volumena, ΔV, te ima negativan predznak u odnosu na sustav:
w = -pΔV. (5.2.)
Prema tome, prirast unutarnje energije, ΔU, za gornju reakciju jednak je:
ΔU = q + w = q - pΔV. (5.3.)
Prirast unutarnje energije sustava moguće je neposredno izmjeriti tako da se kemijska reakcija izvede u zatvorenoj posudi čvrstih stijenki. U tom slučaju ne može doći do prirasta volumena pa sustav ne vrši rad na okolinu. Stoga se može uzeti da je w = 0. Kad se kemijska reakcija provodi pri konstantnom volumenu, kao u kalorimetru s bombom, tada je prirast unutarnje energije sustava jednak toplini, q, koja se tijekom reakcije oslobađa ili veže (ΔU = q).
5.4. Entalpija
Većina kemijskih reakcija, a posebno onih koje se događaju u živim organizmima, odvijaju se pri atmosferskom, tj. konstantnom tlaku. Stoga je iz čisto praktičnih razloga uvedena nova termodinamička funkcija, H, koja se naziva entalpija. Ona je definirana jednadžbom:
H = U + pV. (5.4.)
gdje je U unutarnja energija sustava, p − tlak, V − volumen. No kemičare ne zanima koliki je apsolutni iznos entalpije nekog sustava već samo prirast entalpije, ΔH, tijekom kemijske ili fizičke promjene. Pri konstantnom tlaku prirast entalpije promatranog sustava jest:
ΔH = ΔU + pΔV. (5.5.)
Ako se u ovoj jednadžbi ΔU zamijeni sa q − p ΔV (jednadžba 5.3.) konačno se dobiva:
ΔH = q − p ΔV + p ΔV,
ΔH = q. (5.6.)
Entalpija je toplina oslobođena ili vezana pri konstantnom tlaku.
5.4.1. Entalpija faznih prijelaza
Zagrijava li se uzorak leda, njegova temperatura postupno raste sve do 0 °C. Daljim dovođenjem topline temperatura se ne mijenja, ali se led tali dok konačno sav ne prijeđe u vodu. Tek nakon toga temperatura vode dalje postupno raste. Toplinu potrebnu za taljenje leda doveli smo izvana pa je to dobitak za promatrani sustav. Stoga prirast molarne entalpije taljenja leda ima pozitivan predznak. Obratno, pri zaleđivanju vode toplina prelazi u okolinu, a to je gubitak za promatrani sustav. Stoga prirast molarne entalpije kristalizacije vode ima negativan predznak:
H2O(s) → H2O(l) Δs,lH = +6,01 kJ mol−1,
H2O(l) → H2O(s) Δl,sH = −6,01 kJ mol−1.
Jednako vrijedi i za druge fazne prijelaze (engl. Phase Transitions). Prirast molarne entalpije pri isparavanju vode iznosi Δl,gH = 40,7 kJ mol−1. Obratno, prirast molarne entalpije pri kondenzaciji vodene pare jest Δg,lH = −40,7 kJ mol−1 ili sažetije rečeno:
H2O(l) → H2O(g) Δl,gH = +40,7 kJ mol−1,
H2O(g) → H2O(l) Δg,lH = −40,7 kJ mol−1.
Prirast entalpije pri nekoj fizičkoj ili kemijskoj promjeni ovisi samo o početnom i konačnom stanju sustava. To je zapravo razlika unutarnje energije produkata i unutarnje energije reaktanata. Valja uočiti da nije svejedno jesu li reaktanti ili produkti u plinovitom, tekućem ili krutom agregacijskom stanju. Zato smo u jednadžbama znakom (g) označili da se reaktanti ili produkti nalaze u plinovitu stanju (g – od gas). Kad je tvar u tekućem stanju to se označava znakom (l), što dolazi od lat. Liquidus – tekući. Tvar u krutom stanju označava se znakom (s), što opet dolazi od latinskog solidus – krut. Hidratizirani ioni označavaju se znakom (aq), također prema latinskom aqua – voda.
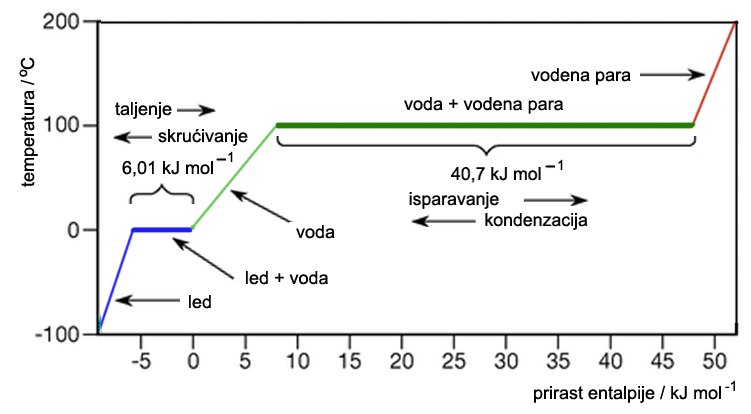
Slika 5.5. Molarna entalpija faznih prijelaza za vodu
Rješenje. Izračunajmo najprije množinu vode sadržanu u 1 kg vode. Molarna masa vode je: M(H2O) = 18,02 g mol−1. Odavde proizlazi:
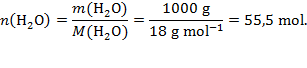
Entalpija isparavanja 1 kg vode je:
Kuhalo za vodu ima snagu 2,2 kW, tj. oslobađa 2,2 kJ s−1. Vrijeme potrebno da se oslobodi 2259 kJ je:
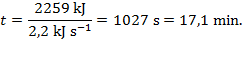
5.4.2. Standardna molarna entalpija stvaranja spoja
Kako bismo mogli jednoznačno govoriti o prirastu entalpije nekog sustava, mora se poznavati njegova temperatura, tlak, agregacijsko stanje i množina tvari. Stoga je uobičajeno uspoređivati standardne molarne entalpije stvaranja (nastajanja) spojeva. Vrijede sljedeće definicije:
Standardne molarne entalpije stvaranja (nastajanja) svih kemijskih elemenata u standardnom stanju jednake su nuli.
Standardna molarna entalpija stvaranja (nastajanja) spoja jednaka je toplini koja se oslobodi kad iz elemenata uzetih u standardnom stanju nastane jedan mol spoja u standardnom stanju.
U ovim se definicijama stalno spominje standardno stanje, a to je temperatura 25 °C (298 K) i tlak 105 Pa.
Rješenje:
O2(g)
+ C(grafit) ![]() CO2(g)
CO2(g) ![]() fHo(CO2(g)
= −393,5 kJ mol−1.
fHo(CO2(g)
= −393,5 kJ mol−1.
Indeks f dolazi od engl. formation = nastajanje.
(Opaska: Pogrešno je engl. formation prevoditi kao stvaranje (engl. creation). Ta je riječ u hrvatskom jeziku rezervirana za Stvoritelja koji stvara ni iz čega. Već smo kazali da pri kemijskim promjenama iz jednih tvari nastaju nove tvari drukčijih fizičkih i kemijskih svojstava. Stoga je bolje reći entalpija nastajanja spoja. Kemijski elementi stvoreni su u Velikom prasku (engl. Big Bang), a njihovim međusobnim spajanjem nastali su ili nastaju kemijski spojevi.)
Upamtimo:
Brojčana vrijednost ΔH u kemijskoj reakciji odnosi se na one množine tvari koje su u jednadžbi reakcije navedene. Upotrijebe li se dvostruke množine reaktanata, prirast entalpije bit će dvostruk. Ako tijekom kemijske reakcije ili fizičke promjene sustav prima toplinu, tad prirast entalpije ima pozitivan predznak, jer je to dobitak za sustav. Ako tijekom kemijske reakcije ili fizičke promjene sustav gubi toplinu, tad prirast entalpije ima negativan predznak jer je to gubitak za sustav.
5.4.3. Hessov zakon
Već smo kazali da je entalpija funkcija stanja. Svejedno je kojim je putem to stanje dostignuto. Standardne entalpije stvaranja (nastajanja) spojeva su izmjerene i može ih se naći u tablicama. Na osnovi podataka iz tablica može se izračunati reakcijska entalpija, a to je prirast standardne entalpije za bilo koju kemijsku reakciju bez obzira na to je li ili nije moguća. (Hoće li se ili neće kemijska reakcija dogoditi ne ovisi o predznaku reakcijske entalpije.) Aditivna svojstva entalpije posljedica su prvog zakona termodinamike, a iskazana su Hessovim zakonom:
Ukupan prirast entalpije nekog niza kemijskih reakcija jednak je ukupnom prirastu entalpije nekog drugog niza kemijskih reakcija ako u oba slučaja polazimo od istih reaktanata i dobivamo iste produkte:
ΔrHo = ΔfHoprodukti - ΔfHoreaktanti
5.4.4. Entalpijski dijagram
Uobičajeno je prirast entalpije, kao i drugih funkcija stanja, prikazivati dijagramom. Na ordinatu se u odgovarajućem mjerilu nanese prirast entalpije, ili koje druge funkcije stanja. Smjer strelice pokazuje predznak prirasta dotične funkcije, kao što to zorno pokazuje slika 5.6.
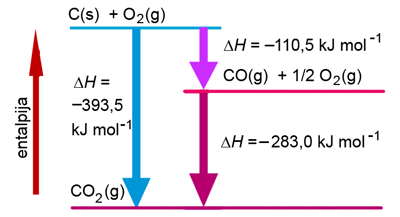
Slika 5.6. Entalpijski dijagram za reakciju ugljika s kisikom
Rješenje:
Neposredno mjerenje entalpije stvaranja (nastajanja) ugljikova monoksida iz elemenata teško je provedivo. No na temelju Hessova zakona entalpiju stvaranja (nastajanja) ugljikova monoksida možemo izračunati. Najprije napišimo obje reakcije:
C(s) + O2(g) → CO2(g) ΔrH = −393,5 kJ mol−1,
CO(g) + ½ O2(g) → CO2(g) ΔrH = −283,0 kJ mol−1.
Donji indeks r u znaku za prirast entalpije kaže nam da je to reakcijska entalpija, što dolazi od engl. reaction − reakcija.
Ako drugu reakciju okrenemo tako da je ugljikov monoksid produkt, dobivamo:
C(s) + O2(g) → CO2(g) ΔrH = −393,5 kJ mol−1,
CO2(g) → CO(g) + ½ O2(g) ΔrH = +283,0 kJ mol−1.
Upamtite! Pri okretanju smjera reakcije mijenja se i predznak reakcijske entalpije.
Zbrojimo li ove dvije jednadžbe i ukinemo jednake članove na obje strane dobivamo:
C(s) + ½ O2(g) → CO(g) ΔrH = −110,5 kJ mol−1.
Tako smo izračunali da je reakcijska entalpija izgaranja ugljika u ugljikov monoksid −110,5 kJ mol−1, a to je ujedno i entalpija stvaranja (nastajanja) ugljikova monoksida, ΔfH(CO(g)) = −110,5 kJ mol−1, što je zorno prikazano entalpijskim dijagramom na slici 5.6.
Rješenje: Napišimo jednadžbu reakcije:
CaCO3(s) → CaO(s) + CO2(g).
Kako je:
ΔrH = ΔfHprodukti − ΔfHreaktanti.
proizlazi:
ΔrH = [(ΔfH(CaO(s)) + ΔfH(CO2(g)] − ΔfH(CaCO3(s))
= {[(−635,1) + (− 393,5)] − (−1206,9)} kJ mol−1
= 178,3 kJ mol−1.
Jednadžba raspada kalcijeva karbonata na ugljikov dioksid i kalcijev oksid glasi:
CaCO3(s) → CaO(s) + CO2(g) ΔrH = 178,3 kJ mol−1.
Rješenje: Najprije ćemo izračunati koliko se topline oslobodilo tijekom reakcije. Iz uvjeta zadatka vidimo da je toplinski kapacitet kalorimetra jednak toplinskom kapacitetu 100 g vode. Kako je specifični toplinski kapacitet vode, cp(H2O) = 4187 J kg−1 K−1, toplina oslobođena tijekom reakcije iznosi:
![]()
![]()
Množine natrijeva hidroksida i klorovodične kiseline u reakciji bile su:
![]()
Molarni prirast topline jednak je:
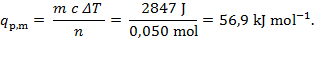
Eksperiment pokazuje da je neutralizacija egzotermna reakcija, pa promjena entalpije ima negativan predznak. Stoga termokemijsku jednadžbu neutralizacije natrijeva hidroksida klorovodičnom kiselinom pišemo ovako:
![]()
Prema točnim mjerenjima entalpija neutralizacije natrijeva hidroksida klorovodičnom kiselinom iznosi -57,1 kJ mol-1.
Vidi na internetu: e-Kemija: Sikirica - Toplina neutralizacije
Izračunajte entalpiju neutralizacije na temelju rezultata eksperimenta. Dobivena vrijednost entalpije,
ΔrH = -62,8 kJ mol-1
veća je od očekivane stoga što su u pokusu upotrijebljene relativno koncentrirane otopine. Naime, razrjeđivanjem koncentriranih otopina kiselina i lužina oslobađa se toplina.
Entalpija otapanja, ΔsolH, (engl. solution) može se jednostavno mjeriti tako da se izmjeri toplina koja se oslobodi ili veže pri otapanju jednog mola tvari. Nije svejedno koliko će se otapala upotrijebiti za otapanje. Primjerice, prirast entalpije otapanja plinovita klorovodika u vodi iznosi ΔsolH = −59,4 kJ mol−1. Dobivena zasićena otopina sadržava 12 mola HCl u litri otopine. Ako se ova koncentrirana otopina razrijedi na pola, oslobađa se daljnjih približno 8 kJ po molu HCl. Prirast entalpije do koje dolazi tijekom razrjeđivanja otopine istim otapalom zove se entalpija razrjeđivanja. Pri otapanju klorovodika u beskonačnoj količini vode prirast entalpije bio bi najveći i iznosio bi ΔsolH = −74,8 kJ mol−1.
Otapanje soli u vodi kojiput se događa uz oslobađanje topline, a kojiput uz trošenje topline. Primjerice, otapanje bezvodnoga natrijeva sulfata u vodi je egzotermna promjena. Prirast entalpije za egzotermne reakcije ima negativan predznak jer je oslobođena toplina gubitak za sustav:
Na2SO4(s) + aq(l) → 2 Na+(aq) + SO42−(aq) ΔsolH = −91,2 kJ mol−1,
MgSO4(s) + aq(l) → Mg2+(aq) + SO42−(aq) ΔsolH = −105.02 kJ mol−1.
Otapanje amonijeva nitrata u vodi je endotermna promjena, pa prirast entalpije ima pozitivan predznak:
NH4NO3(s) + aq(l) → NH4+(aq) + NO3−(aq) ΔsolH = +25,7 kJ mol−1.
Na entalpiji otapanja temelje se "instant hladne vrećice" (engl. instant ice pack) i "instant tople vrećice". Vrećice se sastoje se od dva dijela, u jednom je voda a u drugom amonijev nitrat, za hladne, ili pak bezvodni magnezijev sulfat ili kalcijev klorid za tople vrećice. Kad se vrećica stisne pukne pregrada između soli i vode. Zbog entalpije otapanja reakcijska smjesa se ohladi ili zagrije, ovisno o vrsti soli koja se otapa. Tijekom vremena vrećica poprimi temperaturu okoline.
Slične instant tople vrećice temelje se na kristalizaciji natrijeva acetata trihidrata, CH3COONa·3H2O, iz prezasićene otopine:
Na+(aq) + CH3COO−(aq) → CH3COONa·3H2O(s) ΔcrystH = −19,7 kJ mol−1.
Jednom iskorištenu vrećicu treba zagrijati u vrućoj vodi te potom pustiti da se spontano ohladi. Tako će se opet dobiti metastabilna prezasićena otopina natrijeva acetata.
Vidi na internetu: e-Kemija: Sikirica - Prezasicena otopina NaAc
CaCl2(s) + aq(l) → CaCl2(aq) ΔsolH = ?
Specifični toplinski kapacitet vode je: cp(H2O) = 4,187 J g−1 K−1. Zanemarite toplinski kapacitet kalcijeva klorida.
Rješenje: Množina otopljenog bezvodnoga kalcijeva klorida je:
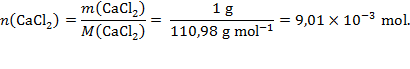
Odavde se za molarnu toplinu otapanja bezvodnoga kalcijeva klorida dobiva:
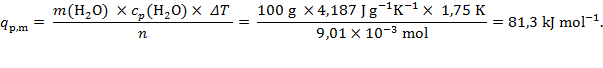
Reakcija je egzotermna pa slijedi:
CaCl2(s) + aq(l) → CaCl2(aq) ΔsolH = −81,3 kJ mol−1.
Entalpija atomizacije, ΔatH, je toplina koja se utroši kad se 1 mol tvari razloži na atome u plinovitu stanju. Atomizacija je endoterman proces pa je ΔatH pozitivna veličina.
Entalpija taljenja, Δs,lH, je toplina koja se utroši za taljenje 1 mola tvari pri temperaturi taljenja i tlaku 105 Pa. Taljenje je uvijek endoterman proces pa je ΔfusH pozitivna veličina (engl. fusion − taljenje).
Entalpija kemijske veze (ili energija veze), ΔrH jest energija koju treba utrošiti da se u molekuli u plinovitu stanju raskine određena vrsta veze pri čemu se oslobođeni atomi nalaze u plinovitu stanju. Primjerice:
H2(g) ➝ 2H(g) ΔrH = 427 kJ mol-1
HCl(g) ➝ H(g) + Cl(g) ΔrH = 427 kJ mol-1
No što se događa ako molekula ima nekoliko kovalentnih veza, a ne samo jednu? Razmotrimo primjerice molekulu metana, CH4, ugljikovodika s četiri jednake C−H veze:
CH4(g) ➝ C(g) + 4H(g) ΔrH = 1,652 kJ mol-1
Čini nam se razumnim da bi sve četiri veze morale imati jednaku entalpiju pa je prosječna entalpija C−H veze u metanu 1.652 kJ mol−1/4 = 413 kJ mol−1. No ako se od molekule metana otkida jedan po jedan atom vodika, potrebne su različite energije za kidanje svake od četiri C−H veze. Svaki put kad se otkine jedan od atoma vodika mijenja se okoliš preostalih atoma što utječe na jakost preostalih veza. Odavde proizlazi da su entalpije veza navedene u tablicama zapravo prosječne entalpije veza.
Tablica 5.1. Primjeri prosječne entalpije nekih kemijskih veza (izvor)
|
Jednostruke veze |
|
Višestruke veze |
|
|
O−O |
146 |
O = O |
495 |
|
C−C |
347 |
C = C |
614 |
|
C−H |
413 |
C ≡ C |
839 |
|
C−O |
358 |
C ≡ O |
1072 |
|
N−O |
201 |
N = O |
607 |
|
N−N |
160 |
N = N |
418 |
|
|
|
N ≡ N |
941 |
|
C−N |
305 |
C = N |
615 |
|
|
|
C ≡ N |
891 |
Na temelju podataka iz tablice 5.1. lako je zaključiti da entalpije dvostruke i trostruke veze nisu dvostruke ili trostruke vrijednosti entalpije jednostruke veze. Primjerice dvostruka C=C i trostruka C≡C veza slabije su od tri jednostruke veze C−C. Time možemo objasniti reaktivnost nezasićenih ugljikovih spojeva. S druge strane trostruka N≡N veza puno je jača od tri jednostruke N−N veze što objašnjava inertnost dušika u kemijskim reakcijama.
N2O4(g)
+ 2 N2H4(l) ![]() 3 N2(g) + 4 H2O(g).
3 N2(g) + 4 H2O(g).
Rješenje:
ΔrH = ΔfHprodukti − ΔfHreaktanti,
ΔrH = [(ΔfH(N2(g)) + ΔfH(H2O(g)] − [ΔfH(N2O4(g)) + 2 ΔfH(N2H4(l))],
ΔrH/kJ
mol−1= [(3![]() 0) + 4
0) + 4![]() −241,8)]
− [9,08 + 2
−241,8)]
− [9,08 + 2 ![]() 50,63] = −1.077,5.
50,63] = −1.077,5.
pa slijedi:
N2O4(g)
+ 2 N2H4(l) ![]() 3 N2(g) + 4 H2O(g)
ΔrH= −1.077,5 kJ mol−1.
3 N2(g) + 4 H2O(g)
ΔrH= −1.077,5 kJ mol−1.
Svaka fizička promjena pri kojoj dolazi do prirasta entalpije ima i svoje ime pa se označava pripadnim znakom, kao što je to već pokazano na nizu primjera.
Vidi na internetu: Energetske promjene pri otapanju i topljivost
Energijske promjene pri otapanju (pdf)
Prisjetite se koje sve izvore energije čovječanstvo danas koristi.
Razmislite o prednostima i nedostacima korištenja pojedinih izvora energije (termoelektrane, nuklearne elektrane ... ) s obzirom na njihov utjecaj na okoliš, ljudsko zdravlje, poljoprivredu, šume, rijeke, izvore pitke vode i dr.
Opišite "goriva" koja se koriste, ili su se koristila pri lansiranju raketa.
Nafta je izvor vrijednih ugljikovodika neophodnih za sintezu polimera. Što će se dogoditi kad izvori nafte presuše? Kako dobiti "sintetski benzin" i druge derivate koje smo prije dobivali iz nafte?
Fischer−Tropschov postupak.
Ekološki prihvatljivi postupci dobivanja vodika kao goriva.
Ukažite na mogućnost korištenja obnovljivih izvora energije u vašem kraju.
Izradite plakat, PowerPoint prezentaciju, snimite video, održite predavanje u razredu, organizirajte diskusiju, pišite u školskom listu ili pokrenite aktivnost u vezi odabrane teme.
6. METALI
Od 118 kemijskih elemenata svaki od njih ima različita kemijska svojstva. Kemijska su svojstva nekih elemenata slična, pa je na osnovi toga Mendeljejev 1869. sastavio periodni sustav elemenata. On je elemente poredao prema porastu njihovih relativnih atomskih masa, ali tako da su se elementi sličnih kemijskih svojstava našli u istoj skupini. Sličnost kemijskih svojstava elemenata iste skupine rezultat je jednake građe valentne ljuske njihovih atoma. Zato ćemo u ovom poglavlju pokušati uočiti neka karakteristična svojstva elemenata i spojeva, predstavnika glavnih skupina periodnog sustava. Upoznat ćemo osnovna načela nazivanja kemijskih spojeva, tj. kemijsku nomenklaturu.
6.1. Alkalijski metali
Prvu skupinu periodnog sustava elemenata čine: litij (Li), natrij (Na), kalij (K), rubidij (Rb), cezij (Cs) i francij (Fr). Nazivamo ih alkalijski metali, a naziv im potječe od arapskog naziva za sodu, al qali, koja se rabila u proizvodnji stakla. Soda, tj. natrijev karbonat, Na2CO3, nekad se dobivala iz pepela biljaka koje sadržavaju više natrija nego kalija. Svi alkalijski metali kristaliziraju po tipu prostorno centrirane kubne rešetke (engl. BCC - Body Centred Cubic Lattice).
Tablica 6.1. Odabrana svojstva alkalijskih metala
|
Element |
Talište t/°C |
Vrelište t/°C |
Gustoća ρ/g cm−3 |
Atomski radijus r/pm |
Ionski radijus r/pm |
Energija ionizacije Ei,m/kJ mol−1 |
|
Li |
180,5 |
1342 |
0,534 |
152 |
90 |
520 |
|
Na |
97,8 |
889 |
0,97 |
186 |
116 |
496 |
|
K |
63,7 |
760 |
0,86 |
227 |
152 |
418 |
|
Rb |
38,9 |
679 |
1,53 |
244 |
166 |
403 |
|
Cs |
28,4 |
690 |
1,88 |
265 |
169 |
356 |

Slika 6.1. Alkalijski metali i njihovi spojevi boje plamen karakterističnim bojama.
Vidi na internetu: e-Kemija: Sikirica - Boje plamena vatromet
Postupak
- Kap otopine soli alkalijskog metala stavite na satno stakalce i približite usisu za zrak plinskoga plamenika.
- Užarenim vrhom željezne žice dotaknite kapljicu. Kapljica će se raspršiti u maglu koju će struja zraka povući u plamen.
- Spojevi alkalijskih metala boje plamen karakterističnim bojama: litij − karmin crveno, natrij − žuto, kalij − ljubičasto.
Zbog male energije ionizacije atoma alkalijski su metali vrlo reaktivni. Dok litij s vodom reagira relativno sporo, natrij reagira burno, kalij se zapali, a rubidij i cezij reagiraju eksplozivno. Svi alkalijski metali s vodom daju jake lužine.
Vidi na internetu: Reactions of the alkali metals with water
Lithium - The Lightest Metal on Earth
Caesium in Water (slow motion)
6.1.1. Litij
Litij ima najmanju gustoću od svih metala, samo 0,534 g cm−3, pa nema organskog otapala pod kojim bi ga mogli čuvati. Na zraku se prevlači slojem litijeva nitrida, Li3N, koji utjecajem vlage i ugljikova dioksida iz zraka prijeđe u vodi netopljiv litijev karbonat, Li2CO3. Litij se rabi za pripremu nekih slitina. Primjerice slitina aluminija s 1 % litija ima čvrstoću i elastičnost osrednjeg čelika.
Rješenje: Jedinična ćelija prostorno centrirane kubne kristalne strukture litija (slika 6.2a.) sadržava jedan atom u središtu i 8 na vrhovima kocke. No atomi na vrhovima kocke samo jednom osminom pripadaju jediničnoj ćeliji. Stoga jedinična ćelija sadržava dva atoma. Atomi se dotiču smjerom prostorne dijagonale kocke, kao što se vidi na slici 6.2a. Odavde proizlazi da je metalni radijus atoma litija (i svih metala koji kristaliziraju na isti način) jednak četvrtini duljine prostorne dijagonale jedinične ćelije.
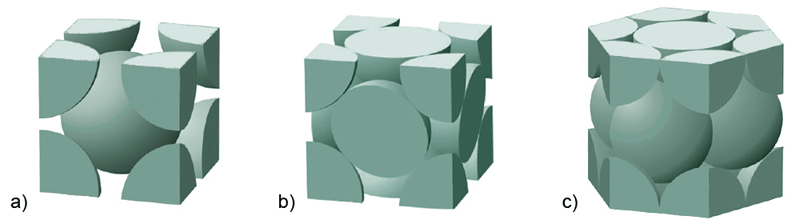
Slika 6.2. Kristalne strukture većine metala. a) Prostorno centrirana kubna slagalina kuglica jednake veličine. Tako kristaliziraju: svi alkalijski metali, vanadij, krom, željezo, niobij, molibden, tantal i volfram. b) Plošno centrirana kubna slagalina kuglica jednake veličine. Tako kristaliziraju: aluminij, kalcij, stroncij, nikal, bakar, rodij, paladij, srebro, iridij, platina, zlato i olovo. c) Heksagonska najgušća slagalina kuglica jednake veličine. Tako kristaliziraju: berilij, magnezij, skandij, titan, kobalt, cink, itrij, cirkonij, tehnecij, rutenij, kadmij, lutecij, hafnij, renij, osmij i talij.
Volumen jedinične ćelija kristalne strukture litija izračunat ćemo tako da masu 2 atoma litija podijelimo gustoćom litija:
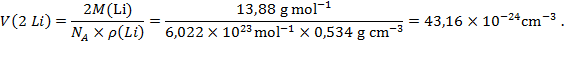
Odavde proizlazi da je brid jedinične ćelije kristalne strukture litija:
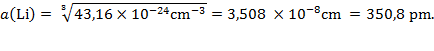
Za radijus atoma litija dobivamo:
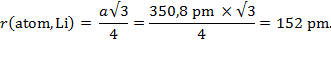
Jednakim postupkom izračunajte metalne radijuse ostalih alkalijskih metala. Obrazložite promjenu radijusa atoma alkalijskih metala.
Litij burno reagira s vodom pri čemu nastaje vodik i litijev hidroksid:
2 Li(s) + 2 H2O(l) → 2 LiOH(aq) + H2(g).
Spremnici s litijevim hidroksidom u prahu i danas se rabe za apsorpciju ugljikova dioksida u podmornicama i svemirskim letjelicama (Apollo 13). Ugljikov dioksid s litijevim hidroksidom reagira prema jednadžbi:
CO2(g) + 2 LiOH(s) → Li2CO3(s) + H2O(l).
Nakon što se litijev hidroksid istroši, spremnik trerba baciti i zamijeniti novim.
Ako se litij zagrijava u struji vodika (≈ 600 °C) dobiva se litijev hidrid, LiH:
2 Li(s) + H2(g) → 2 LiH(s).
Litijev hidrid je spoj ionske građe - sličan solima. Talište LiH je visoko, 692 °C. Kristalizira po tipu natrijeva klorida, tj. bezbojni kristali LiH sastoje se od iona Li+ i H−. Stoga se pri elektrolizi taline litijeva hidrida vodik izlučuje na anodi.
Litijev hidrid reagira s vlagom iz zraka pri čemu nastaju LiOH, Li2O i Li2CO3. S vodom burno reagira pri čemu nastaje vodik i litijev hidroksid:
LiH(s) + H2O(l) → LiOH(aq) + H2(g).
Litijev hidrid, LiH, i litijev aluminijev hidrid, LiAlH4, jaka su redukcijska sredstva koja se primjenjuju u laboratoriju i industriji kod sinteze organskih spojeva.
Litij je strateški element za proizvodnju baterija. Litij−ionske baterije sastoje se od pozitivne LiCoO2 elektrode i negativne LiC6 (grafitne) elektrode. Elektrode su odvojene krutim elektrolitom kroz koji litijevi ioni prolaze tijekom punjenja i pražnjenja baterije. Na elektrodama se događaju sljedeće reakcije:
pražnjenje
LiCoO2 + 6 C(grafit) ⇆ LiC6 + CoO2.
punjenje
Suvremene litij-ionske baterije umjesto LiCoO2 sadržavaju LiNixMnyCozO2.
Više doznajte na: Lithium-ion battery, How does it work?
Zanimljiva je primjena litija za pogon torpeda. U klasičnim (neelektričnim) torpedima izgara petrolej u komprimiranom zraku (ili kisiku) koji tako daje toplinu za pogon parne turbine. Pri tome se stvara ugljikov dioksid koji ostavlja trag iza torpeda. No Rusi su napravili gorivo za torpeda koje ne stvara nikakav dim! Riječ je o rekciji litija sa sumporovim heksafluoridom:
8 Li(s) + SF6(g) → Li2S(s) + 6 LiF(s).
Standardne entalpije nastajanja su: ΔfH(SF6(g)) = −1220 kJ mol−1, ΔfH(Li2S(s)) = −447 kJ mol−1, ΔfH(LiF(s)) = −408 kJ mol−1.
Rješenje:
ΔrH = ΔfHprodukti − ΔfHreaktanti.
Odavde proizlazi:
ΔrH/kJ mol−1= [(ΔfH(Li2S(s)) + 6 ΔfH(LiF(g)] − ΔfH(SF6(g))
= [(−447) + 6x(−408)] − (−1220).
8 Li(s) + SF6(g) → Li2S(s) + 6 LiF(s) ΔrH = −1675 kJ mol−1.
Usporedite energiju koju oslobodi kilogram ove reakcijske smjese, prema energiji koju oslobodi kilogram reakcijske smjese N2O4 + 2 N2H2 (primjer 5.8.).
6.1.2. Natrij
Natrij u elementarnome stanju najviše se rabi u organskoj kemijskoj industriji kao snažno redukcijsko sredstvo. Dobiva se elektrolizom taline natrijeva klorida u tzv. Downsovoj ćeliji shematski prikazanoj na slici 6.3a. Talište natrijeva klorida je visoko, čak 801 °C. Pri toj temperaturi dolazi do velikih gubitaka topline i natrija. Dodatkom kalcijeva klorida, CaCl2, snižava se talište smjese čime se postižu velike uštede energije. Stoga se u Downsovoj ćeliji, pri temperaturi 560 − 580 °C, elektrolizira smjesa od 60% CaCl2 i 40% NaCl. Na elektrodama se događaju sljedeće reakcije:
Katoda: 2 Na+(l) + 2 e− → 2 Na(l),
Anoda: 2 Cl−(l) → Cl2(g) + 2 e−.
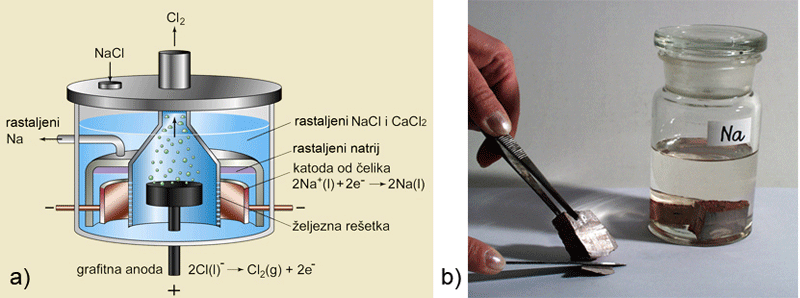
Slika 6.3. a) Shematski prikaz Downsove ćelije za dobivanje natrija elektrolizom taline natrijeva klorida. b) Natrij je mekan i može se rezati nožem. Na svježemu presjeku pokazuje metalni sjaj, ali se brzo prevuče slojem oksida i hidroksida. Kad se natrij čuva u staklenoj boci pod petrolejem, staklenu bocu treba uvijek uložiti u metalnu kanticu na čijem se dnu nalazi pijesak. Metalna kantica štiti staklenu bocu od slučajnih udaraca i loma.
Natrij, kao i svi alkalijski metali burno reagiraju s vodom pri čemu nastaje vodik i otopina pripadnog hidroksida:
2 Na(s) + 2 H2O(l) → H2(g) + 2 Na+(aq) + 2 OH−(aq).
Kako natrij reagira s vodom doznajte u rubrici Kemija u nastavi, časopisa Kemija u industriji u članku: Kako natrij reagira s vodom? (pdf)
Natrijev klorid, NaCl, ili kuhinjska sol, nalazi se u prirodi u podzemnim naslagama, slanim jezerima i u moru. Iz podzemnih naslaga može se dobivati rudarenjem. U Tuzli se tzv. varena sol dobiva otapanjem podzemnih naslaga soli u vodi. Zasićena se otopina crpe na površinu i isparava pa sol kristalizira u obliku sitnih kristala. U morskim solanama sol se dobiva isparavanjem morske vode na suncu. Pritom nastaju krupni kristali pa se takva sol melje za upotrebu u kućanstvu. Morska sol sadržava najviše nečistoća, posebno magnezijeva sulfata i klorida. Zbog prisustva magnezijevih spojeva takva je sol higroskopna, a kojiput i gorka. Za ljudsku prehranu sol se treba jodirati. Nedostatak joda u hrani uzrokuje gušavost i zaostajanje u umnom razvoju (endemski kretenizam). Gušavost je posljedica povećanja štitnjače (tiroidne žlijezde). U štitnjači se sintetizira hormon tiroksin, čija molekula sadržava 4 atoma joda. Ako u hrani nedostaje jod, štitnjača se poveća kako bi apsorbirala što više joda.
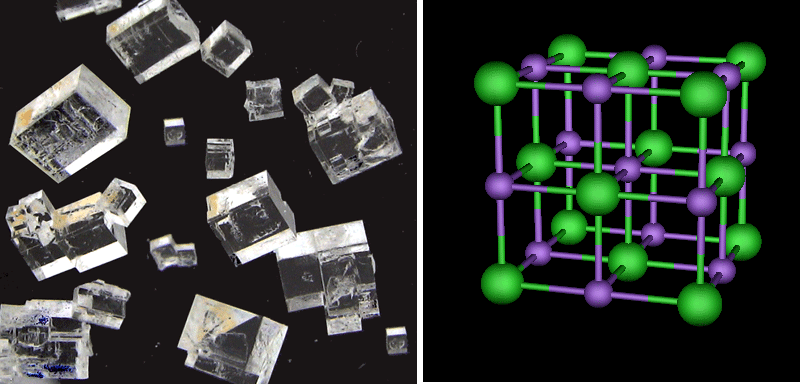
Slika 6.4. Kristali i model kristalne strukture natrijeva klorida
Natrijev hidroksid, NaOH, je bijela higroskopna tvar koja jako nagriza kožu i sve organske tvari. Rabi se u proizvodnji sapuna, papira, aluminija i drugdje. Dobiva se elektrolizom koncentrirane otopine natrijeva klorida u vodi.
Tijekom elektrolize ioni Na+(aq) putuju prema katodi, ali se na njoj reduciraju molekule vode prema jednadžbi:
Katoda: 2 H2O(l) + 2 e− → H2(g) + 2 OH−(aq).
Na katodi se razvija vodik, a ioni OH−(aq) ostaju u otopini. Njihov naboj neutraliziraju ioni Na+(aq) koji kroz polupropusnu membranu doputuju iz anodnog prostora. Tako u katodnom prostoru nastaje otopina natrijeva hidroksida. Na anodi se istodobno izlučuje elementarni klor:
Anoda: 2 Cl−(aq) → Cl2(g) + 2 e−.
Elektrolizom otopine natrijeva klorida dobivaju se tri važna proizvoda kemijske industrije: vodik, klor i otopina natrijeva hidroksida. Vodik se najčešće odmah spaljuje u struji klora radi dobivanja klorovodika koji se dalje rabi za sintezu ili za dobivanje klorovodične kiseline:
½ Cl2(g) + ½ H2(g) → HCl(g) ΔfH = −92,3 kJ mol−1,
HCl(g) + H2O(l) → HCl(aq) ΔsolH = −74,8 kJ mol−1.
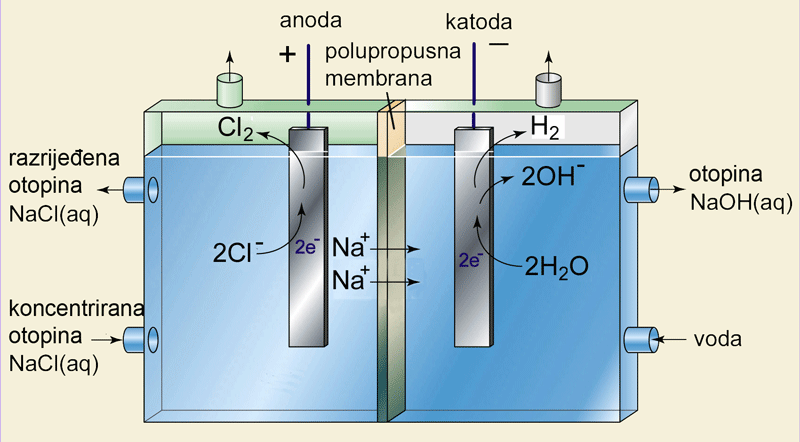
Slika 6.5. Shematski prikaz dobivanja natrijeva hidroksida elektrolizom otopine natrijeva klorida u vodi. Katodni i anodni prostor odvojeni su membranom oslonjenom na teflonsku mrežicu. Membrana je polimer koji sadržava negativno nabijene skupine −SO3−. Ioni Na+(aq) putuju od jedne do druge skupine −SO3− i tako prolaze kroz membranu. Kroz membranu mogu prolaziti molekule vode i pozitivno nabijeni ioni, ali zbog negativnog naboja skupina −SO3− u membrani prolaz ionima Cl−(aq) znatno je otežan.
Natrijev karbonat, Na2CO3, ili soda važna je sirovina za kemijsku industriju. Primjenjuje se u industriji stakla, boja, papira, celuloze, umjetne svile, tekstila, deterdženta, prašaka za pranje, sapuna i dr. Proizvodi se Solvayevim postupkom. U zasićenu otopinu natrijeva klorida uvodi se amonijak i ugljikov dioksid koji u vodenoj otopini daju ione NH4+(aq) i HCO3−(aq):
NaCl(aq) + CO2(g) + NH3(g) + H2O(l) → NH4+(aq) + HCO3−(aq) + Na+(aq) + Cl− (aq).
Iz zasićene otopine iskristalizirat će se najmanje topljiva sol, tj. natrijev hidrogenkarbonat, NaHCO3. Talog natrijeva hidrogenkarbonata filtriranjem se odvoji od matičnice. Žarenjem natrijeva hidrogenkarbonata dobije se natrijev karbonat i ugljikov dioksid koji se vraća u proces:
2 NaHCO3(s) → Na2CO3(s) + H2O(g) + CO2(g).
Nakon odvajanja natrijeva hidrogenkarbonata (sode bikarbone) otopina sadržava amonijev klorid i dio upotrijebljenog natrijeva klorida. Iz te se otopine amonijak regenerira gašenim vapnom dobivenim žarenjem vapnenca:
2 NH4Cl(aq) + Ca(OH)2(s) → 2 NH3(g) + CaCl2(aq) + 2 H2O(l).
Što se time postiglo? Kad se zbroje sve navedene jednadžbe, dolazi se do zbirne reakcije Solvayevog postupka:
CaCO3(s) + 2 NaCl(s) → Na2CO3 + CaCl2,
a to znači da uz željeni produkt, sodu, ne nestaju otrovni i štetni produkti koje bi potom trebalo zbrinjavati. Usto se tehnološki proces odvija pri niskim temperaturama, što znači i uz mali utrošak energije.
Soda se proizvodi iz jeftinih i lako dostupnih sirovina, natrijeva klorida i vapnenca. Otpadni proizvodi, kalcijev klorid i približno četvrtina upotrebljenog natrijeva klorida, može se iskoristiti za posipanje cesta zimi.
6.1.3. Kalij
Elementarni kalij proizvodi se u vrlo malim količinama redukcijom taline kalijeva klorida natrijem. Najviše se rabi za dobivanje kalijeva superoksida. Slitine natrij−kalij rabe se kao rashladno sredstvo u nekim nuklearnim reaktorima. Slitina od 77 % kalija i 23 % natrija u tekućem je stanju od −12,6 do 785 oC.
Kalij eksplozivno reagira s vodom:
2 K(s) + 2 H2O → 2 KOH(aq) + H2(g).
Kalijev superoksid, KO2, nastaje kad se elementarni kalij zapali na zraku. Rabi se kao izvor kisika i za uklanjanje ugljikova dioksida i vode u uređajima za disanje u podmornicama, rudnicima i dr. Primjena se temelji na reakciji kalijeva superoksida s produktima disanja:
4 KO2(s) + 4 CO2(g) + 2 H2O(g) → 4 KHCO3(s) + 3 O2(g).
Kalijev klorid, KCl, u prirodi se nalazi kao mineral silvin ili kao sastojak karnalita, KCl · MgCl2 · 6H2O. Kalijev klorid lako je topljiv u vodi, a slabo u acetonu i etanolu. Blago je toksičan. Najviše se rabi za dobivanje umjetnih gnojiva.
Kalijev nitrat, KNO3, rabi se kao umjetno gnojivo, kao konzervans, kao jeftin oksidans u pirotehnici (crni barut) i dr.
Kalij je esencijalni element, prijeko potreban svim životinjama i biljkama. Bitno utječe na rad srčanog mišića te mišićnog i živčanoga sustava. Njegova je razina u krvi stalna, a reguliraju je hormoni kore nadbubrežne žlijezde. Čovjek unosi kalij u organizam uglavnom biljnom hranom – oko 2 grama dnevno.
6.2. Zemnoalkalijski metali
Berilij (Be), magnezij (Mg), kalcij (Ca), stroncij (Sr), barij (Ba) i radij (Ra), čine drugu skupinu periodnog sustava elemenata. Ti elementi ulaze u sastav zemlje, a kako su njihovi hidroksidi jake alkalije dobili su naziv zemnoalkalijski metali.
Tablica 6.2. Najvažnija svojstva zemnoalkalijskih metala
|
Element |
Talište t/°C |
Vrelište |
Gustoća ρ/g cm−3 |
Atomski radijus r/pm |
Ionski radijus r/pm |
Energija ionizacije Ei,m/kJ mol−1 |
|
Be |
1287 |
2469 |
1,850 |
111 |
59 |
899 |
|
Mg |
649 |
1091 |
1,738 |
160 |
86 |
738 |
|
Ca |
842 |
1484 |
1,550 |
197 |
114 |
590 |
|
Sr |
777 |
1382 |
2,640 |
215 |
132 |
549 |
|
Ba |
727 |
1897 |
3,510 |
222 |
142 |
503 |

Slika 6.6. Zemnoalkalijski metali i njihovi spojevi boje plamen karakterističnim bojama
Vidi na internetu: e-Kemija: Sikirica - Boje plamena vatromet
Zemnoalkalijski metali uvijek su dvovalentni. Nisu tako reaktivni kao alkalijski metali. Primjerice, berilij je postojan na zraku. Magnezij reagira tek s vrućom vodom, a na zraku se prevuče slojem magnezijeva oksida, MgO. Kalcij je reaktivniji od magnezija, ali se može dugo čuvati u dobro zatvorenoj boci. Općenito, reaktivnost zemnoalkalijskih metala raste u skupini porastom rednog broja elementa. U prirodi se nalaze samo u spojevima. Dobivaju se elektrolizom talina svojih soli.
Berilij se rabi za pripravu slitina. Berilijeve slitine s bakrom tvrde su poput najtvrđeg čelika, a usto otporne na koroziju. Berilij propušta rendgenske zrake pa se od njega izrađuju "prozori" na rendgenskim cijevima. Berilij i njegovi spojevi jako su otrovni. Za dobivanje berilija najvažniji je mineral beril, berilijev alumosilikat, Be3Al2Si6O18. Kristali berila mogu biti veliki i nekoliko metara. Obojeni i prozirni kristali berila cijenjeni su kao drago kamenje. Najpoznatiji su smaragd (emerald), zeleno obojen od kromova oksida te zelenkasti i modri akvamarin.
Stroncij je sastojak slitina za automobilsku industriju, kao i pirotehničkih rekvizita ("bengalki"). Radioaktivni izotopi, stroncij−89 i stroncij−90, koriste se u liječenju raka. Stroncij−90 nastaje u nuklearnoj fisiji. Ima ga u radioaktivnom oblaku nakon testiranja nuklearnog oružja ili nesreća u nuklearnim elektranama. Stroncij−90 je radioaktivni element koji ostaje u tijelu i nemoguće ga je ukloniti jer zamjenjuje kalcij u kostima. Nakon Černobilske katastrofe ogromno je područje bilo zagađeno stroncijem−90.
Barijevi spojevi jako su otrovni. No barijev sulfat, BaSO4, praktično je netopljiv u vodi. Rabi se u medicini pri rendgenskom pregledu probavnog trakta tako da bolesnik popije zaslađenu kašu barijeva sulfata. Kaša barijeva sulfata apsorbira rendgenske zrake pa se na fluorescentnom zaslonu medicinskog rendgena može pratiti njezino kretanje kroz probavni trakt.
6.2.1. Magnezij
Vidi na internetu: e-Kemija: Sikirica - Magnezij i kalcij
Elementarni magnezij bijel je poput srebra ili aluminija. Na zraku brzo potamni. Zapaljen gori na zraku ili u kisiku uz pojavu blještave svjetlosti. Magnezij u prahu u smjesi s jakim oksidansom, kao što je KClO3, rabio se kao "flash" u ranim danima fotografije. Mogli ste to vidjeti u nekim starijim filmovima. Takve su bljeskalice bile vrlo opasne u usporedbi s današnjim standardima. No od 1927. proizvodile su se sigurnije bljeskalice, tj. "žarulje" punjene magnezijevom vunom i kisikom. Palile su se električnom strujom, a mogle su se iskoristiti samo jednom. Od polovine 20. stoljeća rabe se elektroničke i LED bljeskalice. Magnezij se i danas rabi u vatrometima, signalnim raketama i dr.
Magnezij se naveliko proizvodi iz dolomita, CaCO3·MgCO3, magnezita, MgCO3, i morske vode u kojoj ga ima oko 1 g L−1. Ovisno o polaznoj sirovini razvijeno je više postupaka dobivanja magnezija. Primjerice dolomit se žarenjem prevede u smjesu MgO i CaO. Redukcijom ferosilicijem (ili silicijem) dobije se magnezij:
MgO + 2 CaO + FeSi → 2 Mg + CaSiO4 + Fe.
Destilacijom u vakuumu iz ove se smjese dobiva čisti magnezij.
Magnezij se dobiva i iz morske vode. Najprije se vapnenim mlijekom, tj. kalcijevim hidroksidom, Ca(OH)2, istaloži slabo topljiv magnezijev hidroksid, Mg(OH)2:
MgCl2(aq) + Ca(OH)2(aq) → Mg(OH)2(s) + CaCl2(aq).
(Topljivosti Mg(OH)2 je 1.8 × 10−11 mol L−1. Topljivost Ca(OH)2 je veća te iznosi 5.5 × 10−6 mol L−1.)
Talog magnezijeva hidroksida neutralizira se klorovodičnom kiselinom:
Mg(OH)2(s) + 2 HCl(aq) → MgCl2(aq) + 2 H2O.
Elementarni magnezij dobije se elektrolizom taline koja se sastoji od smjese magnezijeva, natrijeva i kalijeva klorida:
Katoda: Mg2+(l) + 2 e− → Mg(l),
Anoda: 2 Cl−(l) → Cl2(g) + 2 e−.
Magnezij se primjenjuje za izradu lakih slitina, ponajviše s aluminijem, ali i s drugim metalima.
6.2.2. Kalcij
Rješenje: Postupit ćemo na jednak način kao u primjeru 6.1. Najprije moramo izračunati volumene jediničnih ćelija kristalnih struktura kalcija i stroncija. Kao što se vidi sa slike 6.2. jedinične ćelije sadržavaju 4 atoma. Atomi se dotiču smjerom plošne dijagonale kocke, pa proizlazi da su metalni radijusi kalcija i stroncija jednaki četvrtini duljine plošne dijagonale pripadne jedinične ćelije.
Kalcij je mekan bijeli metal. Može se kovati. Dobiva se elektrolizom taline kalcijeva klorida. Rabi se kao redukcijsko sredstvo za dobivanje vrjednijih metala, primjerice Zr, Th, U, te lantanoida. Oni se ne mogu dobiti redukcijom svojih oksida ugljikom jer se s njime spajaju tvoreći karbide, ZrC, ThC, UC, UC2, U2C3, LaC2 i dr. Rabi se kao redukcijsko sredstvo u proizvodnji čelika i aluminija, potom kao dodatak slitinama aluminija, berilija, bakra, olova i magnezija te kao polazni materijal za proizvodnju kalcijeva hidrida, CaH2. Slitina olova s kalcijem rabi se u olovnim akumulatorima. Kalcij s olovom tvori intermetalni spoj Pb3Ca, koji poveća čvrstoću i tvrdoću rešetkastih elektroda akumulatora zapunjenih pastom PbO2 na anodi, te spužvastim olovom na katodi.
Kalcij reagira s vodom:
Ca(s) + 2 H2O(l) → Ca(OH)2(aq) + H2(g),
ali ne tako burno kao natrij.
Kalcijev karbonat, CaCO3, se nalazi u prirodi kao mineral u različitim oblicima. Vapnenac se sastoji od kristalića CaCO3 koji se ne vide golim okom. Na mjestima gdje je vapnenac bio izložen povišenoj temperaturi i tlaku nastala je metamorfna stijena mramor. On se sastoji od gusto zbijenih kristalića kalcita. Ako su kristali veći ili lijepo razvijeni onda kažemo da je to mineral kalcit. Uz kalcit postoji još jedan mineral istog kemijskog sastava (CaCO3) koji se zove aragonit. Kalcit je trigonska, a aragonit rompska modifikacija kalcijeva karbonata.
Zbog različite brzine širenja svjetlosti u raznim smjerovima pri prolazu kroz kristal kalcita svjetlosna se zraka lomi u dvije linearno polarizirane zrake. Ravnine polarizacije tih dviju zraka okomite su jedna na drugu. Primjerice, kad se kroz prozirni kristal kalcita promatra neki predmet ili slika vide se dvostruko. Ta se pojava naziva dvolom.
Slika 6.7. Prolazom kroz kristal kalcita upadna se zraka lomi na dvije zrake pa se promatrani predmet vidi dvostruko. Izvornu sliku vidi OVDJE.
Polarizacijski mikroskopi nekad su sadržavali dvije Nicolove prizme, načinjene od kalcita, od kojih jedna služi kao polarizator smješten ispred objektiva a druga kao analizator smješten između objektiva i okulara. Danas se umjesto Nicolove prizme rabe polarizacijski filteri, slični onima od kojih načinjeni "polaroid filteri" za fotoaparate i naočale za sunce.
Linearno polariziranom svjetlošću, pomoću polarizacijskog mikroskopa, promatraju se i određuju mineraloško-petrografska svojstva svih vrsta stijena, ruda, minerala i drugih mineralnih sirovina. Polarizacijski se mikroskop rabi i u biologiji za promatranje orijentacije staničnih struktura.
Više doznajte na: Microscopy: Polarization (Edward Salmon)
Veći dio teritorija Hrvatske građen je od sedimentnih stijena, od kojih su najzastupljenije karbonatne stijene, vapnenac i dolomit. Prema načinu postanka vapnenci se klasificiraju na biokemijske, kemijske i klastične. Biokemijski vapnenci su nastali taloženjem školjaka i pužnica na morskom dnu. Kemijski vapnenci nastaju izravnim izlučivanjem karbonatnih minerala u morima, jezerima i na izvorima rijeka. Klastični vapnenci nastaju transportom i akumulacijom školjaka ili fragmenata već nastalih vapnenaca.
Sve hrvatske planine pripadaju Dinaridima za koje je karakterističan krški reljef. Čak 46 % površine Hrvatske čine krški predjeli, a podzemlje tog krša seže do dubina od više kilometara. Zbog svoje šupljikavosti i velike poroznosti vapnenac može upiti veliku količinu vode, što je bitno za vodni potencijal kojim obiluje hrvatsko krško podzemlje. Nažalost, odlaganje otpada u podzemlje loš je običaj koji ugrožava temeljne prirodne resurse Hrvatske, zalihe podzemne pitke vode i život u špiljama. Glavni uzroci onečišćenja podzemlja su nedovoljna svijest stanovnika krša koji odlažu otpad na neprimjeren način, ali i nerazvijen i neučinkovit sustav gospodarenja otpadom. Voda u kršu kreće se brzo i ne može se prirodnim putem pročistiti pa štetni sastojci mogu lako onečistiti vodocrpilišta i pitku vodu. Primjerice, nakon velikih oborina redovito dolazi do zamućenja izvora rijeka Jadro i Ombla. Povećani stupanj zamućenosti prirodna je pojava za naše krško područje i obično traje nekoliko dana.
Vapnenac je slabo topljiv u čistoj vodi, ali je puno topljiviji u vodi koja sadržava otopljen ugljikov dioksid. Pritom nastaje kalcijev hidrogenkarbonat, Ca(HCO3)2:
CaCO3(s) + CO2(aq) + H2O(l) D Ca(HCO3)2(aq).
Voda zasićena kalcijevim hidrogenkarbonatom prodire kroz pukotine u stijenama. U većim pukotinama i špiljama događa se obrnut proces. Voda isparava a kalcijev hidrogenkarbonat se raspada na kalcijev karbonat i ugljikov dioksid. Tako u špiljama nastaju sige. One koje vise sa stropa špilje nazivaju se stalaktiti, one koje se izdižu s poda zovu se stalagmiti, a sige koje čine stupove od poda do stropa spilje nazivaju se stalagnati. Zanimljivo je da sige mogu sadržavati i druge minerale osim kalcita, recimo halkantit, koji kemijskim sastavom odgovara modroj galici (CuSO4·5H2O).
I pitka voda, sadržava otopljen kalcijev hidrogenkarbonat. Zagrijavanjem vode kalcijev se hidrogenkarbonat raspada. Ugljikov dioksid izlazi iz vode a na stijenkama posude taloži se kalcijev karbonat – „kamenac“ ili "kamen kotlovac".
Vidi na internetu: e-Kemija: Sikirica - Kalcijev karbonat
Kad se kalcijev karbonat zagrijava, on se ne tali, već se pri oko 800 °C raspada na kalcijev oksid i ugljikov dioksid:
CaCO3(s) → CaO(s) + CO2(g).
Tako se dobiva živo vapno, CaO, koje se rabi u kemijskoj industriji, pri proizvodnji šećera, dobivanju stakla, a ponajviše u građevinarstvu. Živo se vapno "gasi vodom" pa se dobije gašeno vapno (ili kreč), Ca(OH)2. Ako se živo vapno gasi stehiometrijskom količinom vode dobiva se "hidrat", tj. suhi prah kalcijeva hidroksida. Ako se živo vapno gasi s puno vode dobiva se kaša, jer je kalcijev hidroksid slabo topljiv u vodi:
CaO(s) + H2O(l) → Ca(OH)2(aq).
S gašenim vapnom pripremaju se različite vrste žbuke (maltera). Žbuka je smjesa pijeska, vode i gašenog vapna, no obično se dodaje i nešto cementa. Kalcijev hidroksid se veže s ugljikovim dioksidom iz zraka:
Ca(OH)2(aq) + CO2(g) → CaCO3(s) + H2O(l).
Nastali netopljivi kristalići kalcijeva karbonata povezuju zrnca pijeska, a voda ispari tijekom "vezanja" žbuke. Zbog toga žbuka se dugo suši.
Kalcijev sulfat dolazi u prirodi u obliku minerala gipsa, CaSO4·2H2O, i anhidrita, CaSO4. Kad se gips zagrijava pri temperaturi od oko 130 °C ion izgubi tri četvrtine vode:
CaSO4·2H2O(s) → CaSO4·½H2O(s) + 3/2 H2O(g).
Dobiveni produkt zove se štukaturni ili pečeni gips, jer se od njega izrađuju štukature - ukrasi u dvoranama i na pročeljima zgrada. Pomiješan s vodom brzo se stvrdne (veže) pri čemu povećava volumen:
CaSO4·½H2O(s) + 3/2 H2O(l) → CaSO4·2H2O(s).
Gips se za upotrebu, primjerice za ravnanje zidova, priprema tako da se u vodu bez miješanja sipa toliko gipsa koliko je on sâm može upiti. Dobivena se kaša grabi lopaticom bez miješanja. Ako kašu miješate ona će se stvrdnuti prije nego uspijete svu pripremljenu smjesu potrošiti. Vezivanje gipsa može se usporiti dodavanjem mlijeka, a ubrzati dodavanjem kuhinjske soli.
Pribor i kemikalije: 3 plastične čaše od jogurta, čep omekšivača za rublje, gips, mlijeko, kuhinjska sol.
Postupak
- U trgovini boja i lakova kupite najmanje pakovanje gipsa.
- Uzmite 3 čaše od jogurta i čep od omekšivača za rublje koji će poslužiti kao mjerica.
- U prvu čašu dodajte jednu mjericu mlijeka, a u drugu i treću po jednu mjericu vode. U treću čašu dodajte pola žličice kuhinjske soli i miješajte dok se sva sol ne otopi.
- Suhom mjericom zagrabite gips, nožem skinite višak iznad ruba i sadržaj dviju mjerica istresite u prvu čašu s mlijekom. Odmah potom na jednak način dodajte jednake količine gipsa u drugu i treću čašu.
- Nemojte miješati sadržaj čaša već pustite da gips sam od sebe upije tekućinu.
- Nakon minutu ili dvije tupom stranom olovke isprobajte je li se gips počeo stvrdnjavati. U kojoj se čaši gips najprije stvrdnuo.
- Rukom popipajte dno čaše. Koja se čaša brže zagrijava?
Vezivanje gipsa događa se tako da se kristali CaSO4·½H2O u vodi otapaju, a iz vodene otopine kristaliziraju međusobno isprepleteni kristali gipsa ili sadre, CaSO4·2H2O. Tijekom vezivanja gipsa oslobađa se toplina pa se smjesa ugrije.
6.3. Aluminij
Aluminij je u spojevima uvijek trovalentan. Prisutan je u mnogim mineralima koji čine stijene. Spomenut ćemo samo ortoklas, K[AlSi3O8], kalijev alumosilikat. Ortoklas je samo jedan predstavnik grupe minerala sličnog kemijskog sastava koji se nazivaju glinenci. Pod utjecajem atmosferilija stijene koje sadržavaju glinence raspadaju se (troše) pa nastaju gline. Minerali glina sadržavaju kemijski vezanu vodu. Gline onečišćene pijeskom i željezovim(III) oksidom zovu se ilovača.
Aluminijev oksid, Al2O3, dolazi u prirodi kao mineral korund. Različito obojeni korund svrstava se u drago kamenje. Ako je korund onečišćen tragovima kobalta obojen je modro i naziva se safir. Onečišćen tragovima kroma ima crvenu boju pa se naziva rubin. Zeleno obojeni korund naziva se orijentalni smaragd, ljubičasto obojen nazivaju orijentalni ametist, a žuto obojen zovu orijentalni topaz.
Zemljina kora sadržava više aluminija nego željeza. Najvažnija ruda od koje se dobiva aluminij je boksit. Najvažniji minerali u boksitu su bemit, AlO(OH), i hidrargilit, Al(OH)3. Bijele su boje, a karakteristična crvenosmeđa boja boksita potječe od željezova(III) oksida kojeg u boksitu ima 20 do 25 %. Boksit sadržava silicijev dioksid, SiO2, 1 do 5 %,. Silicijev dioksid poskupljuje proizvodnju aluminija pa su bolji oni boksiti koji ga manje sadržavaju.
Aluminij se dobiva tako da se boksit melje, a potom pri povišenoj temperaturi, 200 do 240 °C, i tlaku 30 do 35 bara kuha 6 do 8 sati u autoklavu s 40 %−tnom otopinom natrijeva hidroksida. Pritom iz netopljivih minerala bemita i hidrargilita nastaje topljiv aluminat, [Al(OH)4]−:
bemit: AlO(OH)(s) + OH−(aq) + H2O(l) → [Al(OH)4]−(aq),
hidrargilit: Al(OH)3(s) + OH−(aq) → [Al(OH)4]−(aq).
Dobivena aluminatna lužina filtriranjem se odvoji od netopljivih minerala i željezova(III) hidroksida. Zbog crvene boje taj se otpad u proizvodnji aluminija naziva crveni mulj. Jako je lužnat, ima pH = 10 - 12. Odlaže se u nepropusnim bazenima gdje se polako suši, a jaki vjetrovi raznose ga po okolišu. Crveni se mulj može iskoristiti kao vrijedna sekundarna sirovina za dobivanje skandija, titanija, vanadija, galija, itrija, cirkonija i lantanoida, tj. elemenata rijetkih zemalja, koji se u minimalnim količinama nalaze u boksitu.
Razrjeđivanjem aluminatne lužine izdvaja se netopljiv aluminijev hidroksid, Al(OH)3:
[Al(OH)4]− (aq) ⇄ Al(OH)3(s) + OH−(aq).
koncentrirana otopina razrijeđena otopina
Aluminijev hidroksid filtriranjem se odvaja od matičnice, a zatim žari u rotacijskim pećima pri temperaturi od oko 1200 °C. Tako se dobiva aluminijev trioksid, Al2O3, glinica:
2 Al(OH)3(s) → Al2O3(s) + 3 H2O(g).
Matičnica, preostala nakon odvajanja aluminijeva hidroksida, uparavanjem se koncentrira te vraća u proces.
Metalni aluminij dobiva se elektrolizom taline koja se sastoji od smjese kriolita Na3AlF6, glinice, Al2O3, i fluorita (kalcijeva fluorida) CaF2. Kriolit se tali pri 1.008 °C, što je mnogo niže od tališta čiste glinice, 2.050 °C. Pokazalo se da je za elektrolitičko dobivanje aluminija najpogodnija smjesa koja uz kriolit sadržava 3 do 5 % glinice i 5 do 15 % kalcijeva fluorida. Elektroliza se provodi pri temperaturi oko 930 do 950 °C u elektrolizerima oblika četvrtaste kade kojoj su dno i stranice obložene grafitom. Dno elektrolizera služi kao katoda, a anode su "grafitni" blokovi uronjeni u rastaljeni kriolit. Elektrolitičke ćelije za dobivanje aluminija spajaju se u seriju. Napon u ćeliji je nizak, iznosi samo 4 do 4,5 V, no kroz ćelije teče struja jakosti oko 150 000 A.
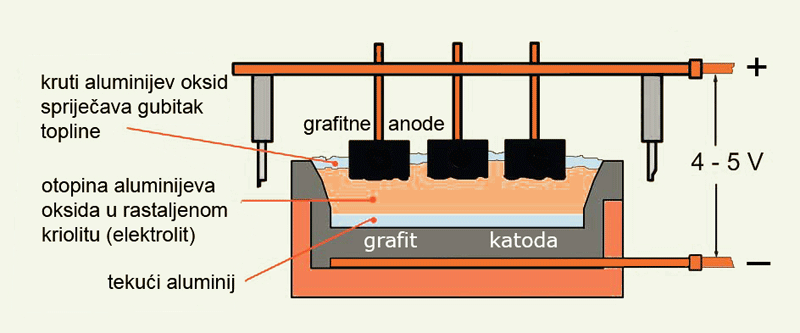
Slika 6.8. Shematski prikaz elektrolizera za dobivanje aluminija
Ovisno o temperaturi i sastavu elektrolita tijekom elektrolize na elektrodama se događa više reakcija. Zato je najbolje dobivanje aluminija prikazati ukupnom reakcijom elektrolize:
2 Al2O3(soln) + 3 C → 4 Al(l) + 3 CO2(g).
Rastaljeni aluminij s dna elektrolizera vakuumskom se sisaljkom usisava u lonac i, lijeva u četvrtaste kalupe. Nakon hlađenja dobiveni ingoti šalju se u valjaonice koje prerađuju lijevani aluminij u limove, profile, folije i dr.
Čisti aluminij je mekan, pa se najčešće legira s bakrom, silicijem, magnezijem titanijem i drugim metalima kako bi mu se povećala čvrstoća. Takav legirani aluminij nazivaju duraluminij (lat. durus − čvrst). Kad se slitina aluminija s oko 4 % bakra naglo ohladi s 550 °C na sobnu temperaturu, dobiva se kruta otopina bakra u aluminiju. Takva je kovina tvrđa od čistoga aluminija, a usto joj se tvrdoća tijekom vremena sama od sebe povećava. Ta se pojava naziva starenjem, a može se objasniti difuzijom atoma bakra pri čemu se unutar kristalnih zrna aluminija stvaraju pod mikroskopom nevidljiva područja (Gunnier-Prestonove zone) u kojima je omjer bakra i aluminija približno jednak sastavu intermetalnog spoja CuAl2. To povećava napetosti unutar kristalnog zrna što konačno dovodi do povećanja tvrdoće. Starenje se može ubrzati tako da se aluminijske slitine nakon naglog hlađenja (kaljenja) nekoliko sati zagrijavaju na približno 200 °C do postizanja maksimalne tvrdoće. Uvjeti termičke obrade ovise o sastavu slitine. Ako se umjetno starenje aluminijevih slitina izvodi pri previsokoj temperaturi ili predugo, na granicama kristalnih zrna aluminija izdvojit će se pod mikroskopom vidljivi zasebni kristalići CuAl2. Stoga slabe veze među kristalnim zrnima aluminija što konačno dovodi do smanjenja tvrdoće i čvrstoće aluminijske slitine.
Aluminij je postojan na zraku jer se prevlači gustim zaštitnim slojem aluminijeva oksida koji ga štiti od daljnje oksidacije. Taj će se zaštitni sloj razoriti u doticaju sa živom i njezinim spojevima. Živa s aluminijem tvori amalgam. Na površini amalgama aluminij se oksidira kisikom iz zraka pa se na tom mjestu pojavljuju bijele pahuljice aluminijeva oksida. Živa neprestano otapa nove količine aluminija, pa proces traje tako dugo dok se sva živa mehaničkim putem ne ukloni s površine aluminija.
Vidi na internetu: Mercury and Aluminum Are Combined Reaction
Deblji sloj aluminijeva oksida na površini aluminija može se načiniti eloksiranjem (kratica od električno oksidiranje). Izvodi se tako da se očišćeni aluminijski predmeti uronjeni u 10-postotnu otopinu sumporne kiseline priključe na izvor istosmjerne struje napona 12 do 20 V. U tom slučaju sloj aluminijeva oksida nastaje samo na anodi. No ako se upotrijebi izmjenična struja, tada će sloj aluminijeva oksida nastajati na obje elektrode. Nakon 20 ili više minuta predmeti se brzo vade iz otopine sumporne kiseline te peru tekućom vodom kako bi se iz pora aluminijeva oksida uklonila kiselina. Nakon bojenja i sušenja zaštitni se sloj može dodatno impregnirati sušivim uljima. Tako obrađeni aluminijski predmeti ljepšeg su izgleda i toplijeg opipa.
Vidi na internetu: e-Kemija: Sikirica - Eloksiranje
Aluminij se ne otapa u dušičnoj kiselini jer ga ona oksidira pa na površini nastaje zaštitni sloj aluminijeva oksida. Naprotiv, klorovodična i sumporna kiselina burno reagiraju s aluminijem:
2 Al(s) + 3 H2SO4(aq) → Al2(SO4)3(aq) + 3 H2(g).
Aluminij se otapa i u jakim lužinama, kao što je natrijev hidroksid. Pritom nastaju vodik i aluminatni ioni, [Al(OH)4]−(aq):
2 Al(s) + 2 OH−(aq) + 6 H2O(l) → 2 [Al(OH)4]−(aq) + 3 H2(g)
Iz otopina aluminijevih soli amonijak i razrijeđene lužine talože bijeli aluminijev hidroksid:
Al3+(aq) + 3 OH−(aq) → Al(OH)3(s).
Aluminijev hidroksid se otapa u kiselinama i jakim lužinama:
Al(OH)3(s) + 3 H3O+(aq) → Al3+(aq) + 6 H2O(l),
Al(OH)3(s) + OH−(aq) → [Al(OH)4]− (aq).
Stoga se kaže da su aluminij i aluminijev hidroksid amfoterni (grč. amfoteros − s obje strane) jer se otapaju u kiselinama i lužinama.
6.4. Bakar
Bakar je metal posebne crvene boje. Može se kovati, valjati u limove i izvlačiti u žice. Jedan je od najboljih vodiča električne struje i topline. Talište bakra je pri 1.083 °C. Sav metalurškim postupcima proizvedeni bakar rafinira se elektrolizom. Naime, sirovi metalurški bakar slabije provodi električnu struju od elektrolitički pročišćenog bakra. Utrošenu električnu energiju "plaća mulj" koji sadržava zlato, srebro, selenij, telurij i druge rijetke metale.
Pribor: 2 elektrode od bakrene žice akva se rabi za električne vodove, čaša od 100 mL, izvor istosmjerne električne struje napona 2 V, 10 %-ta otopina bakrova(II) sulfata.
Postupak
- Ulijte u čašu otopinu bakrova(II) sulfata i uronite bakrene elektrode u otopinu.
- Jednu bakrenu elektrodu spojite na negativni a drugu na pozitivni pol izvora istosmjerne struje.
- Uočite da se bakar otapa na anodi: Cu(s) → Cu2+(aq) + 2e−
- Na katodi se izlučuje elementarni bakar: Cu2+(aq) + 2e− → Cu(s)
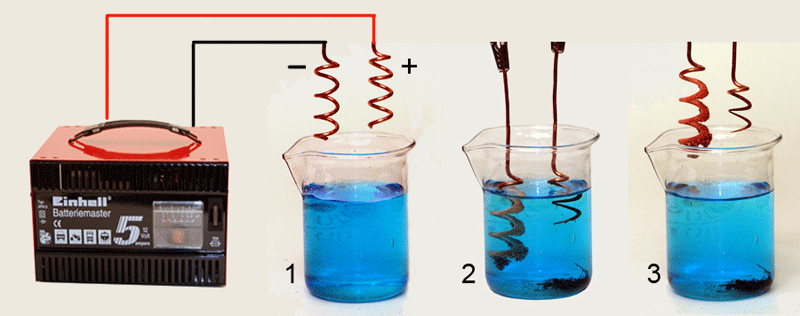
Slika 6.9.
Elektroliza otopine modre galice s topljivom anodom. Anoda je ona elektroda na kojoj se događa oksidacija. Katoda je ona elektroda na kojoj se događa redukcija.Vidi na internetu: e-Kemija: Sikirica - Galvanoplastika 2
Pet miliona tona katodnog bakra
Bakar je sastojak mnogih slitina, a najpoznatije su mjed (messing), tj. slitina bakra s cinkom i bronca koja je slitina bakra s kositrom. Mjed, koja sadržava manje od 38 % cinka, je kruta otopina cinka u bakru. To znači da je dio atoma bakra u njegovoj kristalnoj strukturi zamijenjen atomima cinka. Takva se mjed može valjati u limove, izvlačiti u žice i sl. U slitinama bakra i cinka s više od 38 % cinka nastaju intermetalni spojevi: CuZn, Cu5Zn8 i CuZn3. Takva je mjed tvrda i krhka, a mjed sastava Cu5Zn8 može se čekićem smrviti u prah, što se neće dogoditi ni s bakrom ni cinkom.
Pod nazivom bronca krije se više slitina bakra s različitim elementima, primjerice kositrom, fosforom, aluminijem, silicijem, manganom, olovom i dr. Bronca za kipove sadržava 82,5 — 91 % bakra, 2 — 6 % kositra, 5,5 — 10,5 % cinka i 1,5 — 3 % olova. Bronca za zvona sadržava 20 — 25 % kositra, ali ne više od 25 %, jer takva slitina postaje previše krhka. Bakar i kositar moraju biti čisti, jer primjese drugih metala slitinu čine krhkom,
Predmeti od bakra i bronce na zraku protekom vremena prevlače se zelenom patinom od bazičnog bakrova(II) karbonata. Patinu možete vidjeti na bakrenim krovovima i brončanim skulpturama. Da bi brončanoj skulpturi dali dojam starosti, umjetnici često posežu za kemijskim postupcima dobivanje patine. Primjerice, znameniti francuski kipar Auguste Rodin od svojih je učenika tražio da uriniraju po skulpturama u dvorištu radionice. Tako se na površini skulpture dobije zelena patina od bazičnog bakrova(II) karbonata, Cu2(OH)2CO3, koji se u prirodi javlja kao mineral malahit:
2 Cu(s) + H2O(l) + CO2(g) + O2(g) → Cu2(OH)2CO3(s).
Sastav patine nije stalan već se mijenja ovisno o okolišu. U urbanim područjima patina sadržava bazične bakrove sulfate, a u primorskim bazične bakrove kloride.

Slika 6.10. Skulptura "Zlosretni ribar" na Jezuitskom trgu u Zagrebu djelo je Simeona Roksandića iz 1906. godine.
Mineral malahit bio je cijenjen u Antičkoj Grčkoj, Starom Egiptu i Rimu. Egipćani su iz malahita izrađivali razne umjetničke predmete kao što su amajlije (talismani). Malahit u obliku fino usitnjenog praha rabili su kao sjenilo za oči. Osim iz estetskih, malahit se nanosio i iz medicinskih, ritualnih i tradicijskih razloga. Egipatski liječnici preporučivali su nanošenje šminke na oči kako bi se spriječile bolesti oka (trahom), jer bakrove soli djeluju baktericidno.
Bakar se ne otapa u klorovodičnoj, sumpornoj i drugim neoksidirajućim kiselinama. Otapa se u razrijeđenoj i koncentriranoj dušičnoj kiselini koja je jak oksidans. Pritom se razrijeđena dušična kiselina reducira u dušikov monoksid, NO, a koncentrirana u dušikov dioksid, NO2.
3 Cu(s) + 8 HNO3(aq) → 3 Cu(NO3)2(aq) + 2 NO(g) + 4 H2O(l).
Koncentrirana dušična kiselina:
Cu(s) + 4 HNO3(conc.) → Cu(NO3)2(aq) + 2 NO2(g) + 2 H2O(l).
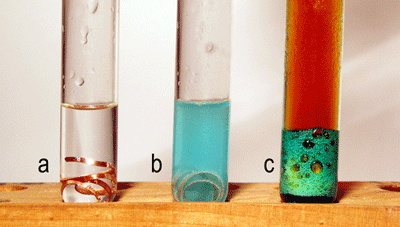
Slika 6.11. a) Bakar se ne otapa u klorovodičnoj i sumpornoj kiselini; b) Otapanjem bakra u razrijeđenoj dušičnoj kiselini nastaje bezbojni dušikov monoksid, NO, koji se na zraku odmah oksidira u crveno−smeđi dušikov dioksid, NO2. c) Otapanjem bakra u koncentriranoj dušičnoj kiselini nastaje crveno−smeđi dušikov dioksid, NO2.
Cu(s) + 2 H2SO4(konc.) → CuSO4(s) + SO2(g) + H2O(g).
2 Cu(s) + 2 H2SO4(aq) + O2(g) → 2 CuSO4(aq) + 2 H2O(l).
U vodenim otopinama bakrovi su ioni oktaedarski koordinirani sa šest molekula vode, tj. tvore kompleksne ione [Cu(OH2)6]2+. Iz vodene otopine kristaliziraju krupni modri kristali bakrova(II) sulfata pentahidrata CuSO4∙5H2O. U kristalnoj strukturi modre galice svaki je ion Cu2+ okružen četirima molekulama vode koje tvore kvadratne jedinke [Cu(OH2)4]2+, a peto i šesto mjesto u nepravilnom oktaedru zauzimaju atomi kisika iz sulfatnih skupina. Peta molekula vode nije izravno vezana na ion Cu2+, nego vodikovim vezama povezuje sulfatne skupine.
Kristali modre galice u suhu zraku gube dio kristalizacijske vode (eflorescencija − cvjetanje), a postupnim zagrijavanjem konačno nastaje bezbojni higroskopni CuSO4(s):
20 °C 100 °C 250 °C
CuSO4∙5H2O → CuSO4∙3H2O → CuSO4∙H2O → CuSO4
− 2H2O −2H2O − H2O
Vidi na internetu: e-Kemija: Sikirica - Modra galica
Kad se u otopinu modre galice doda otopina lužine, NaOH ili Ca(OH)2, taloži se svjetloplavi bakrov(II) hidroksid, Cu(OH)2, topljiv u kiselinama, ali i u lužinama:
Cu2+(aq) + 2 OH−(aq) → Cu(OH)2(s),
Cu(OH)2(s) + OH−(aq) → Cu(OH)3−(aq).
Lako se otapa u amonijaku pri čemu nastaju tamno plava otopina koja sadržava kompleksne ione [Cu(NH3)4(H2O)2]2+:
Cu(OH)2(s) + 4 NH3(aq) → [Cu(NH3)4(H2O)2]2+ + 2 OH−(aq).
Više doznajte na: e-Kemija: Sikirica - Kompleksni spojevi
Modru galicu rabe u vinogradarstvu protiv peronospore, vrste nametničke gljivice. Ioni Cu2+(aq) otrovni su za niže organizme. Otopina modre galice pokazuje kiselu reakciju što šteti lišću. Zato se vinogradi prskaju bordoškom juhom, tj. smjesom otopine modre galice i gašena vapna.
Bakrovi(II) halogenidi, primjerice CuCl2, pri visokoj temperaturi isparavaju i boje plamen zeleno. Stoga se rabe u pirotehnici. No to je svojstvo bakrovih halogenida iskoristio ruski kemičar Friedrich Konrad Beilstein (Фёдор Фёдорович Бейльштейн) (1838. – 1906.) za dokazivanje prisustva halogena u organskim spojevima.
Vidi na internetu: e-Kemija: Sikirica - Dokazivanje halogena
Bakrov(II) oksid, CuO, kao crna presvlaka nastaje zagrijavanjem bakra na zraku te termičkim raspadom bakrova(II) nitrata, Cu(NO3)2, ili bakrova(II) karbonata, CuCO3:
CuCO3 → CuO(s) + CO2(g).
Bakrov(II) oksid lako se otapa čak i u slabim kiselinama:
CuO(s) + 2 CH3COOH → Cu(CH3COO)2(aq) + H2O(l),
CuO(s) + 2 HCl(aq) → CuCl2(aq) + H2O(l),
CuO(s) + H2SO4(aq) → CuSO4(aq) + H2O(l).
2 CuO(s) → Cu2O(s) + ½ O2(g).
Bakrov(I) oksid je baza, ali otapanjem u kiselinama prelazi u elementarni bakar i ion Cu2+(aq):
Cu2O(s) + 2 H+(aq) → Cu2+(aq) + Cu(s) + H2O(l).
Bakrovi(I) spojevi su stabilni samo ako su u vodi netopljivi, kao što je CuCi, ili u kompleksnim spojevima kao što je [Cu(CN)4]3−. Inače se bakrovi(I) spojevi u vodenim otopinama brzo disproporcioniraju u ione Cu2+(aq) i elementarni bakar. Žuti ili smeđi talog bakrova(I) oksida nastaje u reakciji dokazivanja prisutnosti glukoze i drugih reducirajućih šećera Trommerovim reagensom. Taj se pokus redovito izvodi u osmom razredu osnovne škole.
Bakar ima važnu ulogu u našem metabolizmu, ponajviše zato što mnogim enzimima omogućuje pravilno funkcioniranje. Neophodan je za održavanje kože, krvnih žila te epitelnog i vezivnog tkiva u cijelom tijelu. Bakar ima ulogu u proizvodnji hemoglobina, melanina, omogućuje štitnjači normalno funkcioniranje i dr. Krv nekih morskih životinja, primjerice hobotnica, je plava jer sadržava kompleks bakra u proteinu hemocijaninu koji služi za prijenos kisika.
6.5. Željezo
Maseni udio željeza u Zemljinoj kori iznosi 4,7 % pa je ono jedan od najčešćih metala. Čisto je željezo srebrnobijeli metal, na vlažnu zraku i u vodi podložan oksidaciji. Otapa se u kiselinama:
Fe(s) + H2SO4(aq) → FeSO4(aq) + H2(g).
U spojevima željezo može biti dvovalentno i trovalentno. Dvovalentni spojevi željeza lako se oksidiraju u trovalentne.
Najbolja željezova ruda je magnetit, Fe3O4, jer sadržava najviše željeza, dok ga hematit, Fe2O3, i limonit, FeO(OH)·nH2O, sadržavaju manje. Željezo se dobiva u tzv. visokim pećima redukcijom željezovih oksida koksom. Najvažnije kemijske reakcije koje se događaju u pojedinim slojevima visoke peći, tj. pri različitim temperaturama, shematski su prikazane na slici 6.12.
Moderne visoke peći visoke su oko 30 m, dok im promjer (volumen) varira. Neke visoke peći imaju volumen i do 6.000 m3. Proizvodnja je visoko automatizirana. Specijalnim sondama mjeri se temperatura, sastav reakcijske smjese i plinova u pojedinim dijelovima peći. Za dobivanje željeza u suvremenoj visokoj peći ruda, koks i dodaci, vapnenac i kvarcni pijesak, najprije se samelju, dobro izmiješaju i prešaju u pilule koje se potom sinteriraju. Tako pripremljena sirovine omogućuju bolju kontrolu proizvodnog procesa i stalan kemijski sastav sirovog željeza.
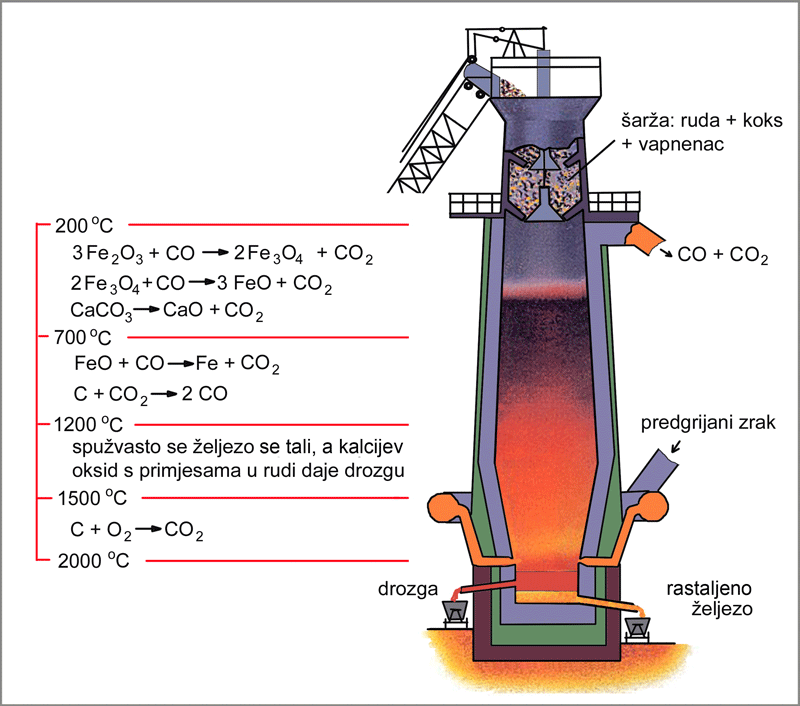
Slika 6.12. Reakcije koje se događaju u visokoj peći.
Sirovo željezo sadržava oko 4 % ugljika i nekoliko postotaka silicija, fosfora, mangana, sumpora i dr. Još rastaljeno željezo odmah se prerađuje u čelik oksidacijom svih primjesa neposrednim upuhivanjem zraka u Bessemerovim konverterima, ili posrednom oksidacijom pomoću otpadaka starog hrđavog željeza u Siemens−Martinovim pećima. Proces u Simens−Martinovim pećima traje nekoliko sati, pa se za to vrijeme može provesti analiza i legiranje dodatkom različitih feroslitina (ferolegura) te dobiti čelik željenog sastava. Primjerice, dodatkom nikla povećava se žilavost čelika, krom čini čelik tvrdim te mu povećava otpornost na koroziju. Danas je u upotrebi više od 1000 vrsta čelika.
Kristalna struktura željeza mijenja se promjenom temperature. Ispod 912 °C, tzv. α-željezo ili ferit ima strukturu prostorno centrirane kocke (BCC). Iznad 912 °C, pa sve do 1.394 °C stabilno je γ-željezo sa strukturom plošno centrirane kocke (FCC). Iznad 1.394 °C, pa sve do tališta, 1.536 °C stabilno je δ-željezo BCC kristalne strukture. (Vidi slike 6.2a. i 6.2b.)
Alatni ugljični čelici dijele se prema sadržaju ugljika. Meki i vrlo žilavi čelici sadržavaju 0,55 do 0,70 % C, žilavi 0,70 do 0,85 % C, a tvrdi čelici 1,15 do 1,30 % C, i vrlo tvrdi 1,30 do 1,50 % C. Čelici s više od 1 % C mogu se kaliti. Kad se takav čelik ugrije na oko 900 ºC nastane kruta otopina ugljika u γ-željezu. Ugljik popunjava samo mali dio, oko 5 %, oktaedarskih praznina što ih čine atomi željeza. (Jedinična ćelija γ-željeza sadržava 4 oktaedarske praznine: jednu u središtu i 12×¼ na bridovima kocke.) Takva kruta otopina ugljika u γ-željezu zove se austenit. Naglim hlađenjem, kaljenjem usijanog čelika vodom ili uljem, dobiva se vrlo tvrd materijal. Pritom se kristalna struktura željeza promijeni iz plošno centrirane (FCC) u prostorno centriranu kocku (BCC), ali atomi ugljika ostaju zarobljeni na svojim mjestima. To uzrokuje velike napetosti u kristalima α-željeza. Dobivena prezasićena kruta otopina ugljika u α-željezu naziva se martenzit. U kaljenom stanju martenzit je suviše krt, pa se nakon kaljenja čelik "popušta" zagrijavanjem na oko 250 °C. Ovisno o tome kakva se svojstva čelika žele postići, žilavost, tvrdoća, elastičnost i dr., određuje se vrijeme i temperatura popuštanja.
Rješenje: U FCC kristalnoj strukturi broj oktaedarskih praznina jednak je broju atoma. Prema tome u strukturi γ-željeza udio praznina popunjenih atomima ugljika jednak omjeru množine ugljika prema množini željeza:


Odavde proizlazi:
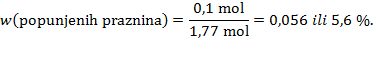
Vidi na intenetu: e-Kemija: Sikirica - Čelik
Pribor i kemikalije: plamenik, laboratorijska kliješta, željezni čavli duljine 5 cm, turpija, kalijev heksacijanoferat(II), K4Fe(CN)6∙3H2O, čaša s vodom.
Postupak
- Na komadić metalnog lima stavite 1 do 2 g kalijeva heksacijanoferata(II). Uzmite dva nova željezna čavla duljine 4 ili 5 cm. Turpijom ispitajte njihovu tvrdoću. Jedan čavao ostavite kao kontrolni uzorak.
- Drugi čavao uhvatite laboratorijskim kliještima za glavicu, a vrh unesite u šušteći plamen plinskoga plamenika. Kad se vrh čavla užari do crvenog usijanja, uvaljajte ga u kalijev heksacijanoferat(II) koji će se rastaliti i uhvatiti na vrhu čavla.
- Žarite vrh čavla oko pola minute i ponovo uvaljajte u kalijev heksacijanoferat(II). Postupak ponovite desetak puta.
- Na kraju užareni čavao bez oklijevanja bacite u posudu s hladnom vodom. Očistite vrh čavla od ostataka i ispitajte turpijom. Uočit ćete da je površina pri vrhu čavla postala skoro jednako tvrda kao i turpija.
- Pri povišenoj temperaturi kalijev heksacijanoferat(II) se raspada, a ugljik i dušik difundiraju u željezo. Pritom u površinskom sloju željeza nastaju cementit, Fe3C, i željezovi nitridi. Cementit je vrlo tvrd i krt, stoga turpija po vrhu čavla klizi kao po staklu.
Korozija željeza. Od svih konstrukcijskih materijala željezo je najviše podložno koroziji. Njegova je površina heterogenog sastava, tj. sadržava niz točkica na kojima se nalaze čestice ugljika ili čestice drugih metala, primjerice bakra. Dođe li na površinu takva željeza kapljica vode nastat će lokalni galvanski članak u kojem se željezo oksidira otpuštajući elektrone (željezo je anoda galvanskog članka):
2 Fe(s) → 2 Fe2+(aq) + 4 e−.
Istodobno čestica ugljika ili bakra, uklopljena u površinu željeza, djeluje kao katoda na kojoj se reducira kisik otopljen u vodi:
2 H2O(l) + O2(aq) + 4 e− → 4 OH−(aq).
Nastali ioni Fe2+(aq) s ionima OH−(aq) čine netopljivi Fe(OH)2(s) koji se kisikom iz zraka ili vode dalje oksidira u Fe(OH)3(s):
4 Fe(OH)2(s) + O2(g) + 2 H2O(l) → 4 Fe(OH)3(s).
Željezov(III) hidroksid Fe(OH)3(s) spontano prelazi u hidratizirani željezov(III) oksid, Fe2O3·xH2O(s), kojeg nazivamo hrđa. Talog hrđe ima veći volumen od željeza iz kojeg je nastao. Zato je sloj hrđe porozan pa ne može štititi željezo od daljnje korozije. Hrđa se neprekidno stvara, a njezin se sastav mijenja od dubljih slojeva prema površini. U dubljim slojevima, neposredno uz željezo, prevladavaju hidratizirani oksidi dvovalentnog, a na površini slojevi trovalentnog željeza.
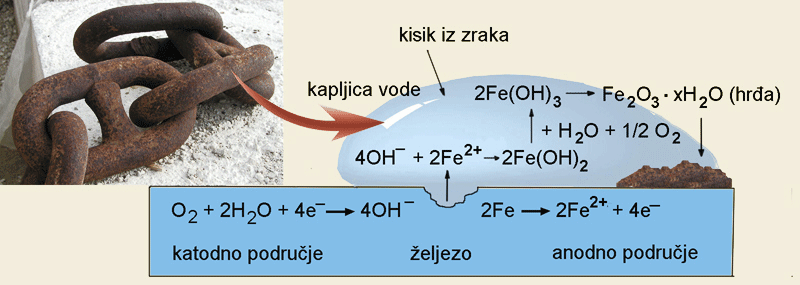
Slika 6.13. Shematski prikaz hrđanja željeza u vlažnoj atmosferi
Korozija željeza sprječava se bojenjem bojama na bazi sušivih ulja, koja na površini tvore za vodu nepropusne prevlake te tako željezo štite od hrđanja. Mnogo bolja zaštita postiže se prevlakama od cinka koje se na očišćenu površinu željeza mogu nanositi elektrolizom ili uranjanjem predmeta u rastaljeni cink. Tako se zaštićuju vodovodne željezne cijevi, limovi od kojih se izrađuju žljebovi (oluci) na krovovima kuća i dr. Zaštita se temelji na namjerno načinjenom korozijskom članku u kojem je cink anoda, koja se troši, a željezo katoda.
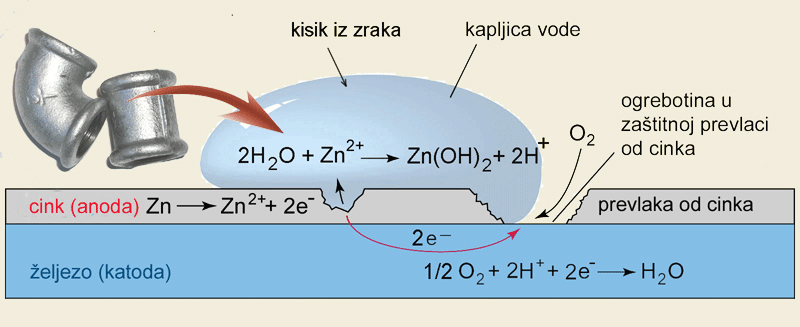
Slika 6.14. Shematski prikaz zaštitnog djelovanja cinka na pocinčanom željezu
Pribor: 4 epruvete, 4 obična željezna čavla, komadić bakrene žice, granula cinka.
Postupak
- U prvu epruvetu ulijte destiliranu a u ostale običnu vodu iz vodovoda.
- U prvu i drugu epruvetu stavite običan čavao, u treću čavao omotan komadićem bakrene žice, a u četvrtu čavao na koji je pričvršćena granula cinka.
- Pratite i obrazložite promjene tijekom desetak dana.

Slika 6.15. Rezultati korozije željeza u različitim uvjetima nakon 7 dana: a) željezo u destiliranoj vodi, b) željezo u vodovodnoj vodi c) željezo u vodovodnoj vodi u doticaju s bakrom čini korozijski članak u kojemu je željezo anoda, d) željezo u vodovodnoj vodi u doticaju s cinkom čini korozijski članak u kojemu je cink anoda. Cink se otapa a željezo ostaje zaštićeno
Vidi na internetu: e-Kemija: Sikirica - Sinteza zeljezova sulfida
Vidi na internetu: e-Kemija: Sikirica - Željezo
Željezo je presudno za svaku vrstu živog organizma, uključujući biljke, bakterije, životinje i ljude. To uključuje transport kisika (kroz hemoglobin u životinja i ljudi) i proizvodnju energije (prijenosom elektrona u mitohondrijskom respiratornom lancu). Uz to željezo je neophodno za mnoge metaboličke procese, uključujući popravak i replikaciju DNA, regulaciju ekspresije gena i dr. Stoga su mnogi patogeni vrlo ovisni o opskrbi željezom te se koriste različitim putovima za apsorpciju željeza iz okoline ili čak "krađom" od svog domaćina. Funkcije željeza uglavnom se temelje na njegovoj sposobnosti davanja elektrona. To omogućuje proizvodnju slobodnih radikala koji su potencijalno toksični za domaćina, ali i za napadače. Željezo je stoga neophodno za život, ali i potencijalno otrovno.
6.6. Kompleksni ili koordinacijski spojevi
Željezo se ne otapa u koncentriranoj sumpornoj kiselini. Stoga se koncentrirana sumporna kiselina transportira u željeznim cisternama i skladišti u željeznim rezervoarima. No, razrijeđena sumporna kiselina otapa željezo.
Pribor i kemikalije: 2 Erlenmeyerove tikvice od 100 mL, menzura od 50 mL, lijevak za filtriranje, filtrirni papir, porculanska zdjelica promjera 6 ili 8 cm, tronožac, staklokeramička pločica, plamenik, termometar do 100 oC, željezne strugotine, 20-postotna otopina sumporne kiseline.
Postupak
- 3 grama željeza u prahu ili željeznih strugotina stavite u Erlenmeyerovu
tikvicu i dodajte 20 mL 20-postotne otopine sumporne kiseline. Nakon što se
otapanje uspori reakcijsku smjesu lagano zagrijte, najviše do 50 oC,
dok se svo željezo ne otopi:
Fe(s) + H2SO4(aq) → Fe2+(aq) + SO42−(aq).
- Otopinu profiltrirajte u drugu Erlenmeyerovu tikvicu kako biste odvojili netopljivi ugljik kojeg svako željezo sadržava.
- Filtrat iz Erlenmeyerove tikvice prelijte u porculansku zdjelicu te polagano isparavajte uz stalno miješanje termometrom, pazeći da temperatura ne prijeđe 55 oC.
- Nakon što se na stijenkama zdjelice pojave prvi svjetlozeleni kristali prekinite zagrijavanje i pustite da se otopina ohladi. Iz dobro ohlađene otopine iskristalizirat će kristali zelene galice, tj. željezova(II) sulfata heptahidrata, FeSO4·7H2O. Dobivene kristale filtriranjem odvojite od preostale matičnice i ostavite da se suše na filtrirnom papiru.
Rendgenskom strukturnom analizom dokazano je da u kristalima zelene galice šest molekula vode koordinira (okružuje) ione Fe2+ tako da tvore oktaedar, [Fe(H2O)6]2+, u čijem je središtu ion Fe2+. Ta se oktaedarska struktura periodički ponavlja kroz cijeli kristal. Očito je da ion Fe2+ s molekulama vode čini vrlo stabilan kompleksni ion [Fe(H2O)6]2+. Sedma je molekula vode smještena blizu sulfatnog aniona. Stoga sastav zelene galice prikazujemo formulom [Fe(H2O)6]SO4·H2O. Pokazalo se da su kompleksni ioni stabilne molekularne vrste, ne samo u kristalima nego i u otopinama.
Molekule ili ioni vezani na središnji atom kompleksnih spojeva nazivaju se ligandima. To mogu biti male anorganske ili organske neutralne molekule i ioni koji posjeduju nepodijeljeni par elektrona, primjerice H2O, H2S, NH3, PH3, NO, CO, ili anioni Cl–, CN–, OH–, CH3COO–, CO32– i dr.
No, postavlja se pitanje kakvom su to vezom, primjerice, ioni Fe2+ i molekule vode, vezani u stabilne kompleksne ione. Ima više teorija o vrsti veze u kompleksnim (koordinacijskim) spojevima. Najjednostavnija je teorija valentne veze (engl. valence bond theory, VB) Linusa Paulinga iz 1930. god. Teoriju kristalnog polja predložio je Hans Bethe 1929. a teoriju ligandnog polja J. H. van Vleck 1935. god.
Prema teoriji valentne veze kovalentna veza između dva atoma nastaje preklapanjem napola popunjenih valentnih atomskih orbitala atoma koji imaju jedan nespareni elektron, primjerice: H· + . H → H : H.
U kompleksnim (koordinacijskim) spojevima veza između centralnog iona i liganda također je kovalentna, s tom razlikom da oba elektrona u zajedničkom elektronskom paru potječu od liganda. Ligandi doniraju nepodijeljeni par elektrona u nepopunjene, primjerice, d-atomske orbitale iona metala. Stoga se veza između centralnog iona i liganda naziva koordinacijsko-kovalentnom vezom.
U poglavlju 5.2.6. Elektronska konfiguracija, udžbenika e-Kemija1, govorili smo o raspodjeli elektrona po ljuskama i podljuskama atoma za prvih 10 kemijskih elemenata, tj. od vodika do neona. Pritom smo elektronske konfiguracije atoma, od bora pa do neona, prikazali metodom „kućica“ kao na slici 6.16.
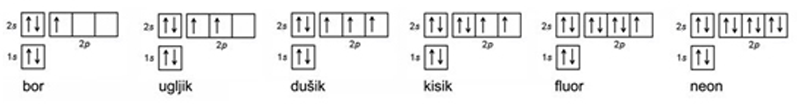
Slika 6.16. Shematski prikaz elektronskih konfiguracija atoma s 2p-podljuskom. Elektroni su predstavljeni strelicama. Strelice suprotna smjera označavaju elektrone suprotna spina. Prva ljuska ima samo jednu i to 1s-podljusku koja može primiti dva elektrona. Druga ljuska sastoji se od 2s i 2p podljuske. Elektroni u 2p podljuski razmještena su tako da broj nesparenih elektrona s paralelnim spinom bude maksimalan.
Jednakim ćemo postupkom prikazati elektronske konfiguracije 3d-podljuske atoma Fe, iona Fe2+ i iona Fe3+.
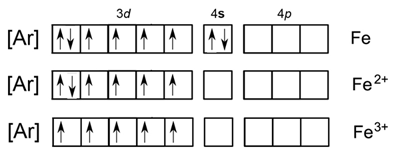
Slika 6.17. Elektronske konfiguracije atoma Fe, iona Fe2+ i iona Fe3+
Da bi postigli stabilnu elektronsku konfiguraciju plemenitog plina kriptona, ioni Fe2+ mogu primiti 12 elektrona u četiri 3d-orbitale, jednu 4s-orbitalu i tri 4p-orbitale. U kompleksnim ionima [Fe(H2O)6]2+ šest molekula vode donira 12 elektrona u šest d2sp3 hibridnih orbitala jednake energije.
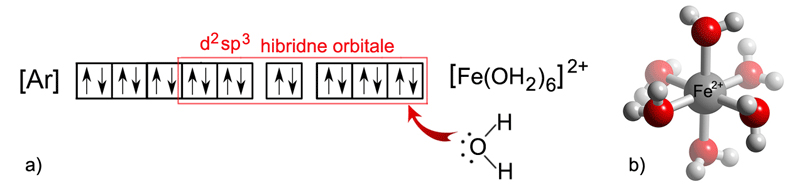
Slika 6.18. a) Elektronska konfiguracija iona Fe2+ u kompleksnom ionu [Fe(H2O)6]2+. Svaka od šest molekula vode donira jedan nepodijeljeni elektronski par u d2sp3 hibridne orbitale centralnog iona. b) model građe iona [Fe(H2O)6]2+. Molekule vode zauzimaju vrhove oktaedra.
Ligandi mogu biti monodentatni, što znači da u nepopunjene orbitale centralnog iona doniraju samo jedan nepodijeljeni par elektrona. Bidentatni ligandi („ligandi s dva zuba“), poput etilendiamina, H2N–CH2–CH2–NH2, u nepopunjene orbitale centralnog iona doniraju dva nepodijeljena elektronska para s atoma dušika.
Etilendiamintetraoctena kiselina (engl. ethylenediaminetetraacetic acid) ili kraće EDTA (poznata još pod nazivom KOMPLEKSON II) je heksadentatni ligand. EDTA, [CH2N(CH2CO2H)2]2, je slaba kiselina pa njezine otopine djeluju slabo kiselo. Ima mnogobrojne primjene, primjerice, rabi se kao aditiv deterdžentima jer s kalcijevim i magnezijevim ionima tvori kompleks. Time se smanji tvrdoća vode i poboljšava moć pranja deterdženta. Dodaje se šamponima, sredstvima za kozmetiku, sredstvima za čišćenje i dr. U medicini se natrijevkalcijevedetat, CaNa2EDTA, rabi za vezanje metalnih iona pri liječenje trovanja živom i olovom.
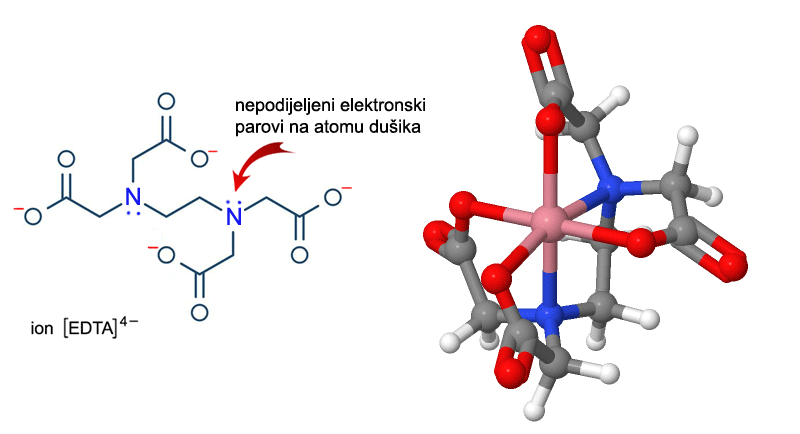
Slika 6.19. Potpuno ionizirana molekula EDTA i model EDTA kao heksadentatnog liganda
Broj molekula, iona ili skupina koje okružuju, tj. koordiniraju, centralni ion u kompleksnim spojevima naziva se koordinacijskim brojem, kraće KB. On ovisi o svojstvima središnjeg atoma, prvenstveno o njegovoj elektronskoj konfiguraciji i veličini. Najčešći su koordinacijski brojevi 4 i 6, ali su mogući 2, 3, 5, 7, 8 ili 12. Primjere prostornog razmještaj liganada, tj. geometrije kompleksnih iona, pogledajte OVDJE.
Vidi na internetu: e-Kemija: Sikirica - Kompleksni spojevi
Zamjena liganada I
Kad se u vodenu otopinu iona nekog metala dodaju drugi ligandi, može doći do zamjene molekula vode drugim „jačim“ ligandom. Primjerice, ako se u otopinu koja sadržava ione [Fe(H2O)6]2+ doda kalijev cijanid, KCN, nastat će vrlo stabilni kompleksni ioni [Fe(CN)6]4−. Iz dobivene otopine iskristaliziraju krupni, poput limuna žuti kristali kalijeva heksacijanoferata(II), K4[Fe(CN)6]·3H2O. Iako je kalijev cijanid vrlo otrovan, cijanidni su ioni u ovom kompleksnom spoju tako čvrsto vezani na ion Fe2+ da se K4[Fe(CN)6]·3H2O dodaje kao sredstvo protiv zgrudavanja (E536), primjerice kuhinjskoj soli, u koncentraciji od 10 do 20 mg po kilogramu proizvoda.
Nekad se kalijev heksacijanoferat(II) trihidrat dobivao taljenjem otpadaka iz klaonica s potašom, K2CO3, i željeznim strugotinama u željeznom kotlu. Otpaci iz klaonica služili su kao izvor ugljika i dušika. Nakon izluživanja taline vodom iz dobivene otopine kristaliziraju kristali „žute krvne soli“, K4[Fe(CN)6]·3H2O. Ako se taljenje izvodi uz dodatak kalijeve salitre, KNO3, dobije se kalijev heksacijanoferat(III), tj. „crvena krvna sol, K3[Fe(CN)6].
Kad se u otopinu kalijeva heksacijanoferata(II) doda otopina željezova(III) klorida u suvišku u odnosu na kalijev heksacijanoferat(II), nastaju koloidno dispergirane čestice tzv. „netopljivog berlinskog modrila“:
K4[Fe(CN)6](aq) + 4 FeCl3 (aq) → Fe4[Fe(CN)6]3(s) + 12 KCl(aq).
Ako se željezov(III) klorid i kalijev heksacijanoferat (II) uzmu u množinskom omjeru 1:1, tad se dobije tzv. „topljivo berlinsko modrilo“:
K4[Fe(CN)6](aq) + FeCl3(aq) → KFe[Fe(CN)6](aq) + 3 KCl(aq).
Otkad je otkriveno, oko 1807. god., zbog jednostavne proizvodnje, jeftinoće, neotrovnosti i jakog kolorita, berlinsko se modrilo brzo proširilo Europom kao uljana boja u slikarstvu i vodena boja za tkanine.
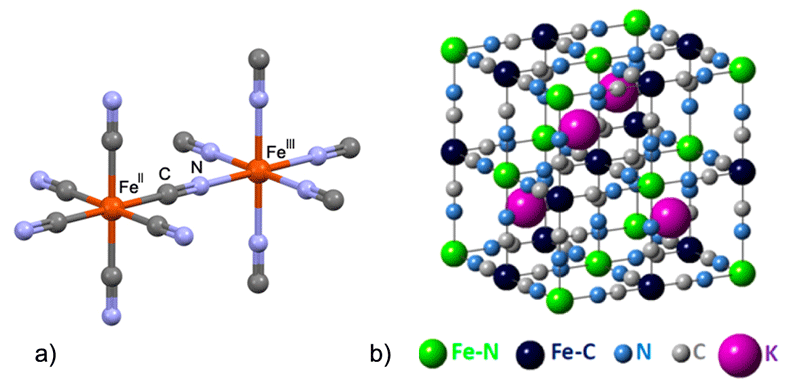
Slika 6.20. a) Koordinacijska sfera u
idealiziranom berlinskom modrilu. b) Jedinična ćelija idealizirane kristalne
strukture berlinskog modrila. Osnovna strukturna jedinka koja daje boju berlinskom modrilu
jest slijed −FeII−C≡N−FeIII−N≡C−
koji se rasprostire u sva tri smjera u prostoru.
Slike izvori:
Prussian_blue; Prussian-Blue-structure
Vidi na internetu: Berlinsko modrilo.pdf
Kalijevi ioni u strukturi berlinskog modrila mogu se zamjenjivati drugim jednovalentnim kationima. Stoga se berlinsko modrilo rabi u terapijske svrhe za uklanjanje talija, Tl+, te radioaktivnog cezija, 134Cs+ i 137Cs+, iz krvotoka osoba otrovanih talijem i osoba izloženih produktima nuklearnih eksplozija ili nesreća u nuklearnim elektranama (Černobil, Fukushima). Smatra se da odrasli muškarac može pojesti 10 g berlinskog modrila dnevno bez ozbiljnih posljedica.
Zamjena liganada II
Jednostavan pokus, koji se može izvesti u svakom školskom laboratoriju, jest zamjena molekula vode, u koordinacijskoj sferi iona [Cu(H2O)6]2+, molekulama amonijaka, NH3. Kad se u otopinu modre galice doda kap otopine amonijaka najprije se istaloži neutralni kompleks modre boje:
[Cu(H2O)6]2+(aq) + 2 NH3(aq) → [Cu(OH)2(H2O)4](s) + 2 NH4+(aq).
Talog se otapa u višku amonijaka pri čemu nastaje tamnoplava otopina koja sadržava tetraamindiakvabakrove(II) ione, [Cu(NH3)4(H2O)2]2+:
[Cu(OH)2(H2O)4](s) + 4 NH3(aq) → [Cu(NH3)4(H2O)2]2+ + 2 OH–(aq) + 2 H2O.
Amonijak istiskuje vodu iz iona [Cu(H2O)6]2+(aq) jer je jači ligand od vode.
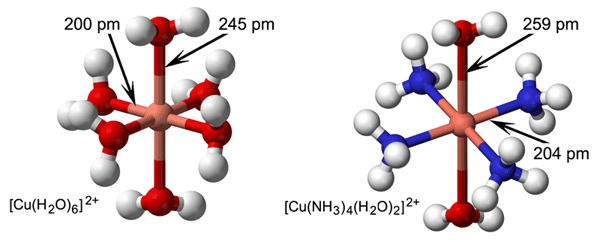
Slika 6.21. a) U
vodenim otopinama bakrovi ioni oktaedarski su koordinirani sa šest molekula
vode, tj. tvore kompleksne ione [Cu(OH2)6]2+. Molekule
vode zaposjedaju vrhove izduženog oktaedra. b) U ionima, [Cu(NH3)4(H2O)2]2+, molekule amonijaka čine
kvadrat, dok molekule vode zauzimaju vrhove izduženog oktaedra.
Više
doznajte OVDJE.
Vidi na internetu: e-Kemija: Sikirica - Kobalt
Vidi na internetu: e-Kemija: Sikirica - Željezo
Koordinacijski spojevi u prirodi
Koordinacijski spojevi koji se pojavljuju u prirodi od velike su važnosti za sva živa bića. Oko 40 % svih poznatih enzima, prirodnih katalizatora koji reguliraju biološke procese, su metaloenzimi. U metaloenzimima ioni metala (Zn, Mg, Ca, Fe, Cu, Mn, Mo, Ni, V) su koordinirani dijelovima polipeptidnog lanca te najčešće čine aktivno mjesto enzima. Aktivno mjesto enzima karboksipeptidaze sadržava ion cinka koordiniran s dva atoma dušika i dva atoma kisika koji čine dijelove polipeptidnog lanca. Peto mjesto zauzima molekula vode. To je važan enzim za probavu jer hidrolizira peptidne veze na C-kraju aminokiselinskog lanca. Enzim katalaza katalizira kemijsku reakciju razgradnje toksičnog vodikova peroksida, H2O2, na kisik i vodu. Sastoji se od četiri podjedinice (tetramer), pri čemu svaka podjedinica sadržava skupinu hem, tj. kompleks željeza i porfirina. Bakterijski enzim nitrogenaza, odgovoran za fiksaciju (asimilaciju) atmosferskog dušika, sadržava željezo i molibden, a rjeđe vanadij. Vitamin B12, poznat i kao kobalamin, sadržava oktaedarski koordiniran ion kobalta.
Klorofil, je zeleni biljni pigment. Imaju ga sve zelene biljke, alge i jedna skupina primitivnih fotosintetskih bakterija. Klorofil je bitan za fotosintezu jer biljkama omogućuje apsorpciju energije svjetlosti. Biljke su zelene stoga što klorofil apsorbira plavi i crveni dio. Klorofil je također kompleksni spoj. Ima nekoliko vrsta klorofila, ali svaki od njih sadržava porfirinski prsten. Porfirini su skupina prirodnih spojeva u kojima su četiri pirolova prstena spojena metilenskim mostovima. Porfirini su planarni ligandi koji doniraju četiri para elektrona u nepopunjene orbitale središnjeg iona Fe2+ u hem-skupini, središnjeg iona Mg2+, u klorofilu i dr.
Slika 6.22. Uočite sličnost građe hem-skupine i molekule klorofila. a) Postoji nekoliko biološki važnih skupina hema, a najrasprostranjeniji je hem B prikazan na slici 6.22a. Različite hem-skupine imaju različite funkcijske skupine vezane na porfirinski prsten. b) U središtu molekule klorofila nalazi se ion Mg2+. Postoji nekoliko vrsta klorofila, ali svi oni sadržavaju porfirinski prsten s ionom Mg2+ u središtu. Različiti bočni lanci, vezani na porfirinski prsten, uzrokuju različitu boju, tj. apsorpcijski spektar klorofila.
Hemoglobin je
protein koji se sastoji od četiri polipeptidna lanca (α1,
α2, β1 i β2). Svaki je lanac
vezan za prostetičku skupinu hem koja se sastoji od porfirina u čijem se središtu nalazi ion željeza(II).
Taj kompleks željeza i
porfirina prenosi kisik iz plućnih mjehurića u periferna tkiva. Naime, ion željeza
u hem-skupini može reverzibilno koordinirati molekulu kisika. Vezanje i
otpuštanje kisika povezano je s promjenom prostorne građe hem-skupine i cijele
makromolekule.
Pogledajte na internetu: HEMOGLOBIN AND MYOGLOBIN BIOCHEMISTRY
Slika 6.23. a) U deoksihemoglobinu željezo je izvan ravnine porfirinskog prstena. b) Prva molekula kisika koja se veže na željezo(II) hem-skupine povlači željezo u ravninu porfirinskog prstena. Ovaj lagani konformacijski pomak potiče vezanje još tri molekule kisika na hem-skupine u preostale tri podjedinice. Konačno, oksihemoglobin u potpuno zasićenom obliku sadržava četiri molekule kisika. Do smrti uslijed trovanju ugljikovim monoksidom dolazi stoga što se molekule CO na hem-skupine vežu na isto mjesto kao i kisik, ali oko 250 puta jačom vezom od njega. Tako nastaje karboksihemoglobin (HbCO) koji ne može prenositi kisik od plućnih mjehurića do stanica. Bez kisika stanice odumiru. Udio HbCO u krvi nepušača manji je od 3 %, dok kod pušača doseže više od 10 %. Pušači umiru ranije i tako štede novac mirovinskih fondova.
Više doznajte na:
hr.wikipedia: Kompleksni_spojevi
enciklopedija.hr: kompleksni spojevi
Nomenklatura kompleksnih spojeva (pdf)
Temeljito proučite postupak dobivanja ili primjenu jednog od tehnički važnih metala, kao što su litij, magnezij, aluminij, bakar, cink, olovo, srebro i zlato. Prezentirajte u razredu rezultate literaturnog istraživanja.
Nađite na internetu video varenja željezničkih tračnica "termitom". Prikažite video u razredu i potkrijepite ga kemijskim reakcijama. Izračunajte entalpiju reakcije.
Istražite ima li Hrvatska prirodna ležišta minerala nekih tehnički važnih ili rijetkih metala.
Upoznajte ulogu najvažnijih metala (biogenih elemenata) u većini oblika života. Osobitu pozornost posvetite alkalijskim i zemnoalkalijskim metalima, bakru, cinku, željezu te klasterima željeza i sumpora. Referirajte u razredu o ulozi odabranog metala za neki od oblika života - od bakterija do sisavaca.
Potražite u knjižnici znanstveno-popularnu knjigu: N. Raos, Metali života – metali smrti, Školska knjiga, Zagreb, 2008.
Nađite primjere primjene koordinacijskih spojeva u tehnologiji, primjerice Mondov postupak rafiniranja nikla, primjena cijanokompleksa u galvanizaciji (bakar, srebro, zlato) i dr.
Upoznajte građu i funkcije nekih prirodnih kompleksnih spojeva, primjerice metaloenzima.
Izradite plakat, PowerPoint prezentaciju, snimite video, održite predavanje u razredu, organizirajte raspravu, pišite u školskom listu ili pokrenite neku aktivnost u vezi odabrane teme.
7. NEMETALI
Od svih poznatih kemijskih elemenata samo je 16 nemetala. Kemijska i fizička svojstva nemetala bitno se razlikuju od svojstava metala. Ktomu i njihova se svojstva međusobno jako razlikuju. Većina ih je pri sobnoj temperaturi u plinovitu stanju, tj. vodik, kisik, kisik, fluor, klor i plemeniti plinovi. Samo je brom tekućina. Svi preostali nemetali - ugljik, fosfor, sumpor i jod, pri sobnoj su temperaturi krutine. Osim grafita svi su nemetali izolatori. Ne mogu se kovati, valjati ili izvlačiti u žice. Nemaju karakterističan sjaj poput metala.
Nemetali u kemijskim reakcijama s metalima tvore ionske spojeve u kojima su atomi metala pozitivno nabijeni ioni ili kationi, a atomi nemetala negativno nabijeni ioni ili anioni. Nemetali mogu imati pozitivna i negativna oksidacijska stanja.
Malu skupinu elemenata, na granici između metala i nemetala nazivamo metaloidi ili polumetali. Ti elementi imaju svojstva metala i nemetala. Slabo provode električnu struju i toplinu, tj. nisu ni provodnici ni izolatori. Treba reći i to da je granica između metala i nemetala dosta neodređena, pa bi se prije moglo govoriti o metalnim i nemetalnim svojstvima nekog elementa. Kako razumjeti pojam „metal“ doznajte u rubrici Kemija u nastavi časopisa Kemija u industriji u članku: Kako razumjeti pojam “metal” (pdf)
U ovom ćemo poglavlju upoznati svojstva samo nekih nemetala: vodika, klora, kisika, sumpora, dušika, fosfora, ugljika i silicija. Posebnu pozornost posvetili smo siliciju stoga što je silicij sastojak gotovo svih stijena Zemljine kore.
7.1. Vodik
Među svim nemetalima posebno mjesto i pozornost zauzima vodik, jer je najzastupljeniji element u svemiru. Vodik čini oko 75 % mase svemira, ili preko 90 % svih atoma u svemiru. Sunce i većina drugih zvijezda sastoje se pretežito od vodika. Prema broju atoma u Zemljinoj kori, nakon kisika i silicija, vodik je treći element po zastupljenosti. Zbog male relativne atomske mase on čini samo 1 % mase Zemljine kore. Većina atoma vodika u Zemljinoj kori vezana je u molekule vode. U Zemljinoj atmosferi vodika ima vrlo malo, svega 0,4 volumna dijela na milijun dijelova zraka. Najviše vodika ima u visokim dijelovima atmosfere, u stratosferi. Zbog male molekulske mase molekule vodika imaju veliku prosječnu brzinu pa zbog toga "bježe" iz atmosfere u svemir. Zato je koncentracija vodika u Zemljinoj atmosferi tako mala.
Vodik se nekad rabio kao plin za punjenje balona i upravljivih zračnih brodova čvrste konstrukcije (dirižabla, cepelina). Posljednji takav zračni brod, Hindenburg, koji je služio za prijevoz putnika preko Atlantika, zapalio se 6. svibnja 1937. godine prilikom pristajanja u USA te izgorio za 32 sekunde. Zbog zapaljivosti vodika danas se istraživački i meteorološki baloni pune helijem, a sportski toplim zrakom.

Slika 7.1. Propast
Hindenburga jednog od najvećih zračnih brodova. Bio je dugačak 245 m, promjera
41 m, a sadržavao je 199.980 m3 vodika.
Vidi na internetu: Hindenburg Disaster - Real Footage (1937)
Vodik se u laboratoriju najčešće dobiva djelovanjem kiselina na metale. Tako je još R. Boyle (1627. − 1691.) dobio vodik djelovanjem klorovodične kiseline na željezne strugotine. U školskim laboratorijima vodik se dobiva elektrolizom vode ili djelovanjem sumporne kiseline na cink u Kippovu aparatu:
Zn(s) + H2SO4(aq) → ZnSO4(aq) + H2(g).
Vidi na internetu: e-Kemija: Sikirica - Vodik
Vidi na internetu: e-Kemija: Sikirica - Elektroliza vode
Vodik je tipičan nemetal. Čini kovalentne spojeve s drugim nemetalima i ionske spojeve s alkalijskim i najreaktivnijim zemnoalkalijskim metalima. Binarni spojevi s vodikom zovu se hidridi. Dijelimo ih u tri skupine: ionske, kovalentne i intersticijske hidride.
Ionski hidridi nastaju reakcijom elementarnog vodika pri povišenoj temperaturi s bilo kojim alkalijskim metalom te kalcijem, stroncijem i barijem:
Ca(s) + H2(g) → CaH2(s).
Po kemijskim svojstvima slični su solima. Bijele su boje, a tališta su im visoka. Pri elektrolizi talina hidrida vodik se izlučuje na anodi. To dokazuje da se u ionskim hidridima vodik nalazi u obliku iona H−. Kalcijev hidrid prikladan je izvor vodika te se u Drugome svjetskom ratu rabio za stvaranje lažnih meta u protupodmorničkom ratovanju:
CaH2(s) + H2O(l) → Ca(OH)2(s) + H2(g).
Kovalentni hidridi nastaju kad se vodik veže kovalentnom vezom na atom drugog nemetala, primjerice ugljika, dušika, kisika, fluora ili klora.
Slika 7.2. Modeli molekula kovalentnih hidrida: CH4, NH3, H2O i HF
Svi kovalentni hidridi elemenata 14. skupine imaju tetraedarsku strukturu kao metan. Svi hidridi 15. skupine imaju strukturu trostrane piramide kao amonijak. Svi hidridi 16. skupine imaju V−oblik kao voda. Svi hidridi 17 skupine linearne su građe.
Intersticijske hidride tvore mnogi prijelazni metali. Nastaju neposrednom reakcijom prijelaznog metala i vodika pri relativno niskoj temperaturi. Na površini metala molekule vodika se disociraju, pa mali atomi vodika difundiraju u međuatomske praznine (intersticije) kristalne strukture metala. Intersticijski hidridi više podsjećaju na krute otopine nego na prave spojeve. Zato im je sastav promjenjiv i ovisi o tlaku i temperaturi. Primjerice, paladij može apsorbirati 900 puta veći volumen vodika u odnosu na vlastiti volumen. Zato se paladij rabi za pročišćavanje vodika od tragova ostalih plinova. Ugrijana cijev od paladija djeluje kao sito kroz koje može proći samo vodik, dok molekule drugih plinova ne mogu. Tako se dobije najčišći vodik.
Neke slitine lantanoida i prijelaznih metala, primjerice LaNi5, mogu apsorbirati toliko vodika da je njegova gustoća u takvoj slitini veća nego u tekućem ili krutom vodiku. To je svojstvo vodika iskorišteno u metalhidrid baterijama koje se mogu ponovo puniti.
S ekološkog stajališta vodik je najčišće gorivo jer njegovim izgaranjem nastaje samo voda. Zato se danas ulažu veliki napori da se nađu jeftine metode dobivanja vodika. Jedno od poznatih rješenja je elektroliza vode električnom energijom dobivenom pomoću fotonaponskih ploča, solarnih panela.
7.2. Halogeni elementi
Halogeni elementi su reaktivniji od svih drugih elemenata. Nema ih slobodnih u prirodi. Dolaze samo u spojevima, najčešće kao soli alkalijskih metala.
Tablica 7.1. Pregled svojstava halogenih elemenata
|
Element |
Struktura molekule |
Svojstva elementa |
Formula i svojstva srebrovih halogenida |
Kiseline |
|
Fluor |
F2, |
Žućkast plin |
AgF, bijel, topiv u vodi |
HF |
|
Klor |
Cl2, |
Žutozeleni plin |
AgCl, žućkast, netopiv u vodi |
HCl, HOCl, HClO2, HClO3, HClO4 |
|
Brom |
Br2, |
Crvenosmeđa tekućina |
AgBr, žut, netopiv u vodi |
HBr, HBrO3 |
|
Jod |
I2, |
Tamnoljubičasti kristali |
AgI, svjetlo žut, netopiv u vodi |
HI, H5IO6 |
Halogeni elementi imaju slična kemijska svojstva. Fluor, klor, brom i jod burno reagiraju s metalima. Spajaju se međusobno te čine niz vrlo reaktivnih interhalogenih spojeva sljedećih tipova:
- AX: ClF, BrF, BrCl, ICl, IBr,
- AX3: ClF3, BrF3, (ICl3)2,
- AX5: ClF5, BrF5, IF5,
- AX7: IF7
O svojstvima i strukturi interhalogenih spojeva više doznajte OVDJE. Atraktivne snimke reakcija ICl s metalima obvezno pogledajte u video isječku:
Iodine monochloride. Interhalogen compound can dissolve Gold
Vidi na internetu: Reaction of Chlorine with Sodium 1
Iodine - THE MOST COLOURFUL ELEMENT ON EARTH!
7.2.1. Fluor
Fluor, F2, je kemijski vrlo reaktivan plin. Žućkaste je boje. Dobiva se elektrolizom taline KHF2. Naime, fluor s vodom daje kisik i fluorovodičnu kiselinu, HF(aq). Stoga se ne može dobiti iz vodenih otopina:
2 H2O(l) + 2 F2(g) → 4 HF(aq) + O2(g).
Elementarni fluor najviše se rabi u postupku obogaćivanja urana za dobivanje uranijeva heksafluorida, UF6. Fluor je najelektronegativniji element te se neposredno spaja sa svim elementima, a s cezijem uz pojavu bliješteće bijele svjetlosti. S plemenitim plinom ksenonom čini bezbojne kristale XeF2, XeF4, XeF6, a s kriptonom KrF2.
Fluor se u prirodi nalazi samo u spojevima kao mineral fluorit, tj. kalcijev fluorid, CaF2, kao mineral kriolit, Na3AlF6, fluorapatit, Ca5(PO4)3F i dr. Fluorit se rabi u proizvodnji stakla, emajla i glazura, a u metalurgiji i zavarivanju za dobivanje lako taljive troske koja štiti rastaljeni metal od oksidacije.
Ako se na fluorit djeluje sumpornom kiselinom dobiva se fluorovodik:
CaF2(s) + H2SO4(l) → CaSO4(s) + 2 HF(g).
Otopina fluorovodika u vodi je fluorovodična kiselina, HF(aq). Njezine se soli nazivaju fluoridi. Fluorovodična kiselina reagira sa silicijevim dioksidom iz stakla pri čemu nastaje plinoviti silicijev tetrafluorid, SiF4:
SiO2(s) + 4 HF(aq) → SiF4(g) + 2 H2O(l).
Stoga se fluorovodična kiselina mora čuvati u plastičnoj boci.
Pri rukovanju fluorovodičnom kiselinom obvezno morate nositi zaštitne naočale i rukavice te raditi u digestoru.Obvezno pogledajte na internetu: universal_safety_solutions - introduction-to-hydrofluoric-acid
7.2.2. Klor
Klor je žutozeleni plin. Gustoća mu je veća od gustoće zraka pa se sakuplja u posudama s otvorom okrenutim prema gore. Transportira se u tekućem stanju u čeličnim bocama pod tlakom 5 do 10 bara. Jako je otrovan jer razara sluzokožu organa za disanje sa smrtonosnim posljedicama. U Prvome svjetskom ratu rabili su ga kao bojni otrov.
Vidi na internetu: otac_kemijskog_rata
Klora u prirodi nema u elementarnom stanju nego samo u spojevima. Najvažnija mu je primjena u kemijskoj industriji. Jedna od svakom poznatih primjena klora je za dezinfekciju vode u bazenima za kupanje. Otopina klora u vodi, klorna voda, je jako dezinfekcijsko sredstvo te se u razrijeđenom stanju može koristiti i u kućanstvu. O kloru u vodi – kao primjeru kemijske ravnoteže i reaktivnosti više doznajte u rubrici Kemija u nastavi časopisa Kemija u industriji u članku: Klor u vodi – primjer kemijske ravnoteže i reaktivnosti (pdf)
Klor se može dobiti na više načina. Laboratorijski se najčešće dobiva oksidacijom koncentrirane klorovodične kiseline. Kao oksidacijsko sredstvo najpogodniji je kalijev permanganat, KMnO4:
2 KMnO4(s) + 16 HCl(aq) → 2 KCl(aq) + 2 MnCl2(aq) + 8 H2O(l) + 5 Cl2(g).
Vidi na internetu: Reactions of chlorine
RADITE U DIGESTORU
Pribor: stakleni cilindar, satno staklo, varikina, lakmusov papir, obojena tkanina
Postupak
- U stakleni cilindar ulijte oko 20 mL "varikine". Na rub cilindra s unutarnje strane nalijepite vlažan lakmusov papir a preko ruba cilindra objesite vlažnu traku platna uprljanu tintom.
- Dolijte u cilindar oko 20 mL klorovodične kiseline kakva se u domaćinstvu rabi za čišćenje sanitarnih uređaja. Cilindar odmah poklopite satnim staklom. Međusobnom reakcijom "varikine" i klorovodične kiseline razvija se klor. Uočite boju klora.
- Pratite promjene na lakmusovu papiru i tkanini uprljanoj tintom.
- Pokus možete izvesti i tako da umjesto "varikine" na dno cilindra stavite malo kalijeva permanganata, KMnO4, ili manganova dioksida, MnO2.
- Uhvatite pincetom ili kliještima smotuljak željezne vune. Radite brzo. Vunu užarite u plameniku te odignite satno staklo. Još užarenu željeznu vunu držite u gornjem dijelu cilindra ispunjena klorom. Uočite promjene.
- Nakon završenog pokusa ulijte u cilindar oko 30 mL otpadne otopine natrijeva hidroksida, začepite gumenim čepom i promućkajte.
"Varikina" je vodena otopina natrijeva hipoklorita, NaOCl. Reakcijom "varikine" i klorovodične kiseline, HCl, razvija se klor:
NaOCl(aq) + 2 HCl(aq) → Cl2(g) + NaCl(aq) + H2O(l).
Lakmusov papir i tkanina uprljana tintom pobijele jer u reakciji klora s obojenim spojevima nastaju novi kemijski spojevi koji su bezbojni. Užarena željezna vuna gori u kloru pri čemu nastaju crvenosmeđe pare željezova(III) klorida:
2 Fe(s) + 3 Cl2(g) → Fe2Cl6(g).
Kad se na kraju pokusa u cilindar doda otopina natrijeva hidroksida, klor reagira prema jednadžbi:
2 NaOH(aq) + Cl2(g) → NaOCl(aq) + NaCl(aq) + H2O(l).
Plinoviti klor apsorbira se u otopini natrijeva hidroksida pa se posuda može otvoriti i oprati.
VAŽNO UPOZORENJENatrijev hipoklorit, NaOCl, glavni je sastojak "Varikine" koja se u kućanstvu rabi kao sredstvo za dezinfekciju, ali i za izbjeljivanje tkanina. Otopina natrijeva hipoklorita jako je oksidacijsko sredstvo pa razara obojene organske spojeve, tj. mrlje na tkaninama. Pritom se djelomično oštećuje struktura prirodnog vlakna. Ako se tkanina predugo izloži djelovanju "varikine", ili se upotrijebi otopina prevelike koncentracije, tkanina se raspadne.
"Varikina" i klorovodična kiselina otrovne su i nagrizajuće kemikalije koje se rabe u većini domaćinstava. "Varikina" i klorovodična kiselina ne smiju se pomiješati jer njihovom međusobnom reakcijom nastaje klor. Pri radu s "varikinom", klorovodičnom kiselinom, kao i svim drugim kiselinama, treba upotrijebiti zaštitne rukavice i naočale. Ako "varikina" ili klorovodična kiselina dospije u oko treba ga odmah isprati sa što više mlačne vode i obvezno potražiti liječničku pomoć.
Klor je jači oksidans od broma i joda pa ih istiskuje iz njihovih soli. Brom je jači oksidans samo od joda i može samo njega istisnuti iz pripadne soli:
2KBr(aq) + Cl2(aq) → KCl(aq) + Br2(aq),
2KI(aq) + Cl2(aq) → KCl(aq) + I2(s).
Ako se klor uvodi u vruću otopinu kalijeva hidroksida dobije se kalijev klorid, KCl, i kalijev klorat, KClO3:
3 Cl2(g) + 6 KOH(aq) → KClO3(aq) + 5 KCl(aq) + 3 H2O(l).
Kalijev klorid dobro je topljiv, a kalijev klorat slabo topljiv u hladnoj vodi, pa se ova smjesa soli može razdvojiti frakcijskom kristalizacijom.
Zagrijavanjem kalijeva klorata, uz manganov dioksid kao katalizator, nastaje kisik:
MnO2(s)
2 KClO3(l) → 2 KCl(s) + 3O2(g).
Kalijev klorat ima mnogobrojne primjene. Rabi se i kao defolijant u agrotehnici, ali i kao sastojak eksploziva. Primjerice, glavice žigica sadržavaju smjesu kalijeva klorata, antimonova(III) sulfida, Sb2S3, sumpora i staklenog praha.
Taljenjem kalijeva klorata bez prisustva katalizatora dobije se kalijev perklorat:
4 KClO3(l) → 3 KClO4(s) + KCl(s).
Pomoćne rakete (booster rockets) Space Shuttle−a i drugih raketnih sustava punjene su smjesom amonijeva perklorata i aluminija u prahu. Pri lansiranju troši se pet tona goriva u sekundi. Kad se gorivo istroši pomoćne se rakete odbacuju.
Klorovodik, HCl, proizvodi se neposrednim spaljivanjem vodika u struji klora:
H2(g) + Cl2(g) → 2 HCl(g).
Zanimljivo je da smjesa vodika i klora može stajati neograničeno dugo u mraku. Do kemijske reakcije, tj. žestoke eksplozije, doći će tek kad se ova smjesa obasja jakom sunčevom ili plavom svjetlošću (fotokemijska reakcija). Klor je žutozelen, što znači da apsorbira plavu svjetlost. Energija apsorbiranog kvanta plave ili UV svjetlosti dostatna je za disocijaciju molekula klora pri čemu nastaju slobodni radikali. Slobodni radikal je svaka čestica koja ima jedan ili više nesparenih elektrona. Takve su čestice vrlo reaktivne:
Cl2 + hν → 2 Cl·
U reakciji Cl·(g) s molekulama vodika nastaju novi slobodni radikali, H·(g):
Cl· + H2 → HCl + H·
Reakcija se dalje nastavlja tako da atom vodika reagira s molekulom klora itd.:
H· + Cl2 → HCl + Cl·
Pritom se povisuje temperatura reakcijske smjese pa dolazi do termičke disocijacije molekula klora na atome klora. Reakcija se dalje širi eksplozivnom brzinom.
Vidi na internetu: Hydrogen and Chlorine Reaction
Photochemical Reaction of Hydrogen and Chlorine
Klorovodik se u laboratorijskim uvjetima, pri sobnoj temperaturi, može dobiti djelovanjem koncentrirane sumporne kiseline, H2SO4, na suh natrijev klorid:
NaCl(s) + H2SO4(konc.) → NaHSO4(s) + HCl(g).
Ako se reakcijska smjesa ugrije na oko 200 °C dolazi do reakcije:
NaCl(s) + NaHSO4(s) → Na2SO4(s) + HCl(g).
Sumporna je kiselina jača od klorovodične, pa ju istiskuje iz njezine soli. Klorovodik i solnu kiselinu prvi je još 1625. god. dobio alkemičar Johann Rudolph Glauber (1604.-1670.), Nijemac iz Bavarske. Bavio se istraživanjem soli, pa je jednu od njih, natrijev sulfat dekahidrat, nazvao "čudesna sol", sal mirabile. Ta se sol i danas naziva "Glauberova sol", a bila je učinkovit i relativno siguran purgativ u doba kad je pražnjenje probavnog trakta bilo popularan način liječenja.
Vidi na internetu: Chemistry experiment - HCl fountain
Klorovodik je topljiv u vodi. Litra vode pri sobnim uvjetima otapa čak 400 L klorovodika. Otopina klorovodika u vodi naziva se klorovodična ili solna kiselina. Koncentrirana klorovodična kiselina sadržava 36 % klorovodika i puši se na zraku. Ako se koncentrirana klorovodična kiselina destilira iz nje će isparavati klorovodik sve dok se njegov udio u otopini ne smanji na 20,2 %. Obratno, ako se destilira razrijeđena klorovodična kiselina iz nje će isparavati voda sve dok udio klorovodika u otopini ne dosegne 20,2 %. Iz takve otopine dalje destilira klorovodična kiselina stalnog sastava, 20,2 % HCl. Vrelište ove smjese je pri 108 °C, a para ima isti sastav kao i tekuća faza, tj. 20,2 % HCl. Smjese stalnog vrelišta, kod kojih je sastav tekuće faze jedak sastavu parovite faze, nazivaju se azeotropima. Ne mogu se razdvojiti frakcijskom destilacijom. Primjerice, smjesa običnog alkohola (etanola) i vode čini azeotrop koji sadržava 95,57 % etanola s vrelištem pri 78,15 °C. Za dobivanje čistog, tzv. apsolutnog alkohola, vodu treba ukloniti kemijskim postupcima, primjerice reakcijom s kalcijevim oksidom, CaO.
Razrijeđena, tj. 18-postotna klorovodične (solna) kiselina, iz koje klorovodik ne isparava, u domaćinstvu se rabi za otapanje kalcijeva karbonata, CaCO3, ili "kamenca" na površinama keramičkih sanitarnih uređaja:
CaCO3(s) + 2 HCl(aq) → CaCl2(aq) + H2O(l) + CO2(g).
VAŽNO UPOZORENJEKrom se otapa u klorovodičnoj kiselini. Stoga se „solnom kiselinom“ ne smiju prati kromirani dijelovi sanitarnih uređaja niti sudoperi od nehrđajućeg čelika. Naime, krom je sastojak nehrđajućeg čelika te se lako otapa i u razrijeđenoj klorovodičnoj kiselini.
Istražite, nađite primjere i obrazložite kako i iz kojih izvora halogeni elementi i njihovi spojevi dospijevaju u atmosferu.
Istražite koje industrije emitiraju u atmosferu najviše halogenih elemenata i njihovih spojeva. Koje se mjere poduzimaju, ili bi trebalo poduzeti, da se smanji emisija halogenih elemenata i njihovih spojeva u atmosferu, tlo i vodu. (Primjeri: proizvodnja aluminija, stakla, keramike, opeka, fosfatnih gnojiva, čelika, gorenje ugljena, insekticidi, pesticidi, lijekovi, freoni i dr.)
Kakav utjecaj na ekosustave imaju halogeni elementi i njihovi spojevi u atmosferi, tlu i vodi?
Izradite plakat, PowerPoint prezentaciju, snimite video, održite predavanje u razredu, organizirajte raspravu, pišite u školskom listu ili pokrenite neku aktivnost u vezi odabrane teme.
7.3. Halkogeni elementi
Kisik, sumpor, selenij, telurij i polonij pripadaju skupini halkogenih elemenata. Naziv halkogeni potječe od grčkih riječi chalkos - ruda i genesis – postanak, jer su ti elementi sastojci većine rudnih minerala. Dok su kisik i sumpor tipični nemetali, selenij, telurij i polonij su polumetali. Mi ćemo u ovom poglavlju detaljnije upoznati kemijska svojstva kisika i sumpora.
Zrak i voda najvažnije su tvari na svijetu. Bez hrane mogli bismo preživjeti i trideset dana, bez vode dva, ali bez zraka samo nekoliko minuta. Najvažniji sastojak zraka je kisik. U suhu zraku volumni udio kisika je oko 0,21, dušika oko 0,78, te argona i ostalih plinova oko 0,01. Praktički sav elementarni kisik u atmosferi nastao je fotosintezom. Prije pojave prvih fotosintetskih organizama, modrozelenih algi, u atmosferi nije bilo kisika. Iako se stalno troši za životne procese te za gorenje i u industrijskoj proizvodnji, volumni udio kisika u zraku je stalan.
Zrak je važna industrijska sirovina. Sve metalurške peći troše zrak da bi se proizveli metali. Zrak je potreban pri proizvodnji dušične i sumporne kiseline. Frakcijskom destilacijom ukapljenog zraka dobiva se čisti kisik, dušik i argon. Tako se proizvede i godišnje utroši više od 100 milijuna tona kisika. Primjerice, tijekom šest i pol minuta nakon lansiranja, raketni motor Space Shuttlea potroši više od 550 m3 tekućeg kisika i 1.500 m3 tekućeg vodika.
Najrasprostranjeniji spoj kisika na Zemlji je voda. Ona je reaktant, ali i produkt u mnogim kemijskim i biokemijskim reakcijama. Dobro je otapalo za sve tvari ionske građe. Tri četvrtine Zemljine površine prekriveno je vodom. Za sve oblike života od posebne je važnosti kružni tok vode u prirodi. Naime, voda neprekidno cirkulira između oceana, jezera, kopna, biljnog pokrova i atmosfere. Vodene pare se u visokim slojevima atmosfere kondenziraju te padaju natrag na Zemlju kao kiša, snijeg ili led.
Sumpor je također važan halkogeni elemenat. Sastojak je aminokiselina cisteina i metionina. Za industriju najvažniji sumporov spoj je sumporna kiselina. Rabi se u proizvodnji boja za tekstil, sapuna i deterdženata, umjetnih gnojiva, plastičnih masa, eksploziva, lijekova, insekticida i dr.
7.3.1. Kisik
Otkriće kisika pripisuje se dvojici kemičara, Priestleyu i Scheeleu. Švedski kemičar Carl Scheele (1742. – 1786.) opazio je 1773. godine da se volumen zraka koji se nalazi u doticaju s mokrim strugotinama željeza smanjuje za 1/5. Spaljivanjem fosfora u začepljenoj boci ustanovio je da voda, kad se boca odčepi pod vodom, ispuni 1/5 volumena boce. Na osnovi mnogobrojnih pokusa ustanovio je da se zrak sastoji od "ognjenog zraka" (kisika) i "pokvarenog zraka" (dušika). Scheele je uspio dobiti čist kisik zagrijavanjem živina oksida, HgO:
2 HgO(s) → 2 Hg(l) + O2(g).
Istodobno kad i Scheele proučavanjem sastava zraka bavio se i engleski kemičar Joseph Priestley (1773. − 1804.). Poslije mnogih pokusa, 1. kolovoza 1774. godine, Priestley je zagrijavao živin oksid pomoću lupe i Sunčevih zraka. Našao je da se pritom razvija plin u kojem svijeća gori žestokim plamenom.
Znameniti francuski kemičar A. Lavoisier (1743. – 1794.) ustanovio je da je aktivni sastojak zraka upravo plin koji su otkrili Priestley i Scheele i dao mu ime oxygène.
Maseni udio kisika u Zemljinoj kori je 49,5 %, a po broju atoma kisik je brojniji nego svi ostali atomi zajedno. Kisik se javlja u dvije alotropske modifikacije, u obliku dvoatomnih molekula kisika (ili dikisika), O2, i troatomskih molekula ozona, O3. Ozon je nestabilna modifikacija kisika.
Male količine kisika u laboratoriju mogu se dobiti zagrijavanjem kalijeva klorata, KClO3, uz manganov dioksid, MnO2, kao katalizator:
2 KClO3(s) → 2 KCl(s) + 3 O2(g).
ili pak zagrijavanjem kalijeva permanganata:
2 KMnO4(s) → K2MnO4(s) + MnO2(s) + O2(g).
Veće količine kisika mogu se dobiti katalitičkim raspadom vodikova peroksida. Koncentrirana otopina H2O2 dokapava se na manganov dioksid ili u sumpornom kiselinom zakiseljenu otopinu kalijeva permanganata:
2 H2O2(aq) → 2 H2O(l) + O2(g),
2 KMnO4(aq) + 5 H2O2(aq) + 3 H2SO4(aq) → 2 MnSO4(aq) + K2SO4(aq) + 8 H2O(l) + 5 O2(g).
Vidi na internetu: e-Kemija: Sikirica - Kisik
Za industrijske svrhe kisik se proizvodi frakcijskom destilacijom ukapljenog (tekućeg) zraka. Vrelište kisika je −183 °C, argona −186 °C, a dušika −196 °C. Pri frakcijskoj destilaciji tekućeg zraka najprije isparava dušik, zatim argon pa se tekuća faza obogaćuje kisikom. Tekući kisik je plavičaste boje, a rabi se kao oksidator u raketama s tekućim gorivom.
Kisik dobiven frakcijskom destilacijom zraka ima bezbrojne primjene. Komprimiran u čelične boce pod tlakom od 200 bara transportira se do mjesta uporabe. U bolnicama se kisikom obogaćuje zrak koji se pomoću respiratora utiskuje u pluća bolesnika. Smjesu kisika i helija udišu ronioci. Kisikom se potiče fermentacija. Rabi se pri pročišćavanju otpadnih voda itd.
Najveći potrošač kisika dobivena frakcijskom destilacijom zraka jest industrija čelika. Za proizvodnju tone čelika utroši se tona kisika. Kisikom se obogaćuje zrak kojim se raspiruje vatra visokih peći. Pri proizvodnji čelika (Bessemerov konverter) kisikom se oksidiraju primjese, kao što su C, Si, P i Mn, sadržane u tekućem sirovom željezu. Pritom se razvija mnogo topline tako da željezo ostaje u tekućem stanju. Istodobno se oksidira i dio željeza:
4 Fe(s) + 3 O2(g) → 2 Fe2O3(s) ΔH = −1.648,5 kJ mol−1.
Ozon, O3, nastaje u visokim slojevima atmosfere djelovanjem kratkovalnog UV zračenja. Naime, molekule kisika apsorbiraju ultraljubičasto zračenje kraće od 242 nm te disociraju se na atome, ·O, koji sadržavaju nesparene elektrone (slobodni radikali):
O2 + hν (<242 nm) → 2 O·
Na visini od 130 km udio molekula i atoma kisika je podjednak, dok je na visini od 400 km 99 % kisika disocirano na atome. Neki atomi kisika nastali fotodisocijacijom u stratosferi i mezosferi sudaraju se s atomima i molekulama kisika, dušika i drugih plinova. U izvanredno rijetkim slučajevima dolazi do trostrukog sudara atoma kisika, molekule kisika i neke treće molekule. Takav sudar može dovesti do nastajanja molekula ozona, O3:
O· + O2 + M(g) → O3 + M*(g).
Zvjezdicom uz molekulu M željeli smo naglasiti da je ta molekula preuzela višak energije, pa je mogla nastati molekula ozona, O3. Ozon je nestabilna alotropska modifikacija kisika. Sam se od sebe raspada, ali i pod utjecajem ultraljubičastog zračenja. Molekule ozona apsorbiraju zračenje valne duljine između 240 i 310 nm. Tako se u visokim slojevima atmosfere pod utjecajem ultraljubičastog zračenja uspostavlja ciklički proces nastajanja i raspadanja ozona.
apsorpcija zračenja O2 + hν (<242 nm) → 2 O·
oslobađanje topline O· + O2(g) + M(g) → O3(g) + M*(g)
apsorpcija zračenja O3(g) + hν (240 − 310 nm) → O2(g) + O·
oslobađanje topline O· + O· + M(g) → O2(g) + M*(g)
Više doznajte na:
Daily ozone cycle in the stratosphere (pdf)
Za nastanak molekula ozona moraju biti ispunjena dva uvjeta. Prvo, djelovanjem ultraljubičastog zračenja mora nastati dovoljan broj atoma kisika, i drugo, tlak plina mora biti dovoljno velik kako bi trostruki sudari bili vjerojatni. Mjerenja su pokazala da je koncentracija ozona najveća na visini između 20 i 30 km. Ozon je prisutan u svim slojevima atmosfere, ali je sveukupna količina ozona jako mala. Kad bismo sav ozon iz atmosfere skupili u jedan sloj, debljina tog sloja iznosila bi pri normalnim uvjetima tlaka i temperature samo tri milimetra.
Prisustvo ozona u atmosferi važno je za sav živi svijet. Ozon je naime jedini sastojak atmosfere koji apsorbira ultraljubičasto zračenje valne duljine od 240 do 310 nm. To zračenje izaziva mutacije i rak kože, a njegovim se utjecajem smanjuje reprodukcijska sposobnost mnogih biljnih i životinjskih vrsta.
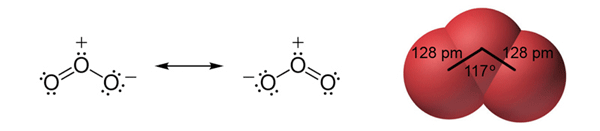
Slika 7.3. Strukturna formula i model molekule ozona. Lewisova strukturna formula ozona prikazuje se kao rezonantni hibrid između obje strukturne formule. Dvostrana strelica rabi se kao znak za rezonanciju. Molekula ozona ima oblik slova V.
Voda je najvažnija tvar i najrasprostranjeniji spoj na Zemlji. U vodi je nastao sav život. Bez vode ne bi bilo ni nas niti svih nama poznatih oblika života. U naš organizam, koji sadržava oko 65 % vode, treba svakodnevno unijeti najmanje 1,5 L svježe pitke vode.
Tri četvrtine Zemljine površine prekriveno je vodom. Cjelokupna količina vode na Zemlji procjenjuje se na oko 1,5·1021 kg. Nažalost, 97 % vode su slane oceanske vode neupotrebljive za piće i poljoprivredu. Ledenjaci sadržavaju oko 2 %, u jezerima i rijekama je 0,017 %, a u podzemlju 0,625 % sveukupne vode. Atmosfera sadržava tek 0,001 %, a u stanicama svih biljaka i životinja tek je 0,0005 % sveukupne vode na Zemlji. Voda zarobljena kao led na Zemljinim polovima slatka je voda, jer led nastao zamrzavanjem mora ne sadržava soli.
Slika 7.4. Kristalna struktura heksagonskoga leda. a) Jedinična ćelija kristalne strukture leda projicirana uzduž osi c. b) Prostorni razmještaj molekula vode u istoj jediničnoj ćeliji. c) U ledu su molekule vode orijentirane tako da je svaki atom kisika okružen sa četiri atoma vodika. Dva su atoma vodika vezana kovalentnom vezom čija je duljina 97 pm, dok se dva atoma vodika nalaze na udaljenosti od 179 pm. Molekule vode u ledu međusobno su povezane vodikovom vezom. Atomi vodika (protoni) mogu preskakati od jednog atoma kisika na drugi. Zato led provodi električnu struju.
Voda je tvar neobičnih svojstava. Zamrzava se pri 0 °C, a ključa pri 100 °C. Za život na Zemlji od posebne je važnosti gustoća leda i vode. Gustoća leda je manja od gustoće vode i zato led pliva na vodi. Kad se led tali, kida se većina vodikovih veza među molekulama vode, rahla struktura leda se urušava a molekule vode bolje pakuju. Stoga je gustoća vode veća od gustoće leda. No pri temperaturi blizu 0 °C voda još uvijek sadržava velike klastere (grozdove, nakupine) molekula vode sa strukturom sličnom strukturi leda. Ti se klasteri mogu neovisno kretati jedni u odnosu na druge, pa je zato voda tekuća. Daljnjim zagrijavanjem vodikove se veze kidaju, broj molekula u klasterima se smanjuje, molekule se bolje pakuju, a gustoća vode raste. Istodobno pri višoj temperaturi molekulama vode treba više mjesta za translatorno i oscilatorno gibanje. Stoga se gustoća vode smanjuje porastom temperature. Utjecaj tih dviju pojava suprotnih težnji dovodi do toga da je gustoća vode najveća pri 4 °C.
Anomalija
vode, činjenica da je gustoća vode u krutom stanju manja od
njezine gustoće u tekućem stanju, važna je za održanje života u zaleđenim
rijekama i jezerima. Led na površini rijeke ili jezera služi kao izolacijski
sloj koji usporava zamrzavanje dubljih slojeva vode. Kako voda ima najveću gustoću pri
4 °C, pri dnu zamrznutih rijeka i jezera nalazi toplija, a u gornjim slojevima
hladnija voda. Plutajuće sante leda izviruju samo s 1/11 svojeg volumena iznad
vode dok se 10/11 nalazi pod vodom. (Vidi Titanik.)
Voda ima velik toplinski kapacitet, a to znači da se kilogramu vode treba dovesti više topline nego kilogramu metala, da bi im se temperatura povisila za 1 °C. Stoga klimu na Zemlji regulira voda oceana tako što upija toplinu sa Sunca. Zbog velikog toplinskog kapaciteta vode oceani se vrlo polagano zagrijavaju i hlade. Naprotiv, kopno se brzo zagrijava i hladi.
Onečišćenje vode najveći je problem današnjice. U rijeke ispuštamo komunalne vode s mnogobrojnim bakterijama, virusima, ali i hranjivim tvarima koje ispuštaju klaonice, šećerane, mljekare, industrija kože i dr. S njiva i oranica u rijeke dospijevaju umjetna gnojiva i sredstva za zaštitu bilja. Zbog nemarnog odnosa prema vodi mnoge su rijeke postale odvodni kanali. Stoga se na riječnim tokovima često grade kaskade kako bi voda došla u što bolji doticaj sa zrakom i tako otopila što više kisika. Otopljeni kisik omogućava aerobni život u rijeci te pomaže prirodnom pročišćavanju vode. (Bez kisika mogu živjeti samo jednostanični organizmi – za život viših biljaka i životinja potreban je kisik.)
Voda je u prirodi u stalnom kruženju (hidrološki ciklus). Voda koja ispari s vodenih površina, tla i vegetacije odlazi u atmosferu. Vlažan zrak, zasićen vodenom parom, "lakši" je od suhoga pa se uzdiže. Na velikim visinama tlak je manji pa se zrak širi i pritom hladi. (Obrnut proces od onog koji se opaža pri pumpanju gume od bicikla kad se stlačeni zrak ugrije.) Tako ohlađen zrak prezasićen je vodenom parom. Stoga se dio vodene pare kondenzira u vrlo sitne kapljice koje vidimo kao oblake. Ovisno o uvjetima koji nastaju u atmosferi te se kapljice spajaju u veće pa tako pada kiša, snijeg ili led.
Kišnica sadržava nešto prašine i plinova koje pokupi prolaskom kroz onečišćenu atmosferu gradova i industrijskih središta. Za kišnicu se kaže da je mekana voda jer ne sadržava otopljene soli. Za vodu koja se crpi iz podzemnih ležišta i rabi kao voda za piće kaže se da je tvrda voda jer sadržava otopljene soli, poglavito kalcijev hidrogenkarbonat, Ca(HCO3)2, i magnezijev sulfat, MgSO4. Zagrijavanjem tvrde vode kalcijev hidrogenkarbonat se raspada na ugljikov dioksid i kalcijev karbonat, CaCO3. Stoga se na stijenkama električnih grijača kućanskih aparata izlučuje kalcijev karbonat ili "kamen kotlovac". (Vidi poglavlje 6.2.2. Kalcij i njegovi spojevi.) Magnezijev sulfat ne može se na taj način ukloniti iz vode.
Vodikov peroksid, H2O2, još je jedan važan spoj kisika s vodikom. To je jako oksidacijsko sredstvo. Rabi se u kozmetici za bojanje kose, ali i u medicinske svrhe kao izvanredno sredstvo za dezinfekciju i čišćenje rana. Ako se rana polije 3−postotnom otopinom vodikova peroksida, on se raspada na kisik i vodu:
2 H2O2(aq) → 2 H2O(l) + O2(g),
što se vidi po nastanku mjehurića (rana se zabijeli).
Vidi na internetu: e-Kemija: Sikirica - Katalaza
Raspad vodikova peroksida ubrzava enzim katalaza koji se nalazi i svakoj stanici, krvi, slini i svim dijelovima našeg organizma. Enzimi su katalizatori, zapravo vrlo velike proteinske molekule složene strukture koje ubrzavaju kemijske reakcije. Enzim katalaza pospješuje raspad molekula vodikova peroksida ili peroksidnih iona, O22−, koji nastaju u stanicama i oštećuju ih.
Slika 7.5. Građa i dimenzije molekule vodikova peroksida u kristaliziranom stanju. Atomi kisika međusobno su vezana jednostrukom kovalentnom vezom. Oksidacijski broj kisika u peroksidima je (−1).
Vodikov peroksid može biti oksidans i reducens. U kiseloj sredini u reakciji s kalijevim permanganatom on je reducens, pa se oksidacijski broj kisika poveća od (−1) na (0). Redukcijska svojstva vodikova peroksida još su jače izražena u lužnatoj sredini:
Cl2(g) + H2O2(aq) + 2 OH−(aq) → 2 Cl−(aq) + 2 H2O(l) + O2(g).
Kad vodikov peroksid djeluje kao oksidans, oksidacijski broj kisika se smanjuje od (−1) na (−2). Jak je oksidans i u kiseloj i u lužnatoj sredini:
2 Fe2+(aq) + H2O2(aq) + 2 H3O+(aq) → 2 Fe3+(aq) + 4 H2O(l),
Mn2+(aq) + H2O2(aq) + 2 OH−(aq) → MnO2(s) + 2 H2O(l).
Vodikov peroksid se čuva na mračnom i hladnom mjestu, najbolje u hladnjaku. Raspada se djelovanjem Sunčeve svjetlosti i organskih tvari. U trgovini i laboratoriju najčešće dolazi kao 40-postotna vodena otopina. Pri radu s koncentriranom otopinom vodikova peroksida uvijek treba nositi zaštitne rukavice i zaštitne naočale. U doticaju s koncentriranom otopinom vodikova peroksida koža pobijeli uz nepodnošljiv svrbež koji prestaje tek nakon nekoliko sati.
7.3.2. Sumpor
Sumpor je u elementarnom stanju poznat od davnine. Ima ga u blizini nekih vulkana. Iz velikih podzemnih naslaga u rastaljenom stanju istiskivali su ga pregrijanom vodenom parom (Fraschov postupak). Danas se sumpor dobiva kao nusprodukt pri pročišćavanju zemnog plina i nafte. Organosumporni spojevi sadržani u nafti najprije se uz katalizator prevode u sumporovodik:
R−S−R + 2 H2 → 2 RH + H2S.
Iz sumporovodika se potom Claus−ovim postupkom dobiva elementarni sumpor.
2 H2S +3 O2 → 2 SO2 + 2 H2O,
4 H2S +2 SO2 → 3 S2 + 4 H2O.
Sumpor je žuta kristalasta tvar. Tali se pri 115 °C. Kad je riječ o sumporu najčešće se spominju rompski i monoklinski sumpor. Rompski ili α−sumpor stabilan je do 96 °C, a iznad te temperature pa do tališta stabilan je monoklinski ili β−sumpor. Monoklinski kristali sumpora su pri sobnoj temperaturi nestabilni te rekristaliziraju u rompski sumpor. Od prvotnog monoklinskog monokristala sumpora nastaje mnoštvo sitnih rompskih kristalića različite orijentacije. Pritom iglice zadržavaju prvotni oblik, no izgube sjaj.
Obje vrste kristala, rompskog i monoklinskog sumpora, sastoje se od jednakih prstenastih S8 molekula u kojima su atomi povezani jednakim kovalentnim vezama. U rompskom i monoklinskom sumporu iste su molekule složene na različit način. No, jesu li rompski i monoklinski sumpor alotropi? Odgovor je ne. Rompski i monoklinski sumpor su polimorfi jer su izgrađeni od jednakih S8 molekula. Tijekom proteklih 100 godina opisana su 24 polimorfa sumpora čiji se kristali sastoje od S8 molekula. Ipak, postoji više alotropskih modifikacija sumpora u kojima su atomi sumpora vezani u prstenaste molekule, S5, S6, S7, S9, S10, S11, S12, S18, S20, ili u polimerne lance koji čine lijevu i desnu uzvojnicu.
Slika 7.6. Razmještaj S8 molekula u jediničnoj ćeliji a) rompskog sumpora i b) monoklinskog sumpora
Vidi na internetu: e-Kemija: Sikirica - Rompski i monoklinski sumpor
Pri zagrijavanju sumpora iznad temperature tališta događa se niz zanimljivih pojava. U početku talina je svjetložuta i male viskoznosti. Sastoji se od molekula S8. Nastavimo li zagrijavanje talina će poprimiti crvenosmeđu boju. Pritom se dio prstenova S8 kida pa nastaju kratki lanci koji se odmah međusobno spajaju u vrlo dugačke lance. Dugački lanci se isprepliću pa viskoznost taline toliko poraste da se epruveta može okrenuti s otvorom prema dolje, a da sumpor ne isteče. Daljnjim zagrijavanjem dugački se lanci kidaju na kraće, pa se viskoznost taline smanji. Boja taline postaje sve tamnija. Pri 444 °C sumpor proključa.
Vidi na internetu: e-Kemija: Sikirica - Plastični sumpor
Ako se sumpor zagrijan skoro do vrelišta izlije u tankom mlazu u hladnu vodu dobije se plastični sumpor. Nema kristalnu nego amorfnu strukturu (grč. a − ne + morfe − oblik) koja se sastoji od dugačkih lanaca atoma sumpora. Lanci su orijentirani paralelno smjeru istjecanja. Zato plastični sumpor ima svojstva slična gumi. Ako ga se gnječi pod prstima ili ostavi stajati vrlo brzo prelazi u kristalasti sumpor.
Jedan od najpoznatijih sumporovih spojeva je sumporovodik, H2S, otrovni plin neugodna mirisa po trulim jajima. U laboratoriju se dobiva djelovanjem kiselina na željezov(II) sulfid, FeS, u Kippovu aparatu. Otopina sumporovodika u vodi u studentskim praktikumima poznata je kao "H2S−voda". Sadržava uglavnom molekule H2S(aq). Dio otopljenog sumporovodika reagira s molekulama vode zbog čega je otopina slabo kisela:
H2S(aq) + H2O(l) → H3O+(aq) + HS−(aq),
HS−(aq) + H2O(l) → H3O+(aq) + S2− (aq).
Molekule sumporovodika građene su slično molekulama vode, ali je kut među vezama H−S−H manji, 97o (u vodi je 104,5o). Odbijanje između podijeljenih elektronskih parova u vezama H−S manje je nego u vezama H−O. Stoga je kut veze H−S−H manji od kuta veze H−O−H u molekulama vode. Veza H−S je duža i manje polarna od veze H−O.
Velike količine sumpora u prirodi vezane su u slabo topljivim sulfidima prijelaznih i teških metala, važnih ruda za njihovo dobivanje. Poznato je oko 600 sulfidnih minerala. Primjerice, cinkov sulfid, ZnS, u prirodi dolazi kao mineral sfalerit, te je važna cinkova ruda. Galenit, PbS, važna je ruda olova. Halkopirit, CuFeS2, je bakrova ruda, a cinabarit ili rumenica, HgS, najvažnija je živina ruda. Lijepe zlatnožute kubne kristale čini pirit, FeS2, (lažno zlato). Nekad je pirit bio važna sumporova ruda, a služio je i kao kresivo, jer udaranjem po njemu skaču iskre (odatle mu i ime, od grč. pyros – vatra). Treba upamtiti da pirit sadržava disulfidne ione, [S−S] 2−, i ione Fe2+. Pirit nije željezova ruda iako sadržava željezo.
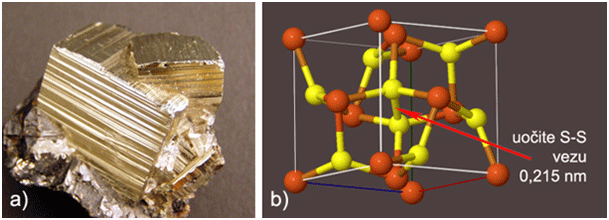
Slika 7.7. a) Kristal pirita. b) Jedinična ćelija kristalne strukture pirita
Gorenjem sumpora na zraku ili u kisiku, kao i prženjem sulfidnih ruda na zraku, nastaje sumporov dioksid, SO2:
2 ZnS(s) + 3 O2(g) → 2 ZnO(s) + 2 SO2(g).
Sumporov dioksid, SO2, je otrovan plin, oštra neugodna mirisa. Topljiv je u vodi, a vodena otopina sadržava uglavnom molekule SO2. Otopina djeluje kiselo, slično kao i otopina CO2 u vodi:
SO2(g) + 2 H2O(l) D H3O+(aq) + HSO3−(aq),
HSO3−(aq) + 2 H2O(l) D H3O+(aq) + SO32−(aq).
Soli hipotetske sumporaste kiseline, H2SO3, zovu se sulfiti. Nastaju reakcijom lužina sa sumporovim dioksidom:
SO2(g) + 2 NaOH → Na2SO3(aq) + H2O(l).
Sumporov dioksid je otrovan za mnoge mikroorganizme, posebno one koji izazivaju truljenje voća, alkoholno i octenokiselo vrenje. Zato ga se rabi u proizvodnji sušenog voća te za sumporenje bačava i drugih posuda u kojima se prerađuje grožđe ili čuva vino. Obično se u bačvi upali sumporna traka. To je papirnata traka prethodno umočene u rastaljeni sumpor.
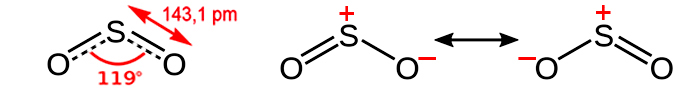
Slika 7.8. Građa molekule sumporova dioksida. Građu molekule sumporova dioksida najbolje je opisati kao rezonantni hibrid dviju prikazanih formula.
Vidi na internetu: e-Kemija: Sikirica - Sumporov dioksid
Sumporov trioksid, SO3, dobiva se zagrijavanjem smjese sumporova dioksida i kisika uz povišeni tlak i prisustvo platine (češće vanadijeva(V) oksida, V2O5) kao katalizatora:
SO2(g) + O2(g) → 2 SO3(g),
SO3(g) + H2SO4(l) → H2S2O7(l).
Dobiveni sumporov trioksid otapa se u koncentriranoj sumpornoj kiselini pri čemu nastaje disumporna kiselina, H2S2O7. Razrjeđivanjem disumporne kiseline vodom dobije se sumporna kiselina, H2SO4.
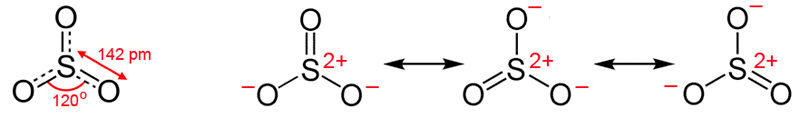
Slika 7.9. Molekule sumporova trioksida sadržava tri ekvivalentne S−O veze s oktetom elektrona na sumporu. Građa molekula sumporova trioksida je rezonantna struktura triju prikazanih formula.
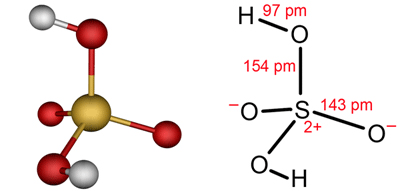
Slika 7.10. Model i strukturna formula sumporne kiseline
Koncentrirana, tj. 96-postotna sumporna kiselina uljasta je tekućina. Vrlo je jaka kiselina. Na koži izaziva rane koje teško zacjeljuju. Jako je higroskopna (grč. hygros − vlažan + skopeo − gledam), to jest upija vlagu iz zraka. Organske tvari u doticaju s koncentriranom sumpornom kiselinom pougljene. Razara sve tvari organskog podrijetla tako da iz njih uzima vodu.
Vidi na internetu: e-Kemija: Sikirica - Sumporna kiselina
U laboratoriju nam je potrebna razrijeđena sumporna kiselina, primjerice za dobivanje vodika reakcijom cinka i sumporne kiseline u Kippovu aparatu i za mnoge druge svrhe.
UPAMTITERazrjeđivanje svih kiselina i lužina izvodi se tako da se tanak mlaz kiseline ili lužine uz miješanje ulijeva u veliku količinu hladne vode.
Pri razrjeđivanju sumporne kiseline razvija se mnogo topline. Kad se u jedan utezni dio vode dodaju četiri utezna dijela koncentrirane sumporne kiseline temperatura smjese povisi se na 120 °C. Zato se nikad ne smije voda ulijevati u koncentriranu sumpornu kiselinu. Kapljice vode u doticaju s koncentriranom sumpornom kiselinom toliko se ugriju da naglo ispare te zajedno sa sumpornom kiselinom pršte na sve strane. To će na odjeći načiniti rupe, ali može imati teške posljedice ako ne nosite zaštitne naočale i rukavice.
Sumporna se kiselina proizvodi i primjenjuje u ogromnim količinama. Rabe ju u proizvodnji lijekova, boja, umjetnih gnojiva, eksploziva itd. Koncentrirana sumporna kiselina ne otapa željezo pa se čuva u željeznim cisternama i rezervoarima. Velike količine koncentrirane sumporne kiseline prevoze se tankerima, željeznicom i autoputovima. Nažalost, nerijetko se pri transportu koncentrirane sumporne kiseline događaju nesreće. Razrijeđena 33-postotna sumporna kiselina nalazi se u svakom olovnom akumulatoru! Stoga je dobro izbjegavati sudare automobila jer bi vas, između ostalog, mogla zaliti sumporna kiselina iz razbijenog akumulatora.
Sumporna kiselina disocira u dva stupnja te čini dvije vrste soli, hidrogensulfate i sulfate:
H2SO4(aq) + H2O(l) → H3O+(aq) + HSO4−(aq) (jaka kiselina),
HSO4−(aq) + H2O(l) → H3O+(aq) + SO42−(aq) (slaba kiselina).
Razrijeđena sumporna kiselina otapa mnoge metale, primjerice cink i željezo. Pritom se razvija vodik i nastaje otopina cinkova, odnosno željezova(II) sulfata:
Zn(s) + H2SO4(aq) → ZnSO4(aq) + H2(g),
Fe(s) + H2SO4(aq) → FeSO4(aq) + H2(g).
Iz zasićenih otopina kristaliziraju odgovarajuće soli, bijela galica, ZnSO4.7H2O, i zelena galica, FeSO4·7H2O. Modra galica, CuSO4·5H2O, ne može se dobiti neposrednim otapanjem bakra u sumpornoj kiselini jer je u Voltinom nizu bakar pozitivniji od vodika.
O sumpornim kiselinama više doznajte na: eskola.chem.pmf.hr: vi pitate e-škola odgovara
Spaljivanje fosilnih goriva još je uvijek glavni način dobivanja energije nužne za opstanak suvremene civilizacije. Kako sva fosilna goriva sadržavaju sumpor, njihovim spaljivanjem u atmosferu se ispuštaju velike količine sumporova dioksida. Procjenjuje se da elektrane na ugljen i tvornice svake godine ispuste u atmosferu preko 200 milijuna tona sumporova dioksida. Velike količine sumporova dioksida u atmosferu dospijevaju i za erupcija vulkana.
Rješenje: Tona navedenog ugljena sadržava 32 kg, tj. 32 kmola sumpora. Njegovim spaljivanjem nastat će 32 kmola sumporova dioksida. Kako je molarna masa sumporova dioksida, M(SO2) = 64 g mol−1, proizlazi da spaljivanjem 1 tone navedenog ugljena nastaje 64 kg, tj. 22,4 m3 sumporova dioksida.
Sumporov dioksid u atmosferi oksidira se u sumporov trioksid na više načina pri čemu nastaju kisele kiše. Naime, fotolizom O3 u prisutnosti vodene pare nastaju hidroksil radikali, ·OH, sljedećim reakcijama:
O3 + hν → ·O + O2,
·O + H2O → ·OH + ·OH.
Oksidacija SO2 započinje reakcijom s hidroksil radikalima ·OH.
SO2 + ·OH + M → HOSO2· + M*,
gdje je M* molekula kisika, O2, ili dušika, N2, koja apsorbira oslobođenu energiju. Međuprodukt, HOSO2· radikal, tada brzo reagira s molekulama kisika, O2, pa nastaje sumporov trioksid, SO3 i radikal ·HO2
HOSO2· + O2 → ·HO2 + SO3.
Nastale molekule SO3 reagiraju s vodenom parom pri čemu nastaje sumporna kiselina, H2SO4(aq):
SO3(g) + H2O(l) → H2SO4(aq).
Kiša ispire iz atmosfere sumporov dioksid i sumpornu kiselinu pa tako nastaju kisele kiše. Normalna kišnica, koja sadržava samo otopljen ugljikov dioksid, ima pH oko 5,5. Kisele kiše imaju pH = 4, ili manje. Stoga štete građevinama i spomenicima izgrađenim od vapnenca i mramora:
CaCO3 (s) + H2SO4(aq) → CaSO4(s) + H2O(l) + CO2(g).
Sumporov dioksid djeluje i izravno na kalcijev karbonat:
2 CaCO3(s) + 2 SO2(aq) + O2(g) → 2CaSO4(s) + 2 CO2(g).
Kalcijev sulfat je u vodi topljiviji od kalcijeva karbonata. Kako je vapnenac uglavnom porozan, kalcijev sulfat nastaje i u dubini kamena koji se zbog toga mrvi pa građevine propadaju. Smatra se da su zbog kiselih kiša u posljednjih stotinu godina mramorne građevine i spomenici više oštećeni nego od svoga postanka prije više od dva tisućljeća.

Slika 7.11. Zapadni portal crkve sv. Marka u Zagrebu načinjen je od vapnenca te je teško oštećen djelovanjem atmosferilija
Osim na građevine, kisele kiše djeluju na vegetaciju. Najviše stradaju šume, više zbog zakiseljavanja tla nego zbog neposrednog utjecaja kiselih kiša na lišće. Povećana kiselost tla uzrokuje promjenu mikroflore na korijenju. Neki mikroorganizmi nestaju a drugi se nesrazmjerno brzo razmnažaju. Osim promjene mikroflore promijeni se i kemijski sastav otopina u tlu. Kiselije tlo pogoduje otapanju minerala koji sadržavaju aluminij. Gubitak hranjivih soli, povećanje koncentracije aluminija i izmijenjena mikroflora remete osjetljivu ravnotežu u i oko korijenja drveća pa dolazi do propadanja čitavih šuma.
Većina sumporova dioksida u naše krajeve dolazi iz industrijski razvijenih zapadnoeuropskih zemalja jer vjetrovi najčešće pušu s Atlantika prema istoku. Tako najviše štete od kiselih kiša imaju zemlje koje proizvode najmanje sumporova dioksida.
Pariškim sporazumom od 12. prosinca 2015. godine praktički se predviđa da svijet do sredine ovog stoljeća okrene leđa fosilnim gorivima. Države su se obvezale dekarbonizirati svoja gospodarstva i pomoći siromašnim zemljama.
Ozonski omotač, utjecaj na procese u biosferi, ozonske rupe – kako i zašto nastaju?
Ozon u urbanim naseljima, zašto nastaje i kako utječe na zdravlje?
Ozon u najnižim slojevima atmosfere i njegov utjecaj na poljoprivredne kulture.
Istražite, nađite primjere i obrazložite kako i iz kojih izvora sumpor i njegovi spojevi dospijevaju u atmosferu.
Doznajte kakav je utjecaj sumporovih oksida na ljudsko zdravlje, poljoprivredne kulture, šume, ekosustave, građevine i dr.
Koje se mjere poduzimaju, ili bi trebalo poduzeti, da se smanji emisija sumporovih spojeva u atmosferu, tlo i vodu?
Kako i zašto se provodi odsumporavanje nafte i zemnog plina?
Izradite plakat, PowerPoint prezentaciju, snimite video, održite predavanje u razredu, organizirajte raspravu, pišite u školskom listu ili pokrenite neku aktivnost u vezi odabrane teme.
7.4. Dušikova skupina elemenata
Dušik, fosfor, arsen, antimon i bizmut čine 15. ili dušikovu skupinu elemenata. Dušik i fosfor su nemetali, a ostali elementi u skupini su polumetali.
7.4.1. Dušik
Dušik je osnovni sastojak zraka. Volumni udio dušika u zraku iznosi 78 %. Dušik je bezbojan plin bez mirisa. Ne podržava gorenje ni disanje. Dobiva se frakcijskom destilacijom tekućeg zraka. Komprimiran u čelične boce pod tlakom od 200 bara transportira se do mjesta uporabe. Dušik ima bezbroj primjena. Mnoge se kemijske reakcije provode u atmosferi suhoga dušika kako bi se reagensi ili produkti reakcije zaštitili od oksidacije. Najviše dušika utroši se za proizvodnju amonijaka.
Tekući dušik, vrelište −196 °C, čuva se i prenosi u Dewarovim posudama. To su metalne ili staklene posude dvostrukih stijenki. Prostor između stijenki je evakuiran da se spriječi prijenos topline iz okoline. Tekući dušik najbolje je sredstvo za hlađenje i čuvanje bioloških preparata. Primjerice, sperma selektiranih domaćih životinja čuva se u tekućem dušiku. Tekućim dušikom se provode manji površinski kirurški zahvati, uklanjaju bradavice i dr.
Atomi dušika u molekuli N2 povezani su vrlo jakom trostrukom :N≡N: kovalentnom vezom. Stoga se dušik teško prevodi u spojeve. Dušik se u prirodi spaja s kisikom pri električnom pražnjenju u atmosferi. Nastali dušikovi oksidi s kišom dospjevaju u tlo gdje su nužni za rast biljaka. Pri sobnoj temperaturi dušik u spojeve mogu prevesti neke dušične bakterije koje žive na korijenju grahorica. Uz prisutnost enzima nitrogenaze dolazi do procesa fiksacije dušika u kojem se atmosferski dušik prevodi u amonijak kojeg biljka dalje uključuje u svoj metabolizam.
Naša civilizacija troši ogromne količine dušikovih spojeva, ponajviše za eksplozive, a zatim za umjetna gnojiva, plastične mase, lijekove i drugo. Tijekom 19. stoljeća glavni izvor dušikovih spojeva bile su naslage čilske salitre, NaNO3, u jednom izrazito sušnom predjelu Čilea. U naše se doba preko stotinu milijuna tona amonijaka, NH3, proizvede Haber−Boschovim postupkom iz elementarnog dušika i vodika. Pod visokim tlakom, od 200 pa do 1000 bara i pri temperaturi od 400 do 500 °C uz prisustvo katalizatora dobiva se amonijak:
3 H2(g) + N2(g) D 2 NH3(g) ΔH = −91,8 kJ mol−1.
Koliko će amonijaka nastati u reakcijskoj smjesi ovisi o temperaturi i tlaku. Viši tlak pogoduje nastajanju amonijaka jer iz četiri mola reaktanata nastaju dva mola produkata. Tako sustav izbjegava porast tlaka (Le Chatelierovo načelo). Niža temperatura također pogoduje nastajanju amonijaka, ali se pri nižoj temperaturi reakcija odvija sporije. Stoga se za sintezu amonijaka odabiru takvi uvjeti temperature i tlaka da se uz najmanji utrošak energije dobije što jeftiniji amonijak. Kad se dušik jednom veže u amonijak, dalje se iz njega mogu dobiti svi drugi dušikovi spojevi.
O fiksacije dušika, brzini i ravnoteži kemijskih reakcija, više doznajte u rubrici Kemija u nastavi časopisa Kemija u industriji u člankui: Fiksacija dušika: brzina i ravnoteža kemijskih reakcija (pdf)
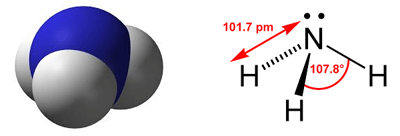
Slika 7.12. Model molekule i strukturna formula amonijaka
Amonijak, NH3, je plin oštra mirisa. Topljiviji je u vodi od bilo kojeg drugoga plina. Litra vode pri sobnoj temperaturi otapa preko 600 L amonijaka. Velika topljivost amonijaka u vodi može se objasniti vodikovim vezama između molekula NH3 i H2O. Vrlo mali dio molekula amonijaka reagira s molekulama vode pri čemu nastaju amonijevi, NH4+(aq), i hidroksidni ioni, OH−(aq). Zato je vodena otopina amonijaka slaba lužina:
NH3(aq) + H2O(l) D NH4+(aq) + OH−(aq).
Najjednostavniji način dobivanja amonijaka u laboratoriju jest dokapavanje koncentrirane otopine amonijaka na kruti natrijev hidroksid. Natrijev hidroksid se otapa u vodi čime se smanji topljivost amonijaka pa on izlazi kao plin. Plinoviti amonijak može se dobiti i djelovanjem koncentriranih jakih lužina na amonijeve soli:
NaOH(aq) + NH4Cl(s) → NaCl(aq) + H2O(l) + NH3(g).
Vidi na internetu: Ammonia Fountain Demo
Obvezno upotrijebite okruglu tikvicu s okruglim dnom. Kod svih drugih tikvica doći će do implozije, tj. atmosferski će ih tlak zdrobiti.
Dušik s kisikom čini više oksida:
|
N2O |
NO |
N2O3 |
NO2 |
N2O4 |
N2O5 |
|
Didušikov monoksid |
Dušikov monoksid |
Didušikov trioksid |
Dušikov dioksid |
Didušikov tetroksid |
Didušikov pentoksid |
Didušikov monoksid, N2O, poznat je kao rajski plin ili smijavac. U smjesi s kisikom rabio se kao blago anestetičko sredstvo pri manjim kirurškim zahvatima, primjerice u stomatologiji. Njegovo svojstvo izazivanja euforije otkrio je 1799. godine engleski fizičar i kemičar Humphry Davy (1778.− 1829.). Ako se N2O udiše u manjim količinama izaziva smijeh, pa se osoba smije bez ikakvoga razloga. Topljiv je u slatkom vrhnju pa se rabi u ugostiteljstvu u aparatima za pripremu šlaga. Neadekvatna, nenamjerna ili pak namjerna prekomjerna inhalacija didušikova oksida rezultira ošamućenošću do konačnog gubitka svijesti, a moguća je i smrt, osobito u kombinaciji s alkoholom i drogama.
Dušikov monoksid, NO, bezbojan je plin. U laboratoriju se može dobiti djelovanjem razrijeđene dušične kiseline na bakar:
3 Cu(s) + 8 HNO3(aq) → 3 Cu(NO3)2(aq) + 2 NO(g) + 4 H2O(l).
Dušikov monoksid je slobodni radikal, ·N=O, jer ima jedan nespareni elektron. Stoga se na zraku spontano oksidira u crvenosmeđi dušikov dioksid, NO2:
2 NO(g) + O2(g) → 2 NO2(g).
Dušikov dioksid, NO2, pri sobnoj je temperaturi crvenosmeđi plin koji pri povišenom tlaku lako prelazi u tamnu crvenosmeđu tekućinu koja se uglavnom sastoji od molekula N2O4. Tekućina je u ravnoteži s crvenosmeđim parama koje se uglavnom sastoje od NO2 molekula. Ako se dušikov dioksid hladi njegova boja postupno blijedi te pri temperaturi nižoj od −11 °C prelazi u bezbojnu krutinu koja se sastoji od N2O4 molekula. Naime, molekule NO2 ima jedan nespareni elektron na dušiku. Stoga se pri nižoj temperaturi molekule NO2 dimeriziraju pa nastaje didušikov tetroksid, N2O4.

Slika 7.13. Pri sobnoj temperaturi i atmosferskom tlaku 3 su ampule napunjene dušikovim dioksidom. Ravnoteža između dušikova dioksida, NO2, i didušikova tetroksida, N2O4, ovisi o temperaturi. Pri nižoj temperaturi (led + voda) ravnoteža se pomiče prema bezbojnom N2O4. Pri višoj temperaturi (vruća voda) ravnoteža se pomiče prema crvenosmeđem NO2.
Vidi na internetu: The Effect of Temperature on Equilibrium - N2O4 to 2NO2
Slika 7.14. a) Građa molekule dušikova dioksida. b) Prava struktura dušikova dioksida je rezonantni hibrid između obje prikazane formule, jer molekula sadržava dvije ekvivalentne N−O veze. Uočite da molekula NO2 ima jedan nespareni elektron. c) Strukturna formula molekule didušikova tetroksida. Sve četiri N−O veze jednake su duljine, 121 pm. Molekula je planarna.
Didušikov tetroksid snažan je oksidans koji spontano reagira s različitim derivatima hidrazina. Stoga se taj dvojac i danas rabi kao tekuće gorivo u raketnoj tehnologiji.
Vidi na internetu: Nitrogen
Dušična kiselina, HNO3, dobiva se iz amonijaka Ostwaldovim postupkom. Smjesa amonijaka i zraka uz prisustvo platine i rodija kao katalizatora najprije se spaljuje u bezbojan dušikov monoksid:
4 NH3(g) + 5 O2(g) → 4 NO(g) + 6 H2O(g).
Dušikov monoksid se pri nižoj temperaturi spontano spaja s kisikom iz zraka pri čemu nastaje crvenosmeđi dušikov dioksid, NO2:
Smjesa dušikovog dioksida i zraka uvodi se u toranj ispunjen staklenim kuglama preko kojih se raspršuje voda. U reakciji s vodom i kisikom nastaje dušična kiselina:
4 NO2(g) + O2(g) + 2 H2O (l) → 4 HNO3(aq).
Dušična kiselina bezbojna je tekućina. Koncentrirana kiselina, kakvu najčešće rabimo u laboratoriju, žuto je obojena od otopljenog dušikova dioksida. Taj oksid nastaje ako se boca s dušičnom kiselinom drži na Sunčevoj svjetlosti ili ako u bocu dospiju organske tvari:
4 HNO3 → 2 H2O + 4 NO2 + O2.
Dušična kiselina važan je industrijski proizvod s mnogostrukom primjenom. Rabi se pri proizvodnji nitroglicerina i trinitrotoluena, TNT, važnih eksploziva, od kojih se prvi ponajviše rabi za mirnodopske svrhe (dinamit), a drugi u ratu. Dušična kiselina je jako oksidacijsko sredstvo. Prolivena koncentrirana dušična kiselina može izazvati čak i požar. Na koži izaziva rane koje teško zacjeljuju. Već od razrijeđene dušične kiseline koža požuti. Prolivena koncentrirana kiselina ne smije se zasipati pijeskom jer se pritom razvijaju zagušljive crvenosmeđe "nitrozne pare", koje se sastoje uglavnom od dušikova dioksida. Nitrozne pare jako oštećuju sluzokožu organa za disanje. Zato se s dušičnom kiselinom mora raditi u digestoru, a prolivenu kiselinu isprati velikom količinom vode.
Vidi na internetu: Otrovni oblak dušikovih oksida
Slika 7.15. Prave strukture dušične kiseline, HNO3, i nitratnog iona, NO3−, rezonantni su hibridi prikazanih formula
Soli dušične kiseline zovu se nitrati. Kalijev nitrat, KNO3, i amonijev nitrat, NH4NO3, rabe se kao umjetno gnojivo, ali i u proizvodnji eksploziva (crni barut). Natrijev nitrat, NaNO3, dodaje se mesnim prerađevinama, kao što su sušeno meso, salame, hrenovke i slično. Nitrati se postepeno reduciraju u nitrite, soli dušičaste kiseline, H−O−N=O, koje sprječavaju razvoj bakterije Clostridium botulinum i tako čuvaju meso od kvarenja te mu ujedno održavaju svježu crvenu boju. Nitrati i nitriti nisu baš najbolji dodatak mesu. Dokazano je da su pojave raka želuca mnogo češće u zemljama gdje se mesnim prerađevinama dodaju nitrati i nitriti.
7.4.2. Fosfor
Fosfor je bitan sastojak biljnog i životinjskog svijeta. Fosfati, kao što je hidroksiapatit, Ca10(PO4)6(OH)2, najvažniji su sastojak kostiju i zuba, a esteri fosforne kiseline, H3PO4, bitan su građevni element ribonukleinskih kiselina, DNA i RNA, staničnih membrana u mozgu (fosfolipidi) te mnogih drugih za život važnih spojeva. Fosfor se u prirodi nalazi u obliku apatita, skupine minerala koju čine fluorapatit, Ca10(PO4)6F2, klorapatit Ca10(PO4)6Cl2, i hidroksiapatit, Ca10(PO4)6(OH)2. Najveće naslage apatita nalaze se u Sjevernoj Africi, Sjevernoj Americi, Aziji i Srednjem Istoku.
Fosfor je 1669. godine otkrio i izolirao njemački alkemičar Hennig Brand (1630. − 1710.) tragajući za "kamenom mudraca". Suhom destilacijom uparenih ostataka trule mokraće dobio je oko 120 g bijeloga fosfora. No to je bio samo jedan od mnogih fosfora – jer su u to doba fosforom nazivali svaku tvar koja svjetluca u mraku.

Slika 7.16. Njemački trgovac, ljekarnik i alkemičar Hennig Brand otkriva fosfor. Slika je djelo Josepha Wrighta engleskog slikara pejsaža i portreta.
Elementarni fosfor dobiva se iz fosfatnih stijena, približnog sastava Ca3(PO4)2, žarenjem sa smjesom pijeska i koksa u elektrolučnoj peći pri temperaturi oko 1300 °C:
2 Ca3(PO4)2(s) + 6 SiO2(s) + 10 C(s) → P4(g) + 6 CaSiO3(l) + 10 CO(g).
Fosforne pare, koje se sastoje pretežno od molekula P4(g) i P2(g), hlade se pod vodom te se kondenziraju u "bijeli fosfor". To je manje stabilna alotropska modifikacija fosfora koja se sastoji od molekula P4. Na zraku se spontano zapali pa se mora čuvati pod vodom. (Zapaljive fosforne bombe i streljivo koristile su sve strane u Prvom i Drugom svjetskom ratu. Fosforna zrna u letu svijetle, pa strijelac može vidjeti pogađa li metu ili ne.) Bijeli je fosfor otrovan: letalna doza za čovjeka iznosi samo 0,1 g. Na koži stvara rane koje teško zacjeljuju. Pri sobnoj temperaturi fosfor na zraku svjetluca jer se polagano oksidira u fosforov(V) oksid, P4O10. Ta se pojava naziva kemiluminiscencija. (Pojam fosforescencija odnosi se na svojstvo nekih tvari da nakon prestanka osvjetljavanja Sunčevom ili UV svjetlošću svjetlucaju u mraku.)
Vidi na internetu: More White Phosphorus
Fosfor se javlja u više alotropskih modifikacija, kao bijeli, crveni, ljubičasti i crni. Pri temperaturi oko 200 °C, bez dostupa zraka, bijeli fosfor polako prelazi u amorfni oblik koji nazivamo „crveni fosfor". Dugotrajnim žarenjem crvenog fosfora pri temperaturi oko 550 °C dobije se ljubičasti ili Hittorfov fosfor. Zagrijavanjem bijelog fosfora pri visokom tlaku, 12.000 bara, ili pri normalnom tlaku i temperaturi od oko 200 °C uz pomoć katalizatora, fosfor prelazi u crni ljuskavi kristalasti oblik koji podsjeća na grafit. To je najstabilnija modifikacija fosfora.
Slika 7.17. Alotropske modifikacije fosfora. U plinovitu stanju, u molekulama P2, atomi fosfora međusobno su vezani trostrukom kovalentnom vezom slično kao atomi dušika u molekulama N2. U svim ostalim alotropskim modifikacijama atomi fosfora međusobno su vezani trima jednostrukim kovalentnim vezama. a) Bijeli fosfor sastoji se od molekula P4. b) Dio beskonačnog lanca ljubičastog (Hittorforovog) fosfora, c) Crni fosfor ima slojevitu strukturu koju čine naborani šesteročlani prstenovi atoma fosfora.
Crveni fosfor u smjesi s ljepilom i staklenim prahom nalazi se na svakoj kutiji žigica. Trenjem glavice žigice po površini s crvenim fosforom lokalno se povisi temperatura. Pritom crveni fosfor prijeđe u bijeli, spontano se zapali te plamen prenese na glavicu žigice koja sadržava smjesu kalijeva klorata, KClO3, antimonova trisulfida, Sb2S3, sumpora, staklenog praha i ljepila.
Vidi na internetu: How Do Matches Work?
Gorenjem fosfora uz nedovoljan dostup zraka nastaje fosforov(III) oksid, P4O6, ali uz dovoljan dostup zraka fosforov(V) oksid, P4O10.
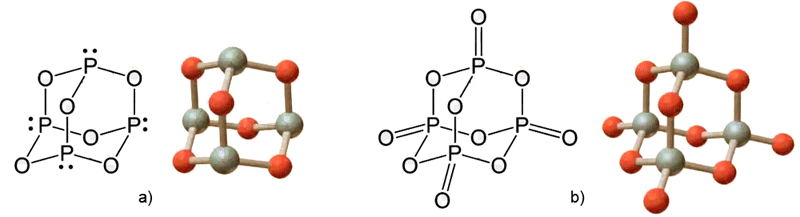
Slika 7.18. a) Strukturna formula i model molekule fosforova(III) oksida. Svaki atom fosfora u fosforovu(III) oksidu sadržava nepodijeljeni par elektrona. b) Strukturna formula i model molekule fosforova(V) oksida.
Fosforov(V) oksid, P4O10, jako je higroskopan pa se često rabi kao sredstvo za sušenje u eksikatorima. S vodom daje fosfornu kiselinu, H3PO4:
P4O10(s) + 6 H2O(l) → 4 H3PO4(aq).
Vodena otopina fosforne kiseline djeluje kao srednje jaka, triprotonska kiselina, pa se od nje odvode tri niza soli: normalni fosfati (PO43−), hidrogenfosfati (HPO42−) i dihidrogenfosfati (H2PO4−). Svi dihidrogenfosfati topljivi su u vodi. Kalcijeve soli fosforne kiseline važna su mineralna gnojiva.
Fosforna kiselina čini estere. Kad dvije hidroksilne skupine u fosfornoj kiselini reagiraju s hidroksilnim skupinama na drugim molekulama nastaju dvije esterske veze. Fosfodiesterske veze bitne su za sav život na Zemlji jer čine okosnicu lanca nukleinskih kiselina. Deoksiribonukleinska kiselina (engl. deoxyribonucleic acid, DNA) je nukleinska kiselina u obliku dvostruke uzvojnice. DNA sadržava upute za izgradnju i održavanje živog organizma. Zbog fosfatnih skupina, između svake deoksiriboze, DNA je kiselina, a lanac DNA ima negativan naboj. Ribonukleinska kiselina (engl. ribonucleic acid, RNA) slična je DNA, ali se od nje razlikuje u nekoliko detalja. RNA u stanicama sastoji se od jednog lanca, dok DNA čini dvostruku uzvojnicu.
Fosforna kiselina nije otrovna pa se rabi za zakiseljavanje bezalkoholnih pića. Primjerice, osnovni sastojci Coca−Cole su voda i šećer kojima se dodaje karamel, fosforna kiselina, arome, kofein i ugljikov dioksid koji izazva specifičan okus. Gotovo sva bezalkoholna gazirana pića imaju približno isti sastav: 88,5 % vode i 11,5 % šećera. Pijenjem slatkih gaziranih pića vara se vlastito tijelo, jer se u organizam unose "prazne kalorije" - to su pića bez vitamina i mineralnih tvari. Od njih se čovjek deblja, a usto unosi u tijelo umjetne boje, arome i sladila od kojih su neka štetna te su zabranjena u mnogim zemljama. Gazirana pića uzrokuju zdravstvene tegobe poput smanjenja razine kalija u krvi, što pak dovodi do problema s mišićima i srcem.
Prašak za pecivo najčešće sadržava natrijevu sol pirofosforne kiseline, Na2H2P2O7 (E 450), i natrijev hidrogenkarbonat, NaHCO3 (E 500). Njihovom međusobnom reakcijom u tijestu nastaje ugljikov dioksid koji nadiže tijesto:
Na2H2P2O7(aq)
+ 4 NaHCO3(aq) → 2 Na3PO4(aq) + 3 H2O(l)
+ 4 CO2.
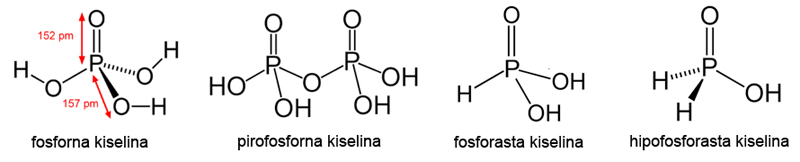
Slika 7.19. Strukturne formule nekih fosfornih kiselina: fosforna kiselina H3PO4, pirofosforna kiselina H4P2O7, fosforasta kiselina HPO(OH)2, hipofosforasta kiselina, H2P(O)OH
Dobro upamtite građu pirofosforne kiseline jer sve stanice sadržavaju adenozin trifosfat, ATP. Dvije krajnje fosfatne skupine u svojim kemijskim vezama čuvaju veliku količinu energije. Stanica može normalno funkcionirati i obavljati redovne životne funkcije samo kad raspolaže dostatnom količinom ATP-a, tj. energije. Hidrolizom ATP-a odcjepljuje se jedna fosfatna skupina i oslobađa energija koja se troši za procese u stanici. Pri tome nastaje adenozin difosfat, ADP, energijski siromašniji spoj koji sadržava samo jednu energijom bogatu vezu. Ako je stanici potrebno još energije ona odcjepljuje još jedan fosfat, puca i druga veza te se oslobađa dodatna energija potrebna za procese u stanici. Pritom nastaje adenozin monofosfat, AMP. Obrnut proces od hidrolize ATP-a je fosforilacija.
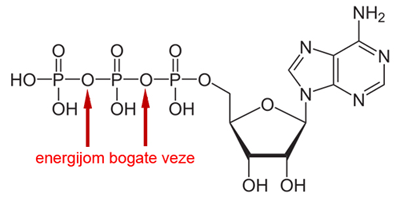
Slika 7.20. Adenozin trifosfat, ATP
Fosforov(III) oksid, P4O6, bezbojna je krutina koja s vodom daje fosforastu kiselinu, H3PO3:
P4O6(s) + 6 H2O(l) → 4 HPO(OH)2(aq).
Iako sadržava tri vodikova atoma fosforasta kiselina je dvoprotonska kiselina, jer je jedan atom vodika kovalentnom vezom vezan na atom fosfora. Stoga fosforasta kiselina čini samo dvije vrste soli: fosfite, HPO32−, i hidrogenfosfite, H2PO3−. Fosforasta se kiselina na zraku polagano oksidira u fosfornu kiselinu. Zagrijavanjem pri 200 °C disproporcionira se na fosfornu kiselinu i fosfin. Tom se metodom fosfin dobiva u laboratoriju:
4 HPO(OH)2(s) → 3 H3PO4(l) + PH3(g).
Fosfin, PH3, ekstremno je otrovan, zapaljiv i bezbojan plin mnogo slabije topljiv u vodi od amonijaka. Može se dobiti djelovanjem vode na fosfide, spojeve koji sadržavaju ion P3−, primjerice kalcijev fosfid Ca3P2:
Ca3P2(s) + 6 H2O(l) → 2 PH3(g) + 3 Ca(OH)2(s).
Čist fosfin nema mirisa, ali onaj tehničke čistoće ima miris trulih riba.
Fosfin se može dobiti i zagrijavanjem bijeloga fosfora u koncentriranoj otopini natrijeva ili kalijeva hidroksida. Pritom nastaju natrijev ili kalijev hipofosfit i fosfin:
P4(s) + 3 NaOH(aq) + 3 H2O(l) → 3 NaH2PO2 (aq) + PH3(g).
Kad se nastali fosfin u obliku mjehurića ispušta kroz vodu, on se na zraku odmah zapali pri čemu nastaju "dimni signali" u obliku kolutova.

Slika 7.21. Dobivanje fosfina. Pri izvođenju demonstracijskog pokusa dobivanja fosfina potreban je naročit oprez i iskustvo. Ako želite izbjeći nezgode obvezno se pridržavajte uputa opisanih u priručniku: M. Sikirica, Zbirka kemijskih pokusa, Školska knjiga, Zagreb, 2018., stranica 236 - 238.
Građa
molekule fosfina slična je građi molekule amonijaka, ali je valentni kut
H−P−H (93,5o) manji nego u amonijaku (106,7o).
Za razliku od amonijaka veze P−H nisu polarne pa fosfin ne tvori vodikove
veze s molekulama vode.
Hipofosforasta kiselina, H2P(O)OH, dosta je jaka ali monoprotonska kiselina jer su dva atoma vodika kovalentnom vezom vezana na atom fosfora.
Hipofosforasta kiselina kao i njezine soli jak su reducens. Primjerice, u tehnologiji poluvodiča tanki slojevi nikla mogu se nanijeti na površinu metala, silicija ili plastike pomoću natrijeva hipofosfita, NaH2PO2. U otopini se događaju sljedeće reakcije:
Ni2+(aq) + H2PO2−(aq) + H2O(l) → Ni(s) + H2PO3−(aq) + 2 H+(aq),
H2PO2−(aq) + H2O(l) → H2PO3−(aq) + H2(g).
Brzina izlučivanja nikla povećava se porastom temperature.
O
fosfornim kiselinama i fosfatima i fosfinu više doznajte na adresama:
en.wikipedia: Phosphoric_acids_and_phosphates
Are Phosphorous and Phosphoric Acids Equal (pdf)
PH3 or Phosphine gas
Istražite, nađite primjere i obrazložite kako i iz kojih izvora dušikovi oksidi dospijevaju u atmosferu.
Zašto se u ispušne sustave automobila ugrađuju „katalizatori“, od čega se sastoje i kakva im je uloga?
Koje se kemijske reakcije događaju u ispušnom sustavu automobila utjecajem katalizatora?
Zašto gotovo svi eksplozivi sadržavaju dušik. Što su produkti gorenja baruta, TNT-a, RDX-a, nitroglicerina i bezdimnog baruta?
Zašto je nakon eksplozije TNT-a „sve crno“, po čemu se može lako vidjeti da je izazvana upravo tim eksplozivom?
Istražite u kojim se svemirskim misijama kao gorivo rabio monometil hidrazin, CH3NHNH2, a kao oksidans didušikov tetroksid, N2O4. Napišite jednadžbu reakcije i izračunajte reakcijsku entalpiju.
Upoznajte tehnološki postupak sinteze amonijaka i umjetna gnojiva na bazi dušikovih spojeva.
Proučite postupke dobivanja fosfornih gnojiva (sirovine, produkti, otpaci).
Kako se proizvode dušična i fosfatna gnojiva? Istražite utjecaj te proizvodnje na okoliš. Gdje i kako se odlaže fosfogips, otpad pri proizvodnji fosforne kiseline i mineralnog gnojiva?
Izradite plakat, PowerPoint prezentaciju, snimite video, održite predavanje u razredu, organizirajte raspravu, pišite u školskom listu ili pokrenite neku aktivnost u vezi odabrane teme.
7.5. Ugljik
Elementi 14 skupine: ugljik, silicij, germanij, kositar i olovo, iako pripadaju istoj skupini, bitno se razlikuju po fizičkim i kemijskim svojstvima. Dok je ugljik tipičan nemetal, olovo je tipičan metal. Svi elementi 14 skupine pojavljuju se u oksidacijskom stanju +4 i +2. No stabilnost oksidacijskog stanja +2 povećava se porastom rednog broja elementa. Ugljik je temeljni kemijski element za sve oblike života koji su se razvili na Zemlji, pa stoga većinu njegovih spojeva svrstavamo u organsku kemiju. Ipak, velik broj ugljikovih spojeva svrstavamo u anorganske spojeve, kao što su metaloorganski spojevi, koordinacijski spojevi, bioanorganski spojevi i dr.
Zemljina kora sadržava samo 0,032 % ugljika. U prirodi dolazi u obliku spojeva, ali i u elementarnom stanju. Najpoznatije su dvije alotropske modifikacije ugljika dijamant i grafit.
Tablica 5. 1. Usporedba svojstava dijamanta i grafita
|
Dijamant |
Grafit |
|
vrlo tvrd |
vrlo mekan |
|
bezbojan, velik indeks loma svijetla |
crn, metalnog sjaja |
|
izolator |
provodi električnu struju |
|
krt, kala se po plohama oktaedra |
savitljiv, kala se u listiće |
|
gustoća 3,51 g cm−3 |
gustoća 2,25 g cm−3 |
|
rabi se za nakit, alate za brušenje |
dodaje se mastima za podmazivanje, koristi |
|
i rezanje stakla, obradu metala i sl. |
se za izradu četkica za elektromotore, |
|
|
elektrode za dobivanje aluminija i dr. |
Dijamant kristalizira u kubnom sustavu. Kristali dijamanta imaju velik indeks loma pa se rabe za nakit. Od ukupno pronađenih prirodnih dijamanata samo se oko 5 % najljepših primjeraka iskoristi za nakit dok se ostatak rabi u industrijske svrhe, uglavnom za izradu alata. Kristali dijamanta su bezbojni, ali češće su obojeni zbog primjesa.
U dijamantu svaki atom ugljika čini četiri jednostruke kovalentne veze s četiri atoma ugljika. Zamislimo li da se atom ugljika nalazi u središtu tetraedra, tad su kovalentne veze usmjerene od središta prema njegovim vrhovima na kojima se opet nalaze atomi ugljika. Sustav kovalentnih veza proteže se od atoma do atoma kroz cijeli kristal tako da je cijeli kristal jedna gigantska molekula. Takav raspored atoma i kovalentnih veza čini dijamant najtvrđim materijalom.
Dijamant je metastabilna modifikacija ugljika. Grafit je termodinamički stabilniji:
C(dijamant) → C(grafit) ΔrH(298 K) = −2,9 kJ mol−1.
No pri sobnoj temperaturi prijelaz iz dijamanta u grafit ekstremno je spor pa ne morate strahovati da će se vaši dijamanti pretvoriti u grafit. Dijamant ima veću gustoću (ρdijamant = 3,51 g cm−3) od grafita (ρgrafit = 2,25 g cm−3).
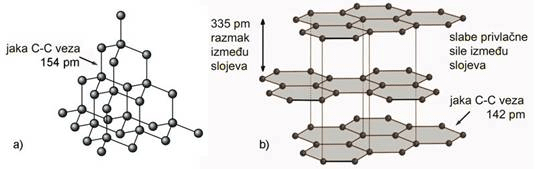
Slika 7.22. Usporedba struktura dijamanta i grafita. a) Kovalentne veze između atoma ugljika u dijamantu usmjerene su prema vrhovima tetraedra. b) U grafitu su atomi ugljika vezani kovalentnim vezama tako da tvore beskonačne ravne slojeve. Grafit kristalizira u heksagonskom sustavu.
Grafit ima slojevitu strukturu. Zamislimo li da se atom ugljika nalazi u težištu istostraničnog trokuta. Tada su kovalentne veze usmjerene prema njegovim vrhovima, gdje se opet nalaze atomi ugljika. Tako se stvara dvodimenzijska slojevita struktura slična pčelinjem saću. Jake kovalentne veze postoje samo unutar jednog sloja. Među slojevima djeluju slabije van der Waalsove sile. Svojstva grafita posljedica su kombiniranja svojstava dviju vrsta kemijske veze. Zbog jakih kovalentnih veza među atomima ugljika unutar sloja talište grafita je više od 4.000 °C. Zbog slojevite strukture i slabih van der Waalsovih sila među slojevima grafit je mekan i masna opipa. Grafit se primjenjuje za izradu elektroda u proizvodnji aluminija i drugih metala, lonaca za taljenje metala, četkica na kolektorima elektromotora, kao materijal za podmazivanje i dr.
Pribor: List papira, mekana grafitna olovka, selotejp.
Postupak
Mekanom grafitnom olovkom zacrnite oko 1 cm2 površine papira. Preko te površine prilijepite i odlijepite komadić selotejpa. Trag olovke na papiru sastoji se kristalića (ljuskica) grafita paralelnih s površinom papira. Kristali grafita se kalaju paralelno slojevima ugljikovih atoma pa na selotejpu zaostaju vrlo tanki slojevi od kristalići grafita. Ovakav je pokus prethodio otkriću grafena, treće alotropske modifikacije ugljika.
Grafen je treća alotropska modifikacija ugljika. Sastoji se od sloja ugljikovih atoma, kao u grafitu, debljine jednog atoma. Atomi ugljika čine dvodimenzijsku rešetku nalik pčelinjem saću.
Više doznajte na: en.wikipedia: Graphene
7.5.1. Karbidi
Spojevi ugljika s metalima nazivaju se karbidi. To su neobično tvrdi materijali. Već smo kod čelika spomenuli željezov karbid, Fe3C, cementit koji se pojavljuje i u meteorima kao mineral kohenit. Za metaloprerađivačku industriju od posebne je važnosti volframov karbid, WC i karbidi prijelaznih metala. Volframov karbid dobiva se u obliku praha kad se smjesa prahova volframa i ugljika (čađe) grije u struji vodika pri oko 1.500 °C. Od smjese volframova karbida i 4 do 6 % kobalta u prahu prešanjem se izrađuju male pločice, valjčići i dr., te sinteriraju u struji vodika. Kobalt povezuje zrnca volframova karbida pa se tako dobije kompaktan vrlo tvrd materijal koji se pod imenom vidija rabi za vrhove tokarskih noževa, svrdla za kamen i beton, vrhove zubaca na pilama za keramiku, drvo itd.
Kalcijev karbid, CaC2, dobije se taljenjem kalcijeva oksida s koksom u elektrolučnoj peći:
CaO(s) + 3 C(s) → CaC2(l) + CO(g).
Kalcijev karbid se rabi za dobivanje etina, H−CC−H (zastarjelo ime je acetilen.):
CaC2(s) + 2 H2O(l) → Ca(OH)2(s) + C2H2(g),
2 C2H2(g) + 3 O2(g) → 4 CO2(g) + 2 H2O(g).
Kad etin izgara s kisikom u specijalnom plameniku postiže se temperatura plamena i do 3.000 C. S takvim se plamenom može rezati i variti željezo, variti i spajati željezne cijevi itd.
Kalcijev karbid je nekoć bio temelj kemijske industije jer je preko etina omogućavao sintezu praktički svih organskih spojeva iz ugljena. Takva je industrija postojala i u Hrvatskoj. O povijesti proizvodnje kalcijeva karbida u Hrvatskoj (1897. – 1945.) više doznajte u časopisu Kemija u industriji u članku: Povijest proizvodnje kalcijeva karbida u Hrvatskoj (1897. – 1945.)
Vidi na internetu:
e-Kemija: Sikirica - Dobivanje etina
Silicijev karbid, SiC, dobiva se zagrijavanjem kvarcnog pijeska i koksa u elektrolučnoj peći pri 2000 C:
SiO2(l) + 3 C(s) → SiC(s) + 2 CO(g).
Silicijev karbid tvrd je skoro kao dijamant. Njegova je kristalna struktura jednaka strukturi dijamanta: u njoj je svaki drugi atom ugljika zamijenjen atomom silicija. Tako su ugljik i silicij međusobno povezani jakim kovalentnim vezama, kao u dijamantu. Zbog sličnosti kristalnih struktura i jakosti veza njihova su kemijska i fizička svojstva slična.
Silicijev karbid je kemijski vrlo otporan materijal. Za razliku od dijamanta, užaren silicijev karbid se ne zapali na zraku jer se prevuče zaštitnim slojem silicijeva dioksida. Stoga se od silicijeva karbida izrađuju obloge specijalnih metalurških peći. Od silicijeva karbida (poznatog pod nazivom carborundum) izrađuju se brusne ploče, brusni papiri i prahovi za brušenje metala, stakla, drveta, betona, mramora, dragog kamenja i dr.
7.5.2. Ugljikovi oksidi
Ugljik zapaljen na zraku uz obilan dostup zraka izgara u ugljikov dioksid, CO2, ali uz nedovoljan dostup zraka nastaje ugljikov monoksid, CO:
C(s) + O2(g) → CO2(g),
C(s) + ½ O2(g) → CO(g),
Ugljikov monoksid, CO, je vrlo otrovan plin koji nastaje u ložištima uz nedovoljan dostup zraka. Ako je dimnjak peći neispravan, ili peć dimi, često dolazi do trovanja ugljikovim monoksidom. Ugljikov monoksid se naime 250 puta čvršće veže na hemoglobin od kisika. Pritom nastaje karboksihemoglobin, (HbCO), kompleks stabilniji od oksihemoglobina (HbO2). Stoga manji broj crvenih krvnih zrnaca raznosi kisik od pluća do stanica. Ukratko, ugljikov monoksid uzrokuje nedostatak kisika u tkivima. Razina karboksihemoglobina u krvi pušača je 2−15 puta viša nego u nepušača. Također je dokazano da pušenje izravno oštećuje stijenke krvnih žila. U dimu cigarete nalaze se i slobodni radikali koji dovode do izravnog oštećenja stanica. Do trovanja ugljikovim monoksidom dolazi i pri paljenju automobila u zatvorenoj garaži. Čest uzrok trovanja ugljikovim monoksidom su atmosferski plinski bojleri u kupaonicama (iza zatvorenih ili zaključanih vrata) bez otvora za dostup svježega zraka. Prvi znak trovanja ugljikovim monoksidom je glavobolja. Ako u prostoriji koja se grije drvima, ugljenom ili plinom osjetiš glavobolju nemoj ići spavati već izađi iz prostorije i dobro je prozrači. Upozori roditelje da provjere ispravnost dimovodnih cijevi i dimnjaka.
Mladići i djevojke iz Posušja ugušili su se monoksidom
Analizom krvi utvrđeno je da je kod svih osam mladih koji su u novogodišnjoj noći umrli u vikendici u Tribistovu kod Posušja došlo do intoksinacije ugljičnim monoksidom s utvrđenom koncentracijom u krvi koja je smrtonosna.
Izvor: 24 sata, četvrtak 14.1.2021.
Ugljikov dioksid, CO2, se, kao i ugljikov monoksid, veže za hemoglobin, ali se od njega lako otpušta. „Trovanje“ ugljikovim dioksidom zapravo je fiziološki proces kojim se CO2 prenosi iz tkiva u pluća. No ako je koncentracija ugljikova dioksida u zraku previsoka, hemoglobin se ne može u plućima odvojiti od njega, pa nastupa trovanje (gušenje).
Velike količine ugljikovog dioksida nastaju pri alkoholnom vrenju. Gustoća mu je veća od gustoće zraka pa se nakuplja u podrumima u kojima vrije mošt. Stoga se u podrume u kojima vrije mošt ulazi s upaljenom svijećom. Ako se svijeća ugasi ne smije se ulaziti u podrum, već treba ostaviti vrata otvorena i načiniti propuh da se ugljikov dioksid izvjetri. Na nekim mjestima ugljikov dioksid izvire iz zemlje pa se nakuplja u dubokim bunarima. Profesionalni kopač bunara neće sići u bunar prije nego svijećom ispita može li ona gorjeti na dnu bunara.
CO2 u atmosferi. Ugljikov dioksid važan je sastojak našeg planeta te je u stalnom kruženju između atmosfere, biosfere, pedosfere, geosfere i hidrosfere. Ugljikov dioksid je staklenički plin. Bez CO2 u atmosferi ne bi bilo biljnoga svijeta, a naš bi planet bio negostoljubiv i hladan. Procjenjuje se da je prije industrijske revolucije zrak sadržavao oko 0,027 vol.% CO2, a danas ga sadržava više od 0,0415 vol.%. Pokazalo se da je povećanje koncentracije CO2 u atmosferi u korelaciji s globalnim zatopljenjem, a to znači s porastom globalne temperature i klimatskim promjenama. Pariškim sporazumom od 12. prosinca 2015. države su se obvezale smanjiti emisiju ugljikova dioksida. Cilj je zadržati povećanje prosječne globalne temperature do najviše 2 °C iznad razina u predindustrijskom razdoblju. Najviše ugljikova dioksida u atmosferu ispuštaju industrijski razvijene zemlje: Kina, 20,9 %, Sjedinjene Američke Države, 17,80 % i Europska unija, 13,09 %. Nažalost, pod predsjedanjem Donalda Trumpa SAD su napustile Pariški sporazum, no novi je američki predsjednik Joe Biden već prvog službenog dana u uredu potpisao uredbu o pokretanju postupka vraćanja SAD-a u sporazum.
Vidi na internetu:
e-Kemija: Sikirica - Globalno zatopljenje
O globalnom zatopljenju više doznajte na:
Na Rubu Znanosti - Iza vela globalnog zatopljenja
Akademik Vladimir Paar o "globalnom zatopljenju"
CO2 u atmosferi. Smatra se da oceani sadržavaju 50 puta više ugljikova dioksida nego što ga ima u atmosferi. No povećanje koncentracije ugljikova dioksida u atmosferi uzrokovalo je povećanje njegove koncentracije u oceanima. Stoga je došlo do povećanja kiselosti oceana i pomaka ravnoteže između koncentracija karbonatnih i hidrogenkarbonatnih i iona:
CO2(aq) + H2O(l) D H2CO3(aq) D HCO3−(aq) + H+(aq) D CO32−(aq) + 2H+(aq).
U predindustrijsko doba pH oceana bio je 8,179, 1990-ih 8,104 a danas je 8,069. To znači da se je u oceanima koncentracija iona H+(aq) povećala se za oko 30 % u odnosu na predindustrijsko doba. Zbog zakiseljavanja oceana morskim je organizmima dostupno manje karbonatnih iona potrebnih za izgradnju ljuštura od kalcijeva karbonata. Već je opaženo smanjenje populacije nekih vrsta školjaka i koralja. Daljnjim zakiseljavanjem oceana koralji će se jednostavno otopiti, pa će s njima nestati staništa i za druge životinjske i biljne vrste.
Fizička svojstva CO2. Pri normalnim okolnostima ugljikov dioksid je plin bez boje i mirisa. U tekuće (kapljevito) stanje može prijeći hlađenjem tek pri tlaku višem od 5,1 bar. Tekući ugljikov dioksid dolazi u trgovinu u čeličnim bocama pod tlakom. Neki aparati za gašenje požara sadržavaju tekući CO2. Takvi aparati imaju mlaznicu u obliku dugačkog roga. Ako na taj rog nataknete vreću od gustoga platna i ispraznite aparat, u vreći će se skupiti suhi led, tj. ugljikov dioksid u krutom stanju. Suhi se led ne tali već sublimira pri –78 °C.

Slika 7.23. Dobivanje suhoga
leda u školskim uvjetima.
Slika izvor: kak-sdelat-suxoj-led
Istim postupkom suhi led možete dobiti i pomoću standardne čelične boce s CO2 pod tlakom. No bocu treba nagnuti s ventilom prema dolje i na ventil privezati vreću od čvrstoga platna. Kad se ventil otvori tekući ugljikov dioksid naglo isparava, a temperatura se toliko snizi da se dio CO2 skrutne u suhi led. (Ako bocu držite uspravnom i otvorite ventil, ohladit će se boca a suhi će led nastati u boci. U aparatima za gašenje požara tekući CO2 se istiskuje s dna boce.)
Suhi led je važno rashladno sredstvo. Primjerice, Pfizerovo cjepivo protiv koronavirusa čuva se transportira u spremnicima sa suhim ledom.
Iznad kritične točke (31,1 oC, 73,8 bar) ugljikov dioksid prelazi u stanje koje se naziva superkritični fluid. Superkritični fluidi imaju svojstva i plinova i tekućina, tj. mogu difundirati kroz otopinu poput plina i otapati tvari poput tekućina. Superkritični ugljikov dioksid primjenjuje se u prehrambenoj industriji za ekstrakciju ulja iz orašastih i drugih plodova, ekstrakciju kofeina iz sirovih zrna kave, ekstrakciju eteričnih ulja i ostalih miomirisnih materijala. Mnogo se radi i na tome da ga se koristi kao otapalo pri sintezi organskih spojeva u kemijskoj industriji.
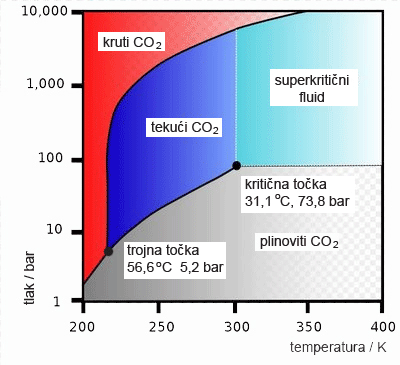
Slika 7.24. Fazni dijagram za ugljikov dioksid. Slika izvor: hr.wikipedia/Ugljikov(IV)_oksid
Primjena CO2. Ugljikov dioksid ima mnogobrojne primjene, primjerice kao zaštitna atmosfera pri zavarivanju čelika. U tekućem stanju pod tlakom primjenjuje se, kao što smo već rekli, u aparatima za gašenje požara. Velike količine koriste se kao sirovina u kemijskoj prerađivačkoj industriji, posebno za proizvodnju metanola i uree. U prehrambenoj industriji rabi se kao sredstvo za hlađenje i zamrzavanje, pakiranje prehrambenih proizvoda u ambalaži s inertnim plinom, za pripremu gaziranih napitaka. Mali spremnici, koji sadržavaju CO2 pod tlakom, rabe se za napuhavanje guma bicikla, prsluka za spašavanje, pripremu "soda vode" i dr.
Ugljikov dioksid rabi se u naftnim bušotinama za vađenje nafte i održavanje tlaka u geološkom sloju. CO2 se djelomično otapa u nafti te joj smanjuje viskoznost čime se olakšava crpljenje nafte iz temeljne stijene. Tako se bolje iskorištava ležište i crpi znatno više nafte.
Povećanje koncentracije CO2 pogoduje rastu bilja. U stakleničkom uzgoju rajčica, krastavaca, salate i drugog povrća, u staklenik se upuhuje ugljikov dioksid. Povećanjem volumnog udjela CO2 od 0,0415 %, koliko ga ima u zraku, na 0,1 - 0,3 % postižu se i do 40 % veći prinosi te skraćuje vrijeme cvatnje i dozrijevanja plodova.
Kaptiranje i skladištenje CO2. Kako bi se ublažile klimatske promjene i smanjilo zakiseljavanje oceana, neke zemlje, poput Norveške, već uspješno hvataju i skladište ugljikov dioksid (engl. CCS – carbon capture and storage). To uključuje kaptiranje CO2 u elektranama, koje za pogonsko gorivo koriste ugljen ili plin, i u industrijskim postrojenjima (čeličane, cementare, rafinerije itd.). Nakon kaptiranja u industrijskom postrojenju, CO2 se komprimira i transportira cjevovodom ili brodom do podzemnog skladišta te se na kraju utiskuje kroz bušotinu u geološku formaciju pogodnu za dugoročno skladištenje.
Ugljikov dioksid je topljiv u vodi, a vodena otopina pokazuje kiselu reakciju:
CO2(aq) + 2 H2O(l) D HCO3−(aq) + H3O+(aq).
Uostalom, svi smo osjetili kiselkast okus različitih gaziranih napitaka i kisele vode.
Velika većina ugljikovog dioksida samo je otopljena u vodi, samo vrlo mali dio reagira s vodom te daje ugljičnu kiselinu, H2CO3(aq). Iako ugljična kiselina nikad nije dobivena ipak poznajemo dvije vrste njezinih soli, hidrogenkarbonate:
NaOH(aq) + CO2(g) → NaHCO3(aq),
i karbonate:
2 NaOH(aq) + CO2(g) → Na2CO3(aq) + H2O(l).
Slika 7.25. Lewisove strukturne formule: a) ugljikov monoksid, b) ugljikov dioksid, c) karbonatni ion. Sve su veze u karbonatnom ionu jednake duljine. Stoga Lewisovu strukturnu formulu karbonatnog iona prikazujemo kao rezonantni hibrid sve tri formule.
Natrijev karbonat, Na2CO3, ili soda, sol ugljične kiseline, najviše se rabi pri proizvodnji stakla, a manje pri proizvodnji sredstava za pranje.
Natrijev hidrogenkarbonat, NaHCO3, ili soda bikarbona, sastojak je mnogih "šumećih tableta", koje sadržavaju i limunsku kiselinu. Dok je tableta suha kristalići limunske kiseline i natrijeva hidrogenkarbonata međusobno ne reagiraju. U otopini limunska kiselina reagira s natrijevim hidrogenkarbonatom pri čemu nastaje ugljikov dioksid pa se tako dobije gazirani napitak. Otopina sode bikarbone slabo je lužnata pa se rabi za neutralizaciju viška želučane kiseline, HCl(aq).
7.5.3. Zasićeni ugljikovodici ili alkani
Ugljikovodici su spojevi ugljika s vodikom. Njihove su molekule izgrađene samo od ugljika i vodika. Ne sadržavaju funkcijske skupine i upravo im to određuje fizičko−kemijska svojstva. Najveći prirodni izvor ugljikovodika je nafta. Pored tekućih ugljikovodika, koji čine najveći dio, nalazišta nafte često su izvor i plinovitih ugljikovodika koje nazivamo prirodni ili zemni plin. Prirodni plin je smjesa nižih alifatskih ugljikovodika od 1 do 5 ugljikovih atoma u molekuli. Plin koji dolazi u kućanstva plinovodima sastoji se pretežito od metana, CH4. Plin koji se u kućanstva dolazi stlačen i ukapljen u plinskim bocama je smjesa 35 % propana, C3H8, i 65 % butana, C4H10.
U eksploziji plinske boce kod Zagreba
ozlijeđen jedan čovjek.
Svakih nekoliko dana
možemo u novinama pročitati kako je negdje "eksplodirala plinska
boca". No plinske boce pri normalnom radu nikad ne eksplodiraju.
Eksplodira samo smjesa plina i zraka i to stoga što boca nije bila zatvorena
ili je na nekom spoju curio plin. Plinska boca može eksplodirati samo ako ju se
izloži visokoj temperaturi, primjerice u požaru.
Posljedice jedne takve eksplozije pogledajte
u članku:
u-eskploziji-plinske-boce-ozlijeden-jedan-covjek
Rješenje: Plin u bocama smjesa je propana i butana. No za potrebe ovog zadatka uzet ćemo da se sastoji samo od butana. Napišimo najprije jednadžbu reakcije gorenja butana:
2 C4H10 + 13 O2 → 8 CO2 + 10 H2O.
Odavde proizlazi da je najbolji volumni omjer butana i kisika jednak omjeru stehiometrijskih koeficijenata u jednadžbi, tj. 2 : 13. Uzmemo li da je volumni udio kisika u zraku, φ(O2,zrak) = 0,20, proizlazi da je za eksploziju idealan volumni omjer butana i zraka 2 : 65, tj. oko 3 vol. % butana u smjesi plinova. No eksplozivne su sve smjese butana i zraka koje sadržavaju 1,8 - 8,4 vol.% butana.
O rukovanju plinskim bocama više doznajte na adresi:
Ugljikovi atomi mogu se međusobno povezivati jednostrukom, dvostrukom i trostrukom kovalentnom vezom. S obzirom na vrstu kovalentne veze ugljikovodike dijelimo na zasićene i nezasićene. Zasićeni ugljikovodici ili alkani su oni spojevi ugljika i vodika u kojima su ugljikovi atomi međusobno povezuju samo jednostrukim kovalentnim vezama u lance, razgranate lance i u prstenaste strukture. Nazivamo ih još acikličkim (alifatskim) ugljikovodicima.
Slika 7.26. Aciklički ugljikovodici ili alkani
Alkani tvore homologni niz. Opća formula homolognog niza alkana je CnH2n+2, a članovi (izuzevši metan) se razlikuju za skupinu CH2. Naziv pojedinog alkana ovisi o broju ugljikovih atoma. Povećanjem broja ugljikovih atoma u molekuli, te povećanom razgranatosti lanca, imenovanje alkana postaje zahtjevnije. Zato je Internacionalna unija za čistu i primijenjenu kemiju, IUPAC (engl. International Union for Pure and Applied Chemistry), preporučila pravila davanja imena organskim spojevima.
Za određivanje imena alkana primjenjuju se sljedeća pravila:
- Nazivi alkana završavaju nastavkom –an.
- Za prva četiri člana homolognog niza alkana prihvaćeni su uobičajeni (trivijalni) nazivi metan, etan, propan, butan.
- Nazivi alkana s pet i više ugljikovih atoma izvode se od grčkog broja koji označava broj ugljikovih atoma u najduljem lancu. (Kako je u grčkom pente = pet, hex = šest, hepta = sedam, okto = osam itd., odgovarajući alkani s pet, šest, sedam i osam ugljikovih atoma imaju imena pentan, heksan, heptan, oktan itd.)
- Kod alkana s razgranatim lancem kao osnova imena uzima se najdulji niz ugljikovih atoma.
- Alkilne skupine, vezane za ugljikove atome osnovnog lanca, dobivaju imena na osnovi imena pripadnog alkana s nastavkom –il. (Primjerice: metil –CH3, etil –C2H5, propil –C3H7, butil –C4H9, pentil –C5H11.)
- Atomi ugljika osnovnog lanca označavaju se brojevima tako da atom na koji je vezana alkilna skupina ima manji broj.
- Broj ugljikova atoma na koji je vezan alkil stavlja se ispred imena alkila.
- Sadržava li spoj više istovrsnih alkilnih skupina, njihov se broj označava prefiksima di−, tri−, tetra−.
Već smo kazali da su kovalentne veze između atoma ugljika u dijamantu usmjerene su prema vrhovima tetraedra i da kut među vezama iznosi 109,5o. U acikličkim ugljikovodicima kutovi među vezama također iznose 109,5o. To znači da formule na slici 7.26. prikazuju projekciju razmještaja atoma u prostoru. No slika 7.27. prikazuje prostorni razmještaj atoma u metanu, etanu, propanu i butanu. Lanci "ravnočlanih" ugljikovodika nisu ravni. Dijelovi molekula mogu rotirati oko jednostrukih veza pa lanac može zauzeti bezbroj prostornih razmještaja.
Slika 7.27. Modeli molekula alkana: metan, etan, propan, butan
Atomi ugljika u ugljikovodicima istoga kemijskog sastava, CnH2n+2, mogu se povezati u razgranate lance ako je broj ugljikovih atoma veći od tri. Primjerice, butan, C4H10, ima dva konstitucijska izomera, pentan C5H12, tri, a heksan C6H14, pet izomera itd. Izomeri su spojevi iste molekulske formule u kojima su atomi povezani različitim redoslijedom. Zbog toga im se fizička, kemijska i biološka svojstva razlikuju. Broj mogućih konstitucijskih izomera nekog alkana raste porastom broja C-atoma u molekuli. Primjerice dekan, C10H12, ima 75 konstitucijskih izomera, a eikosan, C20H42, 366.319.
Kako prebrojati konstitucijske izomere alkana doznajte u rubrici Kemija u nastavi časopisa Kemija u industriji u članku:
Kako prebrojati konstitucijske izomere alkana (pdf)
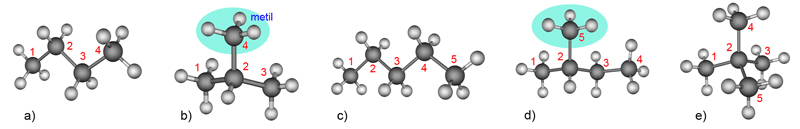
Slika 7.28. Konstitucijski izomeri butana i pentana: a) n-butan, b)
2-metilpropan,
c) n-pentan, d) 2-metilbutan, e) 2,2-dimetilpropan.
Već smo nekoliko puta naglasili da su za zasićene ugljikovodike svojstvene četiri jednostruke veze usmjerene prema vrhovima tetraedra. Zato prostornu građu molekula osim modelima prikazujemo i klinastim formulama.
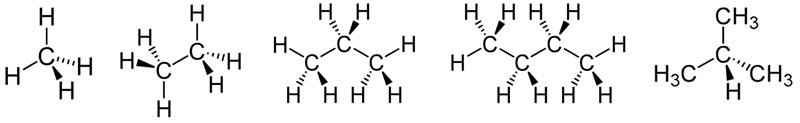
Slika 7.29. Klinaste formule metana, etana, propana, butana i 2-metilpropana
Puni klin prikazuje vezu koja je iznad ravnine papira a crtkani klin vezu ispod ravnine papira. Veze koje leže u ravnini papira prikazane su crtama jednolične debljine. Takav način prikazivanja formula organskih spojeva moguće je primjenjivati kad se radi o jednostavnim molekulama. No molekule organskih spojeva najčešće su mnogo složenije građe pa nije uvijek moguće ili potrebno na papir vjerno prenijeti sve valentne kutove.
Pisanje formula organskih spojeva može se pojednostaviti tako da se lanac ugljikovih atoma prikaže izlomljenim crtama. Na svakom uglu treba zamisliti –CH– skupinu a na krajevima lanca –CH3 skupine.
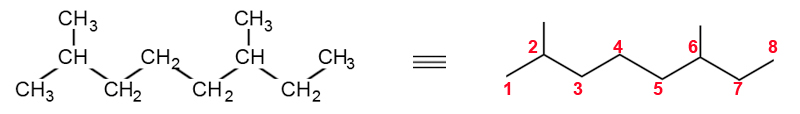
Slika 7.30. Strukturna formula 2-6-dimetiloktana prikazana sustavom izlomljenih crta
Kod cikličkih zasićenih ugljikovodika vrijedi isto načelo, pa trokut označava ciklopropan, četverokut ciklobutan, peterokut ciklopentan, šesterokut cikloheksan itd.
Ugljikove atome u lancu razvrstavamo na primarne (1°), sekundarne (2°), tercijarne (3°) i kvaterne (4°), ovisno o broju neposredno vezanih ugljikovih atoma. Ugljikov atom vezan na samo jedan ugljikov atom je primarni. Ugljikov atom vezan na dva druga atoma je sekundarni. Primjerice, propan ima dva primarna i jedan sekundarni ugljikov atom, 2-metilpropan ima tri primarna i jedan tercijarni ugljikov atom, 2,2-dimetilpropan ima četiri primarna i jedan kvaterni ugljikov atom. (Vidi sliku 7.28.)
Fizička svojstva alkana ovise o broju ugljikovih atoma u molekuli. Primjerice, prva četiri alkana (metan, etan, propan i butan) su plinovi, sljedećih 13, od C5H12 do C17H36, su tekućine, a od C18H38 nadalje su krutine. Općenito, tališta i vrelišta alkana rastu porastom broja ugljikovih atoma u lancu: vrelište metana je −162, etana −89, propana −42, butana 1, pentana 36, heksana 69, heptana 98, oktana 126, nonana 151, a dekana 174 °C. Ugljikovodici s 5 do 10 ugljikovih atoma najvažniji su sastojci benzina. Na vrelište utječe i način povezivanja atoma. Razgranati ugljikovodici imaju niže vrelište od ravnočlanih ugljikovodika s istim brojem ugljikovih atoma. Uzmimo za primjer izomere pentana. Pentan ima vrelište 36 °C, 2-metilbutan vrije pri 27 °C, a 2,2-dimetilpropan pri 9,5 °C. Izooktan, tj. 2,2,4-trimetil pentan, koji služi kao referentni spoj kod određivanja oktanskog broja pogonskih goriva, vrije pri 99 °C, dok je vrelište oktana 126 °C.
Kemijska svojstva alkana. Alkani su općenito slabo reaktivni i ne reagiraju s kiselinama i lužinama, kao ni s kalijevim permanganatom, koji se rabi kao karakterističan reagens na zasićene ugljikovodike. Zbog malog afiniteta na djelovanje različitih reagensa, u prošlosti su dobili ime parafini (lat. parum affinis - mali afinitet). Dok fluor spontano reagira s alkanima, smjese metana i klora može neograničeno stajati u mraku. No ako se tu smjesu obasja ultraljubičastom svjetlošću doći će do žestoke eksplozije. Pritom se jedan ili više vodikovih atoma u molekuli metana zamijeni (supstituira) atomima klora. Reakcije u kojima se atom ili dio molekule zamjenjuje nekim drugim atomom ili skupinom atoma nazivamo reakcijama supstitucije.
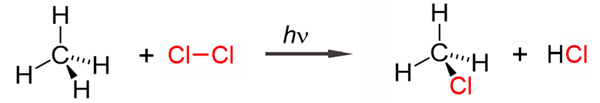
Slika 7.31. Reakcija supstitucije
Postavlja se pitanje zašto metan i klor međusobno reagiraju tek kad ih obasjamo ultraljubičastom svjetlošću? Da bi došlo do kemijske reakcije između molekula s kovalentnim vezama potrebno je najprije neke veze pokidati da bi nove mogle nastati. Zato je potrebno izvana dovesti energiju. Uzmimo kao općenit primjer spoj sastavljen od atoma A i B međusobno vezanih kovalentnom vezom, tj. zajedničkim parom elektrona. Ta se veza može pokidati na dva načina.
Heterolitičko kidanje veze. Poslije kidanja veze oba elektrona ostanu na elektronegativnijem atomu. To je heterolitičko kidanje veze, a produkti su ioni.
energija
A : B → A+ + :B−
molekula kation anion
Homolitičko kidanje veze. Poslije kidanja veze na svakom je atomu ostao jedan elektron iz zajedničkog elektronskog para. Dobiveni produkti su slobodni radikali:
energija
A : B → ·A + ·B
molekula slobodni radikali
Klor je žutozelen što znači da apsorbira komplementarnu, tj. ljubičastu boju vidljive svjetlosti. Kad se smjesu klora i metana obasjamo ultraljubičastom svjetlošću molekula klora apsorbira energiju jednog kvanta svjetlosti pa dolazi do homolitičkog kidanja kovalentne veze:
hν
Cl:Cl → ·Cl + ·Cl
molekula klora slobodni radikali
Nastali slobodni radikali, tj. atomi klora, bogati su energijom te brzo reagiraju s molekulama metana pa nastaje klorovodik i metilni radikal, ·CH3:
CH4 + ·Cl → HCl + ·CH3
Nastali metilni radikal dalje reagira s molekulom klora pri čemu se oslobodi novi klorov radikal, ·Cl, koji pak reagira s molekulom alkana:
·CH3 + Cl2 → CH3Cl + ·Cl
·Cl + CH4 → HCl + ·CH3
Slijedi lančana reakcija jer se u svakoj reakciji oslobodi novi radikal koji reagira s molekulom klora, metana ili klormetana. Stoga pri kloriranju metana nastaje više produkata: CH3Cl, CH2Cl2, CHCl3 i CCl4. U načelu jedan bi radikal mogao uzrokovati neograničen broj daljnjih reakcijskih stupnjeva u lančanoj reakciji, ali se u stvarnosti to ne događa. Slobodni radikali koji nastaju tijekom reakcije mogu se izgubiti u reakcijama u kojima ne nastaju novi slobodni radikali. Najčešće reakcija završava spajanjem dvaju slobodnih radikala pri čemu nastaje stabilan produkt:
·Cl + ·Cl → Cl : Cl
·Cl + ·CH3 → CH3Cl
·CH3 + ·CH3 → H3C–CH3
Diklormetan, CH2Cl2, triklormetan, CHCl3, i tetraklormetan, CCl4, rabe se kao otapala, ali su otrovni i štetni za zdravlje. Triklormetan (kloroform) primjerice, oštećuje bubrege, jetru i srce. Neki se halogenalkani primjenjuju kao anestetici. 1,1,1-trifluor-2-brom-2-kloretan, poznatiji pod trgovačkim nazivom halotan, primjenjuje se kao sredstvo za narkozu inhalacijom. Halotan je nezapaljiv i siguran za pacijenta, ali se nikad ne primjenjuje sam već u kombinaciji s drugim anesteticima.
Halogenalkani koji u molekulama sadržavaju atome klora i fluora nazivaju se klorfluorugljikovodici (kraće CFCs što dolazi od engl. chlorofluorocarbons). Poznatiji su pod nazivom freoni. Zbog slabe kemijske reaktivnosti i nezapaljivosti već su se ranih 1930–ih godina pokazali kao izvrsno sredstvo za prijenos topline u rashladnim uređajima. Rabili su se kao potisni plinovi u raspršivačima (sprejevima), kao sredstva za čišćenje elektroničkih sklopova itd. Tek je 1974. godine pretpostavljeno da freoni uništavaju Zemljin ozonski omotač. „Montrealskim protokolom" iz 1987. ograničena je proizvodnja CFCs, a 1996. prestala je njihova proizvodnja. Suvremeni rashladni sustavi sadržavaju ekološki prihvatljivije prijenosnike topline.
7.5.4. Cikloalkani
Cikloalkani su ugljikovodici u kojima su ugljikovi atomi povezani u prsten. Imena dobivaju po istom načelu kao i alkani, ali uz predmetak ciklo. Opća formula cikloalkana je CnH2n.
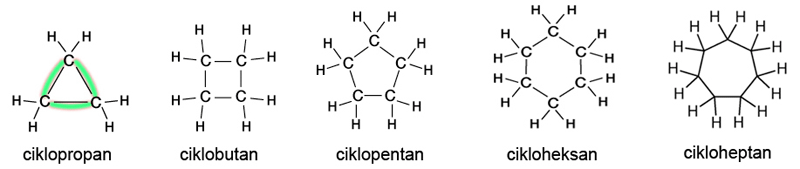
Slika 7.32. Ciklički ugljikovodici ili cikloalkani
Kovalentne veze između atoma ugljika u dijamantu i alifatskim ugljikovodicima usmjerene su prema vrhovima tetraedra, tj. kut među vezama iznosi 109,5o. Kod cikloalkana taj uvjet ne može uvijek biti ispunjen. Primjerice u ciklopropanu ugljikovi atomi zauzimaju vrhove trokuta. Zbog odstupanja od tetraedarskog kuta, 109,5o, javlja se "kutna napetost" u molekulama ciklopropana, ciklobutana i ciklopentana.
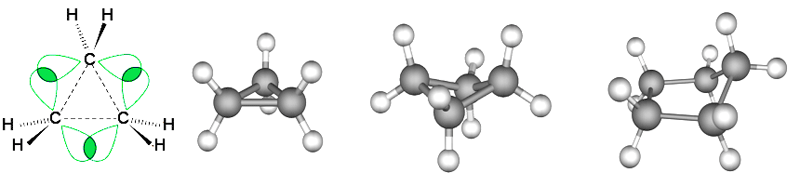
Slika 7.33. Kovalentne veze među atomima u ugljika nižih cikloalkana "savijene" su zbog nelinearnog preklapanje elektronskih oblaka, tj. odstupanja od tetraedarskog kuta 109,5o. Stoga u molekulama ciklopropana, ciklobutana i ciklopentana dolazi do "kutne napetosti".
Zbog kutne napetosti ciklopropan je reaktivniji od drugih cikloalkana. Reakcije ciklopropana i ciklobutana slične su reakciji adicije, dok su reakcije ciklopentana i heksana reakcije supstitucije:
C3H6 + Br2 → Br−CH2−CH2−CH2−Br (adicija),
C4H8 + Br2 → Br−CH2−CH2−CH2−CH2−Br (adicija),
C6H12 + Br2 → C6H11Br + HBr (supstitucija).
Dijelovi molekule mogu rotirati oko jednostrukih veza, pri čemu se ne kidaju veze među atomima u molekuli. Stoga iste molekule mogu imati različite oblike. Oblici istih molekula, koji nastaju okretanjem oko jednostrukih veza i koji lako prelaze jedan u drugi, zovu se konformacije. .U molekulama cikloheksana s konformacijom stolice kutna napetost je najmanja jer su kutovi među vezama idealnih 109,5o. U konformeru oblika kolijevke kutovi su također jednaki 109,5o. No taj je konformer manje stabilan, jer se bliski elektronski oblaci vodikovih atoma međusobno odbijaju.
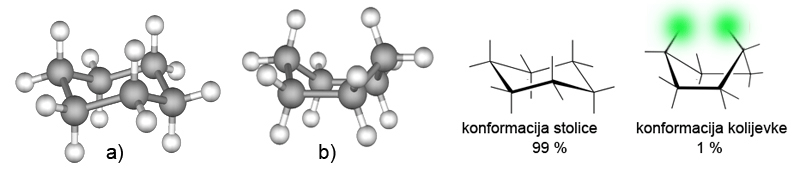
Slika 7.34. Konformacije cikloheksana: a) konformacija stolice (engl. chair), b) konformacija kolijevke (engl. boat)
7.5.5. Alkeni
Alkeni ili olefini su nezasićeni ugljikovodici u kojima postoji najmanje jedna dvostruka veza između ugljikovih atoma. Najjednostavniji alken je eten, C2H4, poznat i kao etilen.
Nazivlje alkena
- Imena alkena završavaju nastavkom –en. (Primjerice, eten, propen, buten, penten itd.).
- Ugljikovi atomi u molekuli alkena označavaju se brojevima tako da ugljikov atom s dvostrukom vezom dobije najmanji broj.
- Alkeni s razgranatim lancem dobivaju nazive prema najduljem lancu ugljikovih atoma koji sadržava dvostruku vezu.
- Alken s više dvostrukih veza u lancu dobiva nastavak –dien, −trien itd.
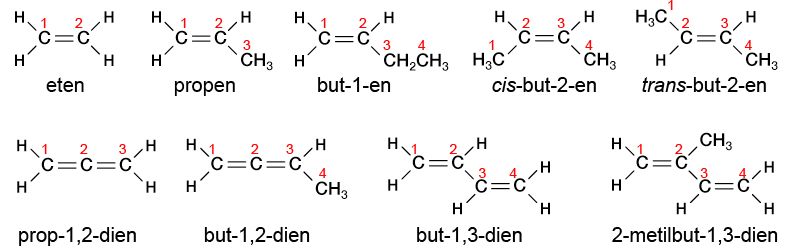
Slika 7.35. Strukturne formule i nazivi jednostavnih alkena
Pri davanju imena alkenu uvijek treba naznačiti ugljikov atom na kojem se nalazi dvostruka veza, kao i broj dvostrukih veza. Primjerice, buten, C4H8, ima četiri konstitucijska izomera, a to su četiri različita spoja. (Konstitucijski izomeri su spojevi iste molekulske formule u kojima su atomi povezani različitim redoslijedom zbog čega im se fizička, kemijska i biološka svojstva razlikuju.)
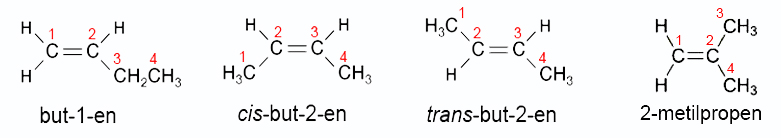
Slika 7.36. Konstitucijski izomeri butena, C4H8
Broj koji označava položaj dvostruke veze piše se između korijena i nastavka –en, od kojih se odvaja crticom. Kod but−1−ena i but−2−ena iz imena možemo zaključiti da najdulji lanac ima četiri ugljikova atoma, dok kod 2−metilpropena najdulji lanac ima tri ugljikova atoma. Kod 2−metilpropena nije potrebno označiti položaj dvostruke veze jer se ona može nalaziti samo između prvog i drugog ugljikova atoma.
Kod razgranatih alkena prvim se brojem označava ugljikov atom na kojem se nalazi razgranatost, kao što je to kod 2−metilpropena, gdje broj dva govori da se na drugom ugljikovom atomu nalazi metilna skupina.
Alkeni u kojima su na ugljikove atome povezane dvostrukom vezom vezane iste skupine čine konfiguracijske stereoizomere. Ova vrst izomerije naziva se još cis−trans izomerijom (lat. cis - s ove strane, trans - s one strane). Uzmimo za primjer but−2−en. Dvije metilne skupine u molekuli but−2−ena mogu biti s iste strane ravnine koja prolazi kroz dvostruku vezu ili na suprotnim stranama, kao što je pokazano na slici 7.37. Kad se metilne skupine nalaze na istoj strani kažemo da su u cis−položaju, a ako su na suprotnim stranama tada su u trans−položaju.
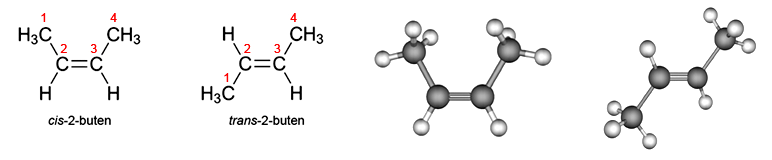
Slika 7.37. Konfiguracijska stereoizomerija (cis-trans izomerija). U molekuli cis−but−2−ena obje se metilne skupine nalaze s iste strane ravnine. U molekuli trans−but−2−ena metilne su skupine na suprotnim stranama ravnine postavljene okomito na dvostruku vezu.
Stereoizomeri imaju istu molekulsku formulu i isti redoslijed vezivanja atoma, ali drukčiji razmještaj atoma u prostoru. Dijelovi molekule međusobno vezani dvostrukom vezom ne mogu rotirati. Energija potrebna za kidanje dvostruke veze naime znatno premašuje energiju termičkog gibanja molekula, pa stoga cis− i trans−izomeri teško prelaze jedni u druge.
Svojstva i karakteristične reakcije alkena. Najjednostavniji alken je eten, CH2=CH2. Polazna je tvar za sintezu mnogih organskih spojeva. Industrijski se dobiva krekiranjem (engl. crack – razbijanje, lomljenje). To je postupak kojim se velike organske molekule iz nafte pri visokoj temperaturi i tlaku cijepaju na manje.
Vidi na internetu: Pokusi iz kemije - Dobivanje i svojstva etena
Zbog dvostrukih veza u molekulama alkeni su vrlo reaktivni. Za njih su karakteristične reakcije adicije pri kojima se neki atom ili skupina atoma veže na ugljikove atome s dvostrukom vezom. Pritom umjesto dvostruke nastaju dvije jednostruke veze. Tako se adicijom vodika na eten dobije etan:
CH2=CH2(g) + H2(g) → CH3−CH3(g).
Reakcija je spora, ali se može ubrzati katalizatorom kao što je nikal, paladij ili platina. Zato se taj proces naziva još i katalitičko hidrogeniranje.
Halogeniranje je proces sličan hidrogeniranju samo što se umjesto vodika na dvostruku vezu veže molekula halogenog elementa:
CH2=CH2(g) + Br2(g) → CH2Br−CH2Br(l).
Adicija halogenvodika na dvostruku vezu odvija se tako da se vodik adira na onaj ugljikov atom koji je vezan s većim brojem vodikovih atoma („tko ima dat će mu se“). To je pravilo 1868. otkrio ruski kemičar Vladimir Vasiljevič Markovnikov pa se njemu u čast naziva Markovnikovljevo pravilo. Adicijom bromovodika na but−1−en nastat će 2−brombutan, a ne 1−brombutan:
CH2=CH−CH2−CH3 + HBr → CH3−CHBr−CH2−CH3.
Polimerizacijom etena dobiva se polieten. Polimerizacija je kemijska reakcija u kojoj se velik broj monomera povezuje kovalentnim vezama u polimere. Dugački lanac nastao spajanjem monomera naziva se polimer.
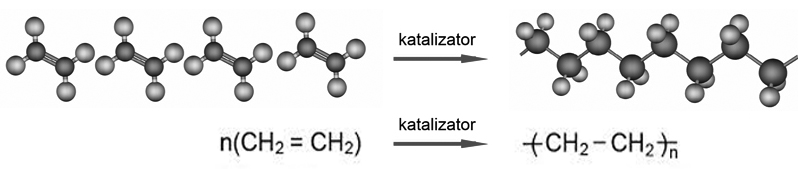
Slika7.38. Shematski prikaz polimerizacije etena
U određenim uvjetima mnogi alkeni, koji sadržavaju terminalne dvostruke veze, mogu se međusobno povezivati u vrlo dugačke molekule koje zovemo adicijski polimeri. U svim polietenima, koji mogu imati različita fizička svojstva, osnovna jedinka koja izgrađuje polimer je eten, CH2=CH2. Nastajanje polimerne molekule temelji se na pretvaranju dvostruke veze u molekulama etena u jednostruke veze u molekulama polietena. Polieten, dobiven pri visokom tlaku (oko 1.000 bara) i povišenoj temperaturi (oko 200 °C) ima razgranatu strukturu pa mu je zato i gustoća mala. To je tzv. polieten niske gustoće (ρ = 0,92 g/mL). Rabi se primjerice za izradu folija. Polimerizacijom etena pri niskom tlaku (oko 70 bar) i niskoj temperaturi (60 do 70 °C) uz katalizator dobije se polieten visoke gustoće ρ = 0,96 g/mL) s linearnim lancima. Rabi se uroizvodnji ambalaže, plinovodnih i vodovodnih cijev i dr.
Vidi na internetu: e-Kemija: Sikirica - Polieten
Eten je biljni hormon (fitohormon). Čemu služi? Banane se beru dok još nisu sazrele. Nezrele banane otpremaju se brodovima prema dalekim odredištima gdje se nakon istovara skladište u komore za dozrijevanje. Dozrijevanje se provodi 24 do 72 sata pri temperaturi 18 do 25 °C u atmosferi koja sadržava 10 do 100 ppm etena (engl. ppm = parts per million = jedan dio na milijun dijelova).
Mnogi prirodni spojevi, naročito oni dobiveni iz bilja, su alkeni s dvije ili više dvostrukih veza. Dvije dvostruke veze mogu se u ugljikovodičnom lancu razmjestiti na više načina. Kumulirane dvostruke veze su dvije dvostruke veze na istom ugljikovom atomu. Ako se dvostruka i jednostruka veza izmjenjuju tako da jednostruka veza slijedi dvostruku i obratno, kaže se da su to konjugirane dvostruke veze. Ako se između dvostrukih veza nalaze dvije ili više jednostrukih veza, onda su takve dvostruke veze izolirane.
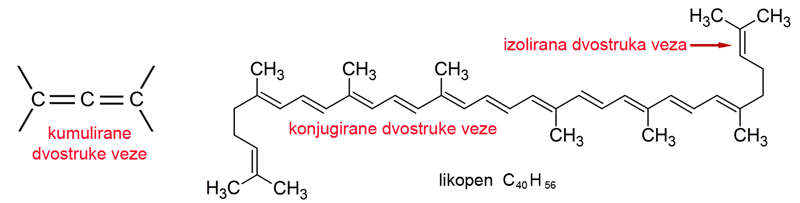
Slika 7.39. Kumulirane, konjugirane i izolirane dvostruke veze
Spojevi s kumuliranim dvostrukim vezama vrlo su rijetki, ali se ipak nalaze u pigmentima nekih algi. Molekule s konjugiranim dvostrukim vezama energijski su stabilnije od molekula s istim brojem izoliranih dvostrukih veza.
Alkeni u prirodi. Mirisi mnogih biljaka su lakohlapljivi spojevi s 10 ili 15 ugljikovih atoma. Ti se spojevi zajedničkim imenom zovu terpeni, a nastali su međusobnim spajanjem dviju ili više tzv. izoprenskih strukturnih jedinki.
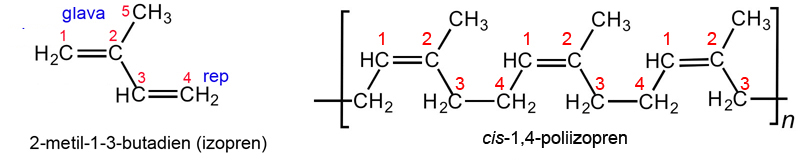
Slika 7.40. 2-metil-1,3-butadien osnovni je sastojak prirodnog kaučuka
Izoprenske jedinke, CH2=C(CH3)−CH=CH2, u molekulama terpena obično su poredane na način "glava-rep", tj. razgranati se završetak jedne izoprenske jedinke veže na nerazgranati završetak druge. Primjerice, limonen iz limunova ulja, mentol iz ulja metvice i geraniol iz ružinog ulja sastoje od dvije izoprenske jedinke međusobno spojene po sistemu "glava-rep". Stoga se molekule terpena mogu u mislima uvijek rastaviti na molekule izoprena. To se pravilo zove „izoprensko pravilo“, a postavio ga je naš nobelovac Leopold Ružička (1887. – 1976.).
Terpeni su najrasprostranjeniji spojevi u biljnom svijetu. Primjerice destilacijom borove smole vodenom parom dobije se terpentin, a zaostala kruta smola zove se kolofonij. Kolofonijem se, na primjer, mažu gudala gudačkih instrumenata.
Izoprenoidi nas mogu oduševiti i svojom bojom. Boja rajčice potječe od likopena, a mrkve od β-karotena. Ti spojevi apsorbiraju svjetlost sustavom konjugiranih dvostrukih veza. Njihovi skeleti od 40 ugljikovih atoma nastaju postupnim vezivanjem izoprenskih jedinki.
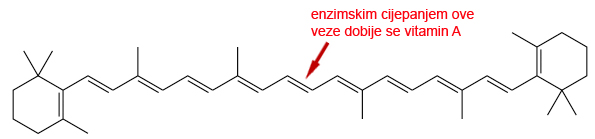
Slika 7.41. β-karoten
Karotenoidi su bitni za vid. β-karoten je preteča retinala, kromofora u svim poznatim pigmentima vida. Kromofor je molekula ili sustav konjugiranih dvostrukih veza unutar neke veće molekule koji može apsorbirati svjetlost.
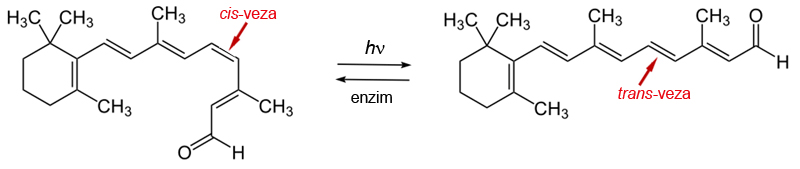
Slika 7.42. Apsorpcijom svjetlosti cis-retinal izomerizira se u trans-retinal. Ta promjena generira električni signal u mrežnici oka. Više doznajte OVDJE.
Fizička svojstva alkena. Molekule alkena nepolarne su građe pa su fizička svojstva alkena slična fizičkim svojstvima alkana. Alkeni s 2, 3 i 4 ugljikova atoma pri sobnoj su temperaturi plinovi. Alkeni s 5 i više ugljikovih atoma su bezbojne tekućine netopljive u vodi, ali topljive u nepolarnim organskim otapalima.
7.5.6. Alkini
Alkini su aciklički nezasićeni ugljikovodici koji u molekuli pored jednostrukih sadržavaju i trostruke veze.
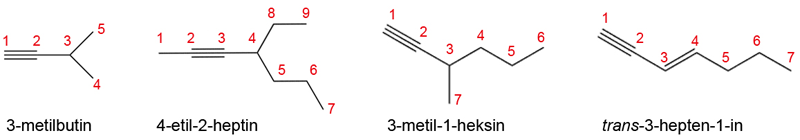
Slika 7.43. Strukturne formule i nazivi nekih alkina
Imena alkina završavaju nastavkom −in, a izvode se na osnovi broja ugljikovih atoma u najduljem lancu koji sadržava trostruku vezu. Ako se u lancu nalazi više trostrukih veza, govorimo o diinima, triinima itd. Mjesto trostruke veze u molekuli označava se brojem tako da ugljikov atom vezan trostrukom vezom dobiva najmanji broj.
Svojstva i karakteristične reakcije alkina. Fizička svojstva alkina slična su svojstvima alkana i alkena. Alkini male relativne molekulske mase pri sobnoj su temperaturi plinovi. Oni s pet i više ugljikovih atoma su tekućine. Alkini su nepolarne građe, pa su kao i alkani i alkeni topljivi u nepolarnim otapalima, a netopljivi u vodi i drugim polarnim otapalima.
Za alkine, kao i za alkene, karakteristične su reakcije adicije. Primjerice, adicijom jedne molekule broma na etin nastaje trans−1,2−dibrometen, a adicijom još jedne molekule broma nastaje 1,1,2,2−tetrabrometan.
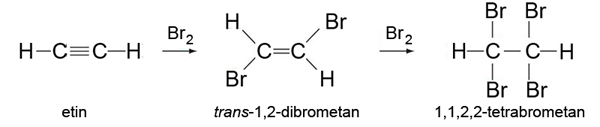
Slika 7.44. Adicija broma na etin
Primjena etina. Pod povišenim tlakom etin je u tekućem stanju i osjetljiv na udarac pa se eksplozivno raspada na elementarni ugljik i vodik uz oslobađanje topline:
C2H2(g) → 2C(s) + H2(g) ∆H = –228 kJ/mol.
Etin se transportira u čeličnim bocama (obojenim bijelo) otopljen u acetonu (propan-2-on, CH3-CO-CH3) pod tlakom 15 bara. Boce su ispunjene molekulskim sitima ili infuzorijskom zemljom. Molekulska sita su sintetički zeoliti koji zbog mnogobrojnih pora i kanala u strukturi mogu apsorbirati velike količine plinova i tekućina. Etin se naveliko primjenjuje za autogeno zavarivanje metala. Uz obilan dostup kisika etin izgara plavičastim plamenom u acetilenskom plameniku:
2 C2H2(g) + 5 O2(g) → 4 CO2(g) + 2 H2O(l) ∆H = –2.599 kJ/mol.
Temperatura plamena premašuje 3.000 ºC pa se rabi za rezanje čeličnih ploča u brodogradnji, za zavarivanje željeznih cijevi pri uvođenju plinovodnih instalacija i dr. Za rezanje čelika plamen se ugodi tako da ima više kisika od stehiometrijskog omjera acetilana i kisika (acetilen : kisik = 2:5), tako da željezo u njemu izgara.
O svojstvima smjesa etina i kisika doznajte više na adresi:
Etin je polazna sirovina za dobivanje mnogih važnih organskih spojeva, od octene kiseline do spojeva za proizvodnju sintetičkog kaučuka. Adicijom jednog mola klorovodika na jedan mol etina dobije se vinil-klorid, H2C=CHCl, koji se naveliko rabi u proizvodnji poli(vinil-klorida), PVC:
HC≡CH + HCl → H2C=CHCl.
Adicijom vode na etin dobije se etanal CH3-CHO, (acetaldehid):
HC≡CH + H2O + (kat. H2SO4 + HgSO4) → [H2C=CHOH] → CH3−CHO.
Adicijom vode na propin dobije se propanon (aceton), CH3−CO−CH3, organsko otapalo koje se između ostalog rabi za odstranjivanje laka za nokte:
CH3−C≡CH + H2O + (kat. H2SO4 + HgSO4) → [H3C−C(OH)=CH2] → CH3−CO−CH3.
7.5.7. Aromatski ugljikovodici
Aromatski ugljikovodici ili areni posebna su skupina ugljikovodika karakteristične građe. Najpoznatiji im je predstavnik benzen, C6H6.
Benzen je 1825. godine otkrio Michael Faraday (1791.- 1867.), ali se na određivanje njegove strukture čekalo četrdeset godina. Godine 1865. Friedrich A. Kekulé (1829. – 1896.) pretpostavio je da je struktura benzena prstenasta, navodno nakon što je sanjao zmije koje plešu i grizu same sebi rep. Poznata je njegova izreka: „Učimo sanjati, moja gospodo! Tako ćemo vjerojatno naći istinu, ali čuvajmo se objave naših snova prije nego ih provjerimo budnim razumom.“ (Čini se da je Kekulé tu zgodu izmislio jer je bio ojađen činjenicom da se organizator nije potrudio da pronađe stenografa za njegovo predavanje. Pa kad vam nije važno što ću govoriti, mislio je njemački kemičar, onda mogu pričati i gluposti!)
Slika 7.45. a) Kekuléova strukturna formula benzena. Dvostrana strelica je znak za rezonanciju, što znači da je prava struktura rezonantni hibrid između obje prikazane strukture. b) Ovako su se suvremenici šalili s Kekuléovom strukturom benzena.
Kekulé je pretpostavio da je šest ugljikovih atoma povezano u prsten naizmjence dvostrukim i jednostrukim vezama. Na svakom od ugljikovih atoma vezan je po jedan vodikov atom. Tek je 1925. Kathleen Lonsdale (1903. – 1971.) rendgenskom strukturnom analizom dokazala da su atomi ugljika povezani u planaran šesteročlani prsten te odredila njegove dimenzije. Iz dobivenih rezultata proizlazi da su ugljikovi atomi u benzenu povezani kovalentnom vezom koja nije ni jednostruka ni dvostruka. Naime, jednostruka kovalentna veza između atoma ugljika duga je 154 pm, a dvostruka 134 pm. U benzenu su sve veze između ugljikovih atoma jednake duljine, 140 pm. Ugljik ima 4 valentna elektrona. Tri su elektrona uključena u jednostruke kovalentne veze s dva susjedna atoma ugljika i atomom vodika. Četvrti elektron je "delokaliziran", tj. sudjeluje u stvaranju zajedničkog elektronskog oblaka od šest elektrona (od šest atoma ugljika). Oblak od šest delokaliziranih elektrona rasprostire se iznad i ispod ravnine ugljikovih atoma te ih tako povezuje.
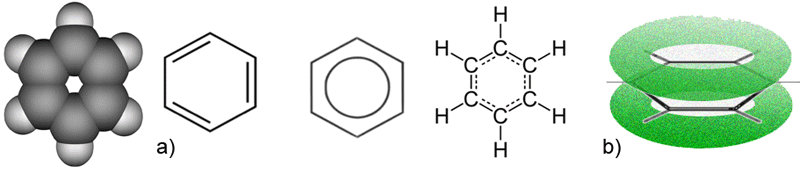
Slika 7.46. a) Model i uobičajeni shematski prikazi građe molekule benzena i drugih aromatskih spojeva. Iako na shematskim prikazima benzenske jezgre vodikovi atomi nisu prikazani, podrazumijeva se da su oni vezani na ugljikove atome. b) Oblak od šest delokaliziranih elektrona rasprostire se iznad i ispod ravnine ugljikovih atoma.
Rezultat delokalizacije elektrona je energijski stabilnija struktura pa je zato benzen slabo reaktivan spoj. Energija rezonancije molekule benzena može se odrediti tako da se izmjeri entalpija hidrogeniranja benzena i usporedi s entalpijom hidrogeniranja cikloheksena. Cikloheksen, C6H10, može se reducirati u cikloheksan vodikom uz prisustvo spužvaste platine ili nikla kao katalizatora:
C6H10 + H2 → C6H12 ΔrH = −120 kJ mol−1.
Redukcija benzena u cikloheksan odvija se pod mnogo većim tlakom i uz povišenu temperaturu:
C6H6 + 3 H2 → C6H12 ΔrH = −208 kJ mol−1.
Kad bi benzen sadržavao tri
dvostruke veze, tj. imao hipotetsku strukturu 1,3,5-cikloheksatriena, njegova
entalpija hidrogeniranja morala bi iznositi 3![]() (−120 kJ mol−1) = −360 kJ mol−1. Mjerenja pokazuju da je entalpija
hidrogeniranja benzena 208 kJ mol−1, što znači da je molekula benzena energijski
stabilnija od hipotetske molekule 1,3,5-cikloheksatriena s tri dvostruke veze u
šesteročlanom prstenu. Razlika energije od 152 kJ/mol zove se energija
stabilizacije ili energija rezonancije benzena.
(−120 kJ mol−1) = −360 kJ mol−1. Mjerenja pokazuju da je entalpija
hidrogeniranja benzena 208 kJ mol−1, što znači da je molekula benzena energijski
stabilnija od hipotetske molekule 1,3,5-cikloheksatriena s tri dvostruke veze u
šesteročlanom prstenu. Razlika energije od 152 kJ/mol zove se energija
stabilizacije ili energija rezonancije benzena.
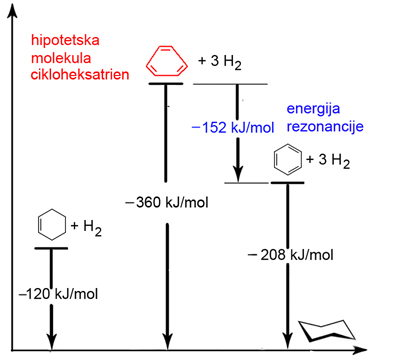
Slika 7.47. Entalpijski dijagram hidrogeniranja cikloheksena i benzena. Molekula benzena je za 152 kJ/mol stabilnija od hipotetske molekule 1,3,5-cikloheksatriena.
Kemijska svojstva benzena. Benzen i drugi aromatski spojevi nezasićeni su ugljikovodici. Zbog naročite vrste veze, koja proizlazi iz delokalizacije elektrona, molekule aromatskih ugljikovodika izuzetno su stabilne. Dok alkeni i alkini obezboje otopinu broma ili kalijeva permanganata, pri čemu dolazi do adicije na dvostruke i trostruke veze, benzen ne reagira s otopinom kalijeva permanganata. Za benzen i druge aromatske spojeve karakteristične su reakcije supstitucije. S bromom benzen reagira samo uz željezne strugotine kao katalizator. Pritom se vodikov atom na benzenskoj jezgri supstituira bromom pa nastaje brombenzen i bromovodik.
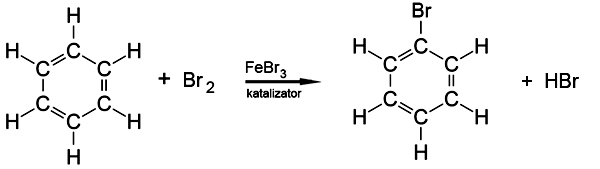
Slika 7.48. Bromiranje benzena je reakcija supstitucije pri kojoj nastaje brombenzen i bromovodik
Ako se dva vodikova atoma supstituiraju bromom dobiva se dibrombenzen. Pritom nastaju tri izomera. Označe li se ugljikovi atomi brojevima, tako da supstituenti dobiju što niže brojeve, ti će se derivati zvati:
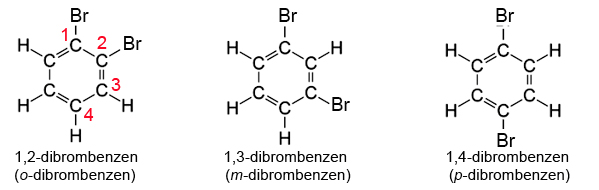
Slika 7.49. Dibrombenzen
Prefiksi o− (grč. orthos − ravan), m− (grč. meta − između) i p− (grč. para − protiv) i označavaju relativne položaje supstituenata, u našem slučaju atoma broma, na benzenskom prstenu.
Ako se smjesa benzena i klora osvijetli UV zrakama, dolazi do adicije šest atoma klora pri čemu nastaje smjesa od devet stereoizomera heksaklorcikloheksana. Dobivanje heksaklorcikloheksana prvi je objavio Faraday 1825. u publikaciji o izolaciji benzena. Gama-izomer heksaklorcikloheksana ima najjača insekticidna svojstva te se pod imenom lindan dugo rabio kao insekticid za usjeve voća i povrća, za tretiranje sjemena, u šumarstvu te, liječenje stoke i kućnih ljubimaca. Zabranjen je 2009. godine, ali se i danas u malim koncentracijama nalazi u kremama i šamponima za liječenje svraba i ušljivosti.
Slika 7.50. Gama-heksaklorcikloheksan, insekticid poznat pod imenom lindan
Hidrogeniranje benzena može se izvesti uz katalizator pri povišenom tlaku i temperaturi, pri čemu nastaje cikloheksan, zasićeni ciklički ugljikovodik. Reakcija je reverzibilna pa se danas benzen, toluen (metilbenzen) i ksilen (dimetilbenzen) dobivaju iz cikloheksana prisutnog u nafti.
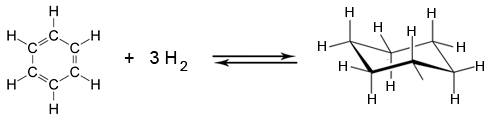
Slika 7.51. Hidrogeniranje benzena
Nitriranjem benzena smjesom koncentrirane dušične i sumporne kiseline nastaju nitrobenzen, dinitrobenzen i trinitrobenzen, važni polazni spojevi za sinteze mnogih organskih spojeva, ali i eksploziva. Nitriranjem metilbenzena dobije se snažan eksploziv 2,4,6−trinitrotoluen, poznatiji po kratici TNT ili imenu trotil.
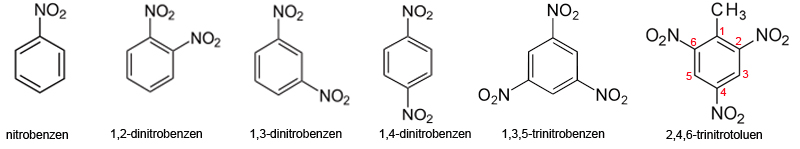
Slika 7.52. Produkti nitriranja benzena. Nitriranjem toluena dobije se eksploziv poznat kao trotil ili kraće TNT.
Osim benzena poznato je mnogo aromatskih spojeva koji mogu biti karbociklični ili heterociklički, te s kondenziranim (sraštenim) aromatskim prstenima. Naftalen, fenantren, benzo[a]piren, samo su neki primjeri policikličkih aromatskih ugljikovodika.
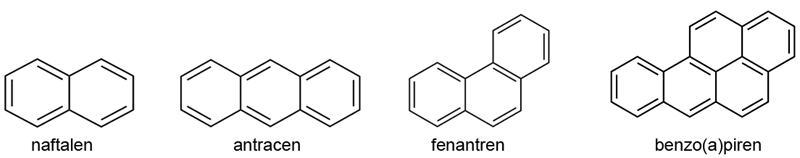
Slika 7.53. Policiklički aromatski ugljikovodici
Policiklički aromatski ugljikovodici nalaze se u najvećim količinama u čađi i dimu. Većina policikličkih aromatskih ugljikovodika je kancerogena (lat. cancer − rak + grč. genos − rod ), tj. izaziva rak.
Pomorske havarije i njihov utjecaj na okoliš. Primjeri izlijevanja nafte. Razmislite gdje završava nafta nakon „čišćenja naftnih mrlja“.
Pronađite znanstvene radove koji se bave problemime onečišćenja mora mikroplastikom. Kakav je utjecaj mikroplastike na morsku faunu i floru?
Upoznajte postupke recikliranja plastičnih materijala.
Upoznjte utjecaj na ekosustav i zdravlje bisfenola A (BPA), ftalata i drugih omekšivača za plastiku.
Pesticidi i njihov utjecaj na ekosustave. Pesticidi u hrani i vodi.
Izradite plakat, PowerPoint prezentaciju, snimite video, održite predavanje u razredu, organizirajte raspravu, pišite u školskom listu ili pokrenite neku aktivnost u vezi odabrane teme.
7.6. Silicij
Najzastupljeniji elementi u Zemljinoj kori jesu kisik, ≈47 %, silicij, ≈28 %, i aluminij, ≈8 %, dok su alumosilikati najzastupljeniji minerali u Zemljinoj kori. Tlo na kojem rastu šume, uzgajamo žitarice, voće i povrće, po kojem hodamo i gradimo naše kuće i gradove sastoji se od spojeva silicija.
Elementarni silicij je polumetal, tj. njegova su fizička svojstva između metala i nemetala. Ima visoko talište, 1.414 °C, i metalni sjaj, ali slabo provodi električnu struju i toplinu. Općenito, polumetali su bolji vodiči električne struje i topline od nemetala, ali ne tako dobri kao metali. Za razliku od metala kod kojih se povišenjem temperature smanjuju električna provodnost, kod polumetala događa se suprotno. Polumetali pri višoj temperaturi bolje provode električnu struju.
Silicij se dobiva taljenjem smjese kvarcnog pijeska i koksa u elektrolučnoj peći pri 1.500 do 2.000 °C:
SiO2(l) + 2 C(s) → Si(l) + 2 CO(g).
Tako se dobiva sirovi, tj. 98-postotni silicij. Pritom treba paziti na omjer kvarcnog pijeska i koksa jer će uz suviše koksa nastati silicijev karbid, SiC.
Čisti silicij danas je najvažniji polumetal jer se od njega proizvode elektroničke komponente kao što su ispravljačke diode, tranzistori, čipovi, procesori i dr. Stoga se sirovi, 98-postotni silicij, mora pročistiti nizom postupaka. Primjerice, reakcijom s klorom dobiva se silicijev tetraklorid, SiCl4, lakohlapljiva tekućina koja ključa već pri 58 °C:
Silicijev tetraklorid se dalje pročišćava višestrukom destilacijom a potom redukcijom vodikom prevodi u čist silicij:
SiCl4(g) + H2(g) → Si(s) + 4 HCl(g).
Najčistiji silicij dobiva se pirolizom silana, SiH4:
Za primjenu u proizvodnji elektroničkih komponenata silicij se mora dalje pročišćavati, sve do čistoće od 99,999999999 %. Kad se dobije dovoljno čist silicij od njega se moraju načiniti monokristali. Njih zatim režu u tanke pločice koje se zovu waferi. Više doznajte OVDJE.
7.6.1. Ferosilicij
Ferosilicij je slitina silicija i željeza. Dobiva se taljenjem smjese kvarcnog pijeska, koksa i željezove rude ili staroga željeza u elektrolučnoj peći pri 1.500 do 2.000 °C. Obično se proizvode slitine koje sadržavaju 15, 45, 75 i 90 % silicija. Ferosilicij se još od 1880. rabi kao sredstvo za deoksidaciju pri proizvodnji čelika. Naime, silicij se lako spaja s kisikom pri čemu nastaje silicijev dioksid uz oslobađanje topline. To je korisno za proces rafiniranja željeza jer se time povisi temperatura taline.
Ima još jedna nadasve zanimljiva primjena ferosilicija. On se rabio za punjenje balona vodikom. Pomiješao bi se s natronskim vapnom, smjesom natrijeva i kalcijeva hidroksida, pri čemu je silicij, zbog amfoternosti, reagirao s hidroksidima:
Si + Ca(OH)2 + 2 NaOH → Na2CaSiO4 + 2 H2.
Takvim se postupkom dobivao vodik na suh način, pa kapljice sumporne kiseline – kao kod postupka reakcije sumporne kiseline i cinka – ili neke druge korozivne tekućine nisu mogle oštećivati balonsku svilu.
7.6.2. Silikati
U prirodi silicij dolazi vezan u raznovrsnim mineralima, primjerice kvarcu, SiO2, silikatima i alumosilikatima. Cigla, crijep, porculan, staklo, cement, azbest, talk i najobičnija ilovača, sve su to od reda silikati ili njihove smjese.
Silikati su soli hipotetske silicijeve kiseline, Si(OH)4. Ta se kiselina ne može izolirati, ali se o njezinoj strukturi može zaključivati na osnovi svojstava njezinih soli, silikata. Silikatnu kiselinu zamišljamo kao pravilan tetraedar s atomom silicija u središtu i skupinama OH− na vrhovima. Minerali, soli silikatne kiseline, koji sadržavaju izolirane ione SiO44−, poput cirkona, ZrSiO4, topaza, Al2(F,OH)2SiO4, i olivina, (Mg2+,Fe2+)2SiO4, nazivaju se nezosilikatima.
Slika 7.54. Jedinične ćelije kristalnih struktura a) titanita, CaTiSiO5, i b) topaza, Al2(F,OH)2SiO4, sadržavaju izolirane tetraedre SiO4, tj. izolirane ione [SiO4]4−. Uočite da su titan i aluminij u kristalnim strukturama koordinirani sa šest atoma kisika.
Možemo zamisliti da se molekule Si(OH)4 međusobno polimeriziraju uz izdvajanje molekula vode.

Slika 7.55. Shematski prikaz polimerizacije hipotetske silicijeve kiseline, Si(OH)4. Dva tetraedara SiO4 međusobno spojena zajedničkim vrhom tvore anione [Si2O7]6−. Nalazimo ih primjerice u strukturi minerala hemimorfita, Zn4(Si2O7)(OH)2·H2O.
Slika 7.56. Jedinična ćelija kristalne strukture hemimorfita, Zn4(Si2O7)(OH)2·H2O, sadržava dva SiO4-tetraedra spojena preko zajedničkog kisika, tj. anione [Si2O7]6−. Minerali koji sadržavaju dva tetraedra povezana preko zajedničkog kisika nazivaju se sorosilikatima.
Tri, četiri ili šest SiO4-tetraedara može se povezati u prstenaste strukture. Silikati s prstenastim strukturama nazivaju se ciklosilikatima.
Slika 7.57. U benitoitu, BaTiSi3O9, tri tetraedra SiO4 međusobno povezana preko zajedničkih atoma kisika čine ione [Si3O9]6−. Četiri međusobno povezana tetraedra SiO4 u bavsiitu, Ba2V2O2[Si4O12], tvore anione [Si4O12]8−. U berilu, Be3Al2Si6O18, šest je tetraedara SiO4 povezano u prsten [Si6O18]12−.
Možemo zamisliti da se tetraedri SiO4 međusobno povezuju u beskonačne lance, vrpce, slojevi ili trodimenzijske mreže. Primjerice mineral enstatit, Mg2[Si2O6], izgrađen je od beskonačnih lanaca međusobno povezanih tetraedara SiO4.
Slika 7.58. a) Beskonačan lanac međusobno povezanih tetraedara SiO4. Tetraedri su međusobno povezani zajedničkim vrhovima, pa su samo dva atoma kisika "slobodna", odnosno nose negativni naboj. Empirijska formula tog polianiona jest [Si2O6]4−. U enstatitu taj negativni naboj neutraliziraju ioni Mg2+. b) Dva lanca tetraedara SiO4 mogu se spojiti tako da tvore vrpcu ili dvostruki lanac. Empirijska formula ovog polianiona je [Si4O11]6−. Minerali koji sadržavaju jednostruke ili dvostruke beskonačne lance tetraedara SiO4, povezanih preko zajedničkog kisika nazivaju se inosilikatima
Slika 7.59. Jedinična ćelija kristalne strukture diopsida, CaMgSi2O6. Uočite beskonačne lance polianiona [Si2O6]4− koji se protežu uzduž oci c.
Slika 7.60. tetraedari SiO4 mogu se povezati u beskonačni sloj preko tri zajednička atoma kisika. Samo jedan "slobodan" kisik svakog tetraedra iz sloja izlazi na istu stranu te nosi negativan električni naboj. Na njih se vežu kationi i hidroksidni ioni koji povezuju slojeve. Empirijska formula ovog kompleksnog aniona je [Si4O10]4− Takvu slojevitu građu imaju minerali talk (milovka), Mg3[Si4O10(OH)2], muskovit, KAl2[ASi3lO10(OH,F)2], mineral iz skupine tinjaca, i mnogi drugi minerali. Tinjci (liskuni) lako se kalaju u tanke prozirne listiće, što je posljedica njihove slojevite strukture. Minerali koji sadržavaju beskonačne slojeve tetraedara SiO4, nazivaju se filosilikatima.
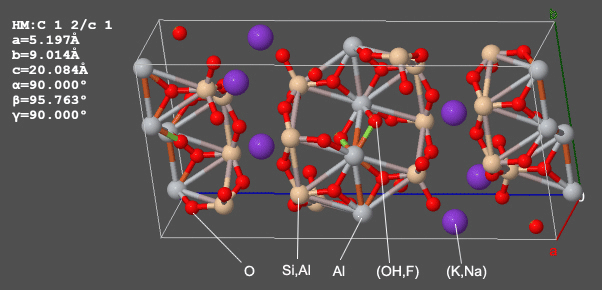
Slika 7.61. Jedinična ćelija kristalne strukture muskovita, KAl2[Si3AlO10(OH,F)2]. Četvrtina tetraedara SiO4 zamijenjena je tetraedrima AlO4. Stoga alumosilikatni slojevi imaju negativan električni naboj. Strukturu možemo opisati kao sendvič od negativno nabijenih alumosilikatnih slojeva između kojih se nalaze kationi koji neutraliziraju njihov negativni naboj. Ime muskovit dobio je prema engl. Muscovy-glass, jer se u srednjovjekovnoj Rusiji (Moskva) rabio kao jeftinija alternativa prozorskom staklu. Listovi muskovita 5 metara × 3 metra pronađeni su u Nelloreu u Indiji.
Zamislimo li da se proces povezivanja tetraedara SiO4 nastavlja, dobit ćemo trodimenzijsku strukturu u kojoj je svaki atom silicija vezan sa četiri atoma kisika. Konačan produkt takve kondenzacije ima kemijski sastav koji možemo opisati formulom SiO2, a to je anhidrid silicijeve kiseline, Si(OH)4, bolje poznat kao kvarc. U njegovoj je strukturi svaki atom silicija okružen sa četiri atoma kisika, tj. svaki je atom kisika podijeljen između dva atoma silicija.

Slika 7.62. Kristalna struktura i kristali kvarca, SiO2. Svaki je atom silicija vezan sa četiri atoma kisika koje dijeli s drugim atomima silicija. Radi lakšeg razumijevanja kako su tetraedri SiO4 međusobno povezuju, na slici su prikazane četiri jedinične ćelije projicirane uzduž osi c.
Često je dio atoma silicija zamijenjen atomima aluminija. Zamjenom četverovalentnih silicijevih atoma trovalentnim aluminijevim atomima u mreži međusobno povezanih tetraedara SiO4 nastaju anioni, primjerice [AlSiO4]− i [AlSi3O8]−. Njihov naboj neutraliziraju ioni alkalijskih ili zemnoalkalijskih metala kao u ortoklasu, KAlSi3O8, anortitu, CaAl2Si2O8 i dr. Minerali u kojima je dio tetraedara SiO4 zamijenjen tetraedrima AlO4 nazivaju se alumosilikatima. Oni čine gotovo 75 % Zemljine kore. Minerali s trodimenzijskom strukturom međusobno povezanih tetraedara SiO4 nazivaju se tektosilikatima.
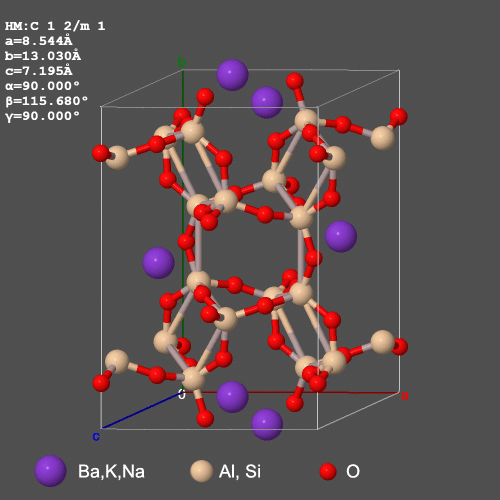
Slika 7.63. Jedinična ćelija kristalne strukture ortoklasa, (Ba,Na,K)AlSi3O8. Uočite mrežu međusobno povezanih tetraedara (Al,Si)O4.
7.6.3. Glina
Gline su sedimenti sitnih čestica minerala nastalih trošenjem eruptivnih stijena Zemljine kore. Smatra se da gline (glinena tla i glinene stijene) čine oko 70 % svih sedimentnih stijena. Sastoje se od vrlo sitnih do koloidnih čestica minerala gline: kaolinita, ilita, montmorilonita… Svi minerali gline imaju sličan kemijski sastav, slojevitu strukturu (filosilikati) i velik afinitet prema vodi. Većina ih ima strukturu "sendviča", tj. dva alumosilikatna sloja između kojih se nalaze kationi koji neutraliziraju negativni naboj alumosilikatnih slojeva. Kationi su najčešće koordinirani (okruženi) molekulama vode. Kationi, anioni i vada mogu reverzibilno ulaziti i izlaziti između slojeva. Stoga suha glina bubri kad ju se nakvasi vodom.
Minerali gline se mogu podijeliti u skupine ovisno o načinu pakiranja tetraedarskih i oktaedarskih ploča u slojeve. Ako u svakom sloju postoji samo jedna tetraedarska i jedna oktaedarska ploča, onda pripadaju skupini 1:1. Alternativa, poznata kao glina 2:1, ima dvije tetraedarske ploče usmjerene jedna prema drugoj tako da tvore nasuprotne strane oktaedarske ploče. Negativni naboj tetraedarskih ploča kompenziran je pozitivnim nabojem oktaedarskih ploča koje sadržavaju katione, kao što su Al3+, Mg2+ i Fe2+.
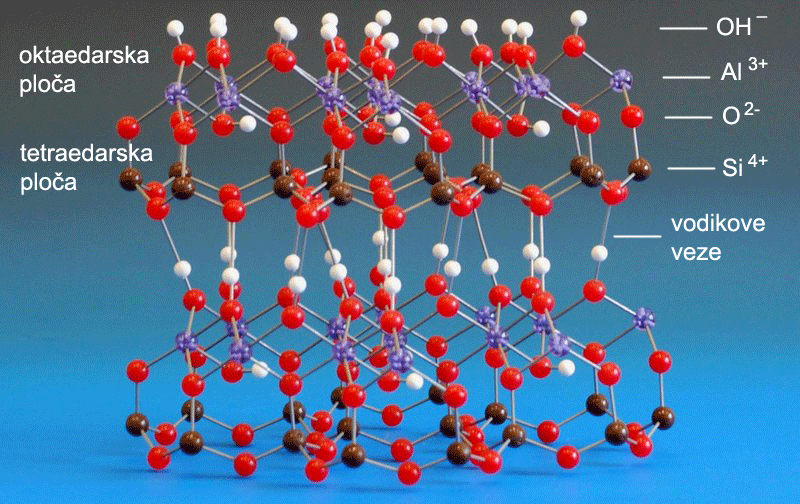
Slika 7.64. Model
kristalne strukture kaolinita, Al2(OH)4Si2O5. Autor: Dr. Gavin Whittaker,
Miramodus ltd.
Slika
izvor: en.wikipedia/Kaolinite
Kaolinit, Al2(OH)4Si2O5, najvažniji je mineral u kaolinu i glini. Nastao je trošenjem feldšpata (glinenaca) i alumosilikata. Slojevite je 1:1 građe. Slojevi su međusobno povezani vodikovim vezama. Ne upija vodu, pa ne bubri u doticaju s vodom. Stoga je kaolin (bijela glina) najbolja vrsta gline od koje se radi porculan. Kaolin onečišćen željezovim oksidima je crven, a može biti plave ili smeđe boje, ovisno o vrsti onečišćenja.
Montmorinolit pripada skupini smektita, tj. 2:1 glina. Sastoji se od dvije tetraedarske ploče usmjerene jedna prema drugoj tako da tvore nasuprotne strane oktaedarske ploče. Ime je dobio po Montmorillonu u Francuskoj. Najvažnije svojstvo smektitne skupine minerala je sposobnost apsorpcije molekula vode između TOT-slojeva. To dovodi do povećanja volumena minerala u doticaju s vodom, stoga gline bubre u vodi.
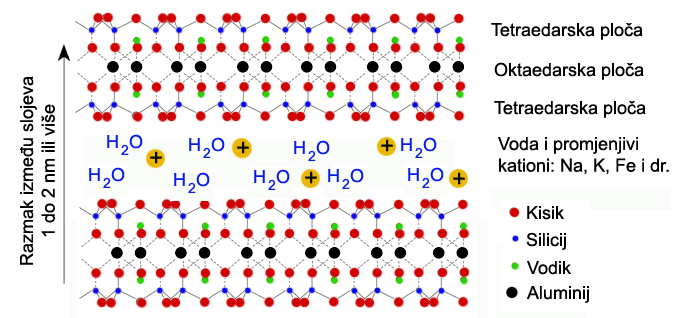
Slika 7.65. Građa montmorilonita (Na,Ca)0,33(Al,Mg)2Si4O10(OH)2∙nH2O.
Slika izvor: en.wikipedia/Montmorillonite
Smektiti imaju značajnu tehničku i industrijsku primjenu. Primjerice, bentonit, koji se sastoji uglavnom od montmorinolita, rabi se za izgradnju prepreka protiv različitih onečišćenja, poput visoko radioaktivnih naslaga, odlagališta otpada i onečišćenog tla. Zbog svojih apsorpcijskih i adsorpcijskih svojstava primjenjuje se u industriji boja, papira, u prehrambenoj industrija, ljevaonicama, za pročišćavanje otpadnih voda, kao aditiv u deterdžentima i dr. Zbog svojih reoloških svojstava, rabi se u tekućinama za bušenje nafte i sl. Bentonit se rabi za bistrenje vina, u kozmetici za obloge za čišćenje kože i maske za lice, a u granulama veličine 1 do 3 mm kao stelja za mačke. U doticaju s vlagom i mačjim izmetom granule se zgrudaju. Grude se mogu lako ukloniti i odložiti u miješani komunalni otpad. Bentonit, tj. pijesak za mačke, ne smije se odlagati u zahod jer se s vodom stvrdnjava pa može začepiti kanalizacijske cijevi.
Montmorilonit ima katatalitička svojstva, pa se smatra da je bio presudan za postanak života na Zemlji (a možda i na Marsu) jer je na njemu došlo do prve sinteze nukleinskih kiselina. Više doznajte u časopisu Kemija u industriji u članku: Catalysis in the Primordial World
7.6.4. Azbest
Azbest je niz minerala vlaknaste strukture čija je osnovna građevna jedinka beskonačna vrpca [Si4O11]6−. Nekad je imao veliku industrijsku primjenu kao izolacijski i građevinski materijal. Pokazalo se da je azbest kancerogen jer se njegova vlakna zabiju u plućno tkivo i ne mogu se iskašljati. Zato je zabranjena njegova upotreba. U nas još uvijek nažalost ima mnogo krovova kuća i tvorničkih hala prekrivenih pločama od salonita. Salonit se proizvodio od azbesta i cementa, a ime je dobio prema Saloni, starom imenu za Solin pokraj Splita. Potreban je naročit oprez i zaštita dišnih organa kod rezanja, obrade i zbrinjavanja proizvoda koji sadržavaju azbest.
7.6.5. Zeoliti
Zeoliti su alumosilikati građeni tako da tetraedri SiO4 i AlO4 tvore skelet s prazninama u obliku kanala ili kaveza. Skelet ima negativan električni naboj jer aluminij ima jedan elektron manje od silicija. Taj negativni naboj neutraliziraju hidratizirani kationi koji se smještaju u šupljine i kanale u strukturi. Šupljine i kanali veći su od promjera kationa pa se oni mogu premještati s jednog mjesta na drugo, a to znači putovati od središta kristala prema rubu i obratno, a da pritom ne dolazi do razaranja alumosilikatnog skeleta. Zeoliti se najviše primjenjuju za čišćenje prirodnoga plina, za sušenje nafte i naftnih destilata, u demineralizaciji vode, kao katalizatori petrokemijskih procesa, kao punilo za papir, u proizvodnji izolacijskog i lakoga građevnog materijala. Primjenjuju se u puljoprivredi za poboljšanje strukture tla, u stočarstvu i peradarstvu dodaju se hrani radi poboljšnja probave i dr. Zeoliti se rabe i za omekšavanje vode. Kad tvrda voda, koja sadržava ione Ca2+, ispire zeolit, ioni Na+ prelaze iz zeolita u otopinu a na njihovo mjesto dolazi odgovarajući broj iona Ca2+. Obratno, kad se zeolit, koji sadržava katione Ca2+, ispire koncentriranom otopinom natrijeva klorida, ioni Ca2+ prelaze u otopinu a na njihovo mjesto dolazi odgovarajući broj iona Na+ iz otopine natrijeva klorida.
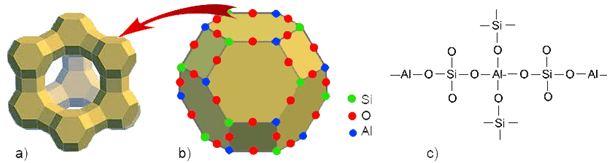
Slika 7.66. a) Shematski prikaz alumosilikatnog skeleta nekih zeolita. Uočite velik kavez (šupljinu) unutar alumosilikatnog skeleta. b) Strukturna osnovne jedinke zeolita. c) tetraedri SiO4 i AlO4 tvore alumosilikatni skelet zeolita. Zeolita ima mnogo vrsta, a svaki od njih ima drukčiju mrežu tetraedara SiO4 i AlO4. Od drugih ih je alumosilikata lako razlikovati po tome što sadržavaju kristalizacijsku vodu.
7.6.6. Staklo
Staklo je materijal koji čovjek odavno poznaje. Isprva se rabilo za izradu nakita. U Zadru postoji muzej rimskog stakla. Posjetite ga! Danas se proizvodi više od 800 vrsta stakla.

Slika 7.67. Primjerci posuda u Zadarskom muzeju rimskog stakla. Posebno
su zanimljive male staklene bočice kratka tijela s
izduženim vratom - lakrimarij (latinski lacrima: suza). Služile su za
pohranu mirisa i balzama korištenih u pogrebnim obredima. Čest su prilog u
rimskim i ranokršćanskim grobovima, te se pogrešno mislilo da su služile za
skupljanje suza za pokojnikom.
Slika izvor: museum-of-ancient-glass-zadar
Staklo se nalazi i u prirodi. Ono nastaje naglim hlađenjem rastaljenih silikatnih stijena. Naglim hlađenjem lave nastaje opsidijan. Pri padu velikih meteorita, dio njihove mase i okolnih stijena rastali se, rasprši i bzo skrutne, pa poput kišnih kapi pada na zemlju. Tako nastaju tektiti, stvrdnute kapi prirodnoga stakla.
Što je staklo i kako nastaje u prirodi doznajte u članku:
Slika 7.68. Struktura stakla: a) Shematski prikaz uređenog razmještaja tetraedara SiO4 u kristalnoj strukturi kvarca. b) U kvarcnom staklu tetraedri SiO4 su razmješteni nasumce, kao u tekućini, pa je kvarcno staklo amorfno, kao i sva druga stakla. c) U običnom staklu, ioni natrija (žuto) i kalcija (crveno) neutraliziraju negativni naboj pokidane mreže tetraedara SiO4.
Kvarcno staklo se dobiva taljenjem čistoga kvarca, silicijeva dioksida (SiO2). Čisti silicijev dioksid tali se pri 1.713 °C. Zbog visokog tališta kvarcno se staklo teško obrađuje a i vrlo je skupo. Unatoč tomu, zbog velike otpornosti prema kemijskim agensima i malog koeficijenta toplinskog širenja, zbog čega ne puca pri naglom grijanju i hlađenju, posude i pribori od kvarcnog stakla vrlo su cijenjeni u kemijskoj industriji i laboratoriju. Usijanu cijev, laboratorijski lončić ili zdjelicu od kvarcnog stakla može se bez štete uroniti u hladnu vodu. (Pokušaj to učiniti s običnim staklom!) Kvarcno staklo propušta ultraljubičaste zrake, pa se od njega izrađuju pribori za rad s ultraljubičastim zrakama, primjerice kvarc-lampe. U naše vrijeme važna je upotreba kvarcnog stakla je za svjetlovode. Svjetlovodi su niti od kvarcnog stakla promjera 0,125 mm. Kako se izvlače kvarcne niti za svjetlovode doznajte OVDJE, OVDJE i OVDJE.
Obično staklo, od kojeg se izrađuju boce i prozorska stakla, dobiva se taljenjem smjese kvarcnoga pijeska, kalcijeva oksida (živog vapna) i natrijeva karbonata (sode). Takvo staklo najčešće sadržava 75 % SiO2, 15 % Na2O i 10 % CaO. Laboratorijsko i kuhinjsko posuđe izrađuju se od borosilikatnog stakla. Ono je otporno na nagle promjene temperature (vatrostalno staklo). Borosilikatno staklo obično sadržava 60 do 80 % SiO2, 4 % Na2O, 10 do 25% B2O3 i oko 2 % Al2O3. Ako se u običnom staklu dio kalcijeva oksida zamijeni olovovim(II) oksidom dobiva se lakotaljivo „kristalno“ ili olovovo staklo. Ima velik indeks loma svjetlosti pa se od njega izrađuju dijelovi optičkih instrumenata, leće, ali i ukrasni te umjetnički brušeni predmeti kao što su vaze, čaše i slično.
Obojeno staklo dobiva se malim dodacima oksida prijelaznih metala. Dodatak FeO boji staklo zeleno, Fe2O3 crvenosmeđe, CoAl2O4 plavo, a CuO tirkizno. Zlato staklu daje tamnocrvenu boju, SnO2 ga čini bijelim i neprozirnim („mliječno staklo“. Iako se na prvi pogled čini da je staklo homogenog sastava, pod elektronskim mikroskopom opaža se staklasta matrica u koju su uklopljene „kapljice“ drukčijeg kemijskog sastava. Naime, staklo je sklono kristalizaciji, to više što je udio CaO veći. Pri proizvodnji predmeta od stakla kristalizaciju treba izbjeći, pa se nakon puhanja ili lijevanja staklo mora brzo ohladiti. No to uzrokuje napetosti u staklu koja staklu daju posebna iznenađujuća svojstva. Stoga se nakon oblikovanja predmeti od stakla „popuštaju“, tj. postupno hlade od oko 500 oC do sobne temperature.
Staklo se ne boji samo zbog estetskih razloga već i zbog sprječavanja utjecaja Sunčeve svjetlosti na sadržaj u boci ili staklenki. Stoga su boce za maslinovo, bućino, laneno i druga nezasićena ulja načinjene od tamnog, gotovo neprozirnog stakla. Žestoka alkoholna pića u trgovinu dolaze u bocama od prozirnog stakla jer Sunčevo svjetlo ne djeluje na etanol, obični alkohol. Boce za pivo bile su zelene sve do 1930-ih, kad je otkriveno da smeđe boce bolje apsorbiraju UV svjetlost i da u smeđim bocama pivo ima dulji rok trajanja. Naime, energija kvanta crvene svjetlosti manja je od energije kvanta zelene svjetlosti (E = hν). Stoga i vino dolazi u tamnim crvenosmeđim bocama. Kako boja boce utječe na svojstva te koje se kemijske promjene događaju u pivu djelovanjem svjetlosti, doznajte na adresi:
How Does the Color of a Glass Bottle Affect the Beer Inside?
Kontroliranom kristalizacijom osnovnog stakla dobiva se staklokeramika. Za pretvorbu običnog stakla u staklokeramički materijal potrebno ga je toplinski obraditi ili devitrificirati. Stoga se predmeti od stakla zagrijavajavaju na dovoljno visokoj temperaturi pri kojoj će u cijelom staklu spontano nastati dovoljan broj centara kristalizacije, tj. jezgri ili nukleusa. Potom se temperatura povisi čime se potiče rast kristalnih jezgri, pa 30 do 90 % preostalog stakla kristalizira. Da bi se postigla visoka koncentracija centara kristalizacije (nukleusa) u cijeloj strukturi, u smjesu za pripremu stakla dodaju se sredstva za nukleaciju, najčešće TiO2, ZrO2, P2O5 i dr. Mješavine od kojih se proizvodi staklokeramika osim Na2O, CaO i SiO2 sadržavaju i Li2O, MgO, ZnO, Al2O3 i dr. Staklokeramika je višefazni sustav, tj. sastoji se od homogene staklaste faze i više kristalastih faza. Zaostala staklasta faza ima pozitivan, a kristalasta negativan koeficijent toplinskog širenja. Prilagođavanjem udjela staklaste te sastava i udjela kristalaste faze, može se postići nulti koeficijent toplinskog širenja staklokeramike. Zato staklokeramičke ploče za kuhanje na suvremenim štednjacima ne pucaju unatoč velikoj razlici temperature pojedinih dijelova. U laboratoriju azbestne su mrežice zamijenjene staklokeramičkim pločicama koje također možemo odmah početi zagrijavati šuštećim plamenom plinskoga plamenika. (Pokušaj isto načiniti s običnim staklom.)
O staklokeramici više doznajte OVDJE.
Olovovo staklo obično sadržava 18 do 40 % olovova(II) oksida, PbO. Nekad su od olovovog stakla izrađivali „kristalne“ čaše za vino, vaze za cvijeće, zdjele za voće i dr. Naziv „kristalno staklo“ proizlazi iz činjenice da se brušenjem na staklu načine ravne plohe koje se sjeku pod određenim kutom tako da se svjetlost reflektira i lomi kao na plohama kristala. Olovovo staklo ima veći indeks loma (n = 1,7) od običnog stakla (n = 1,5). Za razliku od običnog stakla, olovovo je staklo topljivije u vodi, a posebno u kiselom vinu, octu i lužinama. Dugotrajnim korištenjem čaša od olovovog stakla u organizmu se nakuplja olovo pa dolazi do trovanja olovom. Olovo je kumulativni otrov. Nemojte kristalne čaše prati u perilici posuđa jer će izgubiti sjaj. Sredstva za pranje posuđa su lužnata, a olovovo je staklo topljivo u lužinama. Suvremeno „kristalno staklo“ umjesto olovova(II) oksida sadržava okside barija, cinka ili kalija. Čuveno kristalno staklo Swarovski sve do 2012. god. sadržavalo je olovov(IV) oksid, PbO2. Danas se Swarovski „kristali“ izrađuje od bezolovnog stakla. Ipak, olovovo se staklo i danas primjenjuje kao zaštita od rendgenskog i radioaktivnog zračenja. Od njega su izrađivane katodne cijevi starih televizora i monitora. Ekran katodne cijevi bio je načinjen od debljeg olovovog stakla. Tako se gledatelje TV-a štitilo od mekanog rendgenskog zračenja (λ = 0,1 do 10 nm) koje nastaje pri kočenju snopa elektrona na ekranu televizora. (Medicinski rendgenski aparati rabe rendgensko zračenje valne duljine λ = 0,001 nm do 0,1 nm.)
Zemljane posude (ćupovi, bukare, testije, cjedila…) radile su se namjenski, primjerice za pečenje, kuhanje ili čuvanje namirnica. Stoga su neke bile glazirane, a neke ne. Naime, neglazirani lončarski proizvodi, poput testije, porozni su pa voda polagano izlazi kroz pore i isparava. Tako su prije izuma termos-boca i hladnjaka žeteoci u polju i tijekom najvećih vrućina imali hladnu vodu u testiji. Dio poroznih lončarskih proizvoda glazirao se umakanjem u vrlo rijetku suspenziju od gline i metalnih oksida, primjerice željeza, mangana, kroma, kobalta, nikla, ali i gleđe, PbO te minija, Pb3O4. To je zahtijevalo još jedno pečenje pri temperaturi oko 900 oC. No olovove glazure topljive su u vodi, a posebno u kiselom vinu, octenoj kiselini (salata, kiseli krastavci), kiselom mlijeku i dr. Stoga je dolazilo do trovanja olovom. Suvremene industrijski pripremljene sirovine za glazuru ne sadržavaju olovo. No, danas je moderno rustikalno keramičko posuđe pa se može dogoditi da na sajmu kupite glinenu posudu s olovovom glazurom. Takve proizvode držite samo kao ukras na policama svoga doma.
Pribor i kemikalije: porculanski tarionik s tučkom, pamučna krpa, vrtlarske rukavice, epruvete, plamenik, mali komadići običnog i „kristalnog stakla“, razrijeđena klorovodična ili sumporna kiselina, 10-postotna otopina natrijeva hidroksida, H2S-voda ili otopina natrijeva sulfida, Na2S(aq).
Opasnost od posjeklina staklom. Obvezno upotrijebite zaštitne naočale, a ruke zaštitite vrtlarskim rukavicama s kožom.
Postupak
- U porculanskom tarioniku mljevenjem usitnite komadić običnog stakla tako da dobijete što finiji prah. Tijekom mljevenja tarionik pokrijte krpom. Ne lupajte tučkom po staklu jer će krhotine stakla letjeti na sve strane.
- Stavite u epruvetu malo staklenog praha, dolijte 2 do 3 mL 10-postotne otopine natrijeva hidroksida i kuhajte dvije ili tri minute.
- Odlijte bistru otopinu u drugu epruvetu. Neutralizirajte otopinu postupnim dodavanjem razrijeđene kiseline. Uočite bijeli voluminozni talog polimera silicijeve kiseline.
- Jednakim postupkom oprezno usitnite komadić „kristalnog“ stakla.
- Malo praha dobivenog od olovova stakla kuhajte minutu dvije u 10-postotnoj otopini natrijeva hidroksida. U još vruću otopinu dodajte nekoliko kapi H2S-vode ili otopine natrijeva sulfida. Nastaje crni talog olovova sulfida, PbS.
Pokazali smo da svojstva stakla ovise o omjeru sastojaka. Primjerice, taljenjem kvarcnog pijeska samo s natrijevim karbonatom dobije se smjesa različitih natrijevih silikata, Na2SiO3, Na4SiO4, Na6Si2O7 i dr. Industrijski se proizvode natrijevi silikati s različitim omjerom Na2O:SiO2, od 2:1 do 1:4.
Na2CO3 + x SiO2 → Na2O·(SiO2)x + CO2
Natrijevi silikati su bezbojne staklaste krute tvari ili bijeli prah. Pri povišenoj temperaturi i tlaku, u autoklavu, silikati s većim udjelom Na2O lako se otapaju u vodi pri čemu nastaju lužnate otopine koje se nazivaju vodeno staklo. (Vodeno staklo može se nabaviti u svakoj trgovini boja i lakova.) Kad se vodenom staklu doda kiselina nastane gel od različitih polimera hipotetske silicijeve kiseline H4SiO4. Sušenjem dobivenog gela dobije se krut, ali porozan i amorfan oblik silicijeva dioksida, koji se sastoji od nepravilne trodimenzijske mreže međusobno povezanih tetraedara SiO4. Poznat je pod nazivom silikagel. Zbog porozne strukture ima veliku specifičnu površine, oko 800 m2/g, pa može adsorbirati veliku količinu plinova i vodene pare. Stoga se u industriji i laboratoriju rabi kao sredstvo za čišćenje i sušenje plinova, kao nosač katalizatora i dr. Silikagel možete naći u obliku kuglica ili granula u malim papirnatim ili platnenim vrećicama u ambalaži elektroničkih uređaja, u kutijama za cipele i dr. Prepoznat ćete ga po natpisima na vrećicama: desiccant, silica gel, throw away, do not eat.
Sušenjem gela silicijevih kiselina u atmosferi superkritičnog ugljikova dioksida, tekućina u gelu zamijeni se plinom pri čemu trodimenzijska mreža tetraedara SiO4 ostaje sačuvana u izvornom obliku. Tako se dobije najlakša krutina na svijetu, tj. aerogel. O svojstvima, vrstama i primjeni aerogelova više doznajte OVDJE
Silikagel impregniran s malo razrijeđene vodene otopine kobaltova(II) klorida, CoCl2, ružičaste je boje. No kad se ružičasti silikagel zagrije u sušioniku i voda ispari boja će mu se promijeniti u plavu. Naime, bezvodne kobaltove(II) soli su plave. Takav plavi silikagel kemičari rabe u eksikatorima kao obnovljivo sredstvo za sušenje. Ružičasta boja silikagela znak je da je zasićen vlagom, da ga treba zagrijati u sušioniku, pa se može ponovo upotrijebiti za sušenje.
Pribor i kemikalije: Staklenka za konzerviranje povrća, vodeno staklo, kristalići soli prijelaznih metala (Cr3+, Mn2+, Fe2+, Fe3+, Co2+, Ni2+, Cu2+, Zn2+).
Postupak
- U staklenku od 800 mL ulijte oko 100 mL vodenog stakla i nadopunite destiliranom vodom do 2 cm ispod ruba. Promiješajte staklenim štapićem.
- Kad se otopina umiri na različita mjesta u staklenki pincetom ubacite kristalić dva nabrojenih soli. Zatvorite staklenku pripadnim poklopcem, postavite na mirno mjesto i promatrajte kako raste „silikatni vrt“.
- Malo vodenog stakla ulijte u epruvetu, dodajte nekoliko kapi klorovodične ili sumporne kiseline te uočite želatinozni talog, tj. gel silicijevih kiselina.

Slika 7.69. Silikatni vrt. U jako lužnatoj otopini natrijeva silikata (vodenog stakla) kristali soli prijelaznih metala se otapaju i istodobno oblažu gelom od hidratiziranog hidroksida i silikata. Taj materijal djeluje kao polupropusna membrana. Osmotski tlak unutar polupropusne membrane veći je od osmotskog tlaka otopine natrijeva silikata. Stoga voda difundira iz otopine vodenog stakla u unutrašnjost polupropusne membrane, pa se kristal dalje otapa. Ulazak vode uzrokuje širenje membrane pa ona puca a otopina soli izlije se pod tlakom. Gustoća otopine soli manja je od gustoće otopine vodenog stakla pa struji prema gore. Tako nastaje „dimnjak“ od različitih krutih silikata prijelaznih metala, tj. minerala, od kojih smo neke već upoznali u poglavlju 7.6.2. O silikatnom vrtu više doznajte OVDJE.
Kemijski ili silikatni
vrt, prikladan je pokus za obrazovanje u STEM području.
Više o tom doznajte u
rubrici Kemija u nastavi časopisa Kemija u industriji u članku: Kemijski (silikatni) vrt, jedan pokus za obrazovanje u STEM području (pdf)
„Vodeno staklo“ ima mnogobrojne primjene, posebno u građevinarstvu. Kad se površina betona ili žbuke impregnira vodenim staklom dolazi do reakcije s viškom kalcijeva hidroksida pa nastaju u vodi netopljivi kalcijevi silikati. Tako se poveća otpornost betona i žbuke prema utjecaju atmosferilija. Drvo impregnirano vodenim staklom manje je zapaljivo. Vodeno se staklo rabi kao ljepilo u proizvodnji kartona, u ljevaonicama za učvršćivanje kalupa od pijeska, u smjesi sa šamotom za obloge ložišta peći i kamina.
7.6.7. Cement
Cement je najrašireniji i najvažniji građevinski materijal u svijetu. Prema kemijskom sastavu cement dijelimo na dvije skupine; silikatne i aluminatne cemente. Kako se cement proizvodi doznajte na adresi:
In the heart of the process of cement manufacturing
The Manufacturing Process at the Lafarge Brookfield Cement Plant
Silikatni cementi dobivaju se pečenjem smjese lapora i vapnenca. Najznačajniji iz skupine silikatnih cementa je portland cement, koji služi i kao baza za proizvodnju metalurškog i supersulfatnog cementa. Jedna od vrsta portland cementa je bijeli portland cement koji se dobiva pečenjem kaolina i vapnenca.
Aluminatni cementi dobivaju se pečenjem boksita i vapnenca. Rabe se za izradu vatrostalnih betona, kao i pri betoniranju pri vrlo niskim temperaturama.
Osnovni sastojak portland cementa jest klinker, dobiven pečenjem sirovine koja u potrebnim omjerima sadržava okside kalcija, silicija, aluminija i željeza. Stoga se tvornice cementa grade u blizini nalazišta prirodnih smjesa vapnenca i gline, poznatih kao lapor ili tupina. Pri sinteriranju na temperaturi od oko 1.450 °C nastaju minerali klinkera, pretežito kalcijevi silikati, aluminati i feriti, uglavnom Ca2SiO4, Ca3SiO5, Ca3Al2O6 i Ca2AlFeO5. Ovdje nisu važne samo kemijske formule, već i strukture produkata. Silikati imaju mnogo polimorfa, ali samo neki imaju tražena svojstva. Klinker se melje u fini prah uz dodatak približno 5 % gipsa, koji služi za usporavanje vezanja. Svojstva cementa (čvrstoća, toplina hidratacije, kemijska otpornost i dr.) ovise o omjeru glavnih minerala klinkera: alita, belita i celita.
Alit, (C3S), trikalcijev silikat, Ca3SiO5, (3CaO·SiO2), glavna je faza portlandskog cementa. Ona je odgovorna za stvrdnjavanje i razvoj "rane" čvrstoće. Reagira s vodom prema sljedećoj približnoj jednadžbi reakcije:
2 Ca3SiO5 + 6 H2O → 3CaO·2SiO2·3H2O + 3 Ca(OH)2.
Belit, (C2S), je dikalcijev silikat, Ca2SiO4, (2CaO·SiO2) koji zbog slabije reaktivnosti pridonosi "kasnoj" čvrstoći. Reagira s vodom prema sljedećoj približnoj jednadžbi reakcije:
2 Ca2SiO4 + 4 H2O → 3CaO·2SiO2·3H2O + Ca(OH)2.
Belit koji se nalazi u portlandskom cementu razlikuje se po sastavu od čistog dikalcijeva silikata. To je kruta otopina koja osim CaO i SiO2 sadržava male količine drugih oksida.
Celit, (C3A), je trikalcijev aluminat (3CaO·Al2O3). Od svih kalcijevih aluminata trikalcijev aluminat najjače reagira s vodom. Pri njegovoj hidrataciji nastaje faza približnog sastava Ca2AlO3(OH)·nH2O. Pritom se razvija velika količina topline. Da bi se to izbjeglo, portlandskom cementu dodaje se 4 do 8 % gipsa. Naime, sulfatni ioni iz otopine preko površine kristala celita čine netopljiv sloj etringita, Ca6Al2(SO4)3(OH)12·26H2O. Tako obloženi kristali trikalcijeva aluminata reagiraju polaganije pri čemu nastaje faza približnog sastava 3CaO·Al2O3·CaSO4·12H2O. Ti hidrati malo pridonose čvrstoći betona.
Ferit, (C4AF) je tetrakalcijev aluminoferit, Ca4AlnFe2-nO7, (4CaO·Al2O3·Fe2O3). Ima ulogu topitelja, tj. tali se pri temperaturi od 1.410 oC. Tijekom hidratacije razvija toplinu, reagira brzo, ali sporije u odnosu na C3A. Tetrakalcijev aluminoferit neznatno utječe na porast čvrstoće cementa.
O kristalnim strukturama minerala sadržanih u cementu više doznajte na adresi: crystallography365: cement
Slika.70. Shematski prikaz minerala sadržanih u zrncu cementa. Slika izvor:archive.cnx
Beton je najviše upotrebljavanu materijal u suvremenom građevinarstvu. Sastoji se od smjese čestica kemijski inertnih tvari, tzv. agregata (pijesak i šljunak), međusobno povezanih cementom i vodom. Pijesak i šljunak moraju biti čisti, bez primjesa mekih čestica gline ili biljnih tvari, jer i male količine organskih tvari iz tla rezultiraju kemijskim reakcijama koje ozbiljno utječu na čvrstoću betona. Zbog istog razloga beton se nikad ne smije lijevati na zemlju, nego na šljunčanu ili kamenu podlogu.
Svojstva betona ovise o omjeru uzetih količina agregata, cementa i vode. Što je pri jednakim uvjetima sadržaj vode niži, to je beton jači. Smjesa mora imati tek toliko vode da svaka čestica agregata u potpunosti bude okružena cementnom pastom tako da se ispune razmaci između čestica. Beton mora biti dovoljno tekuć da se može uliti u oplatu ili raširiti po podlozi. Drugi čimbenik koji utječe na svojstava betona jest količina cementa u odnosu na agregat. Za 1 m³ betona gustoće 2,2 do 2,5 t/m³ potrebno je 150 do 400 kg cementa, 1.680 do 2.100 kg agregata i 120 do 220 L vode. Ovisno o granulometrijskom sastavu agregata određuje se udio cementa i vode. Kad se beton priprema na gradilištu teško je postići najbolji omjer agregata, cementa i vode. Stoga je bolje upotrijebiti beton iz tvornica betona, tzv. betonara, koje će pripremiti beton traženih svojstava s obzirom na čvrstoću, brzinu vezanja i dr. Tamo gdje je potreban posebno jak beton, bit će relativno manje agregata.
Na čvrstoću betona posebno utječu temperatura i vlaga. Beton se ne smije naglo osušiti jer je njegova čvrstoća uvjetovana već spomenutim kemijskim reakcijama vode i minerala iz cementa. Stoga se nakon izlijevanja beton održava vlažnim. Tijekom stvrdnjavanja dolazi do hidratacije minerala sadržanih u cementu pri čemu nastaju strukturno slične skupine kalcijevih silikatnih hidrata (C-SH), ali s različitim omjerom kalcija i silicija i različitim sadržajem kemijski vezane vode. Preko 90 % konačne čvrstoće smjese obično se postigne u roku od četiri tjedna, dok se preostalih 10 % postiže godinama ili čak desetljećima. Niske temperature također nepovoljno utječu na čvrstoću betona, jer se pri nižoj temperaturi kemijske reakcije odvijaju sporije. Zato se pri niskim temperaturama betonu dodaju aditivi poput kalcijeva klorida i cementa čime se ubrza proces stvrdnjavanja i ujedno razvija toplina koja sprječava zamrzavanje betona.
Beton je vatrootporan i stoga najsigurniji građevinski materijal.
Upoznajte povijest dobivanja stakla na tlu Hrvatske.
Doznajte što je Vycor staklo, kako se dobiva i kakva su mu svojstva.
Upoznajte način dobivanja i upotrebu staklene vune u građevinarstvu.
Što je stakloplastika i gdje se sve koristi? Fiberglass.
Svjetlovodi, optički kabeli i dr.
Proučite zdravstvene posljedice uporabe azbesta (azbestoza).
Istražite povijest rudarstva na tlu Hrvatske (ugljen, boksit....).
Istražite koje su mineralne sirovine dostupne na tlu Hrvatske?
Istražite ležišta kvalitetnih vrsta gline u Hrvatskoj. Razmislite o mogućnostima njihove primjene.
Upoznajte vrste cementa, njihov sastav, svojstva i način primjene.
Kako proizvodnja građevinskih materijala, cementa, opeka i druge keramike utječe na emisiju CO2. Postupci kaptiranja i skladištenja CO2.
Razmislite o mogućnostima primjene i recikliranja građevinskog otpada.
Istražite utjecaj na okoliš legalne i ilegalne eksploatacije kamena, pijeska i šljunka.
Hoće li nam uskoro nedostajati pijeska i šljunka?
Upoznajte povijest otkrića i uporabe cementa i betona.
Izradite plakat, PowerPoint prezentaciju, snimite video, održite predavanje u razredu, organizirajte raspravu, pišite u školskom listu ili pokrenite neku aktivnost u vezi odabrane teme.
Pogovor
Ovim udžbenikom nisu obuhvaćene dvije teme: doseg reakcije i kinetika kemijskih reakcija, jer se te teme pojavljuju u programu trećeg razreda. S druge strane u poglavlje o otopinama uključene su i koloidne otopine, koje se inače navode u programu četvrtog razreda. Nadalje, uz nastavne sadržaje o metalima obrađeni su temeljni pojmovi o kompleksnim spojevima, koji se u programu nigdje ne spominju. Posebna pozornost posvećena je siliciju i silikatima, kojih također nema u nastavnom programu, unatoč tomu što živimo u „silicijskom dobu“ i što se tlo na kojem živimo sastoji od silicijevih spojeva. Posljedica je to raznih „reformi obrazovanja“ kad je mineralogija priključena kemiji, a tvorci nastavnih programa kemije nisu shvatili svoju zadaću.
U Zagrebu, jesen 2021.
Redaktor
- dr. sc . Nenad Raos
Fotografije
- Prof. dr. sc. Milan Sikirica
Udžbenik je besplatan. Nastao je nesebičnim radom autora i redaktora. Zato se ni jedan dio ovog udžbenika i njegovih sastavnih dijelova ne smije ni u kojem obliku i na bilo koji način koristiti u komercijalne svrhe. Dozvoljeno je korištenje za osobne potrebe i za nastavu u školama. Slobodno smijete besplatno umnožavati, dijeliti, distribuirati i prerađivati ovaj udžbenik za potrebe nastave uz obvezno citiranje izvornika. Sva su autorska prava zadržana.
Autor neće biti odgovoran ni za kakve izravne, slučajne, posljedične, neizravne ili kaznene štete nastale korištenjem ovog udžbenika i njegovih sastavniih dijelova.
Webmaster - kontakt e-mail