|
 |
|
Ja imama malo više pitanja i par zadataka koji me muče.pomažite ako možete. 1.Izvojite skupinu u kojoj svi spojevi ili ioni imaju amfoterna svojstva:A) HCO3-,AL(OH)3,NH2CH2COOH B)H2SO4, HSO4-, AL(OH)3 C)NH4CL, NH4OH, HPO42- , kako to određujemo? 2.kakva je to izoelektrična pH vrijednost? 3.u kompleksnom ionu (Ni(CN)4)2- cijanidni ligandi su u uglovima?
4. Izračunajte masu uzorka u kojem je maseni udio kalcijeva fosfata 97.3% ako kalcijev fosfat u uzorku sadrži 3.o11×10na 22 atoma kisika.
5.Izračunajte broj atoma kisika u uzorku aluminijeva sulfata ako 3.4582g uzorka sadrži 5.8% nečistoća koje ne sadrži kisik?
Hvala!!!!
|
|
Ime i prezime:
Valentina Kaćera
Renato.Kacera@fer.hr
|
 |
 |
1)
Amfoterne su tvari koje se istodobno mogu ponašati kao kiseline i kao baze. Kada djeluje kao kiselina, drugoj tvari predaje protone (točnije hidrone, H+, jer protoni su samo 1H+ ioni).. Kao baza prima hidrone (Brønstedova teorija kiselina i baza).
Najvažnije otapalo, voda, također je amfoterna:
kiselinsko-bazna ravnoteža u vodi: H2O + H2O <=> H3O+ + OH- (češće skraćeno pišemo: H2O <=> H+ + OH-)
reakcija s jakom kiselinom: H2O + H2SO4 => H3O+ + HSO4- (skraćeno: H2SO4 <=> H+ + HSO4-)
reakcija sa slabom lužinom: H2O + NH3 <=> OH- + NH4+
U vodenoj otopini lijep primjer amfoterne molekule je hidrogenfosfat:
baza: HPO42- + H+ <=> H2PO4-
kiselina: HPO42- <=> H+ + PO43-
Takav je i dihidrogenfosfat (prima i otpušta hidrone), ali fosfat djeluje samo kao baza (nema vezanih vodika), dok je fosforna kiselina samo kiselina (ne prima vodikove ione).
Pod amfoternošću obično podrazumjevamo nekakve ‘normalne’ uvjete. Neka tvar, koja je inače samo kisela, u jačoj kiselini se može ponašati kao baza, ali to su već finese. Za svoj zadatak pretpostavi da se radi o običnoj vodenoj otopini.
2)
Za početak pogledajmo kakva je raspodjela kemijskih vrsta (specijacija) ugljika u otopini ugljične kiseline u ovisnosti o pH (slika 1). U kiselom postoji samo H2CO3 (zapravo CO2(aq)) dok su koncentracije HCO3-, a pogotovo CO32-, zanemarive. Zaluživanjem otopine ugljična kiselina otpušta vodikove ione (hidrone), odnosno neutralizira se, a naboj jedinki je sve negativniji.
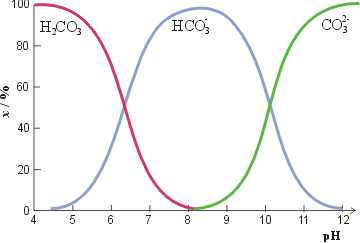
Slika 1. Specijacija u ugljičnoj kiselini
Slično je s amonijakom (slika 2). U kiselom su prisutni gotovo isključivo amonijevi ioni, dok je u lužnatom disocijacija potisnuta prema NH4OH (u stvari NH3(aq)). S porastom pH naboj je također sve negativniji.
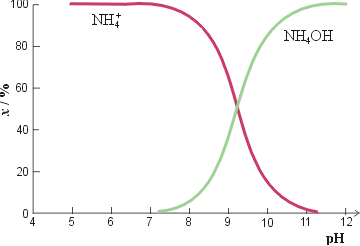
Slika 2. Amonijak
I jedna aminokiselina – lizin (slika 3). U kiselom je lizin pozitivno nabijen, u jako lužnatom postoji u obliku negativnih iona. Između (blago lužnato) je velika količina neutralnih molekula lizina. pH kod kojega pretežu molekule kojih je ukupan naboj 0 je izoelektrična točka. U slučaju lizina to je oko pH 10. Lizin u izoelektričnoj točki nosi po jedan negativan i pozitivan naboj što zbrojeno daje nulu (zwitterion). Tako se ponašaju sve aminokiseline, ali nije nužno da tvar bude zwitterion u izoelektričnoj točki.
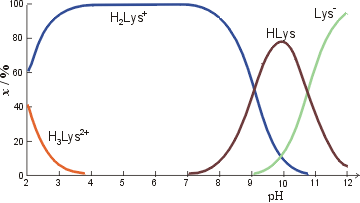
Slika 3. Specijacija lizina
Znak za vrijednost izoelektričnu točku obično je pI. Ipak, bolje je rabiti pH(I) ili pHI jer se ne radi o ničem drugom nego o posebnoj vrijednosti pH.
3)
... u vrhovima kvadrata. Za ovakva pitanja najbolje ti je pogledati u neku opširniju knjigu iz anorganske kemije. Iako se može poznavanjem ponašanja liganada i elektronske strukture središnjeg iona predvidjeti struktura. Možda ste učili u školi?
4)
Izračunaj množinu kisika, a zatim množinu i masu kalcijeva fosfata (množine O i Ca3(PO4)2 se odnose 8:1). Lako ćeš iz toga dobiti masu uzorka.
5)
Obratno od gornjeg zadatka. Izračunaš masu Al2(SO4)3 pa zatim množinu, pa broj atoma kisika. |
|
|
Odgovorio:
Kristijan A. Kovač
kkovac@chem.pmf.hr
<-- Povratak
|
|

|
Postavite
pitanje iz bilo kojeg područja kemije i
e-škola će osigurati da dobijete odgovor od kompetentnog znanstvenika. |
  |
|

