Milan Sikirica
e-Kemija 1
Digitalni udžbenik za znatiželjne
učenike
1. razreda srednjih škola
Predgovor
"Kemija je temeljna prirodna znanost koja proučava svojstva i građu tvari, pretvorbe jedne tvari u drugu tvar te izmjenu energije do koje pritom dolazi. U skladu s tim opisom, poučavanje i učenje Kemije provodi se u sljedećim konceptima (organizacijskim područjima): Tvari, Promjene i procesi, Energija, Prirodoznanstveni pristup.
Tri koncepta, Tvari, Promjene i procesi, Energija, proizišla su iz makrokoncepata prirodoslovnoga područja. Oni objedinjuju i pokrivaju sve bitne kemijske teme. Prirodoznanstveni pristup uveden je zbog nužnosti da se usvajanjem sadržaja triju navedenih koncepata razvijaju učeničke eksperimentalne i matematičke vještine. Njegova je svrha poticati učenike da svoja promišljanja o sličnostima i razlikama između različitih prirodnih sustava, njihovim međudjelovanjima i međuovisnosti izraze jezikom znanosti. Time se ujedno razvija i prirodoslovna pismenost, nadređeni koncept u cijelome prirodoslovnom području, pa tako i u predmetu Kemija."
Tako piše u Odluci o donošenju kurikuluma za nastavni predmet Kemije za osnovne škole i gimnazije u Republici Hrvatskoj. No, to je lakše reći ili napisati negoli izvesti bez odgovarajućih materijalnih uvjeta. Zato je mnogim učenicima kemija teška i nerazumljiva. Uzrok tome je učenje kemije bubanjem. To je pogrešna i nemoguća metoda. U kemiji ima toliko činjenica, jednadžbi kemijskih reakcija i formula da ih je besmisleno učiti napamet. Mnogo je bolji put koji se temelji na razumijevanju osnovnih načela. Svojstva tvari treba razumjeti kao posljedicu vrste kemijskih veza među atomima i molekulama. I obratno. Na osnovi poznavanja vrste kemijske veze u nekoj tvari treba naučiti predviđati promjene do kojih može doći pri promjeni fizičkih uvjeta, tlaka i temperature, ili pri kemijskim reakcijama jedne tvari s drugom.
Danas su od posebne važnosti komunikacijske vještine. Nekima su one urođene pa mogu satima razglabati o ničemu stvarajući privid velikog znalca. No, u znanosti i tehnologiji traži se sažeto i jasno izlaganje potkrijepljeno rezultatima eksperimenata i mjerenja iskazano brojkama, grafičkim prikazima, formulama, jednadžbama, simulacijama procesa i dr. Proučite neku aktualnu temu, primjerice klimatske promjene, zagrijavanje oceana, plastika u oceanima, recikliranje otpada, obnovljivi izvori energije, nove tehnologije, lijekovi, opojne droge i dr. Izložite problem pred razredom, pokrenite diskusiju (razgovor) ili raspravu te branite svoje stajalište. Pritom se poslužite svim mogućim metodama i dostupnom tehnologijom. Organizirajte "igru" na odabranu temu, učenicima dajte "uloge", a učionicu preuredite prema vašoj zamisli i prilagodite kreativnim aktivnostima. Pišite u školskom listu, popularnom časopisu, pokrenite neku aktivnost (akciju) u školi, na društvenim mrežama i sl. Oslobodite svoje kreativne potencijale. Oni postoje i morate ih pustiti iz ormara. Kreativnost i komunikacijske vještine traže se u svakom zanimanju.
U suvremenoj školi učenike se ne tjera da prepisuju s ploče i uče napamet bez razumijevanja. Učenici dobivaju zadatke ili rade na projektima. Za rješavanje zadatka dostupno im je sve što je potrebno, poput laboratorija, kemikalija, radionica, Interneta, printera, kompjutora, itd. Na djelu je nova obrazovna paradigma (obrazac). Današnji učitelji ne moraju više znati sve o svemu. Oni uče zajedno s učenicima i jedni od drugih, jer znanje više nužno ne teče od starijih prema mlađima, već od onih koji nešto znaju prema onima koji to još ne znaju. Za učenike više nije najbitnije dobiti peticu, nego steći nova znanja, vještine i sposobnosti kojih prije nisu imali.
U Zagrebu, 02.02.2020.
Autor
sikirica@chem.pmf.hr
Uvod - znanstvena metoda istraživanja
Do novih spoznaja o pojavama u prirodi znanstvenici dolaze znanstvenim metodama istraživanja. Pritom razvijaju odgovarajuće teorije kojima će objasniti opažene pojave i predvidjeti moguće nove još nepoznate pojave. Znanstvena metoda istraživanja uključuje: a) kvalitativno i kvantitativno opažanje prirodnih pojava, b) klasificiranje podataka, c) logično zaključivanje, d) izvođenje pažljivo odabranih i pripremljenih eksperimenata, e) postavljanje hipoteze kojom se objašnjavaju pojave i f) iskazivanje rezultata istraživanja matematičkim izrazom ili prirodnim zakonom.
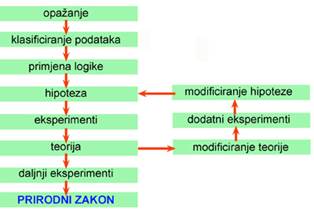
Shematski prikaz znanstvenog pristupa razumijevanju prirodnih pojava
Opažanje prirodnih pojava najstarija je znanstvena metoda. Opažanja mogu biti kvalitativna i kvantitativna. Kvantitativna opažanja češće se nazivaju mjerenjem. Primjerice, još su stari Egipćani prateći kretanje nebeskih tijela uočili prirodne zakonitosti te na temelju njih predskazivali dolazak poplava Nila.
Klasificiranje prikupljenih podataka dovodi na vidjelo odnos između opaženih činjenica. Primjerice, ruski znanstvenik D. I. Mendeljejev (1834.- 1907.) razvrstao je sve tada poznate elemente u skupine na temelju njihovih kemijskih svojstava te tako 1869. god. otkrio periodni sustav elemenata, odnosno prirodni zakon periodičnosti.
Primjena logike omogućuje znanstvenicima da iz postojećih informacija donose zaključke. Mendeljejev je na temelju periodnog sustava elemenata u članku iz 1871. predvidio postojanje i opisao svojstva 11 tada još nepoznatih kemijskih elemenata, a nekim poznatim elementima ispravio netočno određene relativne atomske mase. Niels Bohr (1885. - 1962.) je na temelju postojećih informacija o spektrima i Rutherfordova modela atoma 1913. objasnio građu i spektar atoma vodika te postavio novu teoriju o građi atoma.
Eksperiment je najvažnije oruđe znanstvenika kojim razvija i provjerava znanstvene teorije. Kako sustavno planirani eksperimenti mogu pomoći otkrivanju prirodnih zakona uočio je još talijanski fizičar i astronom Galileo Galilei (1564. - 1642.). Puštajući kugle različitih masa niz kosinu otkrio je da na sva tijela, bez obzira na težinu (masu), djeluje ista akceleracija sile teže. Engleski znanstvenik Michael Faraday (1791. - 1867.) nakon mnogobrojnih pokusa dokazao je 1832. da je masa tvari koja se na elektrodama izluči tijekom elektrolize srazmjerna količini elektrike koja je prošla kroz elektrolizer. Bohrovu jednostavnu teoriju o građi atoma trebalo je nadopuniti kako bi se mogli objasniti eksperimentalni podaci o spektrima drugih atoma, a ne samo vodika. Takvih primjera ima bezbroj. Kemičar, kao i svaki drugi znanstvenik, provodi eksperimente zato da bi uočene promjene ponovio u laboratoriju pod strogo kontroliranim uvjetima. Pri donošenju zaključaka oslanja se na rezultate mjerenja, koje je najvažnija znanstvena metoda.
Hipoteze i teorije predstavljaju pokušaj da se opažene prirodne pojave objasne te predvide rezultati budućih eksperimenata, kojima se ujedno provjerava postavljena hipoteza. Vladajuće hipoteze i teorije podvrgavaju se neprekidnim eksperimentalnim provjerama. Kad se eksperimentima pokaže da hipoteza ili teorija nije točna, znanstvenici moraju pronaći novu teoriju koja će objasniti sve poznate činjenice te omogućiti objašnjavanje novih, još nepoznatih činjenica. Primjerice, flogistonska teorija, koja je dugo vremena bila jedina teorija o kemijskim promjenama, nije uspjela objasniti gorenje. Otkrića kisika i ugljikova dioksida omogućila su 1789. god. francuskom znanstveniku Antoineu Laurentu Lavoisieru (1743. - 1794.) da objasni gorenje, što je označilo kraj flogistonske teorije i početak kemije kao prirodne znanosti.
Kemičarima je dobro poznata hipoteza, koju je 1811. iznio talijanski fizičar i kemičar Amedeo Avogadro (1776. - 1856.), da jednaki volumeni bilo kojeg plina pri istom tlaku i temperaturi sadržavaju jednak broj čestica (molekula). Brojni eksperimenti (pokusi) su dokazali ispravnost te hipoteze, pa je danas nazivamo Avogadrovim zakonom. Hipoteze i teorije ne služe samo zato da objasne opažene prirodne pojave nego pokazuju put prema novim otkrićima.
Prirodni zakon je sažet matematički iskaz rezultata mnogobrojnih opažanja i provedenih eksperimenata. Tako je primjerice umnožak mjernih brojeva tlaka i volumena određene količine plina pri istoj temperaturi stalan broj, što se iskazuje Boyleovim zakonom: p × V = konst. Albert Einstein je našao da su masa i energija ekvivalentne što je iskazao jednadžbom E = m × c². Energija, E, je ekvivalentna masi, m, pomnoženoj s kvadratom brzine svjetlosti, c². Ova nam jednadžba, kao izraz prirodnog zakona, objašnjava zašto se ogromne količine energije oslobađaju tijekom nuklearnih reakcija u nuklearnim reaktorima i atomskim bombama.
1. TVARI
Pogledamo li oko sebe, vidjet ćemo mnoge predmete načinjene od raznovrsnih tvari: metala, mramora, granita, drva, plastičnih masa i dr. Metali, mramor, granit, drvo i plastične mase različite su tvari različitih fizičkih i kemijskih svojstva. Iskustvo nas uči da se metali i mramor mogu usitniti na manje komadiće, a ti komadići zadržavaju prvotna svojstva. Ali, postavlja se pitanje dokle se tvari mogu dijeliti na sve manje i manje čestice. To su pitanje načelno riješili grčki filozofi prije 2500 godina. Sve su tvari izgrađene od najmanjih, dalje nedjeljivih čestica, atoma (grč. a = ne + temno = režem, siječem) što na grčkom znači nesjeciv, nedjeljiv, pa se nekoć riječ "atom" prevodila kao "nesjek".
Grčki su atomisti sve u svijetu tumačili iz neprestanoga gibanja atoma, najsitnijih i nedjeljivih čestica tvari. Za Leukipa (5. stoljeće pr. Kr.) i njegova učenika Demokrita (460. - 370. pr. Kr.) postoje samo atomi i prazan prostor. Demokrit je smatrao da su atomi čvrsti i masivni, ali nisu jednaki. Kad se atomi ne bi razlikovali, ne bismo mogli objasniti kako se spajaju u sve i svašta. Vjerovao je da u prirodi postoji bezbroj vrsta atoma. Neki su okrugli i glatki, drugi nepravilni i iskrivljeni. Baš zato se mogu spajati u različita tijela. Iako su bezbrojni i različiti, atomi su vječni, nepromjenjivi i nedjeljivi. Primjerice, da bi objasnili zašto je željezo pri sobnoj temperaturi krutina zamišljali su da atomi željeza imaju kukice kojima se drže zajedno, atomi vode su glatki i klizavi i zato je voda pri sobnoj temperaturi tekućina koja se može prelijevati itd. Gledano sa suvremenog stajališta njihovi su atomi više odgovarali našim molekulama. Kada su njihove ideje bile prihvaćene u 18. stoljeću, postavile su temelje za buduće tumačenje građe tvari.
Danas imamo na raspolaganju mnoštvo dokaza da su tvari izgrađene od atoma. Poznato je 118 elementarnih tvari (kemijskih elemenata) izgrađenih od atoma s istim brojem protona u jezgri. No u prirodi se nalaze samo 92 različite elementarne tvari. Ostale elementarne tvari dobivene su u laboratorijima, ali su njihovi atomi nestabilni te se raspadaju na stabilnije atome kakvi se inače nalaze u prirodi.
Sve se tvari mogu podijeliti u dvije skupine: elementarne tvari i kemijske spojeve. Elementarna tvar je makroskopski uzorak neke tvari koja se sastoji od istovrsnih atoma, točnije od atoma istoga kemijskog elementa. Atomi različitih kemijskih elemenata mogu se međusobno spajati na različite načine i u različitim omjerima, pri čemu nastaju kemijski spojevi u obliku izoliranih molekula, kao i atoma vezanih u lance, mreže ili trodimenzijske strukture.
Doznajte više na: www.compoundchem.com/atomicmodels
doi.org/KUI.2015.042
doi.org/KUI.2015.020
1.1. Elementarne tvari
Znameniti francuski kemičar Antoine Laurent de Lavoisier (1743. - 1794.) u udžbeniku iz 1789. godine prvi je naveo tablicu jednostavnih tvari koje se ni na koji način ne mogu razložiti na jednostavnije. Tablica je sadržavala jednostavne tvari podijeljena u četiri skupine: plinove (kisik, dušik, vodik), nemetale (sumpor, fosfor, ugljik), metale (antimon, arsen, bizmut, kobalt, bakar, kositar, željezo, mangan, živa, molibden, nikal, zlato, platina, olovo, volfram, cink) i zemlje (Chaux (CaO), Magnésie (MgO), Barite (BaO), Alumine (Al2O3), Silice (SiO2)). Naslutio je da će se "zemlje" jednog dana prestati uvrštavati u jednostavne tvari jer su vjerojatno zasićene kisikom kad s njim ne reagiraju. Lavoisierova tablica je temelj modernog popisa kemijskih elemenata. Lavoisierov je popis također uključivao "svjetlost" i "kaloričnost", za koje se u to doba smatralo da su materijalne prirode.
Doznajte više na: www.skolskiportal.hr/otac-suvremene-kemije/

Slika 1.1. Marie i Antoine Lavoisier
Slika izvor: www.wikiart.org
Svatko od nas s lakoćom može prepoznati metale kao što su zlato, srebro, bakar, olovo ili željezo. Većina zna da se cink rabi za zaštitu željeznih limova od kojih su načinjeni žljebovi na kućnim strehama. Aluminijem u obliku tankih listova (folija) svakodnevno zamatamo hranu. Živa je tekući metal kojim se pune termometri. Od volframa su načinjene niti električnih žarulja. Krom se rabi kao ukrasna prevlaka slavina i drugih metalnih dijelova sanitarnih uređaja. O uraniju svakodnevno možemo nešto pročitati u novinama ili čuti u TV vijestima. Sve nabrojene i masnim slovima istaknute tvari jesu metali. Mogu se kovati pa ih još nazivamo kovinama. Riječ metal proizašla je iz latinske riječi metallum (grč. metallon), koja znači kovina, ali i rudnik.
Teško bismo pronašli nekoga tko nije čuo za sumpor, jer se o njemu svakodnevno govori u vijestima o onečišćenju okoliša, sadržaju sumpora u nafti i zemnom plinu itd. Sigurno vam je poznato da crvenosmeđi premaz na kutiji žigica sadržava fosfor. Kisik i dušik glavni su sastojci zraka, klor se rabi za dezinfekciju vode u bazenima za kupanje itd. Sve nabrojene masnim slovima istaknute tvari u ovom odjeljku su nekovine ili nemetali.
Suvremeni uređaji omogućuju da se posredno ili neposredno vide čestice tvari. Te čestice mogu biti atomi, ioni ili molekule. Stoga ćemo u ovom priručniku sva svojstva tvari objašnjavati upravo na osnovi činjenica o njihovoj čestičnoj građi.
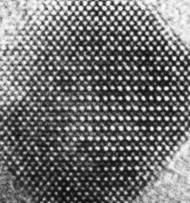
Slika 1.2. Uređeni razmještaj cirkonijevih i kisikovih iona u kristalu cirkonijeva dioksida, ZrO2, kako se vidi pod elektronskim mikroskopom. Ioni cirkonija i kisika u kristalu leže na međusobno okomitim pravcima (bridovima kocke) uvijek na jednakoj udaljenosti jedni od drugih. (Snimila prof.dr.sc. Anđelka Tonejc, profesor Fizičkog odsjeka PMF-a Sveučilišta u Zagrebu.)
Metali ili kovine čine više od dvije trećine svih elementarnih tvari koje nalazimo u prirodi. Svi su metali pri sobnoj temperaturi krutine, osim žive koja je jedina tekuća. Uglađene površine svih metala reflektiraju svjetlost.

Slika 1.3. Bakar, aluminij, zlato i željezo primjeri su elementarnih
tvari od kojih se izrađuju uporabni predmeti i nakit
Tablica 1.1. Opća svojstva metalnih i nemetalnih tvari
|
Svojstvo |
Metali |
Nemetali |
|
Agregacijsko stanje pri sobnoj temperaturi |
Svi su krutine osim žive. |
Jedanaest plinova, brom je tekućina, a ugljik, fosfor, sumpor, selen i jod su krutine. |
|
Talište |
Najčešće visoko. |
Ugljik ima vrlo visoko talište, a svi ostali nemetali imaju značajno niža ili niska tališta. |
|
Izgled površine u krutom stanju |
Mogu se polirati do visokog sjaja, pokazuju metalni sjaj. |
Uglavnom bez sjaja osim dijamanta koji je proziran, sumpora koji je žut i joda čiji su kristali tamnoljubičasti i sjajni. |
|
Električna provodnost |
Dobri vodiči električne struje |
Svi su izolatori, osim ugljika koji u obliku grafita provodi struju. |
|
Toplinska provodnost |
Svi su dobri vodiči topline. |
Svi su slabi provodnici topline. |
|
Gustoća |
Uglavnom velika i nekoliko puta veća od gustoće vode. |
Uglavnom mala, jer je većina nemetala u plinovitu stanju. Od svih nemetala samo jod ima gustoću koja je veća od gustoće aluminija i drugih lakih metala. |
Od svih nemetala pri sobnoj temperaturi krutine su ugljik, sumpor, fosfor i jod. Ugljik se u prirodi pojavljuje u dva oblika, kao dijamant i grafit. Dijamant je tvrd, proziran, ima velik indeks loma svjetlosti, a njegova uglađena površina reflektira svjetlost poput ogledala. Grafit je mekan i crn, kristali sumpora su žuti, a joda ljubičasti. Njihove uglađene površine slabo reflektiraju svjetlost. Od svih nemetala pri sobnoj temperaturi samo je brom tekućina (crvenosmeđe boje). Svi ostali nemetali su bezbojni plinovi, osim klora koji je žutozelen.

Slika 1.4. Izgled nekih elementarnih tvari koje svrstavamo u nemetale: brom, jod fosfor i sumpor. Bijeli fosfor se sam od sebe zapali na zraku. Čuva ga se pod vodom u tamnoj boci ili u mraku.
1.2. Kemijski spojevi
Francuski kemičar Joseph Louis Proust (1754. - 1826.) najpoznatiji je po otkriću zakona o stalnim masenim udjelima (omjerima) elemenata u kemijskom spoju. Kemijski spoj uvijek sadržava kemijske elemente u stalnom masenom omjeru. Zakon je otkrio 1794. a objavio 1799. godine.
Doznajte više na: www.researchgate.net/Joseph_Louis_Proust.
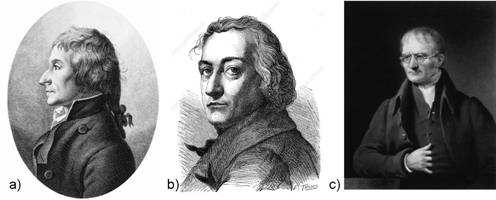
Slika 1.5. a) Joseph Louis Proust (1754. - 1826.). b) Claude-Louis Berthollet (1748. - 1822.). c) John Dalton (1766. - 1844.)
Proustovom zakonu stalnih omjera snažno se protivio Claude-Louis Berthollet koji je tvrdio da kemijski spoj nema stalan sastav. Po Bertholletu metali se postupno oksidiraju od najmanjeg do najvećeg sadržaja kisika. Bertholletu je kemijska reakcija bila otapanje jednog elementa u drugom, jedne tvari u drugoj. No, Proust je na primjeru bakra, željeza, kositra i olova dokazao postojanje nižeg i višeg oksida, pa je Bertholletov promjenjiv sastav oksida metala objasnio kao smjesu različitih udjela nižeg i višeg oksida koja nastaje tijekom postupne oksidacije metala. Berthollet se pozivao na različit sastav taloga dobivenih lužinom ili sodom iz otopine metalnih soli. Proust je dokazao da pritom nastaju dvije ili više bazičnih soli, ali svaka određenog sastava. Berthollet je tvrdio da se otapanjem metala u kiselini dobiju soli različitog sastava ovisno o količini metala ili kiseline. Proust je, na primjeru žive, pokazao da nastaju dva zasebna živina nitrata, prvo onaj s manje žive, a zatim, kako se dodaje živa, i onaj s više žive, i, konačno samo taj.
Engleski kemičar John Dalton u početku se bavio meteorologijom pod utjecajem istaknutog meteorologa E. Robinsona koji ga je zainteresirao za matematiku i meteorologiju. No, Dalton je izvodio i kemijske pokuse. Analizom kemijskog sastava tvari otkrio je zakon o stalnim omjerima i zakon umnoženih omjera masa tvari u kemijskim spojevima. Stalnim omjerima sastojaka određen je kemijski spoj kao vrsta tvari koja ima stalan sastav bez obzira gdje je i kako nastala. Drugim omjerom istih sastojaka određen je drugi spoj.
Nakon Daltonova otkrića zakona o stalnim i višestrukim masenim omjerima elemenata u kemijskom spoju Proustove su ideje prihvaćene kao konačne i potvrđene, a Bertholletove napuštene. No, ruski kemičar Nikolaj Semjonovič Kurnakov (1860. - 1941.) u vremenu od 1912. do 1914. godine pokazao je da su oba kemičara, i Prust i Berthollet, bili u pravu. Tijekom termičke analize slitina (legura) različitih metala Kurnakov je na dijagramima "sastav - svojstvo" uočio kako se u mnogim slitinama javljaju faze stalnih fizičkih svojstava i stalnog kemijskog sastava koji se može iskazati kemijskom formulom, primjerice: Mg2Pb, Mg2Ni, Mg2Si, ili Fe3C. Takve je spojeve nazvao daltonidima. Tako se u sustavu magnezij-antimon javlja intermetalni spoj visokog tališta čiji se sastav može prikazati formulom Mg3Sb2. Dok je talište čistog magnezija pri 650 oC, a antimona pri 630,6 oC, Mg3Sb2 tali se pri 1245 oC. Spojevi definiranog sastava javljaju se i u trokomponentnim slitinama metala, primjerice, ThCr2Si2 i Sc2FeSi2. No, u mnogim slitinama javljaju se intermetalni spojevi čiji sastav varira unutar određenih granica. Primjerice u slitinama bakra s cinkom javlja se pet faza:
Tablica 1.2. Faze u sustavu bakar - cink
|
Faza |
Maseni udio Zn |
Struktura |
|
a |
0 - 35% |
Kruta otopina cinka u bakru koja nije intermetalni spoj. U kubnoj najgušćoj slagalini atoma bakra (kristalnoj strukturi bakra) dio atoma bakra nasumično je zamijenjen atomima cinka. |
|
b |
45 - 50% |
Intermetalni spoj promjenjiva sastava približne formule CuZn s kristalnom strukturom koja se može opisati prostorno centriranom kockom. |
|
g |
60 - 65% |
Intermetalni spoj promjenjiva sastava približne formule Cu5Zn8 sa složenom (kompliciranom) kubnom kristalnom strukturom s 52 atoma u jediničnoj ćeliji. |
|
e |
82 - 88% |
Intermetalni spoj promjenjiva sastava približne formule CuZn3 s heksagonskom kristalnom strukturom. |
|
η |
97 - 100% |
Kruta otopina bakra u cinku koja nije intermetalni spoj. U heksagonskoj najgušćoj slagalini atoma cinka (kristalnoj strukturi cinka) dio atoma cinka nasumično je zamijenjen atomima bakra. |
Spojeve čiji sastav varira unutar određenih granica Kurnakov je nazvao bertolidima. Primjerice u intermetalnom spoju ThNi5, dio atoma nikla može se zamijeniti atomima aluminija, pri čemu sve slitine sastava ThNi5-xAlx (x = 0 do 3,25) imaju istu kristalnu strukturu. Nestehiometrijski sastav imaju mnogi kruti oksidi, sulfidi i hidridi, primjerice Fe0,95O, UO2±x, YxBa2Cu3O7−x, Fe0,89…1,00S ili LaNi5H6. Tipičan primjer bertolida je i titanijev(II) oksid koji se dobije zagrijavanjem titanijeva dioksida, TiO2, i titanija pri oko 1500 oC. Idealna formula titanijeva(II) oksida jest TiO, a stvarna TiO0,7 do TiO1,3. Nestehiometrijski sastav bertolida može se objasniti defektima u kristalnoj strukturi te različitim oksidacijskim stanjima metalnih iona. Zbog iznimnih fizičkih svojstava bertolidi se danas rabe kao katalizatori, poluvodiči, supravodiči i dr.
1.3. Periodni sustav kemijskih elemenata
en.wikipedia.org/History_of_the_periodic_table
www.vanderkrogt.net/chemical_symbols
Paralelno kako su otkrivani novi kemijski elementi i njihovi spojevi, znanstvenici su uočavali neka njihova zajednička svojstva. Lavoisier, u svojoj knjizi Traité élémentaire de chimie (Osnove kemije), prvi je 1789. god. objavio "Tablicu jednostavnih tvari" odnosno kemijskih elemenata. On je tada poznate elemente razvrstao u četiri skupine. Prvu skupinu činili su plinovi kisik, dušik i vodik. Za Lavoisiera kisik je središnji element i svi ostali elementi svrstavaju se prema kisiku. Drugu skupinu čine nemetalne jednostavne tvari koje daju okside i kiseline. To su sumpor, fosfor, ugljik i tri radikala murjatični, fluorov i boraksov. Treću skupinu čine metalne jednostavne tvari koje daju okside i kiseline. Tu skupinu čine metaloidi antimon i arsen te jedanaest tada poznatih metala. Četvrtu skupinu čine zemljane jednostavne tvari koje čine soli (Chaux, Magnésie, Baryte, Alumine, Silice). No, Lavoisier je i sam naslutio da su te zemlje "zasićene kisikom". I zaista, već početkom 19. stoljeća iz tih su zemljanih tvari, odnosno oksida, dobiveni pripadni metali: kalcij, magnezij, barij, aluminij i silicij. Osim kemijskih elemenata Lavoisierova tablica je sadržavala svjetlost (lumière) i toplinu (calorique). Doznajte više u knjizi: Drago Grdenić, Povijest kemije, Školska knjiga Zagreb, 2001. str. 506 - 511..
Tijekom 18. stoljeća i prvih desetljeća 19. stoljeća mnogi su istraživači uspjeli prikupiti brojne podatke o svojstvima tada poznatih kemijskih elemenata i njihovih spojeva. To je znanje činilo bitnu osnovu za sistematizaciju svojstava elemenata. Prijelomna je 1817. godina, kada je Johann Wolfgang Dobereiner (1780. - 1849.), profesor kemije u Jeni, utvrdio sličnost grupa elemenata, tzv. trijade:
Tablica 1.3. Dobereinerove trijade
|
Element Ar |
Element Ar |
Element Ar |
Element Ar |
Element Ar |
|
Li 7 |
Ca 40 |
P 31 |
S 32 |
Cl 35,5 |
|
Na 23 |
Sr 87 |
As 75 |
Se 78 |
Br 80 |
|
K 39 |
Ba 137 |
Sb 122 |
Te 128 |
I 127 |
Elementi u trijadama pokazivali su slična kemijska svojstva. Litij natrij i kalij burno reagiraju s vodom, dajući jake lužine. Kalcij, stroncij i barij manje burno reagiraju s vodom i daju slabije lužine. Sulfati i karbonati kalcija, stroncija i barija u vodi su netopljivi. Klor, brom i jod daju slične spojeve s litijem, natrijem i kalijem itd. Trijade je zasnovao na činjenici da je srednja vrijednost relativnih atomskih masa najlakšeg i najtežeg elementa približno jednaka masi srednjeg elementa u trijadi, npr. za prvu trijadu (7 + 39)/2 = 23. Time je prethodio otkriću periodnoga sustava elemenata. Nažalost, nije mogao potkrijepiti svoju hipotezu s dovoljnim brojem trijada, pa njegova otkrića u to doba nisu bila više od zanimljivosti. No, između 1829. i 1858. godine drugi su znanstvenici (Jean Baptiste Dumas, Leopold Gmelin, Ernst Lenssen i Max von Pettenkofer) uočili sličnost kemijskih svojstava i izvan trijada.
Francuski geolog Alexandre Béguyer de Chancourtois (1819. - 1886.) prvi je 1862. godine uočio da se u nizu kemijskih elemenata poredanih po rastućoj relativnoj atomskoj masi ponavljaju elementi sa sličnim kemijskim svojstvima. Njegov glavni doprinos kemiji bio je vis tellurique - "zemaljski vijak", trodimenzijski raspored elemenata u obliku spirale oko valjka. Ona se spušta tako da se elementi sličnih kemijskih svojstava pojavljuju od zavoja do zavoja jedni ispod drugih. Iako "zemaljski vijak" nije točno prikazao sva svojstva elemenata koja su tada bila poznata, de Chancourtois je bio prvi koji je uočio periodičnost svojstava kemijskih elemenata kao funkciju relativnih atomskih masa.
Engleski kemičar John Alexander Reina Newlands (1837. - 1898.) poredao je 1863. godine kemijske elemente prema porastu relativnih atomskih masa i svakom elementu dao "redni broj". Godine 1865. Newlands je sastavio tablicu od osam stupaca sa sedam elemenata u svakom stupcu. Ustanovio je da se elementi sličnih kemijskih svojstava pojavljuju u vodoravnim redovima nakon svakog sedmog elementa. Stoga je tu pravilnost nazvao "zakonom oktava" (plemeniti plinovi u to doba nisu bili poznati što objašnjava zašto je u Newlandsovoj tablici periodičnosti 7, a ne 8). Newlands nije ostavio prazna mjesta za neotkrivene elemente, a ponegdje je morao staviti dva elementa u isti stupac kako bi zadržao uzorak. Godine 1866. uzeo je Cannizzarove relativne atomske mase i postigao bolje slaganje.
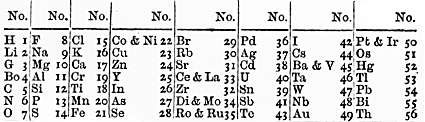
Slika 1.6. Newlandsov "zakon oktava"
Na predavanju održanom u Engleskom kemijskom društvu uočena pravilnost nije prihvaćena kao prirodni zakon. Štoviše, dočekana je s podsmjehom: George Carey Foster (1835- - 1919.), profesor fizike na University College u Londonu, rekao je da je mogao elemente navesti abecednim redom. No, Foster je kazao i da ne može prihvatiti sustav u kojem je krom odvojen od mangana i željezo od kobalta i nikla. Ipak, Newlandsu je učinjena nepravda jer njegovo predavanje od 1. ožujka 1866. nije objavljeno, a kemičari toga doba još nisu bili svjesni periodičnosti svojstava kemijskih elemenata. Čak i kad je Mendeljejev objavio svoj periodni sustav, Newlands je tvrdio da ga je on prvi otkrio i 1884. čak napisao knjižicu da dokaže svoje prvenstvo. Za svoj rad odlikovan je 1887. Davyjevom medaljom Kraljevskog društva u Londonu, najvećim priznanjem koje je u to doba mogao dobiti kemičar. Pet godina prije toga tom su medaljom bili odlikovani L. Meyer i D.I. Mendeljejev.
Godine 1864. njemački kemičar Julius Lothar Meyer (1830. - 1895.) u svojoj knjizi Die modernen Theorien der Chemie objavio je tablicu s 44 elementa raspoređenih prema njihovim valencijama. Tablica je pokazala da elementi sličnih svojstava često imaju istu valenciju. Nije spomenuo pravilnost u odnosu na rastuće relativne atomske mase elemenata. Svoj drugi sustav, koji je uključivao 53 elementa, namijenjen drugom izdanju udžbenika dovršio je 1868. godine. No izdavanje udžbenika se odužilo. Pročitavši 1869. sažetak Mendeljejeva priopćenja, objavljenog u časopisu Zeitschrift für Chemie (1869, str. 405–6), Meyer je odmah napisao priopćenje o svom sustavu koji je dovršio 1868.
Engleski kemičar William Odling (1829. - 1921.) objavio je 1864. tablicu od 57 elemenata poredanih na temelju njihovih relativnih atomskih masa. Tablica je imala pet stupaca s elementima sličnih svojstava u redovima. Ostavio je prazna mjesta za galij, germanij i druge elemente. Nekim je elementima pogrešno odredio mjesto u tablici. Kasnije, 1870. godine predložio je valencijsku klasifikaciju elemenata. No, ni Odlingova ni sve druge prethodne klasifikacije elemenata nisu ukazivale na najvažnije, a to je periodično ponavljanje kemijskih svojstava elemenata.
Najviše uspjeha u otkrivanju periodnog sustava elemenata imao je profesor Sveučilišta u Sankt Peterburgu, Dmitrij Ivanovič Mendeljejev (1834. - 1907.). On je tada 63 poznata elementa poredao po rastućim relativnim atomskim masama. Ustanovio je da se kemijska svojstva elemenata ponavljaju u stanovitim razmacima, periodama, pa se slični elementi svrstavaju u grupe. Krajem 1868. godine bio je uvjeren da to ponavljanje nije slučajno: postoji zakon periodičnosti kemijskih svojstava elemenata u ovisnosti o relativnoj atomskoj masi (rukopis Mendeljejeve tablice nosi nadnevak 18. veljače 1869. po julijanskom kalendaru). Dana, 1. ožujka 1869. godine Mendeljejev je mnogim ruskim i inozemnim uglednim kemičarima razaslao prvu tablicu svog sustava elemenata. Na sjednici Ruskog kemijskog društva, 6. ožujka 1869. godine, Mendeljejev nije bio nazočan, ali je u njegovo ime N.A. Menšutkin pročitao "Prikaz sistema elemenata temeljen na njihovim atomskim težinama i kemijskim svojstvima" (Опыт системы элементов, основанной на их атомном весе и химическом сходстве). Opsežan prikaz "ogleda" i Mendeljejevo priopćenje objavljeno je u travnju 1869. u prvom broju Žurnala Ruskog kemijskog društva. U istom je časopisu 1871. objavljen opširan Mendeljejev članak pod naslovom: "Prirodni sustav elemenata i njegova primjena u predskazivanju svojstava neotkrivenih elemenata" (Естественная система элементов и применение её к указанию свойств неоткрытых элементов).
Doznajte više na: rusdarpa.ru/
doi.org/KUI.2015.029

Slika 1.7.
Periodni sustav elemenata D. I. Mendeljejeva prvi puta publiciran izvan Rusije
u časopisu Zeitschrift für Chemie (1869, str. 405–6).
Izvor: archive.org,
Mendeljejevu nesumnjivo pripada prednost u otkriću periodnog zakona. I drugi su istraživači u to doba, vidjeli smo, sastavljali manje ili više potpune tablice elemenata, ali je samo Mendeljejev uočio prirodni zakon. Na osnovi svojstava elemenata koji okružuju neko mjesto u tablici predvidio je svojstva središnjeg elementa. Kako je tablica sadržavala mnoga prazna mjesta, jer su tada bila poznata samo 63 elementa, Mendeljejev je u jednom članku iz 1871. predvidio postojanje i svojstva još 11 elemenata. Predviđanja su se ostvarila još za njegova života, a novootkriveni elementi imali su upravo svojstva koja je predvidio. Mendeljejev je bio toliko siguran u otkrivenu zakonitost, da se svojstva elemenata periodički mijenjaju (periodni zakon), da je mnogim elementima ispravio tada određene relativne atomske mase. Jedan od tih elemenata je indij. Poznato je da indij dolazi u cinkovim rudama pa se pretpostavljalo da čini oksid sastava InO, kao što cink čini oksid sastava ZnO. Na osnovi masenog udjela indija u njegovu oksidu, w(In) = 82,5 %, za indij je tada izračunata relativna atomska masa oko 76. Indij je, prema tome, valjalo smjestiti između nemetala arsena i selena. Mendeljejev predlaže za indijev oksid formulu In2O3, a iz te formule zaključuje da je relativna atomska masa indija 113. Stoga indij smješta na pravo mjesto, između metala kadmija i kositra.
Tablica 1.4. Usporedba svojstava ekasilicija, Es, koja je predvidio D. I. Mendeljejev, i opaženih svojstava germanija, Ge
|
Svojstvo |
|
Ekasilicij, Es, Mendeljejev predvidio 1871. god. |
|
Germanij, Ge, opaženo 1886. god. |
|
boja |
|
siv |
|
sivobijel |
|
relativna atomska masa |
|
72 |
|
72,6 |
|
gustoća |
|
5,5 g cm−3 |
|
5,47 g cm−3 |
|
gustoća oksida |
EsO2 |
4,7 g cm−3 |
GeO2 |
4,703 g cm−3 |
|
vrelište klorida |
EsCl4 |
ispod 100 °C |
GeCl4 |
86 °C |
|
gustoća klorida |
EsCl4 |
1,9 g cm−3 |
GeCl4 |
1,837 g cm−3 |
Doznajte više na:
www.rsc.org/periodic-table/history
Suvremena tablica periodnog sustava elemenata više nema praznih mjesta. Štoviše, znanstvenici su uspjeli načiniti i elemente kojih nema u prirodi. Elementi su u suvremenoj tablici svrstani u vertikalne stupce ili skupine i horizontalne retke ili periode. Elementi su poredani po rednom ili atomskom broju, koji uglavnom prati porast relativne atomske mase elemenata.
Skupine u tablici periodnog sustava elemenata sadržavaju elemente sličnih kemijskih svojstava. Oznake pojedinih skupina, od 1 do 18, dane su prema preporuci Međunarodne unije za čistu i primijenjenu kemiju (International Union of Pure and Applied Chemistry, IUPAC). Skupine elemenata imaju i zasebne nazive. Tako se svi elementi 1. skupine zovu alkalijski metali. To su Li, Na, K, Rb, Cs i Fr, a naziv su dobili po tome što čine jake lužine (alkalije). Elementi 2. skupine, Mg, Ca, Sr, Ba i Ra, zovu se zemnoalkalijski metali, jer su to metali koji ulaze u sastav Zemlje, točnije minerala i stijena a čine također jake lužine (alkalije). Elementi između 2. i 13. skupine zovu se prijelazni metali. Elementi 16. skupine zovu se halkogeni elementi, jer čine rude bakra i cinka (grč. chalkos = slitina bakra i cinka + genesis = rod). Halogenim elementima (grč. hals = sol + genesis = rod) nazivaju se elementi 17. skupine, jer oni sa svim metalima čine soli. Osamnaestu skupinu čine tzv. inertni ili plemeniti plinovi. Naziv "plemeniti" dobili su zato što se pri uobičajenim uvjetima ne spajaju niti s jednim elementom, a osim toga, pri normalnim uvjetima (n.u., p = 101 325 Pa (1 atm), t = 0 °C) u plinovitu su stanju. Međutim, do danas je načinjeno više stotina spojeva kriptona, ksenona i radona npr. XeF2, XeF4, XeF6 i XeO3.
Periodni sustav elemenata D. I. Mendeljejeva iz 1869. i kasnijih godina nije sadržavao plemenite plinove jer oni u to doba nisu bili poznati. Postojanje nepoznatoga inertnog plina utvrdili su tek 1894. John William Strutt Rayleigh (1842. - 1919.) i William Ramsay (1852. - 1916.). Nazvali su ga argon (grč. argos = lijen) zbog njegove kemijske inertnosti. Daljnja su Ramsayjeva istraživanja pokazala da je argon kemijski element. Do 1898. Ramsay je sa suradnicima izolirao još četiri inertna plina - helij, neon, kripton i ksenon. Ramsay je predložio uvođenje posebne skupine u tablicu periodnog sustava elemenata, skupinu plemenitih plinova. Na osnovi njihovih relativnih atomskih masa smješteni su iza halogenih elemenata, a ispred alkalijskih metala. Kasnija određivanja rednih ili atomskih brojeva elemenata (Moseley, 1913; Chadwick, 1920.) dala su dokaze da je takav smještaj plemenitih plinova, kao i nekih drugih elemenata u periodnom sustavu, ispravan. No ta su istraživanja otkrila i odstupanja u nizu porasta relativnih atomskih masa (argon - kalij, kobalt - nikal, telurij - jod, torij - protaktinij).
Redci u periodnom sustavu elemenata (periode), njih sedam, sadržavaju nejednak broj elemenata. Prva ili vrlo kratka perioda sadržava samo dva elementa, vodik i helij. Dvije kratke periode, druga i treća, sadržavaju po 8 elemenata. Prva od tih perioda sadržava elemente s rednim brojevima od 3 do 10, tj. od litija do neona, a druga one rednih brojeva od 11 do 18, tj. od natrija do argona. Dvije duge periode, četvrta i peta, sadržavaju po 18 elemenata. Unutar šeste (vrlo duge periode), koja uključuje 32 elementa, nalazi se i posebna skupina od 14 elemenata. Ti su elementi, od atomskog broja 57 do 70, vrlo sličnih kemijskih svojstava. Nazivaju se lantanoidima jer dolaze iza lantana, metala s kojim pokazuju veliku kemijsku sličnost. I sedma vrlo duga perioda uključuje 14 elemenata, tzv. aktinoida, s atomskim brojevima 89 do 102. To su elementi koji dolaze iza aktinija s kojim pokazuju veliku kemijsku sličnost. Lantanoidi i aktinoidi se zbog posve grafičkih razloga obično izdvajaju na dno tablice periodnog sustava elemenata.
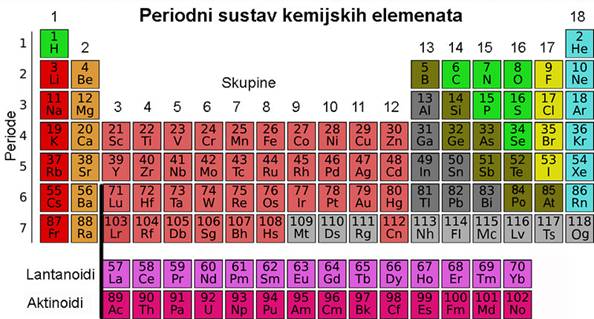
Slika 1.8. Suvremena tablica periodnog
sustava kemijskih elemenata D. I. Mendeljejeva.
Izvor: drum.hr/periodni-sustav-elemenata
Elemente unutar periodnog sustava dijelimo na tipične metale, koji su na lijevoj strani, i tipične nemetale, koji su na desnoj strani tablice. Neki elementi pokazuju kemijska i fizička svojstva koja su na prijelazu između svojstava tipičnih metala i tipičnih nemetala, pa se nazivaju metaloidima. To su bor, silicij, germanij, arsen, antimon, telur, polonij i astat.
Nakon što je Mendeljejev otkrio periodni zakon mnogi su autori smislili različite prikaze periodnog sustava elemenata koje možete naći u Internetskoj bazi tablica periodnog sustava na adresi:
1.4. Porijeklo imena kemijskih elemenata
Imena elemenata imaju zanimljivu povijest. Neki su elementi poznati od davnine, pa se i ne zna kako su dobili ime. Većini elemenata imena su dali znanstvenici koji su ih i otkrili. Obično su to bila latinizirana imena. Kad govore o kemijskim elementima kemičari se služe simbolima. Taj skraćeni način pisanja imena elemenata uveo je Jöns Jakob Berzelius (1779. - 1848.), švedski kemičar, liječnik i pronalazač, najveći znanstveni autoritet u kemiji svoga doba. Simbol se sastoji od velikoga početnog i malog, obično drugog slova latiniziranog imena elementa. Samo neki elementi imaju simbol koji se sastoji samo od jednog, velikog slova. Tablica 1.5. sadržava latinizirana imena, godinu otkrića te objašnjenje podrijetla imena prvih 20 elemenata.
Tablica 1.5. Imena i porijeklo imena nekih kemijskih elemenata
|
Latinizirano ime |
Simbol |
Godina otkrića |
Istraživač Porijeklo imena |
|
Hydrogenium |
H |
1766 |
H. Cavendish grč. hydor = voda + genesis = postanak predložio ga je 1799. Lavoisier, pošto je odredio sastav vode |
|
Helium |
He |
1868. |
N. Locquier, J. Jensen grč. hellios = Sunce (otkriven analizom Sunčeva spektra), linije nepoznatog elementa u Sunčevu spektru snimili su astronomi Locquier i Jensen 1868., a objasnio Locquier 3. 4. 1871. god. |
|
Lithium |
Li |
1817. |
I. Arfvedson grč. lithos = kamen (otkriven u mineralu petalitu); nalazi se u stijenama, a natrij i kalij u živom svijetu |
|
Berillyum |
Be |
1798. |
L. Vouquelin grč. beryllos = dragi kamen (otkriven u berilima, dragom kamenju); prvotno ime glicinium (grč. glykys = sladak), jer su mu spojevi slatki. |
|
Borum |
B |
1808. |
J. Gay-Lussac, L. Thenard,
H. Davy boraks, po kojemu je bor dobio ime, upotrebljavao se već u srednjem vijeku; bor su od 21. 6. do 30. 6. 1808. neovisno otkrila tri kemičara |
|
Carboneum |
C |
|
Poznat od antičkog doba (lat. carbo = ugljik). Latinizirano ime ima korijen u sanskrtu gdje cra znači kuhati; naše ime ugljik potječe od češkoga uhlik. |
|
Nitrogenium |
N |
1772. |
grč. nitron + genesis = koji tvori salitru (natrijev nitrat); Lavoisier je predložio ime azot, prema grč. a + zoe = neživot,ne podržava život |
|
Oxygenium |
O |
1774. |
J. Priestley C. Scheele grč. oxys+ genesis = tvori kiseline; ime je predložio Lavoisier, smatrajući da sve kiseline moraju sadržavati kisik
|
|
Fluorum |
F |
1771 |
C. Scheele lat. fluere = teći; fluorit, kalcijev fluorid, upotrebljava se kao dodatak pri taljenju metala; ime je predložio Davy, analogno imenu chlorum |
|
Neon |
Ne |
1898. |
W. Ramsay M. Travers grč. neos = nov; ime je predložio dvanaestogodišnji Ramsayjev sin; postojanje tog elementa pretpostavljeno je na osnovi periodnog sustava |
|
Natrium |
Na |
1807. |
H. Davy egipatski n'tr = hebrejski neter = grč. nitron = lat. nitrum = soda = natrijev karbonat; ime sodium dolazi od soda, pri čemu se mislilo na prirodnu sodu, mineral trona; kalijev nitrat također se zvao nitrum; soda i salitra nisu se razlikovale sve do otkrića baruta |
|
Magnesium |
Mg |
1808 |
H. Davy žarenjem minerala nađenih u grčkoj pokrajini Magneziji dobiva se bijeli prah jednak onome što se dobiva od sode i »gorke soli« |
|
Aluminium |
Al |
1825. |
H. Oersted lat. alumen = alaun; poznat je odavno, a služio je pri bojenju tkanina; »srebro iz gline« izloženo je tek 1855. na svjetskoj izložbi u Parizu; (u Rusiji se dugo vremena aluminij zvao »glinium«) |
|
Silicium |
Si |
1823. |
J. Berzelius lat. silex = kremen |
|
Phosphorus |
P |
1669. |
H. Brandt grč. fotos = svjetlo + foros = nosač (onoj koji nosi svjetlo); Brandt, propali trgovac i alkemičar iz. Hamburga, destilirao je mokraću ne bi li pronašao »kamen mudraca« kojim bi obične metale pretvorio u zlato, tako je otkrio bijeli fosfor, vjerujući do je uspio izolirati element vatru |
|
Sulphur |
S |
|
poznat od antičkog doba |
|
Chlorum |
Cl |
1774. |
C. Scheele grč. chloros = zelen; Davy ga je 1810. tako nazvao zbog njegove zelene boje |
|
Argon |
Ar |
1894 |
W. Ramsay, W. Rayleigh grč. argos = lijen, neaktivan (ime dobio zbog kemijske inertnosti) |
|
Kalium |
K |
1807. |
H. Davy arap. kali = pepeo; potasium je kovanica od engl. riječi pot = lonac + ash = pepeo; potaša, kalijev korbonat - dobivao se od pepela drveća |
|
Calcium |
Ca |
1808. |
H. Davy lat. calx = vapno |
Doznajte više na:
en.wikipedia.org/List_of_chemical_element_name_etymologies
doi.org/KUI.2017.022
1.5. Plemeniti plinovi
Plemeniti plinovi nemaju miris ni okus, a u vodi su slabo topljivi. Danas imaju važnu primjenu u tehnologiji i znanstvenim istraživanjima. Primjerice, smjese helija, kisika i dušika, tzv. Trimix, rabe se za punjenje boca za dubinsko ronjenje ispod 40 m. Helij se dodaje da bi se smanjio udjel dušika i kisika u "zraku" koji ronioci udišu pri povišenom tlaku. Neon se rabi za punjenje reklamnih svjetlećih cijevi. Argon se koristi za punjenje sijalica sa žarnom niti, no još je važnija njegova primjena kao zaštitne atmosfere pri zavarivanju. Kripton i ksenon rabe se za punjenje sijalica i bljeskalica.
Iako se mislilo da plemeniti plinovi ne mogu ulaziti u sastav kemijskih spojeva, napravljeno je više stotina spojeva ksenona, npr. s fluorom (XeF2, XeF4, XeF6) i kisikom (XeO3), a dobiveni su i spojevi kriptona i radona.
Među atomima plemenitih plinova djeluju samo slabe Van der Waalsove privlačne sile. One rastu s porastom broja elektrona u elektronskom omotaču, tj. porastom atomskog broja (vidi poglavlje 6.16). Jednako rastu i tališta i vrelišta plemenitih plinova. Primjerice, talište helija je pri 0,95 K (−272,2 °C), a vrelište pri 4,22 K (−268,93 °C), dok je talište ksenona pri 161,4 K (-111,75 oC), a vrelište pri 165,15 K (-108,0 oC).
Dovoljno ohlađeni plemeniti plinovi prijeći će u tekuće stanje, a kristalizirat će se pri još nižoj temperaturi. Zamislimo li atome plemenitih plinova kao kuglice među kojima djeluju vrlo slabe privlačne sile, možemo pretpostaviti da će se atomi u kristalima složiti poput kuglica i to na najgušći mogući način. Naime, krajem 19. i početkom 20. stoljeća kristalne strukture minerala, metala i najjednostavnijih kemijskih spojeva, kao što je natrijev klorid, bile su potpuna nepoznanica. Ipak, znanstvenici su još u 19. stoljeću pretpostavili postojanje jednostavnih kristalnih struktura. Dobar primjer je niz kristalnih struktura koje je 1883. objavio engleski geolog i kristalograf William Barlow (1845. – 1934.). Atome je smatrao čvrstim kuglicama. Tako je za kristale koji se sastoje samo od jedne vrste atoma predvidio da imaju strukturu najgušće slagaline kuglica jednake veličine (vidi sliku 5.9a).
Ponovimo
· Sve se tvari mogu podijeliti u dvije skupine: elementarne tvari i kemijske spojeve.
· Elementarne tvari su tvari koje se nikakvim kemijskim postupkom ne mogu razložiti na nove, jednostavnije tvari (Lavoisier, 1789.).
· Elementarna tvar je makroskopski uzorak tvari koja se sastoji od istovrsnih atoma, tj. od atoma istog kemijskog elementa.
· Mendeljejevu nesumnjivo pripada prvenstvo u otkriću periodnog zakona. I drugi su istraživači u to doba sastavljali tablice elemenata, ali je samo Mendeljejev uočio prirodnu zakonitost kojoj podliježu kemijski elementi. U članku iz 1871. predvidio je postojanje i svojstva još 11 nepoznatih elemenata.
Pitanja i zadaci 1
- Po kojem su kriteriju elementi u periodnom sustavu svrstani u skupine i
periode?
- Razvrstajte nabrojane kemijske elemente na metale, nemetale i metaloide:
Au, B, C, Na, Ne, Pu, Si, S, Se, Te, Ti.
- Usporedite električnu i toplinsku provodnost metala, nemetala i
metaloida.
- Ne gledajući u tablicu periodnog sustava elemenata nabrojite sve
elemente druge skupine.
- Kako se zvala Tantalova kći i koji je element po njoj dobio ime?
- Metalurzi koji su se na tlu Njemačke u srednjem vijeku bavili dobivanjem kositra primijetili su da dobivaju mnogo manje kositra kada se u rudi nađe "teško kamenje" smeđe ili žućkaste boje. Govorili su da teški kamen proždire kositar kao vuk ovcu. Švedski kemičar Sheele u tom je kamenju 1781. otkrio novi kemijski element kojemu je dao i ime, a koje prevedeno na hrvatski, znači "vučja pjena". O kojemu je kemijskom elementu riječ?
2. FORMULA KEMIJSKOG SPOJA
Sve su tvari izgrađene od atoma. To je temeljno učenje kemije. Atomi su najmanje čestice bakra, sumpora i svih drugih elementarnih tvari ili kemijskih elemenata. Atomi se mogu međusobno spajati u različitim brojčanim omjerima. Pri tome nastaju kemijski spojevi.
Već smo kazali da su bakar i sumpor elementarne tvari koje se nikakvim kemijskim postupkom ne mogu razložiti na jednostavnije tvari. No, što će se dogoditi ako pomiješamo bakar sa sumporom te smjesu zagrijemo? Odgovor slijedi iz pokusa.
POKUS 2.1. Reakcija bakra sa sumporom
Vidi na Internetu: www.youtube.com/watch?v=2FGICnXEVCA
Pri zagrijavanju smjese bakra i sumpora događa se kemijska promjena: sumpor i bakar međusobno reagiraju uz pojavu crvenog žara i oslobađanje topline. Pritom nastaje nova tvar, kemijski spoj bakra sa sumporom. Spojevi sa sumporom nazivaju se sulfidi (lat. sulphur – sumpor), pa se kaže da je reakcijom bakra sa sumporom nastao bakrov sulfid. Bakar i sumpor su reaktanti, a bakrov sulfid produkt kemijske reakcije.
Vaganjem smo ustanovili da je masa reaktanata jednaka masi produkata i time dokazali zakon o očuvanju mase u kemijskim reakcijama.
Masa tvari koje ulaze u kemijsku reakciju jednaka je masi tvari koje nastaju tom reakcijom.
Taj su zakon, neovisno jedan o drugome, otkrila i dokazala dva kemičara – ruski kemičar Mihail Vasiljevič Lomonosov 1748. i francuski kemičar Lavoisier 1785. godine.
Fizička svojstva bakrova sulfida bitno se razlikuju od svojstava elementarnog bakra i sumpora. Dok je bakar lako savitljiva crvenkasta kovina, a sumpor žuti prah, nastali bakrov sulfid je crna ili tamnoplava masa koja se može drobiti prstima.
Kemijskom analizom ustanovljeno je da pri temperaturi višoj od 450 oC nastaje spoj bakra sa sumporom u kojemu je maseni udio bakra w(Cu) = 0,798. No, u prirodi se nalazi vrlo rijedak mineral kovelin, boje indiga, u kojemu je maseni udio bakra w(Cu) = 0,664. Maseni udio nekog sastojka u kemijskom spoju jest omjer mase tog sastojka prema masi svih sastojaka spoja. Za spoj dobiven pri temperaturi višoj od 450 oC vrijedi:
w(Cu) = m(Cu) / m(bakrov sulfid) = 0,798 ili 79,8 %
Ostatak do 100 % čini sumpor i njegov je maseni udio: w(S) = 1.000 – 0,798 = 0,202 ili 20,2 %.
No, nas ovdje zanima omjer broja atoma bakra i sumpora u spoju. Omjer broja atoma bakra, N(Cu), i broja atoma sumpora, N(S), izračunat ćemo tako da masene udjele elemenata u spoju podijelimo njihovim relativnim atomskim masama. U prvom slučaju dobivamo:
N(Cu) : N(S) = w(Cu)/Ar(Cu) : w(S)/Ar(S) = 0,798/63.55 : 0,202/32,06 = 0,0126 : 0,00630 = 2 : 1.
Dakle, reakcijom bakra sa sumporom, pri temperaturi višoj od 450 oC, dobiva se bakrov sulfid u kojemu su atomi bakra i sumpora spojeni u omjeru 2 : 1. Omjer broja atoma kemijskih elemenata u spoju kemičari iskazuju kemijskom formulom. Prema tome Cu2S je formula dobivena bakrova sulfida.
Jednakim postupkom za mineral kovelin dobivamo:
N(Cu) : N(S) = w(Cu)/Ar(Cu) : w(S)/Ar(S) = 0,664/63.55 : 0,336/32,06 = 0,01045 : 0,01048 = 1 : 1.
U mineralu kovelinu atomi bakra i sumpora spojeni su u omjeru 1 : 1, pa je njegova formula CuS.
Tako smo "otkrili" zakon stalnih omjera masa, koji je još 1799. godine otkrio francuski kemičar Joseph Proust (1754. - 1826).
Dva ili više kemijskih elemenata uvijek se međusobno spajaju u kemijski spoj u stalnom omjeru njihovih masa.
Također smo "otkrili" i zakon umnoženih omjera masa, koji je 1802. godine postavio engleski kemičar John Dalton (1766. - 1844.).
Kad se dva elementa spajaju tako da daju više nego jedan kemijski spoj onda se mase jednog elementa koje se spajaju s određenom masom drugog elementa odnose kao mali cijeli brojevi.
(Opaska: Osim Cu2S i CuS, bakar i sumpor čine čitav niz spojeva različita sastava.)
Većina tvari izgrađena je od molekula. Molekula se može sastojati od atoma istoga elemenata ili od atoma više različitih elemenata.
Neki kemijski elementi dolaze u obliku dvoatomnih molekula. To su vodik, kisik, dušik, fluor, klor, brom i jod, a njihove molekule prikazujemo kemijskim formulama: H2, O2, N2, F2, Cl2, Br2 i I2 (čitaj: ha-dva, o-dva, en-dva, ef-dva, ce-el-dva, be-er-dva, jod-dva). Kisik se javlja i kao ozon, čije se molekule sastoje od triju atoma, pa mu je kemijska formula O3. Fizička i kemijska svojstva običnog kisika, O2, i ozona, O3, različita su. Molekule bijeloga fosfora sastoje se od četiri atoma, pa bijeli fosfor obilježavamo formulom P4. Molekule sumpora imaju osam atoma, pa zbog toga elementarni sumpor obilježavamo formulom S8, no poznate su i molekule sumpora S2, S6, S10, S12 i dr.
Tih nekoliko primjera dovoljno jasno pokazuje kako atomi nemetala tvore jednostavne molekule. Atomi metaloida (bor, silicij, germanij, arsen, antimon, telur, polonij, astat) i ugljika ne tvore jednostavne molekule, već se međusobno vezuju tako da tvore složene strukture koje uključuju velik broj istovrsnih atoma. Slično se i atomi metala slažu poput kuglica, tvoreći trodimenzijske strukture od vrlo velikog broja atoma. Stoga sve metaloide, metale i ugljik kad su u elementarnom stanju obilježavamo samo simbolom elementa.
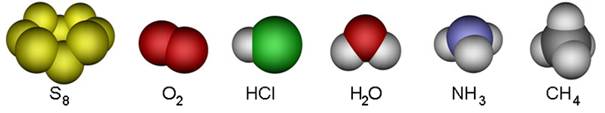
Slika 2.1. Kalotni modeli nekih molekula
Na sl. 2.1. prikazano je nekoliko primjera modela molekula s pripadnim kemijskim formulama koje pokazuju brojeve atoma koji ih izgrađuju. Molekule redovito nastaju pri međusobnom spajanju atoma nemetala. Pri međusobnom spajanju atoma metala s atomima nemetala najčešće nastaju kristalne strukture, a rjeđe jednostavne molekule. Formule spojeva s kristalnim strukturama, u kojima nema izoliranih molekula, pišu se tako da pokazuju omjer najmanjih brojeva različitih atoma koji čine kristalnu strukturu. Tako se sastav kalcijeva karbonata (minerala kalcita koji izgrađuje vapnenac i mramor) prikazuje formulom CaCO3. Ta formula znači da su u kalcijevu karbonatu atomi kalcija, ugljika i kisika vezani u omjeru 1 : 1 : 3. U strukturi kalcijeva karbonata nema izoliranih molekula CaCO3. Najjednostavnije formule takvih spojeva zovu se formulske jedinke.
2.1. Relativna molekulska masa
Za razumijevanje kvantitativnih odnosa tvari u kemijskim reakcijama treba poznavati njihove relativne molekulske mase.
Relativna molekulska masa spoja izračunava se tako da se zbroje relativne atomske mase svih atoma u molekuli ili formulskoj jedinki spoja.
Da bismo izračunali relativnu molekulsku masu, primjerice ugljikova dioksida CO2, upotrijebit ćemo tablice relativnih atomskih masa ili periodni sustav elemenata. Iz tih je izvora vidljivo:
- relativna atomska masa ugljika, Ar(C) = 12,011 15
- relativna atomska masa kisika, Ar(O) = 15,999 4
Kako molekula ugljikova dioksida sadržava jedan atom ugljika i dva atoma kisika, relativna molekulska masa ugljikova dioksida izračuna se tako da se zbroje relativne atomske mase jednog atoma ugljika i dvaju atoma kisika:
Mr(CO2) = Ar(C) + 2 Ar(O)
= 12,011 + 2 · 15,999
= 44,009
Relativne molekulske mase spojeva s kristalnom strukturom, u kojima nema izoliranih molekula, izračunaju se tako da se zbroje relativne atomske mase atoma koji čine formulsku jedinku. Na primjer, relativna molekulska masa kalcijeva karbonata, CaCO3, bit će:
Mr(CaCO3) = Ar(Ca) + Ar(C) + 3 Ar(O)
= 40,08 + 12,01 + 3 · 16,00
= 100,09
Relativne atomske mase nekih elemenata u tablicama dane su s vrlo velikom točnošću, s više znamenki, dok su relativne atomske mase drugih elemenata manje točne. Manja točnost, tj. manji broj znamenki u vrijednosti relativne atomske mase, uzrokovan je nejednolikim izotopnim sastavom elemenata u prirodi. Da bi se pojednostavilo izračunavanje, relativne se atomske mase elemenata zaokružuju na ukupno četiri znamenke. Time se postiže da se relativne atomske mase svih elemenata uzimaju s jednakom točnošću. Tako smo postupili u primjeru izračunavanja relativne molekulske mase kalcijeva karbonata.
2.2. Molarne veličine
"Sitna roba" u trgovinama nekad se prodavala na tucete, a i danas to čine trgovci u Sjedinjenim Američkim Državama. Kod nas se kupuju jaja u kutijama po 10, a u Americi u kutijama po 12. Tucet ili tuce (njem. Dutzend: dvanaest), stara je brojčana jedinica za količinu stvari, a znači dvanaest komada. (To je praktična jedinica jer se može lako dijeliti (12 = 2 x 6 = 4 x 3). Kemičari imaju sličnu brojčanu jedinicu za količinu tvari. Ona se naziva mol, a znači 6,022 140 76 × 1023 komada. Najnovija definicija mola, koja se primjenjuje od 2019. glasi:
Mol, simbol mol, je SI jedinica količine tvari. Jedan mol sadržava točno 6,022 140 76 × 1023 definiranih jedinki. Taj broj se zove Avogadrov broj te je ujedno brojčana vrijednost Avogadrove konstante, NA = 6,022 140 76 × 1023 mol−1.
Izvor: iupac.org/new-definition-mole-arrived
Pod definiranim jedinkama razumiju se atomi, molekule, ioni, elektroni, ili bilo koje druge čestice ili skupina definiranih čestica. Prema novoj definiciji mol je SI jedinica neovisna o bilo kojoj drugoj jedinici.
Nova definicija mola izrekom govori o količini tvari (engl. amount = iznos, svota, količina), dakle definiranom broju. U nas se za količinu tvari rabi nezgrapan izraz množina koji ničim ne ukazuje na broj jedinki, a to je suština fizičkog značenja SI jedinice mol.
Upamtite:
Avogadrov broj: N = 6,022 × 1023
Avogadrova konstanta: NA = 6,022 × 1023 mol−1.
Količina tvari je omjer broja jedinki tvari (N) i Avogadrove konstante (NA) i označava se znakom n.
Molarna masa je omjer mase (m) i količine tvari (n) i označuje se znakom M.
Molarni volumen plina je omjer volumena plina (Vo) i
količine plina (n) i označuje se znakom Vom
.
Navedene fizičke veličine u sljedećem su međusobnom odnosu koji valja upamtiti:
n
=
![]() =
=
![]() =
=
![]()
Odavde proizlazi: odvažemo li onoliko grama neke tvari kolika je njezina relativna atomska ili molekulska masa, onda smo odvagali 1 mol, tj. Avogadrov broj čestica te tvari. Primjerice:
1 mol atoma C = 6,022 · 1023 atoma C ≈ 12,01 g ugljika
1 mol molekula CO2 = 6,022 · 1023 molekula CO2 ≈ 44,01 g ugljikova dioksida
1 mol atoma Al = 6,022 · 1023 atoma Al ≈ 26,98 g Al
Kako se navedene fizičke veličine rabe pri računanju količina tvari koje se troše ili nastaju u kemijskim reakcijama pokazat ćemo na nekoliko primjera.
Primjer 2.1. Izrazite količinu (množinu) broma u 100 g broma jedinicom mol, uzimajući kao formulske jedinke molekule broma, Br2.
Rješenje
Relativna molekulska masu broma je:
Mr(Br2) = 2 · Ar(Br) = 2 ·79,9 = 159,8
Odvažemo li 159,8 g broma odvagali smo Avogadrov broj, odnosno 1 mol molekula Br2. Molarna masa broma jest, M(Br2) = 159,8 g mol−1, pa za količinu (množinu) broma u 100 g broma dobivamo:
![]() Br2
Br2![]()
![]() =
= ![]() =
= ![]()
Primjer 2.2. Izračunajte broj molekula u 20 g ugljikova dioksida, CO2.
Rješenje
Kako je:
n =vrijedi:
N(![]() ) =
) = ![]()
![]()
U 20 g ugljikova dioksida ima 2,737 ![]() 1023 molekula
CO2.
1023 molekula
CO2.
Primjer 2.3. Analizom je nađeno da je u jednom organskom spoju maseni udio ugljika 0,522 ili 52,2 %, vodika 0,13 ili 13,1 %, a ostatak do 100 % čini kisik. Izračunajte formulu istraživanog spoja.
Rješenje
Omjer broja atoma ugljika, vodika i kisika u spoju izračunat ćemo tako da masene udjele elemenata u spoju podijelimo njihovim relativnim atomskim masama. Maseni udjeli i relativne atomske mase su neimenovani brojevi pa vrijedi:
N(C) : N(H) : N(O) =
![]() 4,35 : 13,1 : 2,17
4,35 : 13,1 : 2,17
Dobiveni omjer podijelimo s najmanjim članom pa dobivamo:
N(C) : N(H) : N(O) =
![]()
Proizlazi da je empirijska formula istraživanog spoja C2H6O.
Empirijska formula daje najmanji mogući omjer broja atoma kemijskih elemenata u nekom spoju. No, prava ili molekulska formula pokazuje broj pojedinih atoma u molekuli spoja. To može biti cjelobrojni višekratnik izračunane empirijske formule. Da bismo doznali pravu formulu spoja moramo nečime, recimo masenim spektrometrom, izmjeriti relativnu molekulsku masu kemijskog spoja. Relativna molekulska masa spoja jednaka je zbroju relativnih atomskih masa atoma koje čine formulsku jedinku ili molekulu spoja.
Primjer 2.4. U epruveti od teškotaljiva stakla ugrijana je smjesa 0,1 g aluminija i 0,2 g sumpora. Na vrh epruvete postavljen je dječji balon kako bi se u epruveti zadržali svi reaktanti i produkti kemijske reakcije. Koliko je nastalo aluminijeva sulfida, Al2S3? Koji je reaktant u višku? Ar(S) = 32, Ar(Al) = 27.
Rješenje
Izračunajmo najprije količine (množine) uzetih reaktanata u reakcijskoj smjesi tako da njihove mase podijelimo pripadnim molarnim masama, pa dobivamo:
n(Al) = m(Al)/M(Al) = 0,1 g/27 g mol−1 = 3,70 · 10−3 mol
n(S) = m(S)/M(S) = 0,2 g/32 g mol−1 = 6,25 · 10−3 mol
Aluminij i sumpor spajaju se u omjeru n(Al) : n(S) = 2 : 3
Odavde proizlazi da s 3,70 · 10−3 mol aluminija reagira sljedeća količina (množina) sumpora:
n(S) = (3/2) · n(Al) = (3/2) · 3,70 · 10−3 mol = 5,55 · 10−3 mol.
Kako je u reakcijsku smjesu uzeto 6,25 · 10−3 mol, a izreagiralo samo 5,55 · 10−3 mol sumpora, proizlazi da je višak sumpora:
n(Svišak) = n(Suzeto) − n(Sreagiralo) = (6,25 · 10−3 mol) − (5,55 · 10−3 mol) = 0,70 · 10−3 mol
Reakcijom je nastao 1,85 · 10−3 mol aluminijeva sulfida, tj. 0,278 g Al2S3, dok je 0,022 g sumpora bilo u višku.
Primjer 2.5. Kolika je masa ugljikova dioksida nastalog gorenjem 1000 g ugljika uz velik dostup zraka? Ar(C) = 12, Ar(O) = 16.
Rješenje
Uz velik dostup zraka gorenjem ugljika nastaje ugljikov dioksid, CO2. Napišimo jednadžbu reakcije.
C(s) + O2(g) → CO2(g)
Jednadžba pokazuje da reakcijom jednog atoma ugljika i jedne molekule kisika nastaje jedna molekula ugljikova dioksida. Odavde proizlazi da reakcijom jednog mola atoma ugljika i jednog mola molekula kisika nastaje jedan mol molekula ugljikova dioksida, pa vrijedi:
n(C) = n(O2) = n(CO2)
Kako je:
n = ![]() =
= ![]() =
= ![]()
proizlazi:
m(CO2) = ![]() =
= ![]() 3667 g
3667 g
POKUS 2.2. Broj formulskih jedinki krede u vašem potpisu na ploči
Pribor i kemikalije: Osjetljiva vaga, školska kreda
Postupak
1. Uzmite komadić krede i izvažite na osjetljivoj vagi.
2. Potpišite se na ploči ili napišite neku riječ te ponovo izvažite kredu.
3. Izračunajte "masu krede u potpisu".
4. Izračunajte količinu (množinu) krede u potpisu uz pretpostavku da se školska kreda sastoji od kalcita, tj. kalcijeva karbonata, CaCO3.
5. Izračunajte broj formulskih jedinki "krede" u vašem potpisu.
2.3. Molarni volumen plinova
U plinu su čestice daleko jedna od druge. Čestice plina su u stalnom nasumičnom kretanju, sudaraju se međusobno, ali i sa stijenkama posude stvarajući tako tlak. Među česticama plina djeluju vrlo slabe, gotovo nikakve privlačne sile. Zato plinovi nemaju određen ni oblik niti volumen. Volumen neke količine plina, primjerice jednog mola ili 6,022 × 1023 čestica plina, ovisi samo o volumenu posude u kojoj se nalazi. Pri normalnom atmosferskom tlaku, 101 325 Pa, i temperaturi t = 0 oC (273,15 K), jedan mol, tj. Avogadrov broj čestica plina zauzima volumen od 22,414 L. Pri dvostruko većem tlaku isti broj čestica plina zauzima upola manji volumen. Između tlaka, p, i volumena, V, stalne količine plina pri stalnoj temperaturi vrijedi sljedeći odnos:
p × V = konstanta
Tu je zakonitost još 1662. godine otkrio irski znanstvenik i filozof Robert Boyle (1627. - 1691.). Istu je zakonitost 1677. neovisno pronašao i francuski prirodoslovac Edme Mariotte (1620. - 1684.).
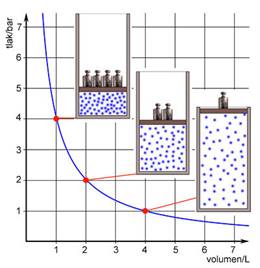
Slika 2.2. Boyle-Mariotteov zakon kaže da je volumen stalne količine plina pri stalnoj temperaturi obrnuto proporcionalan tlaku (p · V = konstanta).
Boyle-Mariotteov zakon često se piše u obliku:
![]()
gdje je V1 volumen neke količine plina pri tlaku p1, a V2 volumen iste količine plina pri tlaku p2.
Povisi li se temperatura plina, njegov će se volumen pri istom tlaku povećati. Promjenu volumena i tlaka plina pri promjeni temperature proučavali su francuski znanstvenici Jacques Charles (1746. - 1823.) i Joseph Louis Gay-Lussac (1778. - 1850.). Charles je 1787. objavio da se pri istom porastu temperature volumen različitih plinova poveća za isti iznos. Godine 1802. Gay-Lussac je pak odredio porast volumena kad se plin zagrije za 1 °C. Na osnovi njihovih mjerenja proizlazi da za stalnu količinu plina vrijedi odnos:
![]()
Taj se zakon obično piše u obliku:
![]()
gdje je V1 volumen neke količine plina pri temperaturi T1, a V2 volumen istoga plina pri temperaturi T2. Temperatura se mora izraziti u kelvinima (K). Između temperature u kelvinima, a to je apsolutna ili termodinamička temperatura T , i nama dobro poznate Celzijusove temperature t vrijedi odnos:
t/°C = T/K - 273,15.
Također je nađeno da za stalnu količinu plina vrijedi:
![]()
Sve tri zakonitosti mogu se izraziti jednom jednadžbom:
![]()
Očito, volumen, tlak i temperatura plina međusobno su zavisne veličine. Zato je dogovoreno da se volumen neke količine plina uvijek izražava pri normalnim uvjetima, (n.u.), a to su normalni tlak, koji je jednak 101 325 Pa (1 atm) i normalna temperatura, koja iznosi 273,15 K (0 °C) .
Kako mol bilo koje tvari sadržava jednak, tj. Avogadrov broj čestica, slijedi da i mol bilo kojeg plina mora imati isti volumen pri istom tlaku i temperaturi. Omjer volumena nekog plina (jedinica L) i njegove količine (jedinica mol) daje novu fizičku veličinu koja se zove molarni volumen, za koju se upotrebljava znak Vm. Uzme li se 1 mol plina, on će pri normalnim uvjetima zauzimati volumen od 22,414 L.
![]()
Međunarodna unija za čistu i primijenjenu kemiju (International Union of Pure and Applied Chemistry, IUPAC) preporučila je 1982 god. da se više ne koristi 1 atm (ekvivalent 101 325 Pa) kao normalni tlak, već standardni tlak po = 105 Pa i standardna temperatura To= 273.15 K (0 °C). Pri tako definiranim standardnim uvjetima, molarni volumen plina je: Vmo = 22.711 L mol−1.
Primjer 2.6. Koliki volumen pri n.u. zauzima 1015 molekula nekoga plina?
Rješenje
Sjetimo se da se količina (množina) tvari može izraziti ovim omjerima:
n = ![]() =
= ![]() =
= ![]()
Odavde proizlazi da je volumen 1015 molekula plina pri normalnim uvjetima:
![]() =
= ![]() 0,03722 μL
0,03722 μL
2.4. Opća plinska jednadžba
Ako se u jednadžbu za stanje plina
![]()
uvrste podaci za tlak i volumen što ga zauzima 1 mol plina pri normalnim uvjetima, dobiva se:
![]() =
= ![]() 0,022414 m3
mol−1 = 8,31447 J K−1 mol−1
0,022414 m3
mol−1 = 8,31447 J K−1 mol−1
Ako se u neki izraz ulaze same konstantne veličine, p°, V° i T°, onda se mora dobiti nova konstanta. U ovom slučaju dobivena je univerzalna plinska konstanta, R = 8,314 J K−1 mol−1.
Prema tome, jednadžba stanja za 1 mol plina može se napisati u obliku:
![]()
Lako je pokazati da za n mola plina ista jednadžba glasi:
pV = n R T
Ta se jednadžba zove opća plinska jednadžba. Ona strogo vrijedi za idealne plinove. Idealnih plinova u prirodi nema. Međusobne ovisnosti tlaka, volumena i temperature plinova kao što su vodik, kisik i dušik samo se približno pokoravaju općoj plinskoj jednadžbi, ali dovoljno točno za svakodnevna mjerenja i izračunavanja u školskom laboratoriju. Iz jednadžbe proizlazi da bi pri temperaturi 0 K, tj. pri apsolutnoj nuli temperature, tlak i volumen plina morali biti jednaki nuli. To ne može biti jer bi se tvar pretvorila u ništa. Stvarni, realni plinovi imaju dakako pri 0 K volumen, a taj je volumen jednak volumenu samih čestica plina. Mjerenja su usto pokazala da pri visokom tlaku realni plinovi pokazuju manji tlak nego što proistječe iz jednadžbe. To se može objasniti privlačnim silama među česticama plina, koje su to jače što su čestice plina bliže. Zbog toga je tlak čestica plina na stijenke posude manji.
Pri malom tlaku čestice plina su daleko jedna od druge, pa među njima djeluju slabe privlačne sile. Zato se ponašanje realnih plinova pri malom tlaku i visokoj temperaturi može dosta dobro opisati jednadžbom za idealne plinove.
POKUS 2.3. Određivanje debljine aluminijske folije
Pribor i kemikalije: čaša od 500 mL ili plastična boca od gaziranih napitaka prerezana na polovini visine, menzura od 100 mL, široka epruveta s prikladnim probušenim gumenim čepom, komadić gumene ili plastične cijevi, 2 koljenasto savijena staklene cijevi, termometar, željezni stalak, hvataljka, aluminijska folija, ravnalo, škare. Ar(Al) = 27, r(Al) = 2,7 g cm−3.
Postupak
1. Složite aparaturu kao na slici 2.3. Menzuru napunite vodom do vrha tako da se voda prelijeva preko ruba. Na tako napunjenu menzuru postavite komadić papira, neznatno veći od promjera otvora menzure. Pazite da ispod papira ne bude mjehurića zraka. Tako napunjenu menzuru možete okrenuti bez opasnosti da se voda prolije. Uronite menzuru u čašu napunjenu do polovine vodom. Papir će otpasti a menzura će ostati ispunjena vodom. Menzuru učvrstite hvataljkom za stalak. Koljenasto savijenu cijev podmetnite pod otvor menzure kako biste sakupili razvijeni plin.

Slika 2.3. Aparatura za mjerenje volumena vodika nastalog reakcijom aluminijske folije i klorovodične kiseline.
2. Izrežite kvadratičan komad aluminijske folije s bridom 4 cm.
3. U široku epruvetu ulijte 10 do 15 mL 15 %-tne klorovodične kiseline.
4. Zgužvajte foliju , ubacite u epruvetu i odmah začepite pripadnim gumenim čepom. Pritom ćete istisnuti malo zraka u preokrenutu menzuru. Odčitajte volumen istisnutog zraka. Njega treba odbiti od ukupnog volumena plina sakupljenog u menzuri.
5. Nakon minutu-dvije aluminijska folija odjednom će se burno otopiti. Kad se sav aluminij otopi odčitajte volumen razvijena vodika. Prema potrebi podignite ili spustite menzuru, ili u čašu dolijte vode, kako bi se razine vode u menzuri i čaši izjednačile.
6. Izmjerite temperaturu vode u čaši. Pretpostavljamo da je temperatura vodika jednaka temperaturi vode. Izmjerite atmosferski tlak i izrazite ga jedinicom Pa. Od izmjerenoga atmosferskoga tlaka odbijte parcijalni tlak vodene pare. Na osnovi dobivenih podataka izračunajte debljinu aluminijske folije.
Tablica 2.1. Parcijalni tlak vodene pare
|
t / °C |
p(H2O) / Pa |
t / °C |
p(H2O) / Pa |
|
11 |
1 312 |
21 |
2486 |
|
12 |
1 402 |
22 |
2 643 |
|
13 |
1 497 |
23 |
2 809 |
|
14 |
1 598 |
24 |
2 983 |
|
15 |
1 705 |
25 |
3 167 |
|
16 |
1 818 |
26 |
3 361 |
|
17 |
1 937 |
27 |
3 565 |
|
18 |
2 063 |
28 |
3 780 |
|
19 |
2 197 |
29 |
4 005 |
|
20 |
2 338 |
30 |
4 243 |
| Rezultati mjerenja : | |
| Volumen vodika | V(H2) = |
| Temperatura vodika | T = |
| Barometarski tlak | p(ukupno) = |
| Tlak vodene pare pri temperaturi pokusa | p(H2O) = |
| Parcijalni tlak vodika | p(H2) = p(ukupno) – p(H2O) = |
| Količina (množina) nastalog vodika | n(H2) = p(H2) · V(H2) /R T = |
| Jednadžba reakcije otapanja aluminija | 2Al(s) + 6HCl(aq) → 3H2(g) + 2AlCl3(aq) |
| Količina (množina) aluminija: | n(Al) : n(H2) = 2 : 3 n(Al) = |
| Masa aluminija | m(Al) = n(Al) · M(Al) |
| Volumen aluminija | V(Al) = m(Al)/r(Al) |
| Površina aluminijske folije | P(Al) = |
| Debljina aluminijske folije | d(Al) = V(Al)/P(Al) = |
Ponovimo
· Molekulskom formulom iskazuje se broj i vrsta atoma koji tvore molekulu spoja (npr. H2O, CO, CO2, O2, O3, C6H6 itd.).
· Empirijskom formulom iskazuje se najmanji omjer broja atoma koji se dobije na osnovi rezultata kemijske analize spoja (empirijska formula benzena je CH, a molekulska formula je C6H6).
· Kod spojeva sa složenom strukturom, kod kojih nema izoliranih molekula, formulom se prikazuje omjer najmanjeg broja atoma u spoju. Najjednostavnije formule takvih spojeva zovu se formulske jedinke (NaCl, CaCO3, SiO2 i sl.).
· Relativna molekulska masa jest broj koji kazuje koliko je puta masa neke molekule veća od atomske jedinice mase.
· Relativna molekulska masa tvari izračuna se tako da se zbroje relativne atomske mase svih atoma u molekuli spoja, odnosno tako da se zbroje relativne atomske mase atoma koji čine formulsku jedinku spoja.
· Jedinica za količinu (množinu) tvari jest mol.
· Mol bilo koje tvari sadržava Avogadrov broj čestica, N = 6,022 · 1023.
· Kad se odvaže onoliko grama neke tvari kolika je njezina relativna atomska ili molekulska masa, odvagan je 1 mol, tj. Avogadrov broj čestica (atoma, molekula ili formulskih jedinki).
· Mol bilo kojeg plina uzetog pri normalnim uvjetima (p = 101 325 Pa, t = 0 °C) zauzima volumen Vm = 22,4 L.
· Molarni volumen plinova: Vm = 22,4 L mol−1,
· Avogadrova konstanta: NA = 6,022 · 1023 mol−1,
· Avogadrov broj: N = 6,022 · 1023,
· Avogadrov zakon: Jednaki volumeni različitih plinova uzetih pri istom tlaku i temperaturi sadržavaju jednak broj čestica.
·
Boyle-Mariotteov
zakon: Umnožak mjernih brojeva tlaka i volumena neke količine plina pri stalnoj
temperaturi jest stalan broj (p1![]() V1
V1![]() p2
p2![]() V2).
V2).
· Gay-Lussacov zakon: V/T = konst. (pri konstantnom tlaku i količini plina)
· p/T = konst. (pri konstantnom volumenu i količini plina).
·
Kombinirajući
Boyle-Mariotteov zakon i Gay-Lussacove zakone dobije se
![]() =
= ![]()
· Čestice idealnoga plina nemaju volumena i među njima ne djeluju nikakve privlačne sile. Idealni plinovi ponašaju se točno prema općoj plinskoj jednadžbi. Idealnih plinova nema u prirodi.
· Čestice realnoga plina imaju volumen. Među česticama realnih plinova djeluju slabe privlačne sile. Te su sile to slabije što je razmak među česticama veći.
· U školskom laboratoriju pri radu s realnim plinovima, kao što su vodik, dušik i kisik pri sobnoj temperaturi i atmosferskom tlaku, nećemo učiniti veliku pogrešku ako primijenimo opću plinsku jednadžbu.
Pitanja i zadaci 2
- Što označava znak Br2, a što 2Br?
- Izračunajte relativnu molekulsku masu običnog
šećera, saharoze, C12H22O11.
- Empirijska formula nikotina jest C5H7N,
a njegova relativna molekulska masa iznosi 162,2. Koja je molekulska formula
nikotina?
- Izračunajte masu jedne molekule hemoglobina ako
je njena relativna molekulska masa 68 000.
- Svaka molekula hemoglobina (Mr =
68 000) sadržava četiri atoma željeza. Koliki je maseni udio željeza u
hemoglobinu.
- Izračunajte masene udjele elemenata u kalcijevu
karbonatu, CaCO3.
- Fozgen je plin koji je upotrijebljen u Prvome
svjetskom ratu kao bojni otrov, no danas se naveliko proizvodi i upotrebljava u
sintezi mnogih korisnih tvari. Nastaje ako se smjesa ugljikova monoksida i
klora osvijetli Sunčevom ili ultraljubičastom svjetlošću. Odredite formulu
fozgena ako su analizom nađeni ovi maseni udjeli elemenata u spoju: w(C)
= 0,121, w(O) = 0,162 i w(Cl) = 0,717. U kojem volumnom omjeru
valja uzeti ugljikov monoksid i klor za sintezu fozgena?
- U ugljenu, kakav se upotrebljava za loženje,
maseni udio sumpora iznosi 3,2 %. Kolika je masa i volumen (pri n.u.) sumporova
dioksida, SO2, koji nastaje izgaranjem 1000 kg ugljena?
- Dovršite jednadžbu reakcije gorenja običnog
šećera ili saharoze:
C12H22O11(s) + . . . O2(g) →. . . CO2(g) + . . . H2O(l). - Koliki je volumen (n.u.) ugljikova dioksida i
masa vode koji nastaju izgaranjem 1 g saharoze?
- Pri eksploziji nitroglicerina, C3H5(NO3)3,
nastaju N2, O2, CO2 i H2O. Dovršite
jednadžbu reakcije:
. . C3H5(NO3)3(l) →. . . . N2(g) + . . . O2(g) + . . . CO2(g) + . . . H2O(g). - Neki plin, koji u smjesi s kisikom upotrebljavaju
pri općoj anesteziji, sastoji se samo od ugljika i vodika. Ako se spali 1 g tog
plina nastaje 3,14 g ugljikova dioksida i 1,29 g vode. Gustoća je tog plina 21
puta veća od gustoće vodika pri jednakim uvjetima. Odredite formulu tog plina.
- Izračunajte prosječnu molarnu masu zraka ako pretpostavite ove volumne udjele pojedinih plinova u zraku: φ(O2) = 21 %, φ(N2) = 78 %, φ(Ar) = 1 %.
3. OKSIDI, KISELINE, BAZE I SOLI
vodik + klor → klorovodik
Kako se vodik i klor pri uobičajenim uvjetima javljaju u obliku dvoatomnih molekula, H2 i Cl2, i u plinovitu stanju, reakcija između ta dva elementa prikazuje se jednadžbom:
H2(g) + Cl2(g) → 2HCl(g)
Znakom (g) označili smo da su reaktanti i produkti u plinovitu stanju. Znak (g) potječe od riječi gas koju je prema grčkoj riječi chaos = stanje bez ikakva poretka, iskovao belgijski liječnik van Helmont.
Valja dobro upamtiti, da se broj atoma tijekom kemijske reakcije ne mijenja. Kad bi tako bilo atomi bi nastajali ni iz čega ili se pretvarali u ništa. Stoga broj atoma na lijevoj strani jednadžbe mora biti jednak broju atoma na desnoj strani jednadžbe. U jednadžbi kemijske reakcije reaktanti se pišu na lijevoj a produkti na desnoj strani.
Koji će produkti nastati, često ovisi o omjeru u kojemu se nalaze reaktanti. Tako gorenjem ugljika uz nedovoljan dostup zraka nastaje ugljikov monoksid, CO, što se prikazuje jednadžbom:
2C(s) + O2(g) → 2CO(g)
Ugljik je krutina pa se uz njegov simbol stavlja znak (s) što dolazi od latinskog solidus = krut, čvrst. Kisik je plin koji se javlja u obliku dvoatomnih molekula O2. Zato je pri pisanju jednadžbe reakcije trebalo uzeti dva atoma ugljika koji reagiraju s jednom molekulom, odnosno dva atoma kisika, pri čemu nastaju dvije molekule ugljikova monoksida.
Ugljikov monoksid i sam dalje gori u ugljikov dioksid, CO2, što se prikazuje jednadžbom:
2CO(g) + O2(g) → 2CO2(g)
To je konačni produkt gorenja ugljika. Kada se do nekih produkata dolazi postupno, putem nekoliko kemijskih reakcija, jednadžbe reakcija mogu se zbrojiti. Zbroji li se jednadžba gorenja ugljika u ugljikov monoksid i jednadžba gorenja ugljikova monoksida u ugljikov dioksid, dobiva se:
2C(s) + O2(g) → 2CO(g)
2CO(g) + O2(g) → 2CO2(g)
_______________________________________________
2C(s) + 2CO(g) + 2O2(g) → 2CO(g) + 2CO2(g)
Ukinu li se jednaki članovi na lijevoj i desnoj strani jednadžbe slijedi:
C(s) + O2(g) → CO2(g)
Dobivena ukupna jednadžba kemijske reakcije pokazuje broj atoma ili molekula koji sudjeluju u reakciji i koji reakcijom nastaju.
3.1. Autoionizacija
vode
Najčišća voda, kakva se uopće može pripremiti, vrlo slabo ali ipak provodi struju. Struju u otopinama mogu prenositi samo električki nabijene čestice, ioni. Činjenica da voda slabo provodi struju navodi nas na zaključak da je voda vrlo slabo disocirana (lat. dissociare = razdvojiti) na ione.
2H2O(l) D [H3O]+(aq) + [OH] -(aq)
Autoionizacije vode često se naziva i autoprotolizom. U
vodenim otopinama protoni (vodikove jezgre ili vodikovi ioni, H+) su
uvijek hidratizirani
s više ili manje molekula vode, pa je u jednadžbama kemijskih reakcija uvijek
bolje pisati [H3O]+(aq) nego H+(aq). No i taj
je način pisanja pojednostavljen jer su u vodenim otopinama prisutne i jedinke
[H5O2]+, [H7O3]+,
[H9O4]+ i dr.
Vidi na internetu: en.wikipedia.org/Hydronium_Solvation
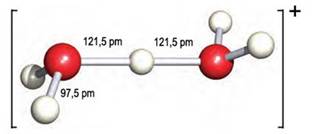
Slika 3.1. Struktura iona [H5O2]+ određena neutronskom difrakcijom u spoju [V(H2O)6][H5O2][CF3SO3]4. Uočite da razmak između atoma kisika iznosi 243 pm, dok duljina obične vodikove veze O-H•••O u vodi iznosi 282 pm. (Vidi sliku 6.31.)
3.2. Oksidi i njihove reakcije s vodom
Kisik čini spojeve sa svim elementima osim s helijem, neonom, argonom i kriptonom. S metalima u nižim oksidacijskim stanjima čini ionske okside. S nemetalima i prijelaznim metalima u višim oksidacijskim stanjima čini kovalentne okside.
Pri gorenju elemenata s malom energijom ionizacije, a to su alkalijski i zemnoalkalijski metali i prijelazni metali u nižim oksidacijskim stanjima, nastaju ionski oksidi. Kisik u ionskim oksidima dolazi kao ion O2-. Tališta oksida alkalijskih metala snizuju se u skupini od litija do cezija. Litijev oksid tali se pri 1438 oC, a cezijev oksid pri 490 oC. Zašto je to tako? Litijev ion puno je manji od cezijeva iona. U litijevu oksidu litijevi ioni bliže su kisikovim ionima nego cezijevi ioni u cezijevu oksidu. Što je razmak između suprotno nabijenih iona manji, to je elektrostatska privlačna sila jača. Zato se tališta oksida elemenata prve skupine snizuju porastom radijusa kationa. Jednaku pravilnost pokazuju oksidi zemnoalkalijskih metala. No, ioni zemnoalkalijskih metala imaju naboj 2+ i manji ionski radijus od iona alkalijskih metala. Što je manji radijus i veći naboj kationa, to je energija kristalne strukture pripadnog oksida veća. Zato oksidi zemnoalkalijskih metala imaju vrlo visoka tališta: BeO 2507 oC, CaO 2852 oC, SrO 2813 oC, BaO 1923 oC.
Svi oksidi alkalijskih metala dobro su topljivi u vodi, pri čemu nastaju hidroksidi. Možemo zamisliti da ion O2- reagira s molekulom vode prema shemi:
![]()
U toj reakciji ion O2- prima proton (ion H+), pa se kaže da je akceptor protona (lat. acceptare = primati). Molekula vode u ovom je slučaju donor protona (lat. donare = darovati).
Topljivost oksida u vodi ovisi o energiji kristalne strukture, a ova o radijusu kationa. Tako su berilijev oksid, BeO, i magnezijev oksid, MgO, u vodi praktično netopljivi. Kalcijev oksid je slabo topljiv, a barijev oksid je dobro topljiv. Dobivene otopine su jake lužine. (Opaska. Radijus kationa raste od Be2+ do Ba2+.)
Okside koji u vodenim
otopinama daju lužine ili se otapaju u kiselinama nazivamo bazičnim oksidima.
To su oksidi alkalijskih i zemnoalkalijskih metala te oksidi ostalih metala u
najnižim oksidacijskim stanjima. U vodenim otopinama bazičnih oksida povećava se
koncentracija iona OH-.
Vidi na Internetu: www.youtube.com/watch?v=uI9bm967O_U
Neki se oksidi ne otapaju u vodi, ali se otapaju u kiselinama, primjerice željezov(III) oksid:
Fe2O3(s) + 6HCl(aq) → 2FeCl3(aq) + 3H2O(l)
Kovalentni oksidi nastaju spajanjem nemetala s kisikom. Uzrok tome je mala razlika elektronegativnosti kisika i nemetala, odnosno velika energija ionizacije njihovih atoma (vidi poglavlje 6.14). Zato nemetali s kisikom čine molekulske strukture. Pri uobičajenim uvjetima to su plinovi, primjerice Cl2O7, SO3, CO2. Dobro su topljivi u vodi i s njom reagiraju dajući kiseline:
Cl2O7(l) + H2O(l) → 2HClO4(aq) perklorna kiselina
SO3(g) + H2O(l) → H2SO4(aq) sumporna kiselina
CO2(g) + H2O(l) → H2CO3(aq) ugljična kiselina.
Njihove vodene otopine pokazuje kiselu reakciju, pa su oksidi nemetala kiseli oksidi. Perklorna kiselina je najjača anorganska kiselina. Sumporna kiselina je gotovo isto tako jaka, dok je ugljična kiselina jedna od najslabijih kiselina. O jakosti kiselina može se suditi prema stupnju disocijacije. Stupanj disocijacije je broj manji od 1, koji kazuje koji je dio od ukupnog broja molekula neke tvari (kiseline, baze, soli) disocirao na ione. U vodenoj otopini sve kiseline disociraju na oksonijeve ione, H3O+, i pripadne anione.
HClO4(aq) + H2O(l) D H3O+(aq) + ClO4-(aq) perkloratni ion
H2SO4(aq) + H2O(l) D H3O+(aq) + HSO4-(aq) hidrogensulfatni ion
HSO4-(aq) + H2O(l)
D H3O+(aq) + SO42-(aq) sulfatni ion
H2CO3(aq) + H2O(l) D H3O+(aq) + HCO3-(aq) hidrogenkarbonatni ion
HCO3-(aq) + H2O(l)
D H3O+(aq) + CO32-(aq) karbonatni ion
Ovako napisanim jednadžbama reakcija željeli smo pokazati da se molekula vode pojavljuje kao akceptor protona, pri čemu nastaje oksonijev ion, H3O+. Za kiselinu čije se molekule u vodenoj otopini u većoj mjeri disociraju, pa stoga daju više oksonijevih iona i pripadnih aniona, kažemo da ima veći stupanj disocijacije. Dvostrana strelica ukazuje na ravnotežu između reaktanata i produkata. To je dinamička ravnoteža: koliko u nekom odsječku vremena nastane produkata, toliko se produkata raspadne na reaktante.
Ugljikov dioksid također je kiseli oksid, iako njegova vodena otopina pokazuje vrlo slabu kiselu reakciju. Naime, vrlo malo molekula CO2 reagira s molekulama vode i daje ugljičnu kiselinu, a i taj mali broj molekula slabo je disociran. Ugljikov dioksid se ipak jako dobro otapa u otopinama lužina, pri čemu nastaju karbonatni ioni, CO32-, i hidrogenkarbonatni ioni, HCO3-.
CO2(g) + 2NaOH(aq) → 2Na+(aq) + CO32-(aq) + H2O(l)
CO2(g) + NaOH(aq) → Na+(aq) + HCO3-(aq)
Amfoterni oksidi (grč. amfoteros = s obje strane) otapaju se u kiselinama i u lužinama.
ZnO(s) + 2HCl(aq) → Zn2+(aq) + 2Cl-(aq) + H2O(l)
ZnO(s) + H2O(l) + 2NaOH(aq) → Zn(OH)42-(aq) + 2Na+(aq)
3.3. Neutralizacija kiselina i baza
Međusobnom reakcijom kiseline i baze nastaje sol i voda. Primjerice:
NaOH(aq) + HCl(aq) → NaCl(aq) + H2O(l)
Ca(OH)2(aq) + 2HCl(aq) → CaCl2(aq) + 2H2O(l)
Al(OH)3(s) + 3HCl(aq) → AlCl3(aq) + 3H2O(l)
2NaOH(aq) + H2SO4(aq) → Na2SO4(aq) + 2H2O(l)
3NaOH(aq) + H3PO4(aq) → Na3PO4(aq) + 3H2O(l)
2NaOH(aq) + H3PO4(aq) → Na2HPO4(aq) + 2H2O(l)
NaOH(aq) + H3PO4(aq) → NaH2PO4(aq) + H2O(l)
Neutralizacija se događa i kad međusobno reagiraju anhidridi kiselina i baza, ali u tom slučaju ne nastaje voda.
CaO(s) + CO2(g)
→ CaCO3(s) CaO je anhidrid kalcijeva hidroksida, Ca(OH)2.
CO2 je anhidrid ugljične kiseline, H2CO3.
Na2O(s) + CO2(g) → Na2CO3(s) Na2O je anhidrid natrijeva hidroksida, NaOH.
CaO(s) + SO3(g) → CaSO4(s) SO3 je anhidrid sumporne kiseline, H2SO4.
3.4. Reakcije halogenih elemenata
Zbog svoje velike elektronegativnosti halogeni se elementi spajaju sa svim elementima, osim helijem, neonom i argonom. Kripton i ksenon spajaju se s elektronegativnim elementima fluorom i kisikom. Od danas poznatih više stotina spojeva plemenitih plinova spomenut ćemo samo KrF2, XeF2, XeF4, XeF6, XeOF2, XeO3 i XeOF4. Većina njih burno reagira s vodom, no neki su vrlo stabilni. Rb2XeF8 se ne razgrađuje ni pri 400 °C.
Halogeni elementi spajaju se i međusobno, čineći kovalentne interhalogene spojeve, ClF, BrF, IF, BrCl, ICl, IBr, ClF3, ClF5, i dr.
S alkalijskim i zemnoalkalijskim metalima halogeni elementi daju ionske spojeve, tj. spojeve slične solima. Otuda i potječe zajedničko ime za sve elemente 17. skupine, jer na grčkome hals znači sol.
2Na(s) + Cl2(g) → 2NaCl(s)
Ca(s) + Cl2(g) → CaCl2(s)
Zbog jakih elektrostatskih sila između iona suprotna naboja soli su kristalizirane krutine. Većina soli dobro je topljiva u vodi. Pri otapanju soli u vodi, koja je polarno otapalo, kristalna se struktura ruši a ioni se okružuju molekulama vode (vidi poglavlje 6.15). Kaže se da se u vodenim otopinama soli disociraju na ione.
Na+Cl- (s) + (aq) → Na+(aq) + Cl-(aq)
Zato vodene otopine soli, kiselina i lužina dobro provode električnu struju.
Kovalentni halogenidi, CCl4 i SF6, ne otapaju se niti reagiraju s vodom. Ostali kovalentni halogenidi više ili manje reagiraju s vodom. Reakcije u kojima sudjeluju molekule vode zovu se reakcije hidrolize.
PCl3(l) + 3H2O(l) → H3PO3(aq) + 3HCl(aq)
Otapanjem fosforova(III)
klorida u vodi nastaju dvije kiseline: fosforasta, H3PO3,
i klorovodična, HCl.
3.5. Reakcije hidrida
S alkalijskim i zemnoalkalijskim metalima vodik čini ionske hidride slične solima. Hidridi alkalijskih metala kristaliziraju po tipu kristalne strukture natrijeva klorida. Radijus iona H- mijenja se od 130 pm u LiH do 154 pm u CsH. Sličan radijus, 133 pm, imaju ioni F-. U hidridima alkalijskih metala vodik se ponaša kao halogeni element, pa je oksidacijski broj vodika u hidridima -1 (vidi poglavlje 4.1). Hidridi alkalijskih metala bezbojne su tvari visokog tališta. Pri elektrolizi taljevine hidrida na katodi se izlučuje alkalijski metal, a na anodi vodik. Hidridi alkalijskih i zemnoalkalijskih metala burno reagiraju s vodom.
CaH2(s) + 2H2O(l) → Ca(OH)2(aq) + 2H2(g)
S nemetalima vodik čini kovalentne hidride. Metan, CH4, neutralan je hidrid, neobično stabilan prema kiselinama, lužinama i oksidacijskim sredstvima. Amonijak, NH3, akceptor je protona, pa je vodena otopina amonijaka (amonijačna voda) slaba lužina.
NH3(g) + H2O(l) D NH4+(aq) + OH-(aq)
Hidridi halogenih elemenata donori su protona, Stoga su njihove vodene otopine kiseline.
HCl(aq) + H2O(l) D H3O+(aq) + Cl-(aq)
Ponovimo
· Kiselina je svaka ionska ili molekulska čestica koja u kemijskoj reakciji može dati proton H+ (donor protona).
· Baza je svaka ionska ili molekulska čestica koja u kemijskoj reakciji može primiti proton, H+ (akceptor protona).
· Molekula vode može primiti proton, pri čemu nastaje oksonijev ion, H3O+, ali i dati proton, pa nastaje hidroksidni ion, OH-. Zato kažemo da je voda amfoterna.
Pitanja i zadaci 3
- Napišite jednadžbu reakcije elementarnog klora s
kalcijem i željezom. U kojemu je od ta dva klorida veći udio kovalentne veze?
- Koji će oksid imati više talište, BaO ili MgO?
Obrazložite.
- Koji element burnije reagira s vodom, natrij,
kalij, ili magnezij?
- Koji je hidroksid jača lužina, Mg(OH)2,
Ca(OH)2 ili Al(OH)3?
- Koji je hidrid jači akceptor protona, NH3
ili PH3?
- Što će se dogoditi ako elementarni fluor uvodimo
u vodu? Napišite jednadžbu reakcije.
- Što će se dogoditi ako elementarni klor uvodimo u
otopinu kalijeva bromida?
- Koji je klorid u vodenoj otopini više podložan
hidrolizi: NaCl, MgCl2 ili AlCl3?
- Napišite jednadžbe reakcija ovih oksida s vodom:
SrO, SO2, SO3, Na2O, Cl2O.
- Koji od sljedeća tri klorida hidrolizira: CCl4, SiCl4 ili GeCl4? Napišite jednadžbu hidrolize.
4. OKSIDACIJA I REDUKCIJA
U svakoj kemijskoj reakciji dolazi do preraspodjele gustoće elektronskog oblaka oko atoma. Pri kemijskim reakcijama između tipičnih metala i tipičnih nemetala elektroni s atoma metala prelaze na atome nemetala. Kao rezultat tog procesa nastaju ionski spojevi. Zapali li se magnezij u kloru, događa se reakcija:
Mg(s) + Cl2(g) → MgCl2(s)
Da bi došlo do te reakcije moraju se molekule klora dovoljnom brzinom sudariti s atomima magnezija. U trenutku sudara elektronski oblaci magnezija i klora prodiru jedni u druge. Pritom dolazi do preraspodjele elektrona pri čemu nastaju nove čestice niže potencijalne energije. Razlika ili višak energije prelazi u okolinu u obliku svjetlosti i topline. U navedenoj je reakciji atom magnezija otpustio dva elektrona i postao ion Mg2+. To se može prikazati jednadžbom:
Mg → Mg2+ + 2e− (oksidacija)
Istodobno je molekula klora primila dva elektrona, pa su nastala dva iona Cl−:
Cl2 + 2e− → 2Cl− (redukcija)
Reakcija u kojoj neka molekula, atom ili ion gubi elektrone zove se reakcija oksidacije. Zato se kaže da se magnezij oksidirao u ione Mg2+.
Reakcija, u kojoj neka molekula, atom ili ion prima elektrone, naziva se reakcija redukcije. Zato se kaže da se klor reducirao u ione Cl−.
Oksidacija i redukcija nerazdvojno su vezane jedna za drugu i događaju se istodobno. Kad se jedna tvar oksidira druga se tvar reducira, jer elektroni moraju nekamo odlaziti i odnekud dolaziti.
U slučaju spajanja magnezija s klorom, magnezij je reducens, jer daje elektrone, a klor oksidans jer prima elektrone. U redoks–reakcijama reducens se uvijek oksidira, a oksidans reducira. Koji će element u kemijskoj reakciji biti oksidans (primati elektrone) ovisi o elektronegativnosti. Tako u reakciji magnezija sa sumporom atomi sumpora primaju elektrone pa prelaze u ione S2−. Prema tome, u toj je reakciji sumpor oksidans, a sam se pritom reducira.
Mg(s) + S(l) → [Mg2+S2−](s)
Najpoznatiji oksidansi su kalijev permanganat (KMnO4), elementarni kisik (O2), ozon (O3), kalijev nitrat (KNO3), elementarni fluor (F2), elementarni klor (Cl2) i vodikov peroksid (H2O2).
Oksidacija i redukcija su nerazdvojne, pa je stoga u reakcija magnezija sa sumporom magnezij reducens. Najpoznatiji reducensi su vodik i svi metali u elementarnom stanju, primjerice litij, natrij, magnezij, željezo, cink i aluminij.
U kemijskim reakcijama među atomima nemetala nastaju kovalentni spojevi. I ovdje dolazi do preraspodjele gustoće elektronskih oblaka oko atoma. Primjerice, pri reakciji užarena ugljika s klorom kao glavni produkt nastaje ugljikov tetraklorid, CCl4.
C(s) + 2Cl2(g) → CCl4(l)
Produkt kemijske reakcije je kovalentni spoj. Oko atoma ugljika formirana su četiri elektronska para koji čine četiri kovalentne veze s četiri atoma klora. No, smjerom svake veze ugljik-klor, došlo je do promjene gustoće elektronskog oblaka. Atomi klora su elektronegativniji od ugljika, pa zato jače privlače zajedničke elektronske parove. Zajednički elektronski parovi više pripadaju atomima klora nego atomu ugljika. Zbog toga se na atomima klora pojavljuje mali višak negativnog naboja. No, zbog simetrije molekule CCl4 težišta negativnog i pozitivnog naboja padaju na isto mjesto pa stoga molekule CCl4 nisu polarne. Grubo razmatrajući proces, može se kazati da atomi ugljika daju elektrone atomima klora. Prema tome, klor je oksidans jer prima elektrone, a ugljik reducens jer daje elektrone.
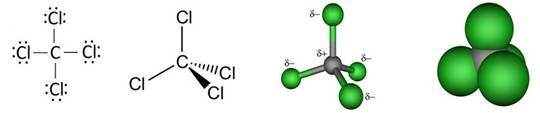
Slika 4.1. Različiti načini prikazivanja građe molekule ugljikova tetraklorida
Kad se na zraku zapali sumpor nastaje sumporov dioksid, SO2, zagušljiv i otrovan plin oštra mirisa koji draži na kašalj:
S(s) + O2(g) → SO2(g)
Kisik je elektronegativniji od sumpora pa će zajednički elektronski parovi više pripadati atomima kisika nego sumpora. Zato će u toj reakciji kisik biti oksidans, jer prima elektrone, a sumpor reducens jer daje elektrone.
Istraživanjem kristalne strukture sumporova dioksida (pri –130 oC) nađeno je da molekula ima oblik slova V. Kovalentne veze sumpor–kisik zatvaraju kut od 119o, a duljine veza sumpor–kisik iznose 143 pm. S obzirom na valentni kut od 119o očito je da se oko atoma sumpora nalaze tri elektronska oblaka koja se međusobno odbijaju. Kovalentne veze u molekuli sumporova dioksida prikazujemo rezonantnim strukturama tako da se oko svakog atoma nalazi oktet elektrona kao na slici 4.2. Kako je kisik elektronegativniji od sumpora proizlazi da su molekule sumporova dioksida polarne.
Slika 4.2. Lewisove rezonantne strukturne formule i model molekule sumporova dioksida
Sumporov dioksid se vrlo polagano oksidira kisikom iz zraka u sumporov trioksid. Uz prisustvo katalizatora, V2O5, oksidacija se događa brže. To je prvi korak kontaktnog postupka dobivanja sumporne kiseline. Molekule sumporova trioksida u plinovitoj fazi su planarne građe. Tri rezonantne strukture prikazane na slici 4.3. ukazuju na tri ekvivalentne veze sumpor–kisik pri čemu se oko svakog atoma u molekuli nalazi oktet elektrona.
Slika 4.3. Lewisove rezonantne strukturne formule i model molekule sumporova trioksida
4.1. Oksidacijski broj
Pri nekim kemijskim reakcijama teško je pouzdano utvrditi koja se tvar oksidira, a koja reducira. Da bi se jednadžbe redoks–reakcija lakše sastavljale, dogovorom je uveden pojam oksidacijski broj. On se zove i stupanj oksidacije, a određuje se na osnovi sedam dogovorenih pravila:
- Oksidacijski broj svih elemenata u elementarnom stanju jednak je nuli. Primjerice, atomi klora u Cl2, sumpora u S8,
bakra u metalnom bakru, svi oni imaju oksidacijski broj nula.
- Oksidacijski broj kisika uvijek je jednak −2, osim u peroksidima gdje je oksidacijski broj kisika
−1. To je zato što peroksidi, npr. H2O2, Na2O2, BaO2, sadržavaju vezu O−O.
- Oksidacijski broj vodika uvijek je jednak +1, osim u hidridima metala 1. i 2. skupine gdje je oksidacijski broj vodika −1. U hidridima elemenata 1. i 2. skupine vodik prima elektron, čime postaje negativno nabijeni ion, pa zato ima oksidacijski broj −1.
- Oksidacijski broj svih jednostavnih iona jednak je naboju iona. Primjerice, u ionu Cl− oksidacijski broj klora je
−1, u ionu Fe2+ oksidacijski broj željeza je +2, a u ionu Fe3+ oksidacijski broj željeza je +3 i sl.
- Zbroj svih oksidacijskih brojeva u molekuli ili formulskoj jedinki spoja mora biti jednak nuli.
- Zbroj svih oksidacijskih brojeva u ionima mora biti jednak naboju iona.
- U spojevima s kovalentnom vezom oksidacijski broj nekog atoma jednak je zamišljenom naboju koji se javlja na tom atomu kada se zajednički elektronski parovi dodijele elektronegativnijem atomu. Primjerice, u ugljikovu tetrakloridu, CCl4, oksidacijski broj klora bit će −1, a ugljika +4. U molekuli IF7 treba uzeti da su zajednički elektronski parovi pripali atomima fluora, koji su elektronegativniji od atoma joda, pa se dobiva da je oksidacijski broj fluora jednak −1, a joda +7.
Spomenuta pravila dovoljna su da se ispravno odrede oksidacijski brojevi u svim tvarima. Pri pisanju formula spojeva, u kojima se elementi mogu javljati u različitim oksidacijskim stanjima, oksidacijsko stanje elementa označava se rimskim brojem, i to gore desno iznad simbola elementa (npr. Pb2IIPbIVO4, FeIIFe2IIIO4 itd). Pri pisanju imena kemijskih spojeva oksidacijski broj pojedinog elementa označava se rimskim brojem u zagradama neposredno iza naziva elementa (npr. bakrov(I) klorid, bakrov(II) klorid, olovov(II) oksid, olovov(IV) oksid i sl.). Kada se neki element javlja samo u jednom oksidacijskom stanju, oksidacijski broj se izostavlja (natrijev klorid, kalcijev oksid, aluminijev oksid, cinkov oksid i sl.).
Oksidacijski brojevi elemenata također podliježu periodičnoj zakonitosti što proistječe iz građe njihove valentne ljuske. Svi alkalijski metali imaju oksidacijski broj +1 jer u valentnoj ljusci imaju samo jedan elektron. Svi zemnoalkalijski metali imaju oksidacijski broj +2, a aluminij +3, jer u valentnoj ljusci imaju dva, odnosno tri elektrona koja mogu predati atomima elektronegativnijih elemenata.
Fluor u spojevima uvijek ima oksidacijski broj −1 jer je najelektronegativniji element pa ima najveći afinitet prema elektronu (vidi poglavlje 6.6).
Klor može imati sve oksidacijske brojeve, od −1 do +7. Ako primi elektron od elektropozitivnijeg elementa imat će oksidacijski broj −1. U kovalentnim spojevima s kisikom može poprimiti sva oksidacijska stanja od +1 do +7. Kisik je elektronegativniji od klora i zato u kovalentnim spojevima s kisikom zajedničke elektronske parove pripisujemo kisiku (vidi sliku 6.23).
Kisik uvijek ima oksidacijski broj −2, osim u peroksidima, kad mu je oksidacijski broj −1. U peroksidnom ionu, O22−, dva atoma kisika dijele jedan zajednički elektronski par. Kako su dva atoma kisika primila ukupno dva elektrona, logično je da se kisiku pripiše oksidacijski broj −1.
4.2. Jednadžbe redoks–reakcija
Kako se praktično sastavljaju jednadžbe redoks–reakcija? Razmotrimo, primjerice, što se događa kad se komadić bakrene žice, Cu, uroni u razrijeđenu otopinu srebrova nitrata, AgNO3. Pokus pokazuje da se na bakru izluči pahuljasto metalno srebro, a bezbojna otopina poplavi.
Radi određivanja stehiometrijskih koeficijenata kemijske reakcije, dobro je najprije napisati shemu reakcije u kojoj se naznače tvari koje u reakciju stupaju i koje reakcijom nastaju. Najbolje je shemu napisati u ionskom obliku:
...Ag+ + ... NO3− + ... Cu → ... Cu2+ + ...NO3− + ...Ag
To još nije jednadžba reakcije jer broj atoma i naboja na lijevoj strani nije jednak broju atoma i naboja na desnoj strani. Zato se naziva shemom reakcije. Nadalje, lijeva i desna strana reakcijske sheme sadržavaju ione NO3− koji ne sudjeluju u redoks–reakciji ("ioni promatrači") pa se mogu izostaviti.
Tako se dobiva jednostavnija shema:
...Ag+ + ...... Cu → ... Cu2+ + ...Ag
Primjenjujući pravila na osnovi kojih se određuju oksidacijski brojevi, valja iznad simbola svakog elementa označiti njegov oksidacijski broj. Piše se u zagradi, i to najprije predznak a zatim brojčana vrijednost. To se čini zato da bi se oksidacijski broj razlikovao od naboja iona:
(+1) (0) (+2) (0)
...Ag+ + ...... Cu → ... Cu2+ + ...Ag
Iz reakcijske sheme vidi se da se ion Ag+ reducira do elementarnog srebra, a elementarni bakar oksidira u ione Cu2+. Najbolje je sada napisati zasebnu reakciju oksidacije i zasebnu reakciju redukcije:
(+1) (0)
(redukcija) Ag+ + e− →
Ag (ioni Ag+ se reduciraju u atome Ag)
(0) (+2)
(oksidacija) Cu → Cu2+ + 2e− (bakar se oksidira u ione Cu2+)
Broj elektrona koji se utroše u reakciji redukcije mora biti jednak broju elektrona koji se dobiju reakcijom oksidacije. Zato prvu jednadžbu treba pomnožiti sa 2, a potom zbrojiti obje jednadžbe:
2Ag+ + 2e− → 2 Ag
Cu → Cu2+ + 2e−
----------------------------
2Ag+ + Cu → Cu2+ + 2Ag
Potom jednadžbi dodamo "ione promatrače", NO3−, da bismo je mogli napisati u molekulskom obliku:
2AgNO3(aq) + Cu(s) → Cu(NO3)2(aq) + 2Ag(s)
Opisani postupak primjenjuje se i pri određivanju koeficijenata svih, pa i mnogo složenijih redoks–reakcija.
Primjer 4.1. Napišite jednadžbu reakcije oksidacije klorovodične kiseline kalijevim permanganatom. Pri toj se reakciji razvija elementarni klor, a mangan se reducira s oksidacijskog broja (+7) na (+2).
Rješenje
Jednadžbe oksidacije i redukcije moraju se postaviti tako da broj elektrona koje daje reducens bude jednak broju elektrona koje prima oksidans. Napišimo najprije shemu reakcije u ionskom obliku tako da naznačimo reaktante i produkte
...MnO4− + ...Cl− → ...Mn2+ + ...Cl2
Da bismo našli stehiometrijske koeficijente najprije moramo odrediti oksidacijske brojeve onih elemenata čiji se oksidacijski broj mijenja tijekom redoks-reakcije. Primijenimo li kriterije za određivanje oksidacijskih brojeva, shemu reakcije možemo napisati ovako:
(+7) (−1)
(+2) (0)
...MnO4−
+ ...Cl− → ...Mn2+ + ...Cl2
Vidimo da se mijenjaju samo oksidacijski brojevi mangana i klora. Stoga možemo napisati dvije neovisne jednadžbe polureakcija. Jedna pokazuje redukciju permanganatnog iona u ion Mn2+, no ta polureakcija događa u kiseloj sredini. Zato ćemo na lijevu stranu dodati onoliko iona H+(aq) koliko je potrebno da se sav kisik spoji u vodu.
(+7) (+2)
MnO4− + 8H+ + 5e−
→ Mn2+ + 4H2O (redukcija)
Provjerimo sadržava li lijeva
strana jednadžbe isti broj naboja i atoma kao i desna.
Potom napišimo jednadžbu
oksidacije kloridnih iona.
(−1) (0)
2Cl− → Cl2 + 2e−
(oksidacija)
Broj elektrona koje daje reducens mora biti jednak broju elektrona koje prima oksidans. Zato moramo naći najmanji zajednički višekratnik za elektrone u obje polureakcije. Jedan permanganatni ion prima 5 elektrona a jedan kloridni ion daje samo 1 elektron. Da bismo dobili isti broj elektrona u obje jednadžbe jednadžbu redukcije moramo pomnožiti sa dva, a jednadžbu oksidacije s pet.
MnO4− + 8H+ + 5e− → Mn2+ + 4H2O / × 2
2Cl− →
Cl2 + 2 e− / × 5
————————————————————
2MnO4− + 16H+ + 10e− + 10Cl− → 2Mn2+ + 8H2O + 5Cl2 + 10e−
Elektroni koji su sudjelovali u reakciji u konačnoj jednadžbi obično se ne iskazuju pa jednadžba, pisana u ionskom obliku, glasi:
2MnO4− + 16H+ + 10Cl− → 2Mn2+ + 8H2O + 5Cl2
Jednadžba sadržava sve bitne podatke, jer ostali ioni nisu ni sudjelovali u redoks-reakciji. Želimo li ipak reakciju napisati u molekulskom obliku, dovoljno je uza ion MnO4− pripisati odgovarajući broj iona K+, i isto tako uza ion H+ odgovarajući broj iona Cl−. Tim postupkom dobivamo:
2 KMnO4 + 16HCl → 2MnCl2 + 8H2O + 5Cl2 + 2KCl
Doznajte više na: doi.org/KUI.2016.020
doi.org/KUI.2016.033
POKUS 4.1. Relativna jakost oksidansa i reducensa
Pribor i kemikalije: stalak s epruvetama, otopina željezova(IlI) klorida, FeCl3, otopina kalijeva bromida, KBr, otopina kalijeva jodida, KI, otopina kalijeva heksacijanoferata(III), K3[Fe(CN)6], heksan, C6H14.
Postupak
1. Pomiješajte u prvoj epruveti malo razrijeđene otopine željezova(III) klorida i kalijeva jodida, a u drugoj željezova(III) klorida i kalijeva bromida. Promućkajte sadržaj epruveta. Dodajte u svaku epruvetu malo heksana, ne više od 1 mL. Snažno promućkajte sadržaj te pustite da se slojevi odijele.
2. Ustanovite u kojoj se epruveti izlučio slobodni halogen. Ako je nastao slobodan halogen, on se bolje otapa u heksanu nego u vodi, što se vidi po promjeni boje heksana.
3. Uzmite dvije čiste epruvete pa ponovo u prvoj epruveti pomiješajte malo razrijeđene otopine željezova(III) klorida i kalijeva jodida, a u drugoj željezova(III) klorida i kalijeva bromida. Promućkajte sadržaj epruveta i u obje epruvete dodajte nekoliko kapi otopine kalijeva heksacijanoferata(III). Ako su prisutni ioni Fe2+, mora nastati tamnoplavi talog kalijeva željezova(III) heksacijanoferata(II), KFe[Fe(CN)6], poznatog i pod nazivom berlinsko modrilo. U kojoj je epruveti došlo do redukcije iona Fe3+ u ione Fe2+?
Heksan je nepolarno otapalo pa se ne miješa s vodom. Gustoća mu je manja od gustoće vode pa se zato izdvaja u zaseban sloj iznad sloja vode. Molekule joda su nepolarne građe. Zato se jod dobro otapa u nepolarnom otapalu, heksanu, a vrlo slabo u vodi čije su molekule polarne.
Fe3+ je jači oksidans od elementarnog joda. Zato ioni Fe3+ oksidiraju ione I− u elementarni jod, a pritom se sami reduciraju u ione Fe2+. Da bi negativno nabijeni ioni I− prešli u elementarni jod, moraju otpustiti elektrone. To prikazujemo jednadžbom oksidacije:
2I−(aq) → I2(s) + 2e−
Oksidacija i redukcija su nerazdvojne, pa su se istodobno ioni Fe3+ reducirali u ione Fe2+.
Fe3+(aq) + e− → Fe2+(aq)
U drugoj epruveti imali smo otopinu KBr, ali se dodatkom otopine FeCl3 nije dogodila promjena. Očito je da ioni Fe3+ nisu mogli oksidirati ione Br− u elementarni brom. Na osnovi tih opažanja poredajte ione Fe3+, Fe2+, I−, Br−, prema porastu jakosti oksidacijskih svojstava.
Jači oksidans jest ona tvar koja ima jači afinitet prema dodatnim elektronima (prima elektrone).
Jači reducens jest ona tvar koja ima slabiji afinitet prema elektronima (lakše otpušta elektrone).
POKUS 4.2. Prijenos elektrona u redoks-reakciji
Pribor i kemikalije: U-cijev, 2 ugljene elektrode, žice, krokodil-štipaljke, miliampermetar, kalijev sulfat, kalijev jodid, željezov(III) klorid, vata, stalak, hvataljka
Postupak
- U savijeni dio U-cijevi ugurajte dosta vate tako
da dobijete tvrd čep dužine oko 5 cm.
- Koncentriranu otopinu kalijeva ili natrijeva
sulfata postupno ulijevate u jedan krak cijevi dok otopina ne istisne zrak iz
čepa od vate.
- Istodobno u jedan krak U-cijevi ulijevajte
razrijeđenu otopinu kalijeva jodida, a u drugi krak otopinu željezova(III)
klorida. Otopine se ne smiju međusobno pomiješati. Miješanje sprječava čep u
sredini U-cijevi natopljen kalijevim ili natrijevim sulfatom.
- Ugljene elektrode uronite u krakove U-cijevi te
ih spojite preko osjetljivog miliampermetra.
- Na temelju otklona kazaljke miliampermetra
ustanovite smjer gibanja elektrona. Pustite da struja teče nekoliko minuta. Opažate
li promjene u otopini kalijeva jodida?
- Kapaljkom prenesite malo otopine kalijeva jodida
u čistu epruvetu te pokušajte dokazati sadržava li otopina elementarni jod.
- Iz okoline druge elektrode čistom kapaljkom prenesite malo otopine željezova(III) klorida u čistu epruvetu te pokušajte dokazati prisutnost iona Fe2+ u otopini.

Slika 4.4. Određivanje smjera gibanja elektrona u redoks-reakciji željezova(III) klorida s kalijevim jodidom
Male koncentracije elementarnog joda mogu se dokazati vrlo osjetljivom karakterističnom reakcijom s otopinom škroba. U oko 100 mL vruće vode dodajte na vrh noža škroba. Kad otopina zakipi i postane prozirna, ohladite je. Tako ste pripremili vrlo osjetljiv reagens koji s elementarnim jodom daje karakterističnu plavu boju. (Umjesto škroba možete u 50 mL hladne vode otopiti na vrh noža "Kremfixa".) Intenzitet boje ovisi o koncentraciji joda u otopini. Prisutnost iona Fe2+ dokazat ćete kao u pokusu 4.1 s nekoliko kapi otopine kalijeva heksacijanoferata(III).
POKUS 4.3. Oksidacija
aluminija kisikom iz zraka
Vidi na Internetu: www.youtube.com/watch?v=IrdYueB9pY4
OPASKA: Jednostavnije je površinu aluminija trljati pola minute štapićem s malo vate umočene u otopinu HgCl2. Oprez! Živa, živini spojevi i živine pare su otrovni. Živa je kumulativni otrov.
Ponovimo
· Oksidacija i redukcija nerazdvojno su vezane jedna za drugu. One se događaju istodobno.
· Oksidans je ona tvar koja u redoks–reakciji prima elektrone.
· Reducens je ona tvar koja u redoks–reakciji gubi elektrone.
· U organskim spojevima oksidacijski broj atoma ugljika se određuje tako da se atomu ugljiku za svaku vezu s elektropozitivnijim atomom (atom vodika) pridoda –1 a za svaku vezu s elektronegativnijim atomom (atom kisika) pridoda +1.
Pitanja i zadaci 4
- Odredite oksidacijske brojeve provg atoma u formulama
sljedećih spojeva i iona: NH3, NH4+, SO2,
SO3, CH4, CO, CO2, CH3OH, IF7,
CaH2, Fe2O3, PO43-, SO42-, Mg3N2, Li3N.
- Koji će od parova iona, molekula ili atoma biti jači oksidans: a) S ili S2
-, b) SO2 ili SO3, c) Mg ili Mg2+, d) Na ili K, e) Na ili Mg, f) O2 ili F2?- Na osnovi elektronskih konfiguracija atoma dušika i fosfora odredite najmanje i najveće vrijednosti oksidacijskih brojeva koje možemo očekivati kod tih elemenata (vidi poglavlje 6.2). Obrazložite svoje tvrdnje.
- Koja je tvar oksidans a koja reducens u reakcijama:
a) S + O2 → SO2
b) 2 SO2 + O2 → 2 SO3
c) 2 H2SO4 + Cu → CuSO4 + SO2 + H2O
d) 4 FeS + 11 O2 → 2 Fe2O3 + 8 SO2
- Željezov(III) klorid upotrebljavaju u radiotehnici za izradu štampanih krugova. Pločice od plastične mase na koje je nanesen sloj bakra zaštite se odgovarajućim lakom na onim mjestima gdje se želi zadržati bakar. Pripremljena pločica uroni se u otopinu željezova(III) klorida. Taj se postupak zove jetkanje. Kao rezultat procesa jetkanja nastaje željezov(II) klorid i bakrov(II) klorid. Napišite jednadžbu redoks-reakcije i označite koja je tvar oksidans a koja reducens.
5. ATOMI
Ruđer Bošković (1711. - 1787.), isusovac iz Dubrovnika, jedan od posljednjih univerzalnih ljudi europske humanističke tradicije i utemeljitelj dinamičke atomistike, smatrao je da je materija građena od primarnih čestica koje su nedjeljive, ali nisu Demokritovi atomi. Nova je Boškovićeva misao da primarne čestice materije ne zapremaju prostor. Te su točke obdarene masom (materijalne točke, materiae puncta). Iz tih točaka izlaze privlačne i odbojne sile. Sile između primarnih čestica proizvode sva svojstva materije. Na malim međusobnim udaljenostima sila je odbojna, a na većim udaljenostima prelazi u privlačnu silu.
Za francuskog kemičara, oca suvremene kemije, Lavoisiera, atomi su bili pitanje filozofije a ne kemije, jer nije vidio načina da ih eksperimentom dokaže. No, ne zaboravimo, Lavoisier je otkrio zakon o očuvanju mase tvari pri kemijskim reakcijama, objasnio gorenje te odredio kemijski sastav mnogih anorganskih i organskih tvari.
Nije poznato kako je Dalton došao na ideju o atomima. Naime, Njemačkim zračnim napadom u Drugome svjetskome ratu na Manchester prosinca 1940. uništena je Daltonova rukopisna ostavština od koje je ostalo samo nekoliko nagorjelih listova. Danas se smatra da je Dalton do svoje atomske teorije došao razmatranjem fizičkih svojstava plinova. Obavljajući meteorološka opažanja i razmišljajući o ustrojstvu atmosfere sigurno se upitao zašto se smjesa plinova, zrak, ponaša kao homogena, iako se sastoji od različitih čestica. Za objašnjenje vlastitih otkrića u kapitalnom djelu A New System of Chemical Philosophy (Novi sustav kemijske filozofije) iz 1808. godine, Dalton je prvi sjedinio pojam kemijskog elementa s pojmom atoma: kemijski je element tvar sastavljenu od istovrsnih atoma. Pošao je od sljedećih pretpostavki:
- Atomi su nedjeljive čestice i najmanji sudionici kemijske reakcije.
- Atomi istoga kemijskog elementa posve su jednaki i imaju jednaku masu.
- Atomi različitih elemenata međusobno se razlikuju po masi.
- Atomi se ne mogu stvarati, uništavati ili cijepati.
- Kemijski spojevi sastavljeni su od atoma različitih kemijskih elemenata.
- Kada se dva kemijska elementa spajaju u više nego jedan spoj, onda se njihovi maseni udjeli u spoju nalaze u omjeru malih cijelih brojeva.
Dalton je atome zamišljao kao kuglice. Atomu svakog elementa pridijelio je njegov znak (symbol). Slikovnim je dijagramima pokazao kako se atomi spajaju u molekule. Slika 5.1. prikazuje dvije stranice iz Daltonovog djela A New System of Chemical Philosophy iz 1808. godine u kojem je iznio svoje viđenje atomske teorije temeljene na vlastitim istraživanjima.

Slika 5.1. Daltonova tablica simbola dvadeset kemijskih
elemenata, njihovih relativnih atomskih masa i prikaz načina međusobnog
spajanja atoma kemijskih elemenata na primjeru 17 molekula.
Izvor: www.meta-synthesis.com
Na temelju rezultata kemijskih analiza Dalton je odredio i relativne atomske mase (težine) elemenata. Primjerice, analizom kemijskog sastava vode ustanovio je da se vodik i kisik u vodi spojeni u masenom omjeru 1 : 7. Kako u njegovo doba nije postojao način kojim bi utvrdio broj atoma u molekuli, Dalton je po "načelu jednostavnosti" pretpostavio da se molekula vode sastoji od jednog atoma vodika i jednog atoma kisika. Stoga je formulu vode napisao, u našim oznakama, kao HO. Uzimajući vodik za jedinicu s kojom je uspoređivao mase ostalih elemenata, na temelju masenog omjera vodika i kisika u vodi, 1 : 7, kisiku je pripisao atomsku težinu 7. Dalton je logično, ali pogrešno pretpostavio da je atomska težina kisika utezni omjer kisika prema vodiku u vodi. Je li voda HO ili H2O, bio je predmet prepirke kemičara sve do šezdesetih godina 19. stoljeća.
U to doba jedini je poznati dušikov spoj s vodikom bio amonijak. Daltonu je i amonijak bio binarni spoj, NH, pa je na temelju masenih udjela vodika i dušika u amonijaku, dušiku pripisao atomsku težinu 5. Sumporovodiku je dao formulu HS, sumporovu dioksidu SO, a sumporovu trioksidu SO2. No za ugljikov monoksid, CO, i ugljikov dioksid, CO2, napisao je ispravne formule.
Iako su Daltonove formule i atomske težine određene na temelju netočnih analiza bile pogrešne, nisu bile pogrešne njegove ideje, koje su snažno utjecale na razvoj kemije. No, kemičari su teško prihvaćali postojanje nevidljivih atoma na temelju rezultata pukog vaganja sastojaka. Mnogi su kemičari i prirodoslovci početkom 19. stoljeća držali da su atomi tek sredstvo kemičara za izračunavanje masenih omjera u kemijskim reakcijama, a ne stvarne čestice.
God. 1805. francuski fizičar i kemičar Joseph Louis Gay-Lussac (1788. - 1870.) je u suradnji s njemačkim prirodoslovcem Alexanderom von Humboldtom (1769. - 1859.), na temelju vlastitih i tuđih eksperimenata zaključio da pri konstantnoj temperaturi i tlaku volumeni plinova, koji međusobno kemijski reagiraju ili nastaju kemijskom reakcijom, stoje u omjeru malih cijelih brojeva. Gay-Lussacove nalaze potvrdili su mnogi kemičari te ih prihvatili kao činjenicu koju treba objasniti.
Nakon što je Gay-Lussac objavio svoj zakon o stalnim volumnim omjerima, talijanski fizičar i kemičar Amedeo Avogadro (1776. - 1856.) prvi je 1811. pokušao Gay-Lussacove volumne omjere protumačiti Daltonovom atomskom teorijom. Pošao od hipoteze da je broj čestica plina pri određenom tlaku i temperaturi razmjeran obujmu plina, neovisno o vrsti plina. Iz toga slijedi da su omjeri relativnih molekulskih masa (težina) bilo koja dva plina jednaki omjeru gustoća tih plinova pri istom tlaku i temperaturi. Najveći problem koji je Avogadro morao riješiti bila je zbrka u vezi s atomima i molekulama: što su atomi, a što molekule? Zato je najvažniji njegov doprinos tvrdnja da su plinovi elementarnih tvari sastavljeni od molekula, a ne od atoma kako se dotad mislilo (kisik u zraku je O2, a ne O). Time je Avogadro ujedinio zakon stalnih i višekratnih uteznih omjera sa zakonom o volumnim omjerima čime je Daltonovu atomsku teoriju učinio primjenjivom u kemiji. No, Avogadrova hipoteza nije odmah prihvaćena. Naime, u to doba kemičari se nisu mogli složiti oko najosnovnijih kemijskih pojmova kao što su atomi, molekule i atomske težine. U međuvremenu je jedino Marc A. A. Gaudin (1804.-1880.), jasno i zorno 1833. godine Gay-Lussacove volumne omjere objasnio Avogadrovom hipotezom na primjeru spajanja vodika s klorom, kisikom i dušikom. No, i njegovi su pogledi ostali bez utjecaja.
Slika 5.2. Dijagrami kojima je Gaudin god. 1833. Gay-Lussacove volumne omjere objasnio Avogadrovom hipotezom na primjeru spajanja vodika s klorom, kisikom i dušikom. Jednaki volumeni (predstavljeni kvadratima) sadržavaju jednak broj molekula (samo jednu molekulu) u skladu s Avogadrovim zakonom. Kao što je vidljivo, Gaudin je koristio Daltonove simbole.
Izvor: www.scielo.br
Za Gay-Lussacov zakon o volumnim omjerima švedski kemičar Jöns Jacob Berzelius (1779. - 1848.) doznao je vjerojatno 1810. godine. U njemu je vidio rješenje svoje dvojbe oko izbora atomskih težina "načelom jednostavnosti", koji je primijenio Dalton izabravši 8 za atomsku težinu kisika i HO za formulu vode. Berzelius je spajanje dvaju volumena vodika s jednim volumenom kisika shvaćao kao spajanje dvaju atoma vodika s jednim atomom kisika u molekulu vode. Zato je utezni omjer 1:8 uzeo kao omjer težina dvaju atoma vodika i jednog atoma kisika. Vodi je zato dao formulu H2O, a kisiku atomsku težinu 16, a ne 8 kao Dalton. Jednako je protumačio i spajanje jednog volumena dušika s tri volumena vodika te amonijaku dao formulu NH3, umjesto Daltonove NH. U svoju tablicu atomskih težina za 32 elementa, koju je objavio 1814. godine, uvrstio je atomsku težinu 16 za kisik i 14 za dušik. Nažalost, na Avogadrovu hipotezu nije se obazirao. Berzelius je uveo i simbole kemijskih elemenata kojima se i danas služimo. Dalton nikad nije prihvatio Berzeliusove simbole tvrdeći da su prekomplicirani te da narušavaju ljepotu molekulskih struktura.
Godine 1859. njemački kemičar August Kekulé (1829. - 1896.) pri pisanju udžbenika organske kemije suočio se sa zbrkom formula i atomskih težina koje su u to doba rabili kemičari. U priopćenjima i knjigama našao je čak 19 različitih formula octene kiseline. Radeći na udžbeniku došao je na ideju o kongresu na kojem bi istaknuti kemičari riješili neke od suvremenih kemijskih sporova - kako definirati molekulu i atom, koju kemijsku nomenklaturu koristiti, kako odrediti atomske težine, kako pisati formule kemijskih spojeva i dr. Prvi međunarodni kongres kemičara održan je 1860. u Karlsruhe-u, u Njemačkoj. Oko 140 kemičara svih narodnosti nakon tri dana razgovora nije se složilo te su se vratili kući. Ugledni sudionici kongresa i dalje su se držali svojih načela ne pokazujući namjeru da ih promijene. No, mnogi su sudionici odnijeli brošuru - tiskanu verziju Cannizzarova Nacrta predavanja kemijske filozofije iz 1858. god. (Sunto di un Corso di Filosofia Chimica fatto nella Reale Università di Genova). Stanislao Cannizzaro (1826. - 1919.) već u prvom odlomku "Nacrta" kaže: Moderna znanost potvrdila je Avogadrovu hipotezu, da jednaki volumeni plinovitih tvari, bile one jednostavne ili složene, sadržavaju jednak broj molekula. Pola stoljeća trebalo je kemičarima da prihvate Avogadrovu hipotezu, što sam Avogadro nažalost nije doživio jer je umro 1856. Unutar narednog desetljeća Cannizzarove ideje proširile su se svim znanstvenim krugovima. Bio je to snažan poticaj razvoju kemije, otkrivanju novih kemijskih elemenata i točnijem određivanju atomskih i molekulskih težina. Mlađi sudionici kongresa unijeli su Cannizzarove ideje u svoju nastavnu i znanstvenu djelatnost.
Kongresu su prisustvovali njemački kemičar Julius Lothar Meyer (1830. - 1895.) i mladi ruski kemičar Dmitrij Ivanovič Mendeljejev (1834. - 1907.). Mendeljejev je poslije rekao kako je odlučujući poticaj za periodni sustav elemenata dobio upravo u Karlsruhe-u, jer je nakon Cannizzarovog izlaganja uvidio da je atomska težina temeljna veličina prema kojoj treba razvrstati elemente.
5.1. Građa atoma
Nakon što su znanstvenici prihvatili pojam atoma kao najmanjih čestica kemijskih elemenata, prirodno se postavljalo pitanje njihove građe. Za spoznaje o građi atoma zaslužni su većinom fizičari. Zato ćemo se najprije ukratko upoznati s otkrićima koja su prethodila i konačno dovela do suvremenih spoznaja o atomu.
Sredinom devetnaestog stoljeća mnogi su fizičari eksperimentirali s pražnjenjem električnih naboja kroz razrijeđene plinove. Već je M. Faraday u kasnim 1830-ima primijetio da pri vrlo malom tlaku, oko 2 mmHg (3 hPa), plin u cijevi svjetluca ako se na elektrode priključi visoki napon. Pritom je uočio tamno područje u središnjem dijelu cijevi koje danas nazivamo Faradayev tamni prostor. Počevši od 1850-ih godina Heinrich Geissler (1815. - 1879.) načinio je veliki broj vakuumskih cijevi, koje su se rabile u istraživanjima no i za zabavu. Julius Plücker (1801. - 1868.) povećao je vakuum u cijevima što je rezultiralo različito obojenim sjajem i povećanjem Faradayevog tamnog prostora. Krajem 1869. Johann Hittorf (1824. - 1914.) primijetio je da objekt smješten ispred katode proizvodi sjenu. Tom se pojavom posebno bavio engleski fizičar William Crookes (1832. - 1919.). On je dokazao da su uzrok svjetlucanju stakla zrake koje izlaze iz katode pa ih je nazvao katodne zrake. Crookes je pokazao da katodne zrake mogu kinetičku energiju predati objektima koji se nađu na njihovu putu. Iz tog su doba poznate Crookesove cijevi u kojima se malo kolo pokreće, poput vjetrenjače, katodnim zrakama.
Engleski fizičar Joseph John Thomson (1856. - 1940.) istraživao je 1897. ponašanje katodnih zraka u električnom i magnetskom polju. Za razliku od zraka svjetlosti, katodne zrake se otklanjaju u magnetskom i električnom polju ponašajući se kao čestice negativnog električnog naboja. Ustanovio je da tih čestica, koje danas nazivamo elektronima, ima u svakoj tvari. Izmjerio je masu elektrona utvrdivši kako je 1 837 puta manja od mase najlakšeg atoma, atoma vodika. Naboj elektrona izmjerio je 1911. Robert Millikan (1868. - 1953.): 1,6 × 10−19 C.
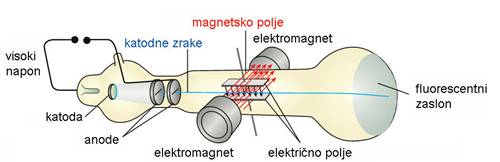
Slika 5.3. Shematski prikaz uređaja kojim je J. J. Thomson
odredio omjer naboja i mase elektrona. Kad se na elektrode evakuiranog uređaja
priključi visoki napon, elektroni koje emitira hladna katoda ubrzaju se
razlikom potencijala između katode i anode. Ubrzani elektroni koji prođu kroz
pukotine u anodama čine paralelni snop koji izaziva fluorescenciju stakla ili
fluorescentnog zaslona na strani suprotnoj od katode. Snop elektrona (katodnih
zraka) otklanja se s obzirom na prvotni smjer gibanja u električnom ili magnetskom
polju poput čestica negativnog električnog naboja. U katodnim cijevima starih
crno-bijelih televizora iskorištene su Thomsonove spoznaje iz 1897. godine.
Izvor: dc.edu.au/ideas-to-implementation
Doznajte više na:
wikipedia/J_J_Thomsons_cathode_ray_tube_with_magnet_coils
I njemački je fizičar Eugen Goldstein (1850. - 1930.) istraživao katodne zrake. Godine 1886. primijetio je da u cijevima s rupičastom katodom staklo iza nje svjetluca. Zaključio je da osim elektrona, ili katodnih zraka, koji putuju od katode prema anodi, postoji još jedna vrsta zraka koja putuje u suprotnom smjeru, od anode prema katodi. Kako te zrake prolaze kroz kanale u katodi, Goldstein ih naziva kanalnim zrakama. Njemački fizičar Wilhelm Wien (1864. - 1928.) proveo je opsežna istraživanje kanalnih zraka u kojima je ustanovio da se one otklanjaju u magnetskom i električnom polju poput čestica pozitivnog naboja te zaključio da su to pozitivni ioni plina zaostalog u cijevi. Godine 1898. ustanovio je kako najveći omjer naboja i mase (e/m) imaju kanalne zrake koje nastaju u cijevima s vodikom. Prema tome, Goldstein i Wien su bili prvi znanstvenici koji su eksperimentirali s ionima H+, česticama za koje danas znamo da su protoni. Wienov rad iz 1898. o kanalnim zrakama postavio je temelje suvremene spektrometrije masa. Naime, Wien je razvio uređaj koji se sastoji od međusobno okomitog električnog i magnetskog polja pa se može koristiti kao filter brzina nabijenih čestica, primjerice u elektronskim mikroskopima i spektrometrima masa.
5.1.1. Thomsonov model atoma
Na osnovi tadašnjih spoznaja Thomson je 1904. postavio model atoma. Atom je zamišljao kao kuglu pozitivnog naboja u koju su usađeni negativni elektroni tako da je atom u cjelini električki neutralan. Iako Thomsonov "plum pudding" model (puding s grožđicama) nije mogao objasniti stabilnost atoma, on se održao sve do 1911. godine kada je Rutherford predložio model atoma sličan planetnom sustavu. No, do Rutherfordovog modela atoma nije se došlo odjednom. Tome je prethodio niz novih otkrića. Prijelaz od 19. na 20. stoljeće izuzetno je uzbudljivo razdoblje znanosti. Novine su tada svakodnevno izvještavale o novim spoznajama i dostignućima znanstvenika.
5.1.2. Otkriće radioaktivnosti
Proučavajući fluorescenciju stakla u Crookesovim cijevima, profesor fizike u Würzburgu Wilhelm Conrad Röntgen (1845. - 1923.) otkrio je u studenome 1895. da cijev ispušta nevidljive zrake koje zacrne fotografsku ploču iako je zamotana u crni papir. X-zrake, kako ih je Röntgen nazvao, pobuđivale su fluorescenciju nekih minerala. To je ponukalo francuskog fizičara Henri Becquerela (1852. - 1908.) da istraži već poznatu pojavu fluorescencije. On je različite minerale izlagao Sunčevoj svjetlosti, a zatim stavljao na fotografsku ploču zamotanu u crni papir. Pri tome je uočio da minerali koji sadržavaju uranij zacrnjuju fotografsku ploču bez obzira na to jesu li prethodno bili izloženi Sunčevu svjetlu. Tako je 1896. Becquerel otkrio novu vrstu zračenja koje je, slično X-zrakama, prolazilo kroz materijale, izazivalo izbijanje elektroskopa i činilo zrak vodljivim.
Potkraj 1897. g. Marie Curie-Sklodowska (1867. - 1934.) diplomirala je kemiju u Parizu i tražila temu doktorske disertacije. Zainteresirale su je zagonetne zrake što su ih je otkrio Becqurel. Radeći sa suprugom, (francuskim fizičarem i kemičarem Pierreom Curieom (1859. - 1906.)) u vrlo teškim materijalnim uvjetima, ubrzo je spoznala da Becqurelovo zračenje potječe od uranija. Slično svojstvo, koje je nazvala radioaktivnost, otkrila je i kod torija. Jednog je dana ustanovila da iz nekih uranijevih minerala izlaze mnogo jače zrake nego što je očekivala, pa je o tome podnijela izvještaj Pariškoj akademiji 12. travnja 1898. Iste godine uspijeva kemijskom analizom utvrditi postojanje dvaju novih kemijskiha elemenata, polonija i radija. Za ta je otkrića, zajedno s Becqurelom, dobila 1903. godine Nobelovu nagradu za fiziku, a 1911. još je, sama, dobila Nobelovu nagradu za kemiju. Njezin rad čini temelje radiokemije. No, ona nije mogla odgovoriti na prvo pitanje koje je postavila doktorskom disertacijom – što je uzrok novim zrakama.
Tijekom 1899. engleski i novozelandskim fizičar Ernest Rutherford (1871. - 1937.) otkrio je da se zračenje što ga ispušta uranij sastoji od dvije vrste čestica. Nazvao ih je a-zrakama i b-zrakama. Neposredno poslije toga francuski fizičar i kemičar Paul Villard (1860. - 1934.) otkrio je 1900. treću vrstu zračenja, g-zrake. Dalja su istraživanja pokazala da su a-zrake teške čestice pozitivnog naboja, da se b-zrake ne razlikuju od elektrona te da su g-zrake vrlo slične X-zrakama, ali su mnogo prodornije. Engleski kemičar Frederick Soddy (1877. – 1956.) zajedno E. Rutherfordom postavio je 1903. teoriju radioaktivnog raspada, po kojoj se atomi radioaktivnih elemenata spontano raspadaju uz zračenje a-čestica, b-čestica i g-zraka pri čemu prelaze u atome drugih elemenata. No pritom je pronašao „elemente“ koji odudaraju od elemenata u periodnom sustavu elemenata. Riječ je bila o atomima istoga kemijskog elementa s različitom masom. Njih je Soddy nazvao izotopima (grč. isos = isti, jednak + topos = mjesto), jer se nalaze u istom mjestu (u istoj „kućici“) periodnog sustava.
Postojanje izotopa pokusima je 1913. godine potvrdio J.J. Thomson. Propuštajući teške ione kroz kombinirano električno i magnetsko polje dobio je na fotografskoj ploči tragove iona razdvojenih prema njihovim masama. Tako je utvrdio da neon ima dva izotopa relativnih atomskih masa 20 i 22. Poslije je, tijekom 1919. godine, engleski fizikalni kemičar Francis W. Aston (1877. - 1945.) načinio uređaj koji je omogućio točno mjerenje omjera mase i naboja čestica. Taj uređaj danas zovemo maseni spektrometar. U masenom spektrometru atomi i molekule prevode se u električki pozitivno nabijene čestice, ione, u plinovitu stanju. Pozitivni ioni ubrzavaju se električnim poljem tako da se dobije uzak paralelan snop, koji zatim prolazi kroz magnetsko polje. Pritom se ioni veće mase manje otklanjaju od prvotnog smjera. Naprotiv, ioni manje mase više se otklanjaju od prvotnog smjera pa se ulazni snop cijepa. Tako je ustanovljeno da neon ima tri izotopa s relativnim atomskim masama 20, 21 i 22.
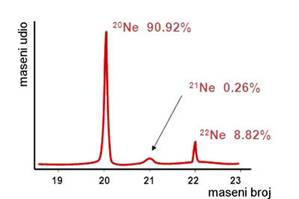
Slika 5.4. Spektrogram masa neona. Visina pojedinog
maksimuma (pika) upućuje na relativnu zastupljenost pojedine vrste čestica u
istraživanom uzorku.
Izvor: n5chemtutor.chemistry-teaching-resources.com
Ako se maseni brojevi atoma pomnože njihovim masenim udjelom u smjesi te dobivene vrijednosti zbroje, dobiva se prosječna relativna atomska masa elementa. Iz podataka na slici 5.4. dobivamo:
udio atoma 20Ne = 90,92 %
udio atoma 21Ne = 0,26 %
udio atoma 22Ne = 8,82 %
Odavde proizlazi da je prosječna relativna atomska masa neona:
Ar(Ne) = (20 × 90,92) + (21 × 0,26) + (22 × 8,82) = 20,18.
Ovaj primjer ujedno objašnjava zašto relativne atomske mase elemenata nisu cijeli brojevi. U suvremenom kemijskom laboratoriju ne može se zamisliti rad bez masenog spektrometra. Uzorci čija je relativna molekulska masa nepoznata u masenom spektrometru se ioniziraju i raspadaju na manje dijelove. Najveću vrijednost omjera m/e imaju ioni nastali od cijelih molekula spoja. Na osnovi mase dijelova molekula nastalih raspadom u masenom spektrometru dobivaju se dragocjeni podaci iz kojih se može zaključivati o strukturi molekula istraživanog spoja.
5.1.3. Rutherfordov model atoma
Tijekom 1909. godine Rutherfordovi su suradnici Hans Geiger (1882. - 1945.) i Ernest Marsden (1889.- 1970.) istraživali prolazak a-čestica kroz tanke metalne listiće. Otkrili su da većina a-čestica prolazi kroz metalne listiće bez otklona. Prolaskom kroz zlatni listić debljine 400 nm, što je oko 1 000 slojeva atoma, od 100 000 a-čestica tek se jedna otklonila od prvotnog smjera, i to obično pod velikim kutom.
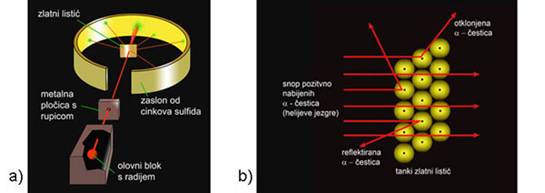
Slika 5.5. a) Geiger–Marsdenov eksperiment.
b) Od prvotnog smjera otklanja se samo ona a-čestica koja se sudari s atomskom jezgrom. Ako se od 100
000 a-čestica
samo jedna odbije na sloju od 1000 atoma zlata, onda će se na
monoatomskom sloju odbiti samo jedna a-čestica
od njih 100 000 000. To znači da se površina
presjeka jezgre prema površini presjeka atoma odnosi kao 1 : 100 000
000. Odavde proizlazi da se radijusi jezgre i atoma odnose kao ![]() . Radijus
jezgre je 10 000 puta manji od radijusa atoma.
. Radijus
jezgre je 10 000 puta manji od radijusa atoma.
Na osnovi tih mjerenja i tadašnjeg znanja Rutherford je zaključio da se sva masa i pozitivni naboj mora nalaziti u malom djeliću atoma, u atomskoj jezgri. Stoga je 1911. predložio model atoma sličan planetnom sustavu. U središtu atoma je pozitivno nabijena jezgra oko koje se gibaju negativno nabijeni elektroni po zatvorenim kružnim orbitama (stazama ili putanjama), baš kao planete oko Sunca. Kako je atom neutralan, negativni naboj omotača mora biti jednak pozitivnom naboju jezgre. Sama jezgra i elektroni sićušni su u odnosu na promjer atoma - najveći dio atoma je prazan prostor, praznina.

Slika 5.6. Rutherfordov model atoma simbol je
Američke agencije za atomsku energiju.
Izvor: hr.wikipedia.org/Rutherfordov_model_atoma
5.1.4. Subatomske čestice
Rezultati dobiveni spektrometrom masa naveli su znanstvenike na razmišljanje o strukturi atomske jezgre. Svi dotadašnji eksperimenti pokazivali su da jezgra atoma vodika nije sastavljena, već da je to subatomska čestica, koja je nazvana proton.
Uzme li se onoliko protona koliki je redni broj elementa u periodnom sustavu, dobiva se tek polovina ili manje od polovine njegove mase. Već a-čestica ima dvostruko veći naboj od naboja vodikove jezgre, ali četiri puta veću masu. Taj se problem mogao riješiti samo tako da se pretpostavi postojanje još jedne subatomske čestice, jednake mase kao i proton, ali bez električnog naboja. Ta je čestica nazvana neutron. Postojanje neutrona eksperimentalno je dokazano tek 1932. godine kad je James Chadwick (1891. - 1974.) ustanovio da neutroni nastaju bombardiranjem berilija a-česticama. Pretpostavkom o neutronima mogao se razjasniti spektrogram masa neona. Jedna vrsta atoma neona mora se sastojati od 10 protona i 10 neutrona, druga od 10 protona i 11 neutrona te treća od 10 protona i 12 neutrona.
Daljnja su istraživanja, kojima se bave fizičari, pokazala da se protoni i neutroni mogu razložiti na manje čestice. No, kemičarima su za razumijevanje svih kemijskih i fizičkih promjena dostatne samo tri subatomske čestice: proton, elektron i neutron.
Proton je subatomska čestica čija je masa približno jednaka masi atoma vodika. Proton ima pozitivni električni naboj od 1,6 · 10−19 C. To je najmanji mogući električni naboj, pa se smatra jediničnim električnim nabojem. Svaki drugi električni naboj može biti samo cijeli broj puta veći od jediničnog naboja, naboja jednog protona. Jedinični električni naboj označava se znakom +e.
Elektron je subatomska čestica čija je masa približno 1 863 puta manja od mase atoma vodika. Elektron ima negativni električni naboj, −e, tj. −1,6 · 10−19 C.
Neutron nema električnog naboja. Masa mu je gotovo jednaka masi protona.
Relativne mase subatomskih čestica najčešće se zaokružuju na najbliže cijele brojeve, pa se tako uzima da je relativna masa protona i neutrona jednaka jedan. Masa elektrona najčešće se zanemaruje, uzima se da je jednaka nuli.
Tablica 5.1. Svojstva subatomskih čestica
|
Čestica |
Znak |
Masa |
Relativna masa |
Naboj |
Nabojni broj |
|
elektron |
e− |
9,109 · 10−31 |
0 |
− 1,6 · 10−19 |
− 1 |
|
proton |
p+ |
1,6726 · 10−27 |
1 |
+ 1,6 · 10−19 |
+ 1 |
|
neutron |
no |
1,6749 · 10−27 |
1 |
0 |
0 |
Atomska jedinica mase, u, jednaka je: 1 u ≈ 1,6605 × 10-27 kg
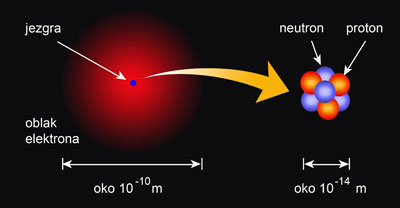
Slika 5.7. Svaki je atom građen tako da se u njemu mogu razlikovati dva dijela. U središtu atoma je nukleus ili pozitivno nabijena atomska jezgra koja se sastoji od protona i neutrona. Čestice koje izgrađuju atomsku jezgru jednim se imenom nazivaju nukleoni. Nukleone u jezgri održavaju vrlo snažne nuklearne sile. Oko jezgre nalaze se elektroni koji čine elektronski omotač.
5.1.5. Protonski i maseni broj - izotopi i izobari
Atomi elemenata razlikuju se brojem protona u jezgri, no i brojem elektrona u omotaču: svi atomi vodika imaju jedan proton u jezgri i jedan elektron u omotaču. Atomi s dva protona u jezgri i dva elektrona u omotaču pripadaju heliju, a atomi litija imaju tri protona u jezgri i tri elektrona u omotaču, itd. Općenito vrijedi: Broj elektrona u omotaču atoma jednak je broju protona u jezgri. Atom je stoga električki neutralan. Još važnije: brojem protona u jezgri određen je kemijski element kojemu pripada atom.
Atom zlata ima u jezgri 79 protona, pa će mu stoga protonski broj biti 79. U jezgri atoma žive ima 80 protona, pa je protonski broj žive 80. Protonski broj označava se slovom Z. Ponekad se naziva i redni broj, jer odgovara rednom broju u periodnom sustavu elemenata. Protonski ili redni broj elementa označava se kao donji indeks ispred simbola elementa. Za prvih šest elemenata to bismo napisali ovako: 1H, 2He, 3Li, 4Be, 5B, 6C.
Jezgre atoma sadržavaju, osim protona i neutrone. Ukupan broj protona i neutrona u jezgri atoma naziva se maseni broj. On se označava znakom A.
![]()
Svi atomi istoga kemijskog elementa ne moraju biti jednaki. Neki mogu imati više, a neki manje neutrona. Tako se u prirodi nalaze tri vrste atoma ugljika koje nazivamo izotopima (grč. isos = isti + topos = mjesto). Svi oni u jezgri sadržavaju 6 protona, pa im je protonski ili redni broj jednak 6. Glavnina, 98,9 %, atoma ugljika koji se nalaze u prirodi sadržavaju u jezgri 6 neutrona, pa je njihov maseni broj 12. No, 1,1 % ugljikovih atoma sadržava 7 neutrona pa imaju maseni broj jednak 13. U prirodi se nalaze još i atomi ugljika s 8 neutrona u jezgri s masenim brojem 14. Ugljikovih atoma s masenim brojem 14 ima vrlo malo, samo 1 atom prema tisuću milijarda atoma ugljika s masenim brojem 12.
U prirodi su jednaki samo svi atomi helija, berilija, fluora, natrija, aluminija, fosfora, zlata i još nekih elemenata. Oni nemaju prirodnih izotopa. Njihovi se izotopi mogu dobiti umjetnim putem tako da ih se izloži zračenju u nuklearnom reaktoru.
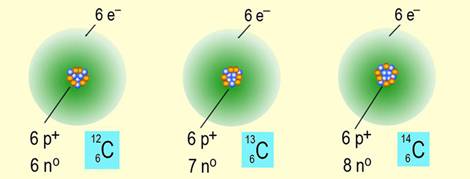
Slika 5.8. Shematski prikaz građe atoma
izotopa ugljika. Svi atomi ugljika sadržavaju 6 protona u jezgri i 6 elektrona
u elektronskom omotaču. Zato je 6 protonski ili redni broj svih atoma ugljika.
Maseni broj nekog atoma jednak je zbroju broja protona i neutrona u jezgri.
Zato atomi izotopa ugljika imaju različite masene brojeve: 12, 13 i
14. Maseni broj piše se kao gornji indeks ispred simbola elementa. Za atome
izotopa ugljika to bismo napisali ovako: ![]()
![]()
Broj izotopa kod
elemenata većeg atomskog broja znatno se povećava. Tako je danas poznato više
od 20 izotopa kriptona, tj. oko 1 200 jezgara za samo 118 elemenata. Zbog toga
se događa da izotopi različitih elemenata imaju jednake masene brojeve. Za njih
se kaže da su izobari (grč. isos = isti + barys = težak). Kao primjer izobara
mogu se navesti ovi izotopi kositra, telura i ksenona:![]() Ti atomi imaju iste masene brojeve, ali im se
razlikuju atomski ili redni brojevi. To je i razumljivo jer je riječ o atomima
različitih kemijskih elemenata.
Ti atomi imaju iste masene brojeve, ali im se
razlikuju atomski ili redni brojevi. To je i razumljivo jer je riječ o atomima
različitih kemijskih elemenata.
Izobari se razlikuju po kemijskim svojstvima, jer su to različiti kemijski elementi. Naprotiv, izotopi su atomi istoga kemijskog elementa i imaju jednaka (zapravo malo različita) kemijska svojstva (izotopni učinak).
5.1.6. Relativna atomska masa, Ar
Mase atoma vrlo su male, reda veličine 10-27 kg. Računati s takvim veličinama u svakodnevnom laboratorijskom radu bilo bi vrlo nespretno. Zato se mase atoma iskazuju relativnom atomskom masom, brojem koji kaže koliko je puta masa nekog atoma veća od odabrane jedinice mase. Izražavanje atomskih masa relativnim jedinicama uveo je 1803. engleski kemičar i fizičar John Dalton. On je za mjernu jedinicu uzeo vodikov atom kao najlakši od svih atoma te mu pridijelio vrijednost 1. Danas rabimo unificiranu jedinicu atomske mase, (simbol Da) koju u čast J. Daltonu nazivamo dalton. Unificirana jedinica atomske mase, jest 1/12 mase nevezanog i neutralnog atoma izotopa ugljika 12C u osnovnom nuklearnom i elektronskom stanju i mirovanju.
mu = m(12C)/12 = 1 Da.
1 Da ili unificirana jedinica atomske mase "u" iznosi približno 1,6605 × 10−27 kg.
Relativne atomske mase kemijskih elemenata nisu cijeli brojevi. To je zato što su kemijski elementi u prirodi smjese izotopa različitih masenih brojeva. Kod određivanja relativnih atomskih masa treba uzeti prosječnu masu svih atomâ kemijskog elementa u prirodi.
5.1.7. Koliko su veliki atomi
Atome zamišljamo kao sićušne kuglice. Nije to neka novost. Već je Dalton atome i molekule prikazivao simbolima koji su izvedeni iz kruga. Koliko su veliki atomi, primjerice magnezija, aluminija, bakra ili srebra možemo i sami približno izračunati poznavajući njihove relativne atomske mase, gustoće te Avogadrovu konstantu, NA = 6,022.×1023 mol−1 (vidi poglavlje 2.2. Molarne veličine). Možemo pretpostaviti da atomi tih elemenata u krutom stanju čine najgušće slagaline kuglica jednake veličine. Dva načina najgušćeg slaganja kuglica jednake veličine, kubna i heksagonska gusta slagalina, prikazana su na slici 5.9.

Slika 5.9. Guste slagaline kuglica jednake veličine. a) Kubna gusta slagalina (engl. CCP - Cubic Close Packing). b) Jedinična ćelija kubne guste slagaline sadržava 4 atoma (8 × ⅛ + 6 × ½ = 4). c) heksagonska gusta slagalina kuglica jednake veličine (engl. HCP - Hexagonal Close Packing).
Kad se pažljivije
promotre modeli gustih slagalina kuglica jednake veličine, očito je da atomi
zauzimaju samo dio prostora. Pokušajmo zato izračunati udio prostora koji u
gustoj slagalini zauzimaju atomi te koliki je udio praznog prostora. Uočite
da se u jediničnoj ćeliji kubne
guste slagaline kuglice dotiču smjerom plošne dijagonale kocke, pa je
radijus kuglice jednak četvrtini duljine njezine plošne dijagonale, r = ![]() . Odavde se za
brid jedinične ćelije dobiva:
. Odavde se za
brid jedinične ćelije dobiva: ![]() . Popunjenost
prostora izračunat ćemo tako da volumen četiriju kuglica podijelimo volumenom
jedinične ćelije, odnosno kocke.
. Popunjenost
prostora izračunat ćemo tako da volumen četiriju kuglica podijelimo volumenom
jedinične ćelije, odnosno kocke.
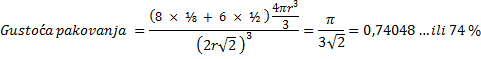
Pokušajmo izračunati radijus atoma aluminija. Njegova relativna atomska masa je Ar(Al) = 27, tj. molarna masa M(Al) = 27 g mol−1. Gustoća aluminija je r(Al) = 2,7 g cm−3. Odavde proizlazi da je molni volumen aluminija Vm(Al) = M(Al)/r(Al) = 27 g mol−1/2,7 g cm−3 = 10 cm3 mol−1. U 10 cm3 aluminija ima Avogadrov broj, 6,022.×1023 atoma aluminija. Već smo kazali da atomi čine 74 % molnog volumena aluminija. Ostalo je prazan prostor. Prema tome 6,022.×1023 atoma aluminija ima volumen 7,4 cm3. Ako volumen svih atoma podijelimo njihovim brojem dobit ćemo volumen jednog atoma aluminija:
Vatom Al = Vm × 0,74 / NA = 10 cm3 mol−1 × 0,74 / 6,022.×1023 mol−1 = 12,3.×10−24 cm3.
Kako je volumen kugle: Vkugla = 4pr3/3, proizlazi da je radijus atoma aluminija:
![]() = 1,43
= 1,43 ![]()
Jednakim postupkom mogu se izračunati i radijusi atoma kalcija, stroncija, nikla, bakra, srebra, zlata i olova. To su približne vrijednosti. Točne vrijednosti radijusa atoma bilo je moguće odrediti tek nakon otkrića difrakcije rendgenskih zraka 1912. godine.
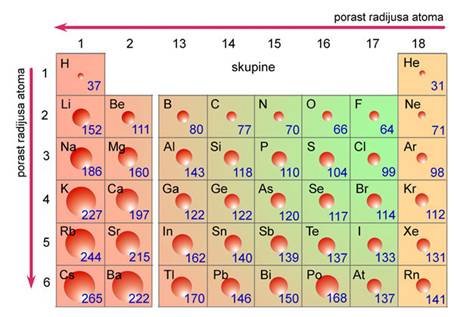
Slika 5.10. Atomski radijusi izraženi u pm. Unutar periodnog sustava elemenata radijusi atoma povećavaju se od desna na lijevo i odozgo prema dolje.
5.2. Građa elektronskog omotača atoma
Otkada je Rutherford predložio model atoma postavljalo se
mnogo pitanja. Najvažnije je bilo zašto elektroni, koji se oko jezgre kreću
poput planeta oko Sunca, ne padnu u jezgru. Naime, prema klasičnoj
elektrodinamičkoj teoriji elektron koji se giba po kružnoj putanji morao bi
proizvesti elektromagnetsko zračenje u obliku svjetlosti iste frekvencije kakva
je frekvencija okretanja elektrona oko jezgre. To znači da bi elektroni u atomu
morali gubiti energiju te se spiralno približavati i konačno pasti u jezgru.
Nadalje, zašto atomi apsorbiraju ili emitiraju svjetlost samo točno određenih
frekvencija? Zašto spektralne linije postaju sve gušće prema manjim valnim
duljinama (većim frekvencijama) da bi konačno prešle u kontinuirani spektar?
Osim toga, prema klasičnoj teoriji atom bi morao emitirati kontinuirani spektar
zračenja, a ne linijski spektar koji zaista emitira. Rutherfordov model atoma i klasična
elektrodinamička teorija iz 19. stoljeća nisu mogli odgovoriti na ta pitanja.
No, bilo je još nekoliko problema koji se ni na koji način nisu mogli objasniti
iz tadašnje teorije, kao npr. zračenja crnog
tijela i fotoelektrični
efekt. Očito, trebala je pronaći novu teoriju kojom se mogu objasniti rezultati
provedenih i predvidjeti rezultati budućih eksperimenata.
5.2.1. Od čega se sastoji svjetlost
Engleski fizičar, matematičar i astronom, Isac Newton (1642. - 1727.) zapitao se od čega se sastoji svjetlost. Mislio je da se svjetlost sastoji od malih čestica, korpuskula, koje emitiraju vrući objekti poput Sunca. Njegov suvremenik, nizozemski fizičar Christian Huygens (1629. - 1695.), smatrao je svjetlost nekom vrstom vala. No, ni jedan ni drugi nisu imali predodžbu o tomu što je svjetlost. Newton nije znao od čega su sačinjene njegove korpuskule, a Huygens nije imao predodžbu o tome što je to što se kreće kao val. Tek je 1873. godine škotski fizičar James Clerk Maxwell (1831. - 1879.), nadovezujući se na radove Michaela Faradaya (1791 - 1867.), objasnio prirodu svjetlosti elektromagnetskom teorijom. Prema toj teoriji postoji uzajamno djelovanje električnog i magnetskog polja. Promjenljivo magnetsko polje proizvodi promjenljivo električno polje, a promjenljivo električno polje za uzvrat proizvodi promjenljivo magnetsko polje. Ta su dva polja međusobno okomita. Prema tome svjetlost je elektromagnetski val kojim se istodobno pravocrtno širi električno i magnetsko polje u prostoru.
Newton je napravio ključan eksperiment, danas poznat svakom učeniku. Uzak snop Sunčeve svjetlosti propustio je kroz staklenu prizmu te na zidu opazio dugine boje. Svakoj boji duge odgovara vlastiti val Sunčeva zračenja. Najveću valnu duljinu ima svjetlost crvene boje, 700 nm, a najkraću ljubičaste, 400 nm. Tako razloženu bijelu svjetlost zovemo kontinuirani spektar. Osim vidljivih, u Sunčevu spektru ima i drugih, npr. infracrvenih zraka (IR - infrared) čija je valna duljina veća od valne duljine crvenih zraka . Ultraljubičaste zrake (UV - ultraviolet) imaju pak valnu duljinu manju od ljubičastih zraka.
Slika 5.11. Kontinuirani spektar. Vidljivi dio spektra obuhvaća valne duljine od 400 do 700 nm.
Slika izvor: www.giangrandi.ch/spectrum
POKUS 5.1. Bojenje plamena
Vidi na internetu: www.youtube.com/watch?v=qLkgtDw4VP8&t=90s

Slika 5.11a. Plamen laboratorijskoga plamenika oboji se žuto kada se u njega unese kuhinjska sol. Žutu svjetlost emitiraju pobuđeni atomi natrija. Kada taj žuto obojeni plamen obasjamo žutim svjetlom natrijeve svjetiljke, tada se na zidu vidi njegova sjena. Uzrok tomu su natrijevi atomi koji apsorbiraju istu valnu duljinu svjetlosti koju sami emitiraju. Uočite da ta ista žuta svjetlost natrijeve svjetiljke prolazi kroz neobojeni dio plamena bez stvaranja sjene jer u tom dijelu plamena nema natrijevih atoma.
Izvor: Physikdepartement ETH Zurich
Njemački fizičar Joseph von Fraunhofer (1787. - 1826.), oko 1814. godine otkrio je da u Sunčevu spektru postoji niz tamnih linija. Njemu u čast te linije danas nazivamo Fraunhoferovim linijama. Nedugo nakon toga Fraunhofer je u spektru svijeće otkrio žutu liniju koja se nalazila točno na istome mjestu gdje i jedna tamna linija u Sunčevu spektru. Unatoč svim nastojanjima, Fraunhofer nije mogao spoznati uzrok toj pojavi.
U prvoj polovini 19. stoljeća više je fizičara otkrilo da svaki kemijski element emitira svjetlost samo određenih valnih duljina karakterističnih za taj element. Primjerice, ako se u plamen plinskoga plamenika unese bilo koji natrijev spoj, u spektru se opaža dvostruka žuta linija svojstvena samo natriju. Obratno, ako se kroz pare natrija propusti bijela svjetlost, dakle ona koja sadržava sve valne duljine, u izlaznoj svjetlosti pojavljuju se tamne linije upravo tamo gdje se nalaze svijetle linije u emisijskom spektru natrija. Tako dobiveni spektar zove se apsorpcijski spektar. To znači da atomi apsorbiraju upravo one valne duljine svjetlosti koje i sami emitiraju. Sada se mogu objasniti Fraunhoferove tamne linije u Sunčevu spektru. Bijelu svjetlost koje izlazi iz dubine Sunca apsorbiraju atomi elemenata u njegovoj atmosferi. Zato do nas dopire svjetlost u kojoj nedostaju određene valne duljine. Tamna linija u Sunčevu spektru, na mjestu gdje se opaža žuta natrijeva linija, dokazuje da se u Sunčevoj atmosferi nalazi natrij. U apsorpcijskom spektru Sirijusa pojavljuju se tamne linije na mjestu koje odgovara linijama vodika. Očito je da Sirijus opkoljavaju goleme količine vodika.
Spektralna analiza omogućila je otkriće mnogih elemenata. U Sunčevu spektru su 1871. opažene linije koje nije pokazivao nijedan na Zemlji poznati element. Te su Iinije pripisane novom elementu koji je nazvan helij (grč. helyos = bog Sunca). U Zemljinoj atmosferi nađen je tek 1898. Spektralnom analizom može se istraživati cijeli svemir, pa se pokazalo da se on sastoji od istih elemenata koji su nađeni i na Zemlji. Spektralna se analiza uvelike primjenjuje u suvremenim analitičkim laboratorijima jer omogućuje detektiranje tragova elemenata u uzorku.
5.2.2. Emisijski spektar vodika
Crookesova cijev napunjena vodikom svijetli ružičasto kada se kroz nju izbija električni naboj. Propuštanjem te svjetlosti kroz staklenu prizmu dobije se linijski spektar sa samo četiri oštre linije. Linijske spektre emitiraju atomi pa se zato nazivaju emisijskim spektrima atoma.

Slika 5.12. Apsorpcijski i emisijski spektar vodika.
Izvor: xaktly.com/Chemistry_Electrons
Švicarski matematičar i fizičar Johann Balmer (1825. - 1898.) našao je 1885. godine formulu kojom se moglo izračunati valne duljine serije linija u vidljivom dijelu vodikova spektra. Uskoro su otkrivene i druge serije linija u ultraljubičastom i infracrvenom području vodikova spektra. Godine 1888. švedski fizičar i astronom Johannes Rydberg (1854. - 2019.) uspio je naći relativno jednostavnu formulu (Rydbergova formula) kojom se mogu izračunati valni brojevi, (recipročne vrijednosti valnih duljina) linija u spektrima kemijskih elemenata. Rydbergova formula sadržava konstantu poznatu kao Rydbergova konstanta. Ona se razlikuje od elementa do elementa. Valne duljine linija vodikova spektra izračunavaju se prema formulama:
U ovim je formulama l - valna duljina apsorbiranog ili emitiranog zračenja, RH - Rydbergova konstanta za vodik, 1/l - valni broj (recipročna vrijednost valne duljine). Valni broj ima dimenziju m-1.
5.2.3. Kvanti energije
Proučavajući zračenje užarenih tijela njemački
fizičar Max
Planck (1858. - 1947.) postavio je 1900. godine hipotezu o kvantima te pogodio da se energija može emitirati ili apsorbirati
samo u paketima najmanje količine energije, E = nhν, gdje je n = 1, 2, 3, …, h = Planckova konstanta = 6,626×10−34
J s,
ν = frekvencija. Rezultat Planckova istraživanja
bilo je iznenađenje, jer se u to doba vjerovalo da je energija kontinuirano
svojstvo tvari pa se stoga može prenijeti bilo koja količina energije. Planck
je pokazao da je energija kvantizirana: mogu se prenositi samo mali paketi
veličine E = hν.
Svaki taj "atom energije" zovemo kvant.
Njemački fizičar Heinrich Rudolf Hertz (1857. - 1894.), prvi je 1888. godine dokazao postojanje elektromagnetskih valova čime je potvrdio Maxwellovu teoriju elektromagnetizma. Usput je 1887. godine otkrio fotoelektrični efekt, ali ga nije dalje istraživao. Fotoelektričnim efektom nazivamo izbijanje elektrona iz poliranih metalnih ploča kad na njih pada elektromagnetsko zračenje. No, njemački fizičar Wilhelm Hallwachs (1859. - 1922.) već je sljedeće godine napravio pokus u kojem je spojio elektroskop na izoliranu pločicu od cinka ili nekog drugog metala. Pločicu je obasjavao svjetlošću različita intenziteta i valnih duljina. Ako je elektroskop bio nabijen pozitivno nije opazio promjene. Ništa se ne događa niti kada se negativno nabijeni elektroskop obasja vidljivom svjetlošću bez obzira na intenzitet. Naprotiv, negativno nabijeni elektroskop izbije se kada se pločica obasja UV-svjetlošću koja ima kraću valnu duljinu (veću frekvenciju) od vidljive svjetlosti. No, u to doba nije bilo teorije kojom bi se mogle objasniti opažene promjene.
Misterij se počeo objašnjavati tek 1899. godine kad su J.J. Thomson i Philipp Lenard (1862. - 1947.) pokusima s vakuumskim cijevima dokazali da pri fotoefektu dolazi do izbijanja elektrona. Lenard je ustanovio da broj izbijenih elektrona ovisi samo o intenzitetu, dok im kinetička energija ovisi samo o frekvenciji svjetlosti. Za svaki metal postoji granična frekvencija, νprag, karakteristična za njega, pa samo elektromagnetsko zračenje frekvencije veće od νprag može izbiti elektrone iz tog metala. Iako su rezultati Lenardovih mjerenja bili neprecizni, američki fizičar njemačko-židovskog podrijetla Albert Einstein (1879. - 1955.) ipak je na temelju tih pokusa 1905. godine postavio hipotezu o kvantima svjetlosti ili fotonima. U objašnjenju fotoefekta Einstein je primijenio Planckovu hipotezu o kvantima energije. Ovisnost najveće moguće kinetičke energije izbijenog elektrona o frekvenciji upadne svjetlosti dana je Einsteinovom jednadžbom:
Ekin = h(ν - νprag)
U ovoj je jednadžbi Ekin = maksimalna kinetička energija izbijenog elektrona, h = Planckova konstanta, ν = frekvencija upadne svjetlosti, νprag = granična frekvencija karakteristična za metal. To znači da frekvencija upadne svjetlosti, mora biti veća od granične frekvencije nprag, da bi se pojavio fotoefekt. Odavde proizlazi da se svjetlost može shvatiti i korpuskularno, tj. kao roj čestica - fotona, od kojih svaki nosi energiju, E = hν. Za objašnjenje fotoefekta Einstein je 1921. god. dobio Nobelovu nagradu.
Na kraju, i Newton i Huygens bili su u pravu jer svjetlost osim valnih posjeduje i čestična svojstva, kao što su to početkom 20. stoljeća pokazali Max Planck i Albert Einstein.
Vidi na intenetu: www.youtube.com/watch?v=JecpMcR4Fss
POKUS 5.2. Elektromagnetski spektar
Vidi na internetu: www.youtube.com/watch?v=tb-u5xEfwMA
5.2.4. Bohrov model vodikova atoma
Danski fizičar Niels Bohr (1885. - 1962.) u proljeće 1912. boravio je nekoliko mjeseci u Rutherfordovom laboratoriju u Manchesteru. Pritom je na samom mjestu događanja upoznao rezultate istraživanja o raspršenju alfa-čestica na metalnim folijama, Rutherfordov model atoma, linijske spektre vodika, Rydbergovu formulu, fotoelektrični efekt, ideje o kvantima energije i fotonima, kao i poteškoće u njihovoj interpretaciji. Očito je bilo da Rutherfordov model atoma ne može riješiti problem linijskih spektara i protumačiti stabilnost atoma. No, Bohr polazi o činjenice da je atom vodika stabilan pa je 1913. vodikov spektar objasnio Planckovom teorijom o kvantima energije.
Prema prvom Bohrovom postulatu atom vodika može postojati u stacionarnim stanjima u kojima ne emitira energiju. Drugim riječima, elektron može kružiti oko jezgre po dopuštenim kružnim orbitama (stazama, putanjama). Najmanja od tih orbita odgovara osnovnom stanju u kojem atom ima najmanju energiju. To je najstabilnije stanje atoma. Drugi Bohrov postulat kaže: ako atomu izvana dovedemo energiju on može apsorbirati samo kvant energije jednak razlici energija stacionarnih stanja, tj. dopuštenih orbita. Prema tome, nema kontinuiranih promjena energije atoma. Elektron u atomu vodika može samo skočiti s nižeg na viši energijski nivo, i obratno, s višeg na niži nivo. Ako je energija elektrona u nižem energijskom nivou bila E1 a u višem energijskom nivou E2, onda je apsorbirana energija jednaka:
E2 – E1 = hν
U ovoj je jednadžbi h = 6,626×10-34 J s, (Planckova konstanta), a ν je frekvencija svjetlosti. Atom koji je apsorbirao kvant energije nalazi se u pobuđenom stanju. Ono traje kratko, oko 10-8 s. Kad u pobuđenom atomu vodika elektron preskoči s gornjeg (višeg) energijskog nivoa na donji (niži) energijski nivo emitira se kvant energije (foton) jednak razlici energija stacionarnih stanja. Tako nam atom sam šalje poruke o energijama stacionarnih stanja. Bohr je to prvi uočio. Slika 5.13. shematski prikazuje energijske nivoe atoma vodika.
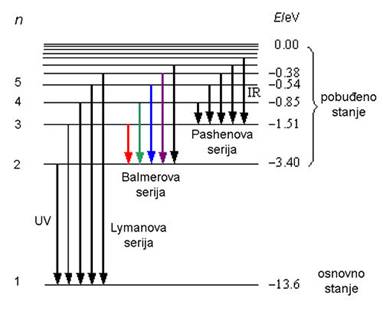
Slika 5.13. Shematski prikaz energijskih nivoa (stacionarnih
stanja) atoma vodika. Pri skoku elektrona s nižeg na viši energijski nivo atom
apsorbira kvant energije jednak razlici energija stacionarnih stanja. Skokom
elektrona s višeg na niži energijski nivo atom emitira kvant svjetlosti čija
je energija opet jednaka razlici energija stacionarnih stanja: DE = Egornji - Edonji = hν.
Izvor: eilat.sci.brooklyn.cuny.edu
Bohr je svojim modelom vodikova atoma uspio objediniti Rutherfordov model atoma i kvantnu teoriju te Rydbergovoj konstanti dati fizički smisao. Spektri atoma vodika mogu se izračunati iz formule:
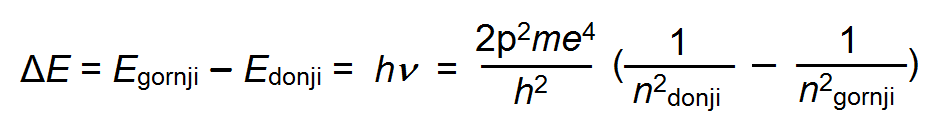
U ovoj je jednadžbi n glavni kvantni broj koji može biti bilo koji cijeli broj. Najnižem energijskom nivou (stacionarnom stanju) odgovara glavni kvantni broj n = 1, a najvišem n = ¥. Razlika energija između ta dva nivoa jednaka je energiji ionizacije, a to je energija potrebna da se elektron otrgne od vodikova atoma. Ta je energija točno izmjerena te iznosi 13,60 eV. Drugi energijski nivo vodikova atoma je iznad prvoga za (1/12 - 1/22) = 3/4 energije ionizacije, tj. viši je za 10,2 eV. Da se elektron u atomu vodika pobudi iz osnovnog stanja u prvo više stanje treba utrošiti energiju jednaku razlici energijskih nivoa:
DE = En=2 - En=1 = -3,40 eV - (-13,6 eV) = 10,2 eV.
Atom je tada u pobuđenom stanju. Kad elektron preskoči u osnovno stanje emitira se UV svjetlost prve linije Lymanove spektralne serije (vidi sliku 5.13).
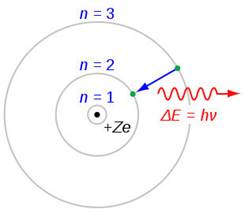
Slika 5.14. Bohrov model atoma. Elektron se
u atomu vodika giba oko jezgre po kružnim orbitama (putanjama, stazama) čiji je
radijus određen glavnim kvantni brojem n. Kad atom primi energiju, npr. tijekom
električnog pražnjenja, elektron preskoči na jednu od orbita dopuštenog većeg
radijusa, odnosno na viši energijski nivo. Skokom elektrona s višeg na niži
energijski nivo emitira se kvant energije jednak razlici energija dopuštenih
nivoa.
Izvor: en.wikipedia.org/Bohr_model
Nažalost, Bohrov model nije zadovoljio u pokušaju tumačenju spektara atoma drugih elemenata. Osim toga, ubrzo nakon što je Bohr objavio svoj planetni model atoma, dogodilo se nekoliko otkrića što je dovelo do drukčijeg pogleda na atom. Primjerice, 1913. njemački je fizičar Johannes Stark (1874. - 1957.) otkrio da se spektralne linije vodika u jakom električnom polju cijepaju u niz vrlo bliskih linija koje se međusobno razlikuju po valnoj duljini za oko 0,005 nm. Pojavu fine strukture spektra, odnosno utjecaj električnog (Starkov efekt) i magnetskog polja (Zeemanov efekt) na linijski spektar Bohrova teorija nije mogla objasniti. Naime, proizlazi da jednom te istom kvantnom stanju, određenom kvantnim bojem n, odgovara više energijskih stanja elektrona koja se malo razlikuju. Nadalje, već smo u poglavlju 5.2.3. kazali da svjetlost osim valnih posjeduje i čestična svojstva. Luis de Broglie (1892. - 1987.) je u doktorskoj tezi iz 1924. godine postavio obrnuto pitanje: "Ako svjetlost osim valnih posjeduje i čestična svojstva, treba li česticama tvari u pokretu, kao što su primjerice elektroni, osim čestičnih pridružiti i valna svojstva?" Ovu njegovu pretpostavku o valnim svojstvima čestica znanstvenici su isprva primili s nevjericom, pa čak i s podsmjehom. No, njegova je pretpostavka poslije eksperimentalno potvrđena difrakcijom elektrona na kristalima. Difrakcijska slika bila je dokaz valnih svojstava elektrona. De Broglieva valna duljina, l, određena je izrazom: l = h/mv, gdje je h - Planckova konstanta, m - masa čestice, v - brzina reda veličine brzine svjetlosti. Dualizam val - čestica osnovno je svojstvo u svijetu atoma: to su dva vida postojanja materije.
5.2.5. Bohr-Sommerfeldov model atoma
Njemački fizičar Arnold Sommerfeld (1868. - 1951.) pretpostavio je 1915. da se elektron oko jezgre ne kreće samo po kružnim nego i po eliptičnim orbitama, baš kao što je to Kepler otkrio za gibanje planeta oko Sunca. Elipsa se ne može opisati jednim parametrom (kvantnim brojem) kao kružnica njezinim radijusom. Eliptična putanja elektrona određena je velikom i malom poluosi elipse, što pak zahtijeva, za elektron dva kvantna broja za definiranje oblika eliptične orbite i još jedan,treći broj za orijentaciju orbitalne ravnine u prostoru. Sommerfeld je razradio Bohrovu kvantizaciju: energijsko stanje elektrona u atomu određeno vrijednostima kvantnih brojeva n, l, i ml:
- glavni kvantni broj (n = 1, 2, ... ¥)
određuje svojstvene vrijednosti energije elektrona.
- sporedni (orbitalni) kvantni broj (l = 0, 1, … n-1)
određuje vrijednost kutne količine gibanja elektrona
u kvantnim stazama,
- magnetski kvantni broj (ml = - l,…, -1, 0, 1,…+l) određuje moguće orijentacije kutne količine gibanja u odnosu na os vanjskoga magnetskoga polja,
Iz Bohr-Sommerfeldove teorije proizlazi da unutar pojedine ljuske, određene kvantnim brojem n, postoje energijski podnivoi ili podljuske koje se označavaju slovima s, p, d, f itd. Te su oznake već prije upotrebljavane za spektralne serije alkalijskih metala. Naime, serija s oštrim linijama dobila je oznaku s prema sharp - oštra. Oznaka p potječe od principal = glavna, d od diffuse = difuzna, f od fundamental = osnovna.
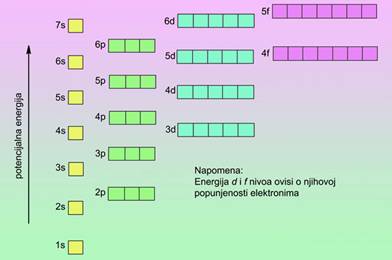
Slika 5.15. Shematski prikaz međusobnog odnosa energijskih nivoa ljusaka i podljusaka i njihovo označavanje u višeelektronskom atomu. Elektroni u elektronskom omotaču atoma u osnovnom stanju zauzimaju najniže moguće energijske nivoe. Crtež nije u skali s realnim odnosom energija.
Njemački fizičari Otto Stern i Walther Gerlach ispitivali su utjecaj nehomogenog magnetskog polja na snop atoma srebra te ustanovili da se on cijepa na dva snopa. Atom srebra ima 47 elektrona, od kojih 46 elektrona čine nekakvu sfernu razdiobu naboja oko jezgre, a 47. elektron je "nesparen", i kao takav određuje ukupnu kutnu količinu gibanja atoma. Njihov su pokus objasnili George Uhlenbeck i Samuel Goudsmit 1925. godine uvođenjem četvrtog kvantnog broja koji su nazvali spin. Elektron se ponaša kao magnet, pa se njegov spinski magnetski moment ili pribraja ili oduzima orbitalnome magnetskom momentu. Kvantni broj spina, ms, može poprimiti samo dvije vrijednosti, +1/2 i -1/2. Ta dva stanja razlikuju se po energiji. Elektroni suprotnog spina označavaju se strelicama suprotna smjera, ↑↓. Spin je unutarnje svojstvo elektrona koje se ne može zorno predočiti. On nema veze sa slikovitom no naivnom predodžbom vrtnje elektrona oko vlastite osi.
5.2.6. Elektronska konfiguracija
Raspodjelu elektrona u atomu po ljuskama i podljuskama zovemo elektronskom konfiguracijom atoma. Najjednostavniji atom vodika ima samo jedan elektron u prvoj ili K-ljusci. Njegovi su kvantni brojevi; n = 1, l = 0, m = 0 i ms = +½. Spinski kvantni broj ms može poprimiti samo dvije vrijednosti, +1/2 ili -1/2.
Helij ima dva elektrona u prvoj ili K-ljusci. Prvi elektron ima iste kvantne brojeve kao u vodikovu atomu. No, u istom atomu dva elektrona ne mogu imati iste kvantne brojeve (Paulijevo načelo) pa su kvantni brojevi drugoga elektrona u atomu helija: n = 1, l = 0, m = 0 i ms = -1/2. S helijem je prva ili K-ljuska popunjena (zatvorena) pa ne može primiti više nijedan elektron.
Sljedeći atom, atom litija, ima 3 elektrona pa treći elektron zaposjeda 2s podljusku. Vrijednosti kvantnih brojeva dodjeljuje se svakom elektronu u atomu postupkom "izgradnje". Niels Bohr je taj proces nazvao "Aufbau" principom. Vidimo ga na djelu u tablici 5.2. na primjerima atoma prvih 10 elemenata.
Tablica 5.2. Elektronske konfiguracije prvih 10 elemenata
|
Element |
n |
l |
ml |
ms |
Podljuska |
Konfiguracija |
Broj elektrona |
|
Vodik |
1 |
0 |
0 |
+½ |
1s |
1s1 |
1 |
|
Helij |
1 |
0 |
0 |
+½ |
1s |
1s2 |
2 |
|
1 |
0 |
0 |
-½ |
||||
|
Litij |
1 |
0 |
0 |
+½ |
1s |
1s2 2s1 |
3 |
|
1 |
0 |
0 |
-½ |
||||
|
2 |
0 |
0 |
+½ |
2s |
|||
|
Berilij |
1 |
0 |
0 |
+½ |
1s |
1s2 2s2 |
4 |
|
1 |
0 |
0 |
-½ |
||||
|
2 |
0 |
0 |
+½ |
2s |
|||
|
2 |
0 |
0 |
-½ |
||||
|
Bor |
1 |
0 |
0 |
+½ |
1s |
1s2 2s2 2p1 |
5 |
|
1 |
0 |
0 |
-½ |
||||
|
2 |
0 |
0 |
+½ |
2s |
|||
|
2 |
0 |
0 |
-½ |
||||
|
2 |
1 |
-1 |
+½ |
2p |
|||
|
Ugljik |
1 |
0 |
0 |
+½ |
1s |
1s2 2s2 2p2 |
6 |
|
1 |
0 |
0 |
-½ |
||||
|
2 |
0 |
0 |
+½ |
2s |
|||
|
2 |
0 |
0 |
-½ |
||||
|
2 |
1 |
-1 |
+½ |
2p |
|||
|
2 |
1 |
0 |
+½ |
||||
|
Dušik |
1 |
0 |
0 |
+½ |
1s |
1s2 2s2 2p3 |
7 |
|
1 |
0 |
0 |
-½ |
||||
|
2 |
0 |
0 |
+½ |
2s |
|||
|
2 |
0 |
0 |
-½ |
||||
|
2 |
1 |
-1 |
+½ |
2p |
|||
|
2 |
1 |
0 |
+½ |
||||
|
2 |
1 |
1 |
+½ |
||||
|
Kisik |
1 |
0 |
0 |
+½ |
1s |
1s2 2s2 2p4 |
8 |
|
1 |
0 |
0 |
-½ |
||||
|
2 |
0 |
0 |
+½ |
2s |
|||
|
2 |
0 |
0 |
-½ |
||||
|
2 |
1 |
-1 |
+½ |
2p |
|||
|
2 |
1 |
-1 |
-½ |
||||
|
2 |
1 |
0 |
+½ |
||||
|
2 |
1 |
1 |
+½ |
||||
|
Fluor |
1 |
0 |
0 |
+½ |
1s |
1s2 2s2 2p5 |
9 |
|
1 |
0 |
0 |
-½ |
||||
|
2 |
0 |
0 |
+½ |
2s |
|||
|
2 |
0 |
0 |
-½ |
||||
|
2 |
1 |
-1 |
+½ |
2p |
|||
|
2 |
1 |
-1 |
-½ |
||||
|
2 |
1 |
0 |
+½ |
||||
|
2 |
1 |
0 |
-½ |
||||
|
2 |
1 |
1 |
+½ |
||||
|
Neon |
1 |
0 |
0 |
+½ |
1s |
1s2 2s2 2p6 |
10 |
|
1 |
0 |
0 |
-½ |
||||
|
2 |
0 |
0 |
+½ |
2s |
|||
|
2 |
0 |
0 |
-½ |
||||
|
2 |
1 |
-1 |
+½ |
2p |
|||
|
2 |
1 |
-1 |
-½ |
||||
|
2 |
1 |
0 |
+½ |
||||
|
2 |
1 |
0 |
-½ |
||||
|
2 |
1 |
1 |
+½ |
||||
|
2 |
1 |
1 |
-½ |
Elektroni se u p-, d- i f-podljuskama razmještaju tako da broj nesparenih elektrona bude maksimalan (Hundovo pravilo). Elektronske konfiguracije od atoma bora do neona metodom "kućica" prikazane su na slici 5.16.
Slika 5.16. Grafički prikaz elektronskih konfiguracija atoma s 2p-podljuskom. Elektroni su predstavljeni strelicama. Strelice suprotna smjera označavaju elektrone suprotna spina. Prva ljuska ima samo jednu i to 1s-podljusku koja može primiti dva elektrona. Druga ljuska sastoji se od 2s i 2p podljuske. Elektroni u 2p podljuski razmještena su tako da broj nesparenih elektrona s paralelnim spinom bude maksimalan.
Konfiguracija u kojoj su sve podljuske popunjene, kao u neonu (1s2 2s2 2p6) zove se konfiguracija zatvorene ljuske. Osim helija, koji ima elektronsku konfiguraciju 1s2, svi plemeniti plinovi imaju osam elektrona (oktet) u posljednjoj ljusci. Elektronske konfiguracije ns2 np6 neobično su stabilne i zato plemeniti plinovi teško grade kemijske spojeve. Zatvorena ljuska ne može primiti više elektrona pa će elektronska konfiguracija sljedećeg elementa, natrija, biti 1s2 2s2 2p6 3s1.
Doznajte više na: doi.org
5.2.7. Periodni sustav elemenata i struktura atoma
Sommerfeldov model atoma našao je potvrdu u Mendeljejevljevom periodnom sustavu elemenata. Naime, redoslijed kojim elektroni popunjavaju atomske ljuske, uz neke iznimke, može se iščitati iz periodnog sustava elemenata.
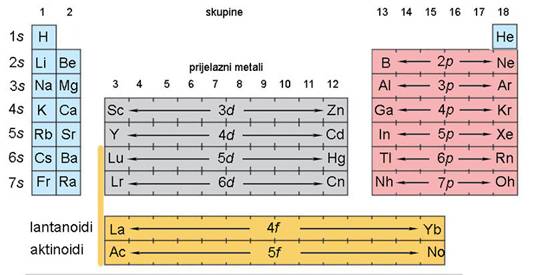
Slika 5.17. Elektronske konfiguracije elemenata
5.2.8. Kvantno-mehanički model atoma vodika
Paradoks opisan Heisenbergovim principom nesigurnosti da je načelno nemoguće istodobno odrediti točan položaj i brzinu čestice i valna priroda subatomskih čestica onemogućili su korištenje jednadžbi klasične fizike za opisivanje gibanja elektrona u atomima. Znanstvenicima je bio potreban novi pristup koji će uzeti u obzir valna svojstva elektrona. Austrijski fizičar Erwin Schrödinger (1887. - 1961.) je na temelju de Broglieve ideje, da čestice tvari u gibanju mogu pokazivati valna svojstva, pretpostavio da se i ponašanje elektrona unutar atoma može objasniti postojanjem valova materije. Taj je model atoma poznat kao kvantno-mehanički ili valno-mehanički model.
Schrödinger je 1926.
godine stanja elektrona u
atomu opisao valnim
funkcijama ψ(r, t). One daju amplitude vala kao funkciju
položaja r u prostoru i vremena t.
To su složene matematičke funkcije koje sadržavaju imaginarnu jedinicu (![]()
![]() ), pa amplituda
vala nema stvarno fizičko značenje. No, kvadrat valne funkcije, |Ψ(r)|2,
ga ima. On je uvijek realna pozitivna veličina čija je vrijednost u točki (x,
y, z) proporcionalna gustoći vjerojatnosti nalaženja elektrona u toj točki. Dakle, Bohrov model
atoma, u kojem se elektron giba po zadanim stazama (orbitama) oko jezgre,
zamijenjen je novim kvantno-mehaničkim modelom koji definira područja prostora
oko jezgre s velikom vjerojatnošću nalaženja elektrona.
), pa amplituda
vala nema stvarno fizičko značenje. No, kvadrat valne funkcije, |Ψ(r)|2,
ga ima. On je uvijek realna pozitivna veličina čija je vrijednost u točki (x,
y, z) proporcionalna gustoći vjerojatnosti nalaženja elektrona u toj točki. Dakle, Bohrov model
atoma, u kojem se elektron giba po zadanim stazama (orbitama) oko jezgre,
zamijenjen je novim kvantno-mehaničkim modelom koji definira područja prostora
oko jezgre s velikom vjerojatnošću nalaženja elektrona.
Valna funkcija povezana je s energijom. Kao u Bohrovom modelu, energija elektrona u atomu može imati samo određene, dopuštene vrijednosti. Razlika između Bohrovog i Schrödingerovog modela je u tome što je Bohr proizvoljno nametnuo ideju kvantizacije, dok u Schrödingerovom pristupu kvantizacija prirodno proizlazi iz elektrona kao stojnog vala.
Valnu funkciju karakteriziraju tri kvantna broja, n, l, i ml. Vrijednosti kvantnih brojeva međusobno su ovisne. Valna funkcija Ψnlm(r) koja odgovara kombinaciji triju kvantnih brojeva (n, l, m) naziva se atomska orbitala. Svaka orbitala može primiti dva elektrona suprotna spina. Ovisno o kombinaciji kvantnih brojeva orbitale dobivaju imena kao u tablici 5.3.
Tablica 5.3. Oznake orbitala u ovisnosti o kvantnim brojevima n, l i m
|
n |
l |
m |
Orbitala |
Maksimalni broj elektrona u podljusci |
Maksimalni broj elektrona u ljusci |
|
n = 1 |
l = 0 |
0 |
1s |
2 |
2 |
|
n = 2 |
l = 0 l = 1 |
0 -1, 0, 1 |
2s 2p |
2 6 |
8 |
|
n = 3 |
l = 0 l = 1 l = 2 |
0 -1, 0, 1 -2, -1, 0, 1, 2 |
3s 3p 3d |
2 6 10 |
18 |
|
n = 4 |
l = 0 l = 1 l = 2 l = 3 |
0 -1, 0, 1 -2, -1, 0, 1, 2 -3, -2, -1, 0, 1, 2, 3 |
4s 4p 4d 4f |
2 6 10 14 |
32 |
Kemičari u prikazima nastajanja kemijskih veza često rabe crteže "elektronskih oblaka" različita oblika i gustoće te ih nazivaju "orbitalama". No to su samo naše predodžbe funkcije |Ψ(r)|2 ili modeli raspodjele gustoće vjerojatnosti nalaženja elektrona u prostoru oko atomske jezgre. Riječ je o matematički definiranom području koje omeđuje jezgru u kojem postoji 99% vjerojatnosti da sadržava elektron. Ondje gdje je "elektronski oblak" gušći, veća je vjerojatnost da se nalazi elektron.
Elektronski oblak 1s-orbitale
Funkcija raspodjele gustoće vjerojatnosti nalaženja elektrona za vodikovu 1s-orbitalu, |Ψ100(r)|2, je sferno simetrična. To znači da ovisi samo o radijusu, kao što je pokazano na slici 5.18. Najveća gustoća vjerojatnosti je pri r = 0. Drugim riječima, izgled da nađemo elektron u nekom djeliću volumena vodikova atoma veća je uz jezgru nego bilo gdje drugdje. Kod vrlo velikih vrijednosti r, gustoća vjerojatnosti je vrlo mala, ali nigdje nije jednaka nuli.
Slika 5.18. Vjerojatnost nalaženja elektrona u osnovnom stanju atoma vodika prikazana modelom oblaka od točkica. a) Gustoća oblaka točkica mijenja se kao |Ψ100(r)|2. Veća gustoća točkica ukazuje na veću vjerojatnost nalaženja elektrona. b) Najveća gustoća vjerojatnosti nalaženja elektrona za 1s-orbitalu je pri r = 0 i smanjuje se povećanjem r.
Zvuči paradoksalno što je najveća gustoća vjerojatnosti nalaženja elektrona upravo uz jezgru atoma. No, taj se paradoks može izbjeći. Zamislimo da smo kuglu gustoće vjerojatnosti za 1s-orbitalu razdijelili u niz vrlo tankih kuglinih slojeva debljine Dr, kao što je pokazano na slici 5.19a. Vidimo da je volumen pojedinih Dr debelih kuglinih slojeva proporcionalan površini kuglina sloja radijusa r, točnije jednak je 4pr2Dr. Funkcija 4pr2Dr raste eksponencijalno s radijusom (slika 5.19b.) te je u jezgri jednaka nuli jer je r = 0.
Ako funkciju 4pr2Dr (slika 5.19b) pomnožimo funkcijom gustoće vjerojatnosti nalaženja 1s-elektrona, |Ψ100(r)|2, (slika 5.19c.) dobit ćemo funkciju radijalne raspodjele gustoće vjerojatnosti nalaženja elektrona, 4pr2Ψ2(r)Dr (slika 5.19d.)
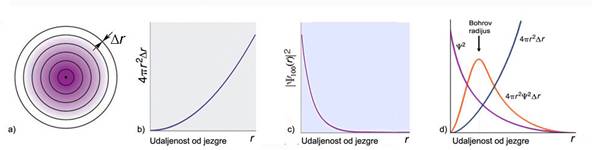
Slika 5.19. Funkcija radijalne raspodjele gustoće vjerojatnosti nalaženja 1s elektrona u atomu vodika. a) Presjek kroz kuglu gustoće vjerojatnosti nalaženja elektrona u prostoru podijeljen u niz vrlo tankih kuglinih slojeva debljine Dr. b) Volumen kuglinih slojeva proporcionalan je 4pr2Dr te raste eksponencijalno s radijusom. c) Gustoća vjerojatnosti nalaženja elektrona za vodikovu 1s-orbitalu, Ψ2(r), smanjuje se porastom radijusa. d) Ako se funkciju volumena kuglinih slojeva, 4pr2Dr, pomnoži funkcijom gustoće vjerojatnosti nalaženja 1s-elektrona, Ψ2(r), dobiva se funkcija radijalne raspodjele gustoće vjerojatnosti nalaženja 1s elektrona, 4pr2Ψ2(r)Dr.
Iz oblika krivulje 4pr2Ψ2(r)Dr prikazane na slici 5.19d. možemo zaključiti da se u vodikovu atomu elektron najčešće nalazi na udaljenosti od oko 53 pm od središta atoma. Ta se udaljenost podudara s radijusom Bohrove orbite. Elektronski oblaci 2s, 3s i 4s orbitala također su sferno simetrični, ali s drukčijom radijalnom raspodjelom gustoće vjerojatnosti nalaženja elektrona.
Elektronski oblaci p-orbitala
Druga ljuska (L) osim 2s orbitale sadržava i tri 2p orbitale. Naime, za 2p podljusku sporedni kvantni broj je ℓ = 1, pa su magnetski kvantni brojevi mℓ = – 1, 0, i 1 što proizvodi tri ekvivalentne 2p orbitale. Njih proizvoljno označavamo simbolima 2px, 2py i 2pz. Treća i četvrta ljuska sadržavaju slične orbitale: 3px, 3py, 3pz, 4px, 4py, 4pz i tako dalje.
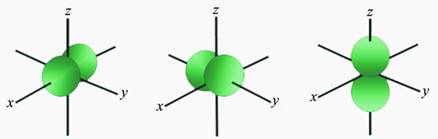
Slika 5.20. Elektronski oblaci 2p orbitala vodikova atoma. Druga ljuska sadržava 2s i 2p podljusku. Za 2p podljusku sporedni kvantni broj je ℓ = 1, pa su magnetski kvantni brojevi mℓ = – 1, 0, i 1. To znači da 2p podljuska sadržava tri ekvivalentne 2p orbitale koje su u prostoru međusobno postavljene okomito.
Prisjetimo li se da elektronski oblaci imaju negativan naboj, razumjet ćemo da se istoimeni naboji odbijaju pa nastoje biti što dalje jedan od drugoga. Zato se elektronski oblaci triju ekvivalentnih 2p orbitala postavljaju okomito jedan u odnosu na druge. Elektronski oblak orbitala prikazan je graničnom površinom unutar koje elektron provede 99 % svog vremena. Orbitale s ℓ = 2 su d orbitale. Pripadni elektronski oblaci imaju složenije oblike. Orbitale s ℓ = 3 su f orbitale, čiji su elektronski oblaci još složeniji.
Doznajte više na: doi.org
Ponovimo
· Atom je najmanja građevna jedinka kemijskog elementa koja može postojati sama ili biti kemijski vezana s atomima istoga elementa ili drugih elemenata.
· Atomi su izgrađeni od protona, neutrona i elektrona.
· Broj elektrona u elektronskom omotaču jednak je broju protona u jezgri.
· Masa elektrona 1 836 puta je manja od jedinice atomske mase.
· Naboj elektrona jednak je jediničnom električnom naboju negativnog predznaka.
· Gotovo sva masa atoma koncentrirana je u njegovoj jezgri, jer jezgru čine protoni i neutroni.
· Protoni imaju masu približno jednaku jedinici atomske mase u i jedinični pozitivni naboj.
· Neutroni imaju masu približno jednaku jedinici atomske mase u, ali nemaju električnog naboja.
· Čestice koje izgrađuju atomsku jezgru jednim se imenom nazivaju nukleoni.
· Nukleone u jezgri održavaju vrlo snažne nuklearne sile.
·
Protonski, atomski ili redni
broj kemijskog elementa, Z, jednak je broju protona u jezgri.
Z = N(p+) = N(e-)
·
Maseni ili nukleonski broj, A,
jednak je zbroju broja protona i neutrona u jezgri atoma.
A = N(p+) + N(no)
· Izotopi su atomi istoga kemijskog elementa koji u jezgri imaju različit broj neutrona.
· Izobari su atomi različitih kemijskih elemenata ali istoga masenog broja.
· Izobari se razlikuju kemijskim svojstvima jer su to različiti kemijski elementi.
· a-čestice su jezgre atoma helija, 42He2+. b-čestice su elektroni, e–. Protoni su jezgre atoma vodika, 1H+.
· U Bohrovom modelu atoma vodika zamišljamo da se elektron kreće po kružnim orbitama (stazama, putanjama) oko jezgre poput Zemlje oko Sunca. Iako takvi prikazi imaju samo povijesnu vrijednost, oni su se zadržali u osnovnoškolskim i srednjoškolskim udžbenicima iz didaktičkih razloga.
· Kvantna fizika je odbacila Bohrov model atoma, ali je zadržala pojmove energijskih nivoa i stacioniranih stanja. Pojam orbita elektrona u klasičnom smislu u potpunosti je odbačen.
· Elektron se u atomu ponaša kao stojni val. Njegova stanja opisuju valne funkcije koje su rješenja Schrödingerove jednadžbe. Kao u Bohrovom modelu, energija elektrona u atomu je kvantizirana te može imati samo određene dopuštene vrijednosti.
· Glavna razlika između Bohrovog modela i Schrödingerovog pristupa je u tome što je Bohr proizvoljno nametnuo ideju kvantizacije, dok je u Schrödingerovom pristupu kvantizacija prirodna posljedica opisivanja elektrona kao stojnog vala.
· Diracovo matematičko rješenje valne jednadžbe pokazuje da valnu funkciju karakteriziraju tri kvantna broja: n, ℓ, mℓ.
· Vrijednosti kvantnih brojeva međusobno su ovisne. Svaki elektron u atomu ima jedinstven skup kvantnih brojeva: n, ℓ, mℓ, i ms (Paulijevo načelo isključenja).
· Valna funkcija Ψnlm koja odgovara kombinaciji triju kvantnih brojeva (n, l, m) naziva se atomska orbitala i odgovara dopuštenom energijskom stanju elektrona. Svaka orbitala može primiti dva elektrona suprotnih spinâ.
· U elektronskom omotaču atoma elektroni se gibaju na nama nepoznat način. Izračunati se ne može njihova putanja nego samo vjerojatnost nalaženja u nekom djeliću volumena atoma. Ta se vjerojatnost mijenja s udaljenošću od jezgre. Obično se prikazuje oblakom točkica različite gustoće koji nazivamo elektronskim oblakom.
· Elektronski oblak pojedinih orbitala prikazuje se graničnom površinom unutar koje elektron provede 99 % svog vremena.
· Elektronski oblaci s-orbitala su sferno simetrični, tj. imaju oblik kugle.
· Elektronski oblaci triju p-orbitala međusobno su okomiti i oblikom podsjećaju na bućice za vježbanje.
Pitanja i zadaci 5
- Dalton je pretpostavio da su svi atomi jednog elementa jednaki. Obrazložite svoje mišljenje o tome.
- Koji od navedenih izotopa ima isti broj neutrona
kao 133Cs? a) 128Xe, b) 136Ce, c) 134Ba,
d) 139La?
- Koliko elektrona ima ion 7834Se2−?
- Koji od navedenih uzoraka sadržava najmanji broj
atoma: a) 1 g H2, b) 1 g O2, c) 1 g S8, d) 1 g
Cl2?
- Prirodna smjesa klora sastoji se od 75,57 %
izotopa relativne atomske mase 34,97 i 24,43 % izotopa relativne atomske mase
36,96. Iz tih podataka izračunajte relativnu atomsku masu prirodne smjese
klora.
- Bor se u prirodi javlja kao smjesa izotopa 10B
i 11B. U prirodnoj smjesi izotopa ima 19,7 % atoma 10B, dok
ostatak čine atomi 11B. Njihove su relativne atomske mase: Ar(10B)
= 10,0129, Ar(11B) = 11,00931. Izračunajte iz tih
podataka prosječnu relativnu atomsku masu bora.
- Po čemu se razlikuju izotopi 39K i 40K?
- Stroncij se u periodnom sustavu nalazi između
kalcija i barija. Možete li na osnovi podataka iz periodnog sustava elemenata
pretpostaviti njegovu relativnu atomsku masu. Nađite još nekoliko sličnih
primjera.
- Relativna atomska masa joda
jest Ar(I) = 126,9045. Izračunajte masu jednog atoma joda (u ≈1,6605 · 10−27
kg). Jod se u prirodi javlja samo kao nuklid 127I.
- Masa je nekog atoma 6,64 · 10−27 kg. Kolika je relativna atomska masa tog atoma? Pomoću tablice relativnih atomskih masa odredite kojemu elementu pripada taj atom.
- Švedski kemičar J. J. Berzelius uzimao je za relativnu atomsku masu kisika vrijednost 100. Kolika je prema Berzeliusu bila relativna atomska masa vodika i ugljika?
- Relativna atomska masa kalija manja je od relativne atomske mase argona. Poredamo li elemente po rastućim relativnim atomskim masama, jasno je da kalij dolazi ispred argona. Obrazložite zašto je u periodnom sustavu elemenata zamijenjen redoslijed kalija i argona.
- U kakvom su međusobnom odnosu radijus atoma i radijus atomske jezgre.
- Na temelju kakvih mjerenja se određuje radijus atoma nekog metala?
- Napišite elektronske konfiguracije natrija, magnezija, aluminija, sumpora i argona. Poslužite se periodnim sustavom elemenata.
- Bez gledanja u periodni sustav elemenata napišite elektronsku konfiguraciju elementa rednog broja 20. Koliko elektrona ima taj element u zadnjoj ljusci i u koju ćete ga skupinu periodnog sustavu elemenata svrstati?
- Zašto atom helija ima manji radijus od atoma vodika?
- Masa je nekog atoma 6,64 · 10−27 kg. Kolika je relativna atomska masa tog atoma? Pomoću tablice relativnih atomskih masa odredite kojemu elementu pripada taj atom.
6. KEMIJSKA VEZA I STRUKTURA MOLEKULA
Prije otkrića elektrona i spoznaja o građi atoma nije bilo moguće razumjeti prirodu kemijske veze. Tek kada je 1916. američki kemičar Gilbert N. Lewis (1875. - 1946.) objavio danas već klasičan rad "The Atom and the Molecule" postala je njezina priroda nešto jasnija. U radu je iznio ideju o kovalentnoj vezi, vezi koja se sastoji od para elektrona koji dijele dvije atomske jezgre. Iste godine njemački kemičar Walther Kossel (1888. - 1956.) obrazlaže nastajanje ionske veze kao prijenos elektrona s atoma metala na atome nemetala. Pri tome nastaju kationi - ioni pozitivnoga naboja i anioni - ioni negativnoga naboja.
Njihova su se zaključivanja temeljila na svojstvima plemenitih plinova. Ako se plemeniti plinovi ne spajaju s drugim elementima, možda upravo elektronske konfiguracije njihovih atoma određuju njihova svojstva. Zato pretpostavljaju da atomi pri spajanju nastoje ostvariti stabilne elektronske konfiguracije atoma plemenitih plinova. Atom helija ima dva, a atomi svih ostalih plemenitih plinova imaju osam elektrona u vanjskoj ljusci. S obzirom na inertnost plemenitih plinova može se zaključiti da su to najstabilnije elektronske konfiguracije. Atomi pri spajanju nastoje ostvariti elektronsku konfiguraciju najbližeg plemenitog plina, a to znači imati oktet elektrona u vanjskoj ljusci. Iznimka su samo vodik, litij i berilij kojima je najbliža elektronska konfiguracija atoma helija s dva elektrona. Teorija razvijena na osnovi tog modela poznata je kao Lewisova teorija kemijske veze. Uskoro je razvijeno je više matematičkih modela koji objašnjavaju prirodu kemijske veze, ali svi sadržavaju osnovne pretpostavke Lewisove teorije. Prema suvremenim predodžbama, kemijska veza je interakcija električne prirode. Iako se povezivanje atoma može ostvariti na više načina, razlikuju se tri osnovna tipa kemijske veze: ionska, kovalentna i metalna.
6.1. Ionska veza
Unese li se užareni metalni natrij u posudu s plinovitim klorom dolazi do burne kemijske reakcije pri kojoj nastaje kruti bijeli prah natrijeva klorida, NaCl. Slično reagiraju svi alkalijski metali sa svim halogenim elementima. Pri tome nastaju halogenidi alkalijskih metala.

Slika 6.1. Rastaljeni natrij u rupičastoj epruveti i plinoviti klor međusobno burno reagiraju uz pojavu svjetlosti i topline. Pri tome nastaje bijeli sitnokristalasti prah natrijeva klorida ili kuhinjske soli.
POKUS 6.1. Gorenje natrija u kloru
Vidi na Internetu: www.youtube.com/watch?v=ZjyRhH7PW24
Nastajanje halogenida alkalijskih metala iz elemenata najjednostavnije
možemo objasniti Lewisovom teorijom kemijske veze. Iz tablice
periodnog sustava elemenata (slika 6.3.) možemo iščitati da svi alkalijski
metali imaju jedan elektron više od konfiguracije prethodnog plemenitog plina.
Svi halogeni elementi imaju pak jedan elektron manje od konfiguracije sljedećeg
plemenitog plina. Lako je iz toga zaključiti da će pri nastajanju kemijskih
veza između alkalijskih metala i halogena, atom alkalijskog metala izgubiti
jedan elektron i tako ostvariti stabilnu elektronsku konfiguraciju prethodnog
plemenitog plina. Istodobno će atom halogenog elementa primiti taj elektron te
tako ostvariti stabilnu elektronsku konfiguraciju sljedećeg plemenitog plina. Zbog
gubitka jednog elektrona atom alkalijskog metala postat će pozitivno nabijeni
ion, kationi, M+. Atom halogenog elemenata postat će negativno
nabijeni ion, anion, A–.
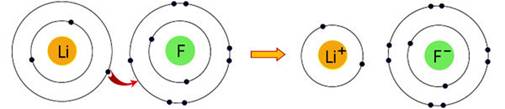
Slika 6.2. Shematski prikaz skoka elektrona s atoma litija na atom fluora prikazan Bohrovim modelima atoma. Pri tome nastaju ioni Li+ i F– s elektronskim konfiguracijama plemenitih plinova helija i neona.
6.2. Valencija u spojevima s ionskom vezom
Atomi elemenata 1. skupine periodnog sustava mogu u kemijskim spojevima predati samo jedan elektron atomima elemenata 17. skupine. Zbog toga će u ionskim spojevima na jedan pozitivni ion elemenata 1. skupine dolaziti po jedan negativni ion elemenata iz 17. skupine. Kaže se da su u ionskim spojevima elementi 1. i 17. skupine jednovalentni. Kemijske formule tih spojeva bit će, prema tome: .
| LiF | LiCl | LiBr | LiI |
| NaF | NaCl | NaBr | NaI |
| KF | KCl | KBr | KI |
Pod valencijom (lat. valere - vrijediti) u slučaju ionske veze razumije se broj elektrona koje neki atom može predati ili primiti pri čemu se pretvara u ion. Jednadžba kemijske reakcije može se prikazati Lewisovim simbolima, kao primjerice pri nastajanju natrijeva klorida, NaCl:
![]()
Lewisov simbol sadržava uobičajeni znak elementa okružen točkama koje pokazuju broj vanjskih ili valentnih elektrona. Natrij ima 11 elektrona, no kako elektroni prve i druge ljuske, njih 10, ne sudjeluje u nastajanju kemijskih veza, jedna točka uz simbol natrija označava jedan valentni elektron. Slično, sedam točaka uz simbol klora označava elektrone treće ljuske (vidi sliku 6.3).
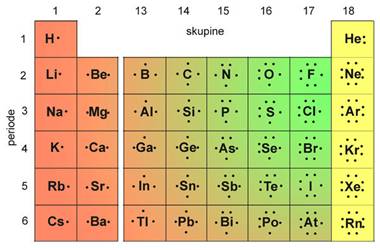
Slika 6.3. Lewisovi simboli najvažnijih elemenata. Elementi iste skupine imaju jednak broj elektrona u valentnoj ili posljednjoj ljusci pa su im Lewisovi simboli jednaki.
Elementi 16. skupine periodnog sustava, kisik i sumpor, su dvovalentni. Dvovalentni su zato što moraju primiti dva elektrona da bi postigli postojanu elektronsku konfiguraciju, onu od osam elektrona u posljednjoj ljusci. Zato će oni s atomima metala činiti spojeve sastava:
| Na2O | MgO | Al2O3 |
| Na2S | MgS | Al2S3 |
Iz navedenih primjera
može se zaključiti: Ionska kemijska veza nastaje kad se elementi lijeve
strane periodnog sustava — metali spajaju s elementima desne strane periodnog
sustava — nemetalima.
6.3. Ionski kristali
Tvari ionske građe uvijek su pri sobnoj temperaturi kristalizirane. Između iona suprotnog naboja djeluje jaka elektrostatska sila koja ih drži u kristalu. Zbog toga tvari ionske građe imaju visoka tališta. Primjerice, talište natrijeva klorida, NaCl, je pri 801 °C, magnezijeva oksida, MgO, pri 2.852 °C, a aluminijeva oksida, Al2O3, pri 2.072 °C.
U kristalima ionske građe ioni se međusobno razmještaju tako da elektrostatske privlačne sile između iona suprotnog naboja budu veće od odbojnih sila između iona istoga naboja. Tako se ostvaruje njihova ravnoteža. U natrijevu kloridu je, primjerice, svaki natrijev ion okružen sa šest iona klora, a svaki klorov ion sa šest iona natrija (vidi slike 6.4b i 6.4c).
Jakost privlačne sile između iona suprotnog naboja ovisi o veličini i razmaku između iona. Što je naboj iona veći, a razmak među ionima suprotnog naboja manji, privlačne će sile biti jače. To objašnjava relativno visoka tališta tvari s ionskom strukturom. U tablici 6.1. navedena su tališta nekoliko spojeva sa strukturom natrijeva klorida.
Tablica 6.1. Tališta nekih tvari s kristalnom strukturom NaCl
|
Tvar |
Talište (t/ °C) |
Tvar |
Talište (t/ °C) |
Tvar |
Talište (t/ °C) |
|
NaF |
997 |
NaCl |
801 |
MgO |
2 640 |
|
KF |
857 |
KCl |
768 |
CaO |
2 580 |
|
RbF |
760 |
RbCl |
715 |
SrO |
2 430 |
Usporede li se tališta fluorida i klorida elemenata 1. skupine periodnog sustava vidi se da su tališta fluorida uvijek viša od tališta odgovarajućih klorida. To je razumljivo jer je ion F− manji od iona Cl−. Fluorov ion može uvijek doći bliže kationu nego što to može klorov ion. Privlačne sile između iona jediničnog naboja jače su što je razmak između iona manji. Coulombov zakon, F = k ⋅ q1 ⋅ q2 / r2, kaže da električna sila opada s kvadratom udaljenosti među nabojima. Zato su tališta fluorida viša od tališta klorida istih metala.
Ioni magnezija, kalcija i stroncija imaju dva pozitivna jedinična naboja. Ioni kisika imaju dva negativna jedinična naboja. Zbog većeg naboja privlačne sile među ionima mnogo su jače. Zato su tališta magnezijeva oksida, kalcijeva oksida i stroncijeva oksida mnogo viša u odnosu na tališta halogenida alkalijskih metala.
Usporede li se tališta fluorida i oksida po uspravnim stupcima u tablici 6.1., vidi se da tališta padaju idući od lakših prema težim elementima iste skupine periodnog sustava. To je također razumljivo jer radijusi kationa rastu od natrija prema rubidiju, odnosno od magnezija prema stronciju.
O kristalnoj strukturi natrijeva klorida zaključivalo se još u 19. stoljeću. Kemijskom analizom utvrđeno je da se natrij i klor spajaju tako da u natrijevu kloridu na svaki ion natrija dolazi jedan ion klora. Kristali su kubni, pa stoga unutarnja građa kristala mora odražavati simetriju kocke. Logično je da se u kristalima ionske građe svaki kation nastoji okružiti najvećim mogućim brojem aniona, i obratno. Takvim razmišljanjem došlo se do toga da struktura natrijeva klorida mora biti kao na slici 6.4b. Da je kristalna struktura natrijeva klorida točno predviđena potvrdio je 1913. godine William Lawrence Bragg (1890. - 1971.) difrakcijom rendgenskih zraka na kristaliću natrijeva klorida.

Slika 6.4. Kristalna struktura natrijeva klorida. a) Kristali natrijeva klorida imaju formu kocke. b) Međusobni razmještaj iona natrija i iona klora u kristalu natrijeva klorida može se opisati kockom koja sadržava ione klora na uglovima i u središtima ploha. Ioni natrija nalaze se na polovinama bridova i u središtu kocke. Isti se međusobni razmještaj iona natrija i klora dobije ako se na uglove i središta ploha kocke postave ioni natrija, a ioni klora na polovine bridova i u središte kocke. c) Ioni natrija i klora u kristalnoj se strukturi dotiču. Jedinična ćelija kristalne strukture natrijeva klorida sadržava 4 formulske jedinke NaCl. Natrijevi ioni (1 + 12 × ¼ = 4). Kloridni ioni (8 × ⅛ + 6 × ½ = 4).
Na osnovi građe kristala natrijeva klorida mogu se objasniti opća svojstva tvari s ionskom vezom. Karakteristično svojstvo mnogih takvih tvari jest kalavost smjerom kristalnih ploha. Kad se mehaničkom silom deformira ionski kristal pomiču se čitavi slojevi u kristalu. Pritom se istoimeni naboji nađu jedan nasuprot drugome pa kristal puca smjerom onih ravnina između kojih vladaju najslabije privlačne sile.
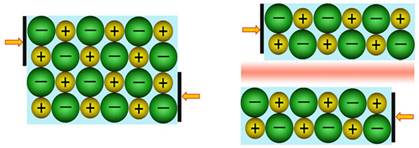
Slika 6.5. Utjecaj mehaničke sile na kristal ionske građe. Pri međusobnom pomaku slojeva unutar kristala ioni istoimenog naboja nađu se jedan nasuprot drugome. Ioni istoimenog naboja međusobno se odbijaju i zato kristal puca smjerom ravnih ploha unutar kojih su privlačne sile najslabije.
Kruti natrijev klorid,
ako je suh, ne provodi električnu struju. No, njegova talina provodi struju. To
je lako objasniti. Struju mogu prenositi ioni ili elektroni. U kristalu
natrijeva klorida ioni natrija i klora ne mogu napustiti svoja mjesta zadana
kristalnom strukturom pa ne mogu sudjelovati u prenošenju naboja. Elektroni su
pak vezani u stabilne elektronske konfiguracije od 8 elektrona pa ni oni ne
mogu prenositi naboje. Zato je kruti natrijev klorid izolator. Taljenjem
natrijeva klorida ruši se uređena kristalna struktura. U talini natrijeva
klorida ioni Na+ i Cl− mogu se gibati kao svaka
druga čestica u tekućini. Pod utjecajem električnog polja ioni Na+
putuju prema negativnoj elektrodi, a ioni Cl− prema pozitivnoj
elektrodi. Zato talina natrijeva klorida provodi električnu struju.
6.4. lonski radijusi
Difrakcijom rendgenskih zraka W. L. Bragg je izmjerio da duljina brida jedinične ćelije kristalne strukture natrijeva klorida iznosi 560 pm (vidi sliku 6.6a). Lako je mogao zaključiti da je razmak između centara kationa i aniona u kristalnoj strukturi jednak zbroju ionskih radijusa kationa i aniona. No, Bragg nije mogao od kuglica načiniti točan model kristalne strukture natrijeva klorida jer nije znao koliki je radijus iona natrija, a koliki iona klora. Radijus kationa uvijek je manji od radijusa atoma, jer pozitivna jezgra jače privlači manji broj elektrona. Naprotiv, radijus aniona veći je od radijusa atoma. To je zato što se veći broj elektrona u elektronskom omotaču aniona jače odbija. Vrijedi jednostavno pravilo: Što je naboj kationa veći, njegov radijus je manji. Naprotiv, što je naboj aniona veći, veći je i njegov radijus.
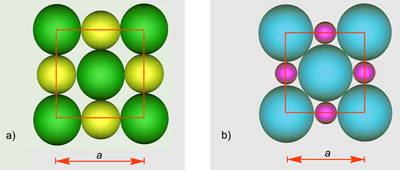
Slika 6.6. a) U kristalnoj strukturi natrijeva klorida
kationi i anioni se dotiču. Razmak između kationa i aniona jednak je zbroju
radijusa kationa i aniona. b) U litijevu jodidu anioni su tako veliki da se
dotiču. Kationi se nalaze u prazninama koje stvaraju veliki anioni i ne utječu
na dimenzije jedinične ćelije kristalne strukture litijeva jodida. Radijus
aniona jednak je 1/4 plošne dijagonale kocke.
Na osnovi takvih
razmatranja Alfred
Landé (1888. – 1976.) je 1920. godine pretpostavio da se u nekim
kristalnim strukturama veliki anioni moraju doticati. Tada mali kationi ulaze u
praznine što ih čine veliki anioni (vidi sliku 6.6b.). Dimenzije jediničnih
ćelija u takvim spojevima neće ovisiti o veličini kationa, nego samo o veličini
aniona. Landé je pretpostavio da je
taj uvjet ispunjen za litijeve halogenide, što je kasnije potvrđeno. Tako je za
litijev jodid izmjeren brid jedinične ćelije, a = 600,0 pm. (Physikalische
Zeitschrift (1923) 24, 209-213). Ako se anioni I−
dodiruju u smjeru plošne dijagonale kocke, njihov je radijus: a ×
![]() : 4 = 600 pm ×
: 4 = 600 pm × ![]() : 4 = 212 pm.
: 4 = 212 pm.
Victor M. Goldschmidt (1888. – 1947.) je sa suradnicima odredio 1926. u Oslu kristalnu strukturu velikom broju jednostavnih spojeva te je iz tih mjerenja sastavio prvu tablicu ionskih radijusa koju, s manjim popravcima, i danas rabimo (vidi sliku 6.7.).
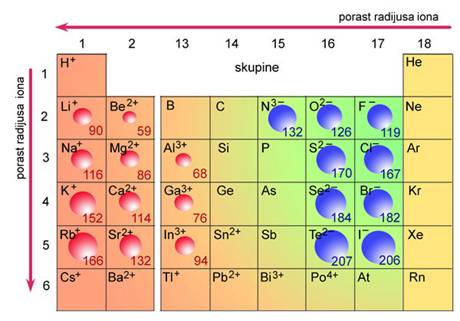
Slika 6.7. Ionski radijusi izraženi u pm. Unutar periodnog sustava elemenata
radijusi iona povećavaju se od desna ulijevo i odozgo prema dolje. Radijusi kationa
uvijek su manji, a aniona uvijek veći od radijusa pripadnog atoma. Navedene
vrijednosti radijusa jesu srednje vrijednosti rezultata više mjerenja na mnogim
spojevima. Kristalne strukture ionskih spojeva nisu slagaline tvrdih kuglica.
Veličina iona ovisi i o njegovu okruženju (koordinaciji). Zato se podaci iz
različitih izvora razlikuju.
6.5. Energija ionizacije
Kao što smo već kazali, pri nastajanju ionskih veza atomi metala otpuštaju elektrone koje istodobno primaju atomi nemetala. No, atomi metala ne će samo tako otpustiti elektrone i prijeći u katione. Za taj proces treba utrošiti energiju. Energija koja se pritom utroši naziva se energijom ionizacije.
Prva energija ionizacije jest najmanja energija potrebna za izbacivanje najslabije vezanog elektrona (valentnog elektrona) iz neutralnog atoma u plinovitu stanju. Prvu energiju ionizacije predočujemo jednadžbom:
M(g) → M+(g) + e− DHion = + ........ kJ mol−1
gdje je M(g) neutralan atom u plinovitu stanju, M+(g) pozitivni ion koji nastaje tom reakcijom. Primjerice, za reakciju ionizacije natrija imamo:
Na(g) → Na+(g) + e− ΔHion = + 496 kJ mol−1 .
Opaska: ΔHion = + 496 kJ mol−1 označava entalpiju kemijske reakcije, a to je toplina (energija) koja se utroši za ionizaciju jednog mola atoma natrija u plinovitu stanju. Mol (znak: mol) atoma natrija označava 6,022 × 1023 atoma, što je isto što i 22,30 g natrija. Znak Δ označava promjenu. H označava toplinu, što dolazi od engl. heat. Predznak "+" kazuje da je reakcija endotermna, tj.da je za tu fizičku promjenu trebalo utrošiti energiju. To znači da energija (toplina) prelazi iz okoline u reakcijski (promatrani) sustav. Obratno, pri egzotermnim promjenama energija (toplina) se oslobađa, pa prelazi iz reakcijskog (promatranog) sustava u okolinu. Tada entalpija kemijske reakcije ima negativan predznak jer je to gubitak topline za promatrani sustav: Na+(g) + e− → Na(g) ΔH = – 496 kJ mol−1.
Druga energija ionizacije je energija potrebna za proces:
M+(g) → M2+(g) + e−
Na jednak su način definirane treća i dalje energije ionizacije. Njihove su vrijednosti dobro poznate za većinu elemenata. Tablica 6.2. pokazuje kako se mijenjaju energije ionizacije kod elemenata treće periode, od natrija do argona. Kao jedinica za energiju u tablici je upotrijebljen elektronvolt, eV, vrlo mala jedinica. Jedan elektronvolt jest promjena energije elektrona kad prođe razliku električnog potencijala od 1V (1 eV = 1,602 · 10−19 J).
Tablica 6.2. Energija ionizacije elemenata treće periode (E/eV)
Na Mg Al Si P S Cl Ar
Ei(1 ) 5,1 7,6 6,0 8,2 10,5 10,4 13,0 15,8
Ei(2) 47,3 15,0 18,8 16,3 19,7 23,3 23,8 27,6
Ei(3) 80,1 28,5 33,5 30,2 34,8 39,6 40,7
Ei(4) 120,0 45,1 51,4 47,3 53,5 59,8
Ei(5) 166,8 65,0 72,7 67,8 75,0
Ei(6) 220,4 88,0 97,0 91,0
Ei(7) 280,9 114,2 124,3
Tablica jasno pokazuje da prva energija ionizacije raste unutar periode od lijeva nadesno. To se objašnjava time što pozitivni naboj jezgre raste unutar periode, a njime se smanjuje radijus atoma. Zbog toga pozitivni naboj jezgre djeluje sve većom silom na elektrone, pa je prirodno da i energija ionizacije raste.
Druga energija ionizacije obično je veća od prve, jer je teže otrgnuti elektron od pozitivnog iona M+(g) nego od neutralnog atoma. Kod natrija, koji ima jedan elektron u valentnoj ljusci, druga energija ionizacije gotovo je deset puta veća od prve. To upućuje na neobično stabilnu elektronsku konfiguraciju plemenitog plina neona. Opaža se da je treća energija ionizacije magnezija nerazmjerno veća od prve i druge energije ionizacije. To ponovno upućuje na stabilnu elektronsku konfiguraciju iona Mg2+(g). Slično se opaža i kod atoma ostalih elemenata iste periode.
Slika 6.8. Prva energija ionizacije raste
unutar periode od lijeva nadesno. Unutar pojedine skupine u periodnom sustavu
energija ionizacije elemenata smanjuje se s porastom rednog broja.To je zato
što unutar skupine raste radijus atoma povećavanjem rednog broja elementa, čime
se povećava prosječna udaljenost elektrona od jezgre. Što je veća udaljenost
elektrona od jezgre, to je potrebna manja energija da se elektron otrgne od
neutralnog atoma.
Vidi na Internetu: chemed.chem.purdue.edu
6.6. Afinitet prema elektronu
Atomi mogu dobiti ili
izgubiti elektrone. Primjerice, kad neutralan atom nemetala u plinovitu
stanju prihvati (dobije) elektron, energija se oslobađa. Afinitet prema elektronu definira se kao energija koja se oslobađa kada se
elektron doda neutralnom atomu u plinovitu stanju.
X(g) + e−
→ X−(g)
Produkti takvih reakcija na nižem su energijskom nivou. Zato reakcijska
entalpija ima negativan predznak. Došlo je do gubitka energije u odnosu na
polazno energijsko stanje reaktanata.
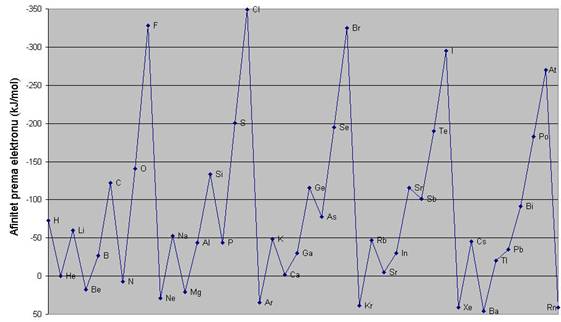
Slika 6.9. Afinitet prema elektronu (kJ/mol) elemenata glavnih skupina periodnog sustava.
Unutar periodnog sustava elemenata afinitet prema elektronu raste odozdo prema
gore i od lijeva na desno.
Slika izvor: www.kentchemistry.com
Kao što se vidi iz podataka na slici 6.9. afinitet prema elektronu unutar periodnog sustava mijenja se jednakim smjerom kao i energija ionizacije (vidi sliku 6.8.). Unutar periode afinitet prema elektronu raste s porastom atomskog broja. Atomi nemetala imaju najveći afinitet prema elektronu jer primanjem elektrona mogu postići elektronsku konfiguraciju plemenitog plina. Unutar skupine afinitet prema elektronu smanjuje se odozgo prema dolje. To se može objasniti povećanjem radijusa atoma. Kad se elektron doda većem atomu oslobađa se manje energije jer se dodani elektron "nalazi" na većoj udaljenosti od jezgre.
Iz slike 6.9. može se lako uočiti da fluor ima manji afinitet prema elektronu od klora, a kisik manji od sumpora. To se objašnjava jačim odbijanjem elektrona. Radijusi atoma fluora i kisika mnogo su manji od radijusa atoma klora i sumpora (vidi sliku 5.10.). Kada se elektron doda manjem elektronskom oblaku, odbijanje između elektrona je jače nego kada se elektron doda elektronskom oblaku većega radijusa. Zato je afinitet prema elektronu kod fluora i kisika manji od afiniteta kod klora i sumpora.
Atomi plemenitih plinova imaju popunjenu valentnu ljusku. Za nastajanje negativno nabijenih iona plemenitih plinova potrebno je uložiti energiju. Zato reakcijska entalpija ima pozitivan predznak (vidi sliku 6.9.). No, anioni atoma plemenitih plinova su nestabilni te se raspadaju.
6.7. Born-Haberov ciklus
Na početku ovog poglavlja već smo kazali da natrij gori u kloru uz pojavu svjetlosti i topline. To znači da su produkti kemijske reakcije na energijski nižem nivou nego reaktanti. No, postavlja se pitanje je li nastajanje stabilne elektronske konfiguracije dovoljna pokretačka sila za nastajanje ionske veze. Energija ionizacije natrija je 5.1 eV, a klorov afinitet prema elektronu iznosi samo 3.6 eV. Ti nam podaci govore da bi za nastajanje elektronskih konfiguracija plemenitih plinova neona i argona trebalo još i utrošiti energiju, a to je suprotno opažanju.
Što se sve zbiva pri nastajanju ionske veze objasnili su njemački fizičar i matematičar Max Born (1882. - 1970.) i njemački kemičar Fritz Haber (1868. - 1934.). Uzmimo za primjer nastajanje kristala natrijeva klorida iz krutog natrija reakcijom s plinovitim klorom:
Na(s) + ½Cl2(g) → NaCl(s).
M. Born i F. Haber su našli da se reakcija može opisati u 5 stupnjeva. Neke su od tih promjena egzotermne, a neke endotermne:
1. isparavanje natrija Na(s)
→ Na(g) ΔHvap = + 107,3 kJ mol−1
2. disocijacija klora ½Cl2(g) → Cl(g) ΔHdiss= + 122 kJ mol−1
3. ionizacija natrija Na(g) → Na+(g) + e− ΔHion = + 495,8 kJ mol−1
4. ionizacija klora Cl(g) + e− → Cl− ΔHion = − 348,6 kJ mol−1
5. nastajanje kristala Na+(g) + Cl−(g) →
NaCl(s) ΔHcrys = − 787 kJ mol−1
----------------------------------------------------------------------------------
Ukupno: Na(s) + ½Cl2(g) → NaCl(s) ΔHrxn
= − 411 kJ mol−1
U nizu reakcija od 1 do 5 veličina ΔH jest entalpija kemijske reakcije, odnosno toplina koja se tijekom kemijske promjene oslobodi (ΔH <0) ili veže (ΔH>0).
Ako tijekom kemijske reakcije toplina prelazi iz okoline u promatrani reakcijski sustav (endotermna promjena) pripadna entalpija kemijske reakcije ima pozitivan predznak, jer je to dobitak za reakcijski sustav.
Ako se tijekom kemijske reakcije toplina oslobađa (toplina prelazi iz reakcijskog sustava u okolinu - egzotermna promjena) pripadna entalpija ima negativan predznak, jer je to gubitak za reakcijski sustav.
Iz podataka u tablici vidi se da se najviše topline oslobodi u petom stupnju, tj. pri nastajanju kristala natrijeva klorida. Ukupna reakcijska entalpija nastajanja NaCl(s) ima negativan predznak. Reakcija je egzotermna.
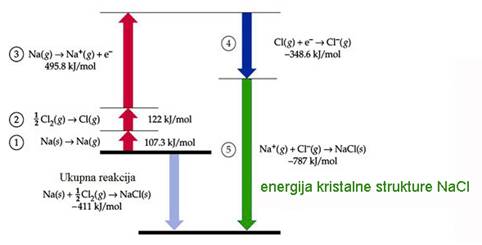
Slika 6.10. Born-Haberov ciklus za natrijev klorid.
Izvor: slideplayer.com
Općenito valja upamtiti da ionski spojevi neće nastati ako su produkti kemijske reakcije na višoj energijskoj razini u odnosu na reaktante. Ionska veza nastaje ako je kemijska reakcija nastajanja ionske strukture (kristala) egzotermna, tj. ako su produkti reakcije na energijski nižoj razini od reaktanata. Kad među atomima elemenata nastaju kovalentne veze, onda se mogu dobiti produkti koji su na energijski višoj razini od reaktanata.
POKUS 6.2. Toplina neutralizacije
Vidi na Internetu: www.youtube.com/watch?v=XPnsPcJzCX0
POKUS 6.3. Endotermna promjena
Vidi na Internetu: www.youtube.com/watch?v=zGWN1XEOwu8
6.8. Kovalentna veza
Prema Lewisovoj teoriji kemijske veze, da bi poprimili elektronsku konfiguraciju plemenitih plinova, atomi nemetala međusobno se spajaju u molekule tako da čine zajedničke elektronske parove. Takvu vrstu kemijske veze nazivamo kovalentnom vezom. Kovalentna veza može biti jednostruka, dvostruka ili trostruka.
Najjednostavnija od svih je molekula vodika. Atom vodika ima samo jedan elektron. Dva atoma vodika mogu postići postojanu elektronsku konfiguraciju atoma plemenitog plina helija tako da načine zajednički elektronski par. Kaže se da u molekuli dva atoma vodika dijele zajednički elektronski par. Zato se taj elektronski par zove i podijeljeni elektronski par. Zajednički elektronski par istodobno pripada objema jezgrama te ih povezuje.
Lewisovim simbolima to se prikazuje ovako:
H· + . H → H : H ΔHform = − 436 kJ mol−1
Pri nastajanju jednog mola molekula vodika (6,02 × 1023 molekula H2)
iz dva mola atoma vodika
(2 × 6,02 × 1023
atoma H) oslobodi se 436 kJ toplinske energije. Stoga je molarna entalpija
nastajanja molekula vodika ΔHform(H2(g))=−436 kJ mol−1. Reakcijska entalpija ima
negativan predznak zato što je oslobađanje topline gubitak za reakcijski
sustav. Obratno, za kidanje jednog mola veza H:H potrebno je utrošiti
energiju od 436 kJ mol−1
pa je energija disocijacije molekula vodika ΔHdiss(H2(g))
= + 436 kJ mol−1. Energija koja je
potrebna da se kemijska veza raskine, tj.da se atomi razmaknu na udaljenost na
kojoj više ne djeluju sile među njima, naziva se energija veze.
Upamtite: Pri kidanju veze energija se uvijek troši. Pri nastajanju veze energija se uvijek oslobađa.
Opaska: Pogrešno je entalpiju nastajanja nazivati entalpijom stvaranja što dolazi od engl. formation = stvaranje, oblikovanje, tvorba. U hrvatskom jeziku riječ stvaranje vezuje se uz pojam Stvoritelja koji stvara iz ničega. U kemijskim reakcijama iz tvari A i B, koje su davno stvorene, nastaju nove tvari. Zato je naziv entalpija nastajanja bliže duhu hrvatskoga jezika.
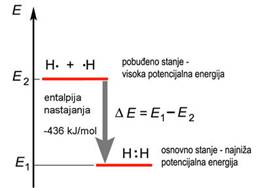
Slika 6.11. Zasebni atomi vodika su u energijski pobuđenom stanju koje je nestabilno. Zato se atomi vodika spajaju u stabilnije molekule H2 uz oslobađanje topline. Spontano se uvijek događaju one promjene i procesi koji dovode do smanjenja potencijalne energije. Knjiga će uvijek sa stola pasti na pod, ali se još nije dogodilo da je knjiga sama od sebe s poda skočila na stol. Da biste knjigu vratili na stol, na viši energijski nivo, morate utrošiti energiju.
U molekuli H2 elektronski se oblaci atoma vodika prekrivaju pa nastaje zajednički elektronski oblak za obje jezgre. Svaka pozitivna jezgra djeluje na oba elektrona pa se oni stoga najčešće zadržavaju u prostoru između jezgara. Negativni naboj elektronskog oblaka između jezgara zasjenjuje jezgre jednu od druge. Zato je odbijanje među pozitivnim jezgrama slabije od njihova privlačenja prema zajedničkom elektronskom oblaku. Ravnoteža između odbojne i privlačne sile održava protone u molekuli vodika na međusobnoj udaljenosti od 74 pm.

Slika 6.12. Shematski prikaz nastajanja molekule vodika
prekrivanjem elektronskih oblaka 1s
orbitala. Najveća gustoća elektronskog oblaka je neposredno uz jezgre i u
prostoru između jezgara.
Valja upamtiti da protoni u molekuli vodika ne miruju, već da titraju oko ravnotežnog položaja, tj. međusobne udaljenosti 74 pm. Ako se razmak među njima smanji, naglo rastu odbojne sile. Malo povećanje razmaka dovodi do slabljenja odbojnih i prevage privlačnih sila. Privlačne i odbojne sile u ravnoteži su kad se jezgre nalaze na udaljenosti 74 pm. Takvo stanje odgovara minimumu potencijalne energije sustava sastavljena od dva protona i dva elektrona.
Opaska: Zbog titranja jezgara, ili – točnije rečeno –
zbog kvantne naravi sustava, udaljenost jezgara ne može se razumjeti na isti način
kao udaljenost točaka na papiru. Udaljenost jezgara se definira statistički;
postoji najmanje osam „udaljenosti“ jezgara, a svaka se mjeri drugom
eksperimentalnom metodom.
6.9. Pravilo okteta - jednostruka kovalentna veza
Lewisova teorija kovalentne veze objašnjava i strukturu drugih molekula. Primjerice, atomi halogenih elemenata u posljednjoj ljusci imaju 7 elektrona. Svaki atom ima jedan nespareni elektron. Zato se atomi halogenih elemenata mogu međusobno povezati tako da načine zajednički elektronski par.
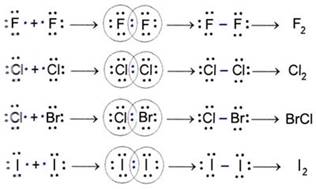
Atomi halogenih elemenata u molekulama elemenata, kao i interhalogenih spojeva, međusobno su povezani jednostrukom kovalentnom vezom, jednim zajedničkim elektronskim parom. Zajednički elektronski par pripada objema jezgrama. Prema tome, u molekulama halogenih elemenata svaka je jezgra okružena s četiri elektronska para. Tako svaki atom u molekuli posjeduje oktet elektrona, tj. ima postojanu elektronsku konfiguraciju atoma plemenitog plina. Oni elektronski parovi koji ne sudjeluju u vezi (nisu podijeljeni između dvaju atoma) zovu se nepodijeljeni elektronski parovi.
Doznajte više na:
doi.org
6.10. Kovalentni i van der Waalsov radijus
Polovina razmaka između jezgara dvaju jednakih atoma međusobno vezanih kovalentnom vezom naziva se kovalentni radijus. Primjerice, kovalentni radijus vodika je 37 pm, a to je polovina razmaka između jezgara atoma vodika u molekuli H2. Razmak između jezgara atoma joda u molekuli I2 iznosi 272 pm pa je kovalentni radijus joda 136 pm (vidi sliku 6.13.). Atomi ugljika u dijamantu vezani su jednostrukim vezama. Razmak između njihovih jezgara iznosi 154 pm, pa je kovalentni radijus za jednostruku C-C vezu 77 pm. No, ugljikovi atomi mogu se vezati dvostrukim i trostrukim vezama. Duljina dvostruke C=C veze iznosi 134 pm, a trostruke C≡C veze 120 pm. Stoga su kovalentni radijusa ugljika 67 pm za dvostruku i 60 pm za trostruku kovalentnu vezu.
U tekućini ili kristalu molekule zauzimaju najmanji mogući volumen, jer se dodiruju. Polovina razmaka između središta dvaju istovrsnih atoma susjednih molekula koje se dodiruju zove se van der Waalsov radijus. On nam govori o veličini atoma, zamišljenoga kao kuglica koja se dodiruje s drugim atomom, također kuglicom. Primjerice, u kristalnoj strukturi joda dva atoma iz susjednih molekula I2, koji se dodiruju, nalaze se na međusobnoj udaljenosti 430 pm. Stoga je van der Waalsov radijus atoma joda 430 pm/2 = 215 pm.
Među molekulama u kristalima joda djeluju slabe tzv. van der Waalsove sile. Zbog toga kristali joda lako sublimiraju. Kada se na kristal joda djeluje mehaničkom silom, dolazi do klizanje čitavih slojeva molekula i to na mjestima gdje između njih djeluju slabije privlačne sile. Pri tome se ne kidaju čvrste kovalentne veze koje postoje unutar molekula. Stoga tvari kojima su kristali izgrađeni od molekula imaju nisko talište i malu tvrdoću.
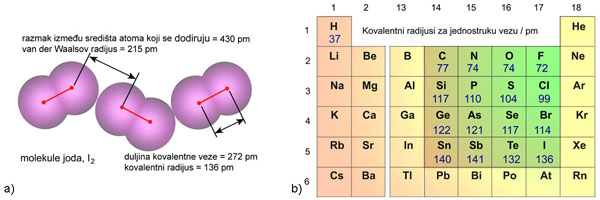
Slika 6.13. a) Kristali joda izgrađeni su od molekula I2
koje se međusobno dodiruju. b) Kovalentni radijusi za jednostruku vezu izraženi
u pm
6.11. Višestruke kovalentne veze
Postojana elektronska konfiguracija može se ostvariti i tako da atomi dijele dva elektronska para. U tom se slučaju kaže da su povezani dvostrukom kovalentnom vezom.
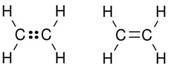
Tri zajednička elektronska para čine trostruku kovalentnu vezu, kao na primjer u molekuli dušika.
![]()
Trostruka veza u molekuli dušika neobično je stabilna. Energija kidanja trostruke veze molekula N2 iznosi čak 946 kJ/mol. Zbog velike energije kidanja trostruke veze dušik se teško spaja s drugim elementima, primjerice kisikom, pa se u čistom zraku nalazi samo kao elementarna tvar.
Pri pisanju strukturnih formula molekula i iona zajednički elektronski parovi najčešće se prikazuju valentnim crticama. Jedna valentna crtica između dva povezana atoma znači jedan zajednički elektronski par. Dvije valentne crtice predstavljaju dva, a tri crtice tri zajednička elektronska para.
Lewisovim simbolima mogu se prikazati i strukture višeatomnih molekula primjenjujući istu ideju o postojanoj elektronskoj konfiguraciji plemenitih plinova. To se vidi na sljedećim primjerima:
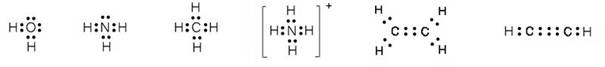
Ponekad je moguće napisati više Lewisovih strukturnih formula za istu molekulu ili ion. Primjerice, struktura nitratnog iona može se prikazati trima formulama:
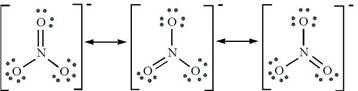
Te se formule razlikuju samo po položaju dvostruke veze. Mjerenja su pokazala da su dvostruke veze uvijek kraće od jednostrukih. No, u nitratnom ionu sva su tri atoma kisika jednako udaljena od atoma dušika. To znači da ni jedna formula ne opisuje pravu prirodu veze u nitratnom ionu. Stoga se za prikazivanje strukture nitratnog iona rabe sve tri formule, no između njih se stavlja dvostrana strelica. Za strukturu nitratnog iona kaže se da je rezonantni hibrid sve tri strukture. Dvostrana strelica rabi se kao znak za rezonanciju između struktura prikazanih s dvije ili više strukturnih formula.
Opaska: Rezonantna struktura znači da ona u prirodi ne postoji, nego je samo oznaka za „nešto između“. To je isto kao da kažemo za mazgu da je konj↔magarac.
Na jednak način može se objasniti i struktura karbonatnog iona. Moguće je napisati tri strukture koje su međusobno u rezonanciji.
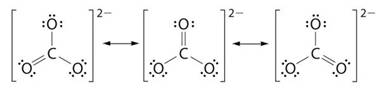
Da bismo dočarali rezonantnu strukturu nitratnog i karbonatnog iona, te sličnih iona i molekula, uobičajeno je dvostruku vezu raspodijeliti na sve atome što se prikazuje crtkanim linijama. Nitratni i karbonatni ioni su izoelektronski i planarne građe.
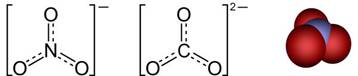
Slika 6.14. a) Prikaz rezonantne strukture nitratnog i karbonatnog iona. b) Kalotni model nitratnog ili karbonatnog iona.
Često se kao primjer dvostruke kovalentne veze uzima molekula kisika. Veza u molekuli kisika u tom se slučaju prikazuje ovako:
![]()
No, ta formula ne objašnjava magnetska svojstva kisika iz kojih proizlazi da molekula kisika ima dva nesparena elektrona. Zato bi bolje bilo Lewisovu strukturnu formulu kisika pisati ovako:
![]()
Dvostruka veza između istih
atoma uvijek je kraća od jednostruke veze. Istraživanja molekulske strukture
kisika ukazala su na postojanje dvostruke veze. Slijedi da ni ta formula nije
točna, ni ona ne pokazuje dobro strukturu molekule O2. Molekula
kisika nije jedina molekula kojoj se građa ne može opisati Lewisovim formulama.
Priroda kemijske veze u molekuli kisika nešto je složenija. No, ni pravilo
okteta nije neko "sveto pravilo" jer valentna ljuska fosfora,
sumpora, klora, broma i joda može sadržavati pet ili šest elektronskih parova -
no, to već prelazi okvire ovog udžbenika.
6.12. Usmjerenost kovalentnih veza
Lewisom teorijom kovalentne veze i njegovim simbolima ne mogu se objasniti strukture mnogih molekula. Ipak, i danas se služimo Lewisovim simbolima te ih ne treba odbaciti. No, Lewisova teorija ne objašnjava usmjerenost kovalentnih veza i neka druga svojstva jednostavnih molekula, kao što je molekula kisika.
Jednostavnu teoriju koja objašnjava građu malih molekula postavili su 1940. godine N. V. Sidgwick i H. M. Powel. To je poznata VSEPR-teorija (Valence Shell Electron Pair Repulsion). Oni su zaključili da razmještaj elektronskih parova oko središnjeg atoma ovisi o njihovu broju. Kako između jednog elektronskog para i svakoga drugog elektronskog para djeluju odbojne elektrostatske sile, njihovi elektronski oblaci u valentnoj ljusci nastoje se razmjestiti tako da budu što dalje jedan od drugoga. Primjerice, molekula berilijeva klorida, BeCl2, u plinovitu stanju linearne je građe. Berilij je element 2. skupine periodnog sustava pa ima dva elektrona u valentnoj ljusci i tvori dvije kovalentne veze. Elektronski oblaci dvaju elektronskih parova bit će najdalje jedan od drugoga ako kovalentne veze zatvaraju kut od 180°.
Molekula BF3 planarne je građe. Atom bora čini jednostruke kovalentne veze s tri atoma fluora. Sve su tri veze jednake duljine. Odavde proizlazi da valentna ljuska bora sadržava tri para elektrona, a njihovi će elektronski oblaci biti najdalje jedan od drugoga ako kovalentne veze zatvaraju kut od 120°.
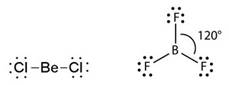
U molekuli metana oko atoma ugljika nalaze se četiri para elektrona. Oni će se rasporediti tako da budu što dalje jedan od drugoga. I zaista, istraživanja su pokazala da u molekulama metana i drugih hidrida elemenata 14. skupine kovalentne veze zatvaraju kut od 109,5°.
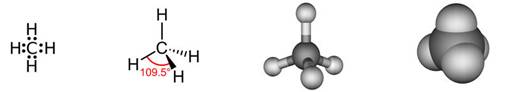
Slika 6.15. Usmjerenost kovalentnih veza u molekuli i modeli molekule metana
Kut što ga međusobno zatvaraju kovalentne veze zove se valentni kut. U svim molekulama hidrida 14. skupine - metana, silana, germana, stanana i plumbana - valentni kut iznosi 109,5°. Zamislimo li na površini kugle četiri negativna naboja (četiri para elektrona, tj. 4 elektronska oblaka), oni će se rasporediti tako da budu što dalje jedan od drugoga.
Tipične primjere usmjerenosti kovalentnih veza nalazimo u kristalima dijamanta te elementarnog silicija i germanija. Atomi su povezani tako da svaki atom čini četiri kovalentne veze s četiri istovrsna atoma. Kovalentne veze usmjerene su prema vrhovima tetraedra, kao što pokazuje sl. 6.16a. Sustav kovalentnih veza proteže se od atoma do atoma kroz cijeli kristal. Kovalentne veze tu su jedine sile koje održavaju atome u kristalnoj strukturi. Ne može se govoriti o molekuli germanija, silicija ili dijamanta jer je zapravo cijeli kristal samo jedna molekula. Dijamant je najtvrđa tvar koja se javlja u prirodi. Usto, dijamant je izvanredan izolator.
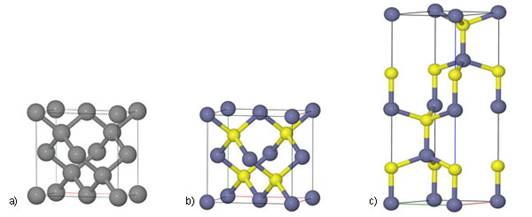
Slika 6.16. Jedinične ćelije kristalnih struktura: a) dijamant, C, b) sfalerit, ZnS, c) vurcit, ZnS. Dijamant i sfalerit kristaliziraju u kubnom, a vurcit u heksagonskom sustavu.Uočite da kovalentne veze međusobno zatvaraju tetraedarski kut (109,5°).
Kristalne strukture u kojima osim kovalentnih nema drugih veza dosta su rijetke. Samo elementi 14. skupine - ugljik, silicij i germanij - mogu činiti kristalne strukture u kojima je svaki atom okružen s četiri istovrsna atoma i u kojima nema drugih veza osim kovalentnih. Spojevi tipa AB, kao što je ZnS, najčešće imaju strukturu sfalerita ili vurcita. Kao što se vidi sa slike 6.16b, struktura sfalerita podsjeća na kristalnu strukturu dijamanta. U strukturi sfalerita i vurcita ne mogu se izdvojiti zasebne molekule AB, jer su atomi međusobno povezani u trodimenzijsku mrežu.
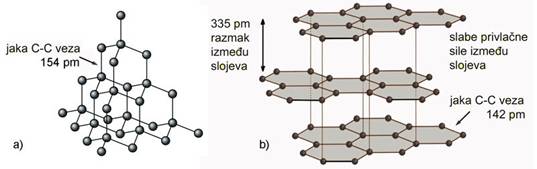
Slika 6.17. Usporedba struktura dijamanta i grafita. a) Kovalentne veze između atoma ugljika u dijamantu usmjerene su prema vrhovima tetraedra. b) U grafitu atomi ugljika vezani su kovalentnim vezama tako da tvore beskonačne ravne slojeve. Grafit kristalizira u heksagonskom sustavu.
Nasuprot dijamantu, grafit je mekan i provodi električnu struju. U grafitu su atomi ugljika vezani kovalentnim vezama tako da tvore beskonačne ravne slojeve. Unutar sloja svaki je atom vezan s tri susjedna atoma. Možemo zamisliti da se atom ugljika nalazi u težištu istostraničnog trokuta, a da su kovalentne veze usmjerene prema njegovim vrhovima, gdje se opet nalaze atomi ugljika. Tako se stvara dvodimenzijska slojevita struktura. Od četiri elektrona u valentnoj ljusci tri su iskorištena za stvaranje jakih kovalentnih veza s tri najbliža atoma. Četvrti elektron također sudjeluje u stvaranju kovalentne veze, ali tako da ulazi u zajednički oblak delokaliziranih elektrona. Taj se "oblak" rasprostire iznad i ispod ravnine u kojoj leže atomi ugljika. Različita svojstava dijamanta i grafita posljedica su različite vrste kemijske veze među atomima ugljika. Zbog jakih kovalentnih veza unutar sloja, talište grafita je visoko, više od 4000 oC. Zbog slojevite strukture i slabih van der Waalsovih sila među slojevima, grafit je mekan i masna opipa. Elektroni zajedničkog elektronskog oblaka, što se prostire iznad i ispod ravnine što je čine atomi ugljika, lako su pokretljivi. Zbog toga grafit provodi električnu struju.
Istraživanja građe molekule etena pokazala su da mu je molekula planarna, da svi atomi leže u istoj ravnini. Kovalentne veze međusobno zatvaraju kut od oko 120°. Kada se atomi vežu dvostrukom kovalentnom vezom, u vezi sudjeluju dva para elektrona. Zanimljivo je da se dijelovi molekula koji se vežu dvostrukom vezom ne mogu oko nje rotirati. Naprotiv, dijelovi molekula vezani jednostrukim vezama mogu se rotirati.
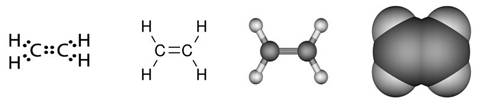
Slika 6.18. Usmjerenost kovalentnih veza u molekuli i modeli molekule etana.
Postojanu elektronsku konfiguraciju od osam elektrona atomi mogu ostvariti i tako da dijele tri elektronska para. Veza koja se ostvaruje pomoću tri zajednička elektronska para naziva se trostrukom kovalentnom vezom.
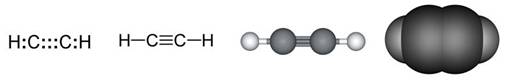
Slika 6.19. Trostruka kovalentna veza u molekuli etina (acetilena), C2H2. Molekula je linearna. Dijelovi molekula međusobno vezanih trostrukom vezom mogu rotirati oko trostruke veze.
Mjera za jakost kemijske veze jest energija veze. Općenito, energija kemijske veze dvaju atoma A i B u molekuli AB jednaka je energiji koju je potrebno utrošiti da se atomi razdvoje na beskonačnu udaljenost.
Ako se usporede vrijednosti energija jednostruke, dvostruke i trostruke veze među atomima ugljika, lako se vidi da je trostruka veza slabija od tri jednostruke veze. Energija jednostruke veze C − C iznosi oko 335 kJ/mol, dvostruke veze C = C oko 610 kJ/mol, a trostruke veze C ≡ C oko 836 kJ/mol. Ugljikovi spojevi s dvostrukim i trostrukim vezama jako su reaktivni. Elektronski oblaci dvostruke i trostruke veze relativno su udaljeni od jezgara pa lako podliježu utjecaju drugih atoma. Ugljikovi spojevi s trostrukim vezama reaktivniji su od ugljikovih spojeva s dvostrukim vezama.
Elektronski oblak trostruke veze u molekuli dušika izgleda jednako kao i elektronski oblak trostruke veze u molekuli etina. No, razmak među atomima ugljika u etinu iznosi 121 pm, a razmak među atomima dušika u molekuli dušika 110 pm. Trostruka veza u molekuli dušika je kraća, prekrivanje elektronskih oblaka je bolje, pa je i energija veze veća. Energija trostruke veze u molekuli dušika gotovo je šest puta veća od energije jednostruke veze N−N. Zato su molekule dušika osobito stabilne. Kada se dušik trostrukom vezom veže s atomima ugljika, energija trostruke veze C≡N približno je jednaka trostrukoj energiji jednostruke veze C−N. Time se objašnjava velika stabilnost funkcijskih skupina -C≡N u molekulama.
6.13. Utjecaj nepodijeljenog elektronskog para
Atomi elemenata 15. skupine periodnog sustava imaju u posljednjoj ljusci pet elektrona. Do stabilne elektronske konfiguracije nedostaju im 3 elektrona. Zato čine kovalentne veze s tri atoma vodika pri čemu nastaju tri podijeljena elektronska para. No, četvrti elektronski par je nepodijeljen. (Opaska: Pogrešno je nepodijeljeni elektronski par nazivati slobodnim elektronskim parom, jer on nije slobodan, već je vezan uz jezgru atoma.) Odbijanje između podijeljenih elektronskih parova slabije je od odbijanja nepodijeljeni par ― podijeljeni par. Zato dolazi do smanjenja valentnog kuta koji u molekuli amonijaka iznosi 107,8°, a na 109,5° (kao kod metana). Slično su građene i molekule drugih hidrida 15. skupine: fosfina, PH3, arsina, AsH3, stibina, SbH3 i bizmutina BiH3. U nizu od amonijaka do bizmutina valentni kut se smanjuje.
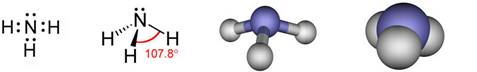
Slika 6.20. Usmjerenost kovalentnih veza u molekuli i modeli molekule amonijaka
Atomi elemenata 16. skupine periodnog sustava imaju u posljednjoj ljusci šest elektrona. Da bi ostvarili postojanu elektronsku konfiguraciju, osam elektrona u posljednjoj ljusci, u spojevima s vodikom moraju načiniti dva zajednička elektronska para. Zato u molekulama hidrida na svaki atom elementa 16. skupine dolaze dva atoma vodika. Formule tih hidrida bit će, prema tome: H2O, H2S, H2Se, H2Te.
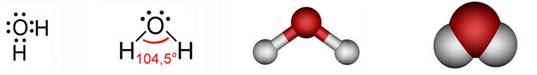
Slika 6.21. Usmjerenost kovalentnih veza u molekuli i modeli molekule vode
Oko kisikova atoma u
molekuli vode dva su elektronska para podijeljena i dva nepodijeljena.
Očekivali bismo da je valentni kut u molekuli vode blizak tetraedarskom kutu,
109,5°, ali on je nešto manji i iznosi 104,5o. Uzrok tome je jače
međusobno odbijanje nepodijeljenih elektronskih parova te slabije međusobno
odbijanje podijeljenih elektronskih parova. Slično se opaža i u molekulama
hidrida ostalih elemenata 16. skupine.
6.14. Elektronegativnost
Energija ionizacije i afinitet prema elektronu dva su zasebna kriterija koja karakteriziraju metalna i nemetalna svojstva elemenata. Zajednički kriterij, koji ovisi o energiji ionizacije i afinitetu prema elektronu, zove se elektronegativnost.
Elektronegativnost je mjera sposobnosti atoma da privuče zajednički elektronski par u kovalentnoj vezi čineći polarnu kovalentnu vezu. Elektronegativnost nije svojstvo atoma samog po sebi, već je to njegovo svojstvo u kovalentnoj vezi. Relativni koeficijent elektronegativnosti osmislio je 1932. američki kemičar Linus Pauling (1901. - 1994.). To je učinio kako bi objasnio zašto kovalentna veza između dva različita atoma A-B jača od očekivane prosječne jakosti veze između istovrsnih atoma A-A i B-B. Naime, u dvoatomnim molekulama kemijskih elemenata (H2, F2, Cl2, O2, N2 i dr.) elektronski oblak je simetrično raspodijeljen između jezgara (vidi sliku 6.22.). Kad se kovalentnom vezom vezuju različiti atomi, jedan od njih više privlači zajednički elektronski par. Veza je zbog toga polarna. Mogli bismo reći i tako, da polarna veza nije posve kovalentna nego ima i udio ionske veze.
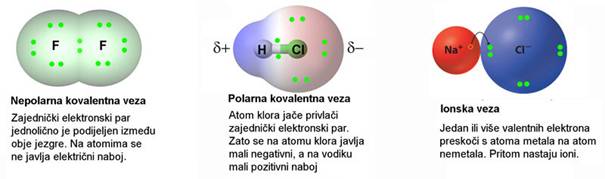
Slika 6.22. Shematski prikaz razlika između
nepolarne, polarne i ionske veze. Polarna veza je prijelaz između krajnjih
slučajeva: kovalentne veze u kojoj su elektroni simetrično podijeljeni između
obje jezgre i ionske veze kod koje elektron preskoči s jednog atoma na drugi.
Izvor: www.new.chemistry-teaching-resources.com
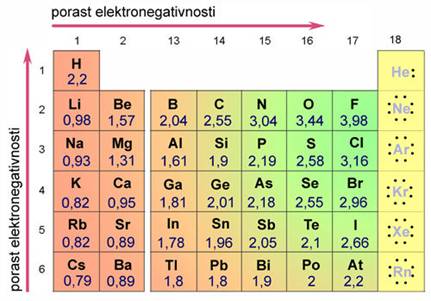
Slika 6.23. Elektronegativnosti nekih elemenata
Prema Paulingu najmanji relativni koeficijent
elektronegativnosti ima cezij (0,7), a najveći fluor (4,0). Elektronegativnost
ostalih elemenata kreće se između te dvije vrijednosti. Gledano unutar
periodnog sustava elektronegativnost raste od lijeva nadesno i odozdo prema
gore. Što je relativna elektronegativnost nekog atoma veća, to on jače privlači
zajednički elektronski par, pa je i udio ionske veze veći.
6.15. Polarnost molekula
U kovalentnoj vezi među jednakim atomima elektronski je oblak simetrično raspodijeljen, kao što pokazuje slika 6.22. No, kada se kovalentnom vezom vežu različiti atomi zbog razlike njihove elektronegativnosti raspodjela gustoće elektronskog oblaka nije simetrična. To ne znači da molekula mora biti polarne građe. Primjerice, iako su građene od različitih atoma molekule tetraklormetana, CCl4, benzena, C6H6, naftalena, C10H8, ugljikova dioksida, CO2, nisu polarne. Uzrok tomu je simetrija molekule zbog čega se sile uzrokovane nabojima poništavaju.
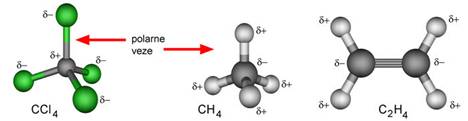
Slika 6.24. Primjeri nepolarnih molekula. Zbog razlike elektronegativnosti sve su kovalentne veze u ovim molekulama polarne. No, zbog simetrične građe te su molekule nepolarne.
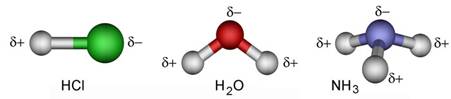
Slika 6.25. Primjeri polarnih molekula. Zbog razlike elektronegativnosti atoma u vezi sile među nabojima se ne poništavaju.
![]() Atomi halogenih elemenata u molekulama halogenovodika vezani su s atomima
vodika zajedničkim elektronskim parom, tj. jednostrukom kovalentnom vezom. Zbog
velike elektronegativnosti halogenih
elemenata, osobito fluora, zajednički elektronski par uvijek je više privučen
atomu halogenog elementa. Zato se na atomima halogenih elemenata
pojavljuje maleni negativni, a na atomu vodika maleni pozitivni naboj. Molekule su halogenovodika stoga električni dipoli.
Općenito, u kovalentnim spojevima koje čine atomi različite
elektronegativnosti zajednički elektronski par uvijek više pripada elektronegativnijem
atomu.
Atomi halogenih elemenata u molekulama halogenovodika vezani su s atomima
vodika zajedničkim elektronskim parom, tj. jednostrukom kovalentnom vezom. Zbog
velike elektronegativnosti halogenih
elemenata, osobito fluora, zajednički elektronski par uvijek je više privučen
atomu halogenog elementa. Zato se na atomima halogenih elemenata
pojavljuje maleni negativni, a na atomu vodika maleni pozitivni naboj. Molekule su halogenovodika stoga električni dipoli.
Općenito, u kovalentnim spojevima koje čine atomi različite
elektronegativnosti zajednički elektronski par uvijek više pripada elektronegativnijem
atomu.
Slika 6.26. Polarnost molekula halogenovodika. Razlika
elektronegativnosti u molekulama H-X smanjuje se od fluora do joda. Zato se
jakost dipola H-X smanjuje istim smjerom.
Izvor: commons.wikimedia.org/HX-polarity-montage-3D-balls
Stavi li se tvar čije su molekule polarne građe u električno polje, između pozitivno i negativno nabijene elektrode, molekule se tvari orijentiraju pod utjecajem električnog polja. Negativni kraj molekule usmjerava se prema pozitivnoj, a pozitivni prema negativnoj elektrodi. Takva se svojstva tvari iskorištavaju za izradu kondenzatora, mikrofona i elektroničkih sklopova.
Slika 6.27. Shematski prikaz orijentacije molekula vode u elektromagnetskom polju mikrovalne pećnice. Kad se smjer polja okrene, zakrenu se i molekule vode. Voda se ugrije zbog trenja među molekulama koje se javlja pri njihovu zakretanju. Ako okolina u kojoj se nalaze molekule vode ne pruža otpor, primjerice u vodenoj pari, ne može doći do trenja i zagrijavanja. Molekule vode u ledu vezane su relativno jakim vodikovim vezama i ne mogu slobodno rotirati djelovanjem mikrovalova. Zato se odmrzavanje odvija od površine, na kojoj ima tekuće vode, prema unutrašnjosti. Tijekom "pauza" toplina se vođenjem širi od površine prema unutrašnjosti zaleđene hrane.
Slika 6.28. a) Plastični štap ili obična vješalica električki nabijeni trljanjem tkaninom privlače tanak mlaz vode jer se dipolne molekule vode orijentiraju pod djelovanjem električnog polja. b) Shematski prikaz orijentacije polarnih molekula u kristalu, dipol - dipol interakcija.
Polarne molekule djeluju i jedna na drugu, tako da se u tekućini ili kristalu same od sebe orijentiraju. Pozitivni kraj jedne molekule nasloni se na negativni kraj druge. U tom slučaju govorimo o dipol-dipol interakciji.
Osim halogenovodika, polarne su građe i molekule vode, sumporovodika, amonijaka i mnoge druge. Dapače, malo je spojeva za koje se može reći da su im molekule nepolarne. Takve su molekule metana, CH4, ugljikova tetraklorida, CCl4, kositrova(IV) klorida, SnCl4, benzena, C6H6 i drugih spojeva simetrične građe.
6.16. Međumolekulske sile
Molekule nastale spajanjem atoma kovalentnim vezama u cjelini su električki neutralne. Ipak, među njima djeluju sile električne prirode koje se zovu van der Waalsove sile, u čast nizozemskog fizičara Johannes D. van der Waalsa (1837. - 1923.) koji je prvi odredio veličinu tih sila istražujući svojstva plinova. Van der Waalsove sile prisutne su u svim tvarima i u svim agregacijskim stanjima. To je opće svojstvo tvari. Pod nazivom van der Waalsove sile krije se više međumolekulskih interakcija: ion - dipol, dipol - dipol, ion - inducirani dipol, vodikove veze, Londonove ili disperzijske sile i dr.

Slika 6.29. a) Molekula sa stalnim dipolnim momentom inducira dipolni moment u inače nepolarnoj molekuli. b) Molekule sa stalnim i induciranim dipolnim momentom međusobno se privlače.
Približe li se dvije nepolarne molekule, A i B, njihovi se elektronski oblaci izbjegavaju. Ako je na mjestu dodira u molekuli A gustoća elektronskog oblaka velika, onda u molekuli B mora biti mala. To znači da je jedna molekula u drugoj inducirala dipole, koji sad djeluju jedan na drugi. To je posljedica deformacije elektronskog oblaka u molekulama. Sposobnost elektronskog oblaka da se u molekuli deformira pod utjecajem okolnih molekula zove se polarizibilnost. Polarizibilnost raste s brojem elektrona u molekuli pa van der Waalsove sile ovise i o veličini molekula. Što su molekule veće, to je među njima više dodira, a svaki dodir pridonosi međumolekulskoj privlačnoj sili. Zbog razlika u veličini van der Waalsovih sila mijenjaju se i fizička svojstva tvari analognoga sastava. Na sl. 6.30. grafički je prikazana ovisnost temperature vrelišta plemenitih plinova i hidrida elemenata 14. skupine. Uočljivo je da vrelišta rastu s porastom relativne molekulske mase.
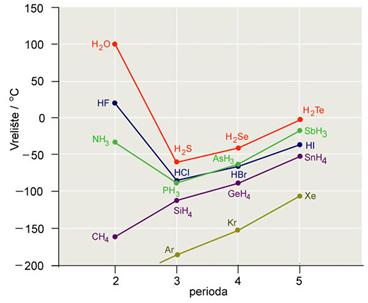
Slika 6.30. Vrelišta plemenitih plinova i hidrida elemenata 14. skupine rastu s njihovim relativnim molekulskim masama. Zbog jakih vodikovih veza vrelišta vode, fluorovodika i amonijaka izrazito su visoka.
Na istoj slici prikazana je i ovisnost vrelišta hidrida elemenata 15., 16. i 17. skupine. Vrelišta njihovih hidrida uvijek su viša u odnosu na vrelišta hidrida elemenata 14. skupine iste relativne molekulske mase. To je lako objasniti. Zbog simetrične građe molekule hidrida elemenata 14. skupine su nepolarne, dok su molekule hidrida elemenata 15., 16. i 17. skupine polarne. Polarne se molekule međusobno jače privlače od nepolarnih. Zato su vrelišta hidrida s polarno građenim molekulama viša u odnosu na vrelišta hidrida elemenata 14. skupine.
Privlačnim silama suprotstavljaju se odbojne sile među elektronima, pa elektronski oblak atoma vrlo malo prodire u elektronski oblak susjednog atoma. Međumolekulski razmaci u kristalima i tekućinama određeni su ravnotežom privlačnih i odbojnih sila. Odbojne sile vrlo naglo rastu smanjenjem međumolekulskih razmaka, pa su zato tekućine i kristali nestlačivi. U kristalima i tekućinama molekule zauzimaju najmanji volumen pri danoj temperaturi.
Doznajte više na:
chem.libretexts.org/Liquids_and_Intermolecular_Forces
6.17. Vodikova veza
Slika 6.30. pokazuje da su vrelišta fluorovodika i vode neobično visoka, iznad svakog očekivanja. To se može objasniti građom njihovih molekula. Zajednički elektronski parovi u molekulama fluorovodika, vode i amonijaka u većoj mjeri pripadaju elektronegativnim atomima fluora, kisika i dušika. Zato se na tim atomima javlja mali negativni, a na atomima vodika mali pozitivni električni naboj. Pozitivni kraj jedne molekule naslanja se na negativni kraj druge molekule. Kaže se da se molekule asociraju (lat. associatio = udruživanje). Asocijacija tih molekula shematski se prikazuje ovako:
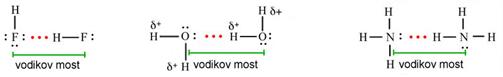
Atom vodika, na kojemu je koncentriran pozitivni naboj dipola, naslanja se na nepodijeljeni elektronski par susjedne molekule i tako premošćuje razmak između dvaju elektronegativnih atoma. Kaže se da su ti atomi, bolje reći pripadne molekule, povezani vodikovim mostom ili vodikovom vezom. Vodikova veza je u osnovi elektrostatske prirode. Ona je mnogo slabija od kovalentne i ionske veze, ali znatno jača van der Waalsovih privlačnih sila. Vodikovim se vezama objašnjavaju neobično visoka vrelišta vode, fluorovodika i amonijaka, no i mnoge druge pojave. Vodikova veza je toliko važna, zanimljiva i još danas nedovoljno istražena pojava da se svaku minutu objavi jedan znanstveni rad na temu te osebujne interakcije među molekulama.
Tablica 6.3. Jakost vodikovih veza
F−H···F 155 kJ/mol
O−H···N 29 kJ/mol
O−H···O 21 kJ/mol
N−H···N 13 kJ/mol
N−H···O 8 kJ/mol
HO−H···OH3+ 18 kJ/mol
Duljina vodikove veze izražava se kao razmak između jezgara elektronegativnih atoma premoštenih vodikom. Razmak je kraći od zbroja atomskih radijusa atoma uključenih u vodikovu vezu. To znači da elektronski oblak atoma kisika iz jedne molekule vode djelomično prekriva elektronski oblak atoma vodika susjedne molekule vode. Skraćenje očekivanog razmaka upućuje na postojanje veze. Što je razmak manji, veza je jača. Dakle, među molekulama vode javlja se slaba veza kovalentne prirode, pa se stoga vodikova veza ne može svesti samo na elektrostatsku interakciju. Model na sl. 6.31. prikazuje geometriju vodikove veze između molekula vode.
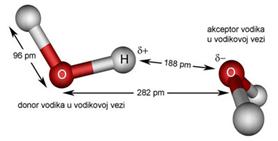
Slika 6.31. Geometrija vodikove veze među molekulama vode.
Vodikova veza najčešće nije linearna. Kut O-H•••O u vodi iznosi 162o.
Inače, u vodikovim vezama kut D-H•••A može iznositi od 140 do 180o. (D =
atom donora vodika u vodikovoj vezi, A = atom akceptora vodika u
vodikovoj vezi.). Ako je kut manji od 140o smatra se
da nema vodikove veze.
Slika izvor: www1.lsbu.ac.uk/water_hydrogen_bonding
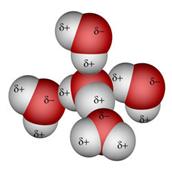
Slika 6.32. Shematski prikaz međusobnog razmještaja molekula vode u ledu.
Struktura leda i anomalija vode također se objašnjavaju vodikovom vezom. (Vidi na internetu: http://ergodic.ugr.es/water2.html) Kristali leda sastoje se od molekula vode pravilno raspoređenih u prostoru. Svaka molekula vode čini četiri vodikove veze, ili – drugim riječima - svaki je atom kisika okružen s četiri atoma vodika kao što se vidi na sl. 6.32. Dva su atoma vodika bliža atomu kisika. To su oni atomi vodika koji pripadaju molekuli budući da su vezani s atomom kisika kovalentnim vezama. Dva atoma su podalje. To su vodikovi atomi dviju susjednih molekula vode vezanih vodikovom vezom. (Vidi sliku 8.4. Kristalna struktura leda i poglavlje 9.2. Međumolekulske sile u tekućinama.)
Voda i vodikove veze vrlo su važne za održavanje strukture i funkcioniranje svakog živog bića . Osnovni građevni materijal živoga organizmu su voda, proteini i nukleinske kiseline (DNA, RNA). Proteini se sastoje od dugačkih lanaca koji se mogu unutar sebe povezivati N-H•••O vodikovim vezama pri čemu nastaje a-uzvojnica ili b-nabrana ploča. Između lanaca nukleinskih kiselina također postoje vodikove veze (vidi sl. 6.34). To se najbolje vidi u slučaju dvostruke uzvojnice molekule DNA, u kojem se lanci („uzvojnice“) drže uspostavljanjem vodikovih veza između nasuprotnih nukleinskih baza (A-T i C-G).
Slika 6.33. Shematski prikaz vodikovih veza između antiparalelnih proteinskih lanaca (β-ploča, eng. beta-sheet). Izvor: oregonstate.edu
Slika 6.34. Sparivanje baza vodikovim vezama u molekulama
DNA. Par baza citozin-gvanin (C-G)
međusobno je povezan trima vodikovim vezama, dok su u paru baza adenin-timin (A-T)
dvije vodikove veze. Vodikove veze održavaju i strukturu dvostruke uzvojnice
molekule DNA.
Slika izvor: www.wikiwand.com/Bazni_par
6.18. Metalna veza
Velika većina kemijskih elemenata su metali. Pri sobnoj temperaturi svi su metali krutine, osim žive. Tališta i vrelišta većine metala vrlo su visoka u odnosu na tališta i vrelišta drugih tvari. U krutom i tekućem stanju metali dobro provode električnu struju i toplinu. Mogu se kovati, pa se stoga zovu i kovine. Metali općenito posjeduju vrlo karakteristična svojstva. Imaju malu energiju ionizacije pa lako otpuštaju elektrone valentne ljuske te tvore katione u spojevima s nemetalima. Kada se promatraju kristalne strukture metala, može se opaziti da većina metala kristalizira tako da svaki atom bude okružen sa što većim brojem atoma na što manjoj udaljenosti. Kristalne strukture metala vrlo su stabilne. To znači da je veza među atomima metala jaka. Možemo to zaključiti iz njihova najčešće visokog vrelišta. Litij, koji ima samo jedan valentni elektron, pri normalnom atmosferskom tlaku ima vrelište pri 1335°C.
Jednaki atomi mogu se povezivati samo kovalentnim vezama, a elektroni među atomima moraju biti jednakomjerno podijeljeni. Prema tome, metalnu vezu možemo smatrati posebnom vrstom kovalentne veze, a kristal metala orijaškom molekulom.
Istraživanja su pokazala da se atomi bakra, srebra, zlata i mnogih drugih metala u kristalnim strukturama pakuju tako da čine kubnu gustu slagalinu (engl. Face Centered Cubic Lattice, FCC). Magnezij, kadmij, cink i još neki drugi metali kristaliziraju po tipu heksagonske guste slagaline (engl. Hexagonal Close Packed, HCP ). Atomi natrija, kalija, rubidija i cezija kristaliziraju po tipu prostorno centrirane kocke (engl. Body Centred Cubic Lattice, BCC).
Slika 6.35. Najčešće kristalne strukture metala. a) Kubna najgušća slagalina ili plošno centrirana kocka. b) Heksagonska gusta slagalina. c) Prostorno centrirana kocka.
U metalnoj vezi atomi ne čine zajedničke elektronske parove. Umjesto toga valentni elektroni čine nešto što se može nazvati zajedničkim elektronskim oblakom. Tako atomi postaju pozitivni ioni uronjeni u "more" delokaliziranih elektrona, "elektronski plin". Zato metalna veza nije prostorno usmjerena.

Slika 6.36. Shematski prikaz metalne veze. Pozitivni ioni u moru delokaliziranih elektrona
Mnoga svojstva metala mogu se objasniti iz ideje o delokaliziranim elektronima. Usporedimo, primjerice, svojstva elemente četvrte periode. U toj se periodi nalazi većina tehnološki interesantnih metala. Već je nekoliko puta naglašeno da je veza među atomima jača što je razmak među njima manji. Isto vrijedi i za metale. Usporedimo npr. vrijednosti atomskih radijusa i temperature tališta elemenata četvrte periode.
|
Metal |
K |
Ca |
Sc |
Ti |
V |
Cr |
Mn |
Fe |
Co |
Ni |
Cu |
Zn |
Ga |
Ge |
|
Radijus/pm |
238 |
196 |
160 |
146 |
135 |
128 |
136 |
127 |
133 |
135 |
128 |
137 |
121 |
139 |
|
Talište/°C |
64 |
842 |
1541 |
1660 |
1890 |
1857 |
1244 |
1535 |
1495 |
1453 |
1083 |
420 |
30 |
937 |
Kalij ima jedan valentni elektron u valentnoj ljusci, pa stoga može iskoristiti za metalnu vezu samo taj elektron. Zato je veza slaba, a metalni kalij mekan i niskog tališta. U metalnom kalciju na svaki atom kalcija dolaze 2 valentna elektrona. Kako u nastajanju veze u metalnom kalciju sudjeluje dvostruko veći broj elektrona nego u kaliju, kalcij je tvrđi metal i višeg tališta od kalija. Analogno, u metalnom skandiju sudjeluju 3 elektrona po atomu u nastajanju veza, pa je skandij tvrđi i tali se na višoj temperaturi od kalcija. Povećanje tvrdoće i povišenje tališta opaža se sve do kroma koji ima 6 valentnih elektrona. Fizička svojstva kroma, mangana, željeza, kobalta i nikla vrlo su slična, pa se može zaključiti da je njihova valencija u metalu (metalna valencija) ista, tj. jednaka 6. Poslije nikla smanjuje se metalna valencija. Kod metalnog galija u nastajanju veze sudjeluju samo 3 elektrona. Galij je mekan metal vrlo niskog tališta, 30 °C. No, vrelište galija je visoko, oko 2400 oC.
Germanij naglo mijenja svojstva. On ima 4 valentna elektrona koji mogu načiniti 4 kovalentne veze s 2 elektrona po vezi. To znači da svaki atom ima oktet elektrona u valentnoj ljusci. Čist germanij slabo provodi električnu struju. Krhak je i ne može se kovati. Zbog takvih svojstava germanij svrstavamo u polumetale.
Svojstva elemenata 14. skupine značajno se mijenjaju porastom rednog broja, točnije broja elektrona u atomu. Dok je dijamant savršen izolator, proziran i najtvrđa tvar, silicij i germanij su poluvodiči, a kositar i olovo mekani metali koji dobro provode električnu struju. Ako se kristali silicija ili germanija zagrijavaju, oni sve bolje provode električnu struju. Germanij na oko 150 °C provodi električnu struju kao svaki drugi metal.
Zanimljiva svojstva ima kositar. Pri sobnoj temperaturi to je mekan metal od
kojega se valjanjem mogu dobiti tanke folije. No, ako se kositar ohladi ispod
13,2 °C, zbog promjene metalne veze u kovalentnu, mijenja se i kristalna
struktura kositra iz tetragonske u kubnu. Zbog toga se bijeli kositar polagano
raspada u sivi prah. Pri temperaturi 13,2 °C prijelaz bijelog
kositra u sivi izvanredno je spor, ali se sniženjem temperature ubrzava. Pri
-48°C brzina prijelaza je najveća. U sivom kositru atomi su međusobno vezani
kao u dijamantu. Svaki je atom okružen s četiri jednaka atoma s kojima dijeli
zajedničke elektronske parove (vidi slike 6.16a i 6.17a.).
Vidi na internetu: www.youtube.com/watch?v=FUoVEmHuykM
Raspadanje predmeta od kositra poznato je još od antičkog doba. Već Aristotel govori o promjeni svojstava kositra pri niskoj temperaturi, a Plutarh ukazuje na raspadanje kipova od kositra. U 16. stoljeću iz Arhangelska je u Moskvu poslano nekoliko sanduka engleskog kositrenog pribora za jelo. Kad su u Moskvi otvorili sanduke unutra je bio sivi prah. Godine 1833. morali su zamijeniti dio kositrenih svirala na orguljama u katoličkoj crkvi u Zeits-u (Njemačka), ali nakon 50 godina od tada zamijenjenih cijevi 24 su se raspale. Naime, kositrene cijevi nalazile su se odmah ispod drvenog krova pa su zimi bile izložene hladnoći. Za vrlo hladne zime 1868./69. godine, u jednom vojnom skladištu u Sankt Peterburgu, kositrena dugmad za vojne uniforme pretvorila se u prah. Što je još čudnije, pojava se poput zaraze širila s "oboljele" na "zdravu" kositrenu dugmad pa je nazvana kositrena kuga. (Rus. oловянная чума - olovjanaja čuma, engl. tin pest, franc. tine plaque, njem. Zinnpest.) U to je doba iz Rotterdama u Moskvu poslano nekoliko vagona ingota kositra. Kad su u Moskvi otvorili vagone u njima se nalazilo samo nekoliko cijelih ingota dok se većina raspala u prah. Da se radi o alotropskim modifikacijama kositra dokazao je 1870. god. ruski kemičar Fritzsche (Юлий Фёдорович Фрицше - njem. Carl Julius Fritzsche (1808. - 1871.)). Mnogo muzejskih primjeraka kositrenog posuđa propalo je zato što se stari dvorci ili muzejske zbirke najčešće zimi ne griju. Kositrena kuga jedan je od uzroka pogibelji Scottove ekspedicije na Južni pol 1912. god. Naime, njihove limenke za petrolej bile su zalemljene kositrom koji se pri niskoj temperaturi pretvorio u prah, pa je gorivo iscurilo.
POKUS 6.4. Kositreni plač (Tin cry)
Pribor i kemikalije: žlijeb od aluminijskog lima ili dugačka porculanska lađica, plinski plamenik, laboratorijska kliješta, kositar p.a. ili puriss.
Postupak
1. U porculanskoj lađici ili žlijebu od aluminijskog lima rastalite čisti kositar tako da dobijete šipku. Pustite da se talina polagano hladi kako bi nastali što veći kristali kositra. Talište kositra je 232 oC.
2.
Kada se kositar
ohladi na sobnu temperaturu dobivenu šipku savijte u blizini uha pa ćete čuti škripu
ili pucketanje. Pri savijanju šipke dolazi do zakretanja i međusobnog smicanja dijelova
kristala što proizvodi "kositreni vrisak", "kositreni plač"
ili "kositreni krik". Vidi na Internetu:
byjus.com/physics/plastic-deformation/
www.youtube.com/watch?v=Xbk5t061x4c
3. Pokus možete ponoviti tako da kositar ponovo rastalite i polagano ohladite. Slitine koje sadržavaju samo 1% olova ne proizvode "kositreni vrisak".
6.19. Dislokacije
Mehanička svojstva metala ne ovise samo o prirodi kemijske veze među njegovim atomima, nego i veličini i strukturi njegovih kristalnih zrna. Ako se površina metala ispolira, nagrize kiselinom te pogleda pod metalografskim mikroskopom, vidjet će se različito orijentirani kristalići metala. Pod elektronskim mikroskopom mogu se pak uočiti mnogobrojne nesavršenosti kristalne strukture ili dislokacije. Na nekom mjestu u kristalnoj strukturi može manjkati atom, ili se na tom mjestu nalazi atom drugog metala. Čitavi nizovi ili slojevi atoma mogu biti prekinuti i pomaknuti jedni prema drugima. Takva mjesta unose napetost u kristalnu strukturu što utječe na mehanička svojstva metala. To se može lako pokazati jednostavnim pokusom.
Slika 6.37. a) Izgled polirane površine
bakra nakon nagrizanja (jetkanja, ecanja) dušičnom kiselinom. Različito
orijentirana kristalna zrna otapaju se različitom brzinom u dušičnoj kiselini pa
zato različito reflektiraju svjetlost. Slika izvor: www.eag.com/metallurgical-testing
b) Shematski prikaz kristalnih zrna metala. Uočite nesređeni raspored atoma
na granicama zrna.
POKUS 6.5. Svojstva bakra
Pribor i kemikalije: plinski plamenik, kliješta, debela bakrena žica promjera 3 do 5 mm.
Postupak
1. Komad bakrene žice, promjera 3 do 5 mm, kakva se rabi za električne vodove duljine oko 20 cm savijte u oblik slova O i ponovno je izravnajte. Usporedite napor koji ste trebali upotrijebiti za savijanje i ponovno izravnavanje žice.
2. Uhvatite jedan kraj debele žice kliještima te žicu po cijeloj dužini žarite u plamenu plinskoga plamenika. Kad se žica ohladi, a možete je ohladiti i pod mlazom vode, savijte je rukama u isti oblik slova O. Poslije toga žicu ponovno izravnajte. Usporedite razlike u naporu koji je trebalo uložiti za savijanje i izravnavanje žice prije i poslije žarenja.
Žice za električne vodove, kakve su upotrijebljene u prethodnom pokusu, izrađuju se postupkom hladnog izvlačenja. Debela žica se postupno provlači kroz otvore sve manjeg i manjeg promjera pa se na kraju dobiju tanje žice željenog promjera. Tim se postupkom kristalići bakra deformiraju i u njih se unose dislokacije. Zbog toga porastu napetosti u kristalnoj strukturi pa bakar otvrdne. To je bilo lako vidjeti iz napora pri savijanju žice.
Nakon zagrijavanja do crvenog žara i hlađenja bakar je postao mekan. Pri crvenom žaru atomi bakra osciliraju velikom amplitudom oko ravnotežnih položaja. Pritom atomi promijene mjesta te se slože na najgušći mogući način u što veće kristale, jer je to energijski povoljnije. Time se smanjio broj dislokacija pa je bakar omekšao. Savijanjem ili kovanjem poveća se broj dislokacija. Napetosti unutar kristalne strukture postaju veće, pa bakar ponovno otvrdne.
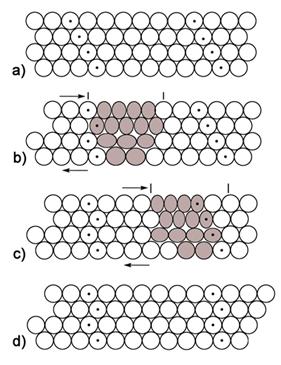
Slika 6.38. Shematski prikaz pomaka slojeva u kristalu metala pod utjecajem mehaničke sile.
Pri kovanju metala ne dolazi odjednom do klizanja čitavih slojeva, nego se pomiču dislokacije. To je energijski povoljnije. Slika 6.38. prikazuje kako jedna dislokacija, koju čini skupina atoma, putuje od jednog kraja kristala na drugi što dovodi do pomaka čitavog sloja. Uočite položaj atoma označenih točkom u početnom stanju (a). Dislokacija koja se stvorila na jednom kraju kristala (b) premješta se od atoma do atoma (c) dok ne izađe na drugom kraju kristala (d). Konačna je posljedica pomak slojeva, kao što pokazuje položaj atoma označenih točkom. Pomak dislokacija prati pokretljivi oblak elektrona, pa se ne kidaju veze. Zato se metali mogu kovati, valjati, izvlačiti u žice, itd. Pomak dislokacija u kristalu možemo usporediti s pomakom nabora na dugačkom prostiraču. Ako se na prostiraču pojavi nabor, da bismo ga izravnali moramo povući čitav prostirač. Za takav zahvat treba odjednom uložiti velik rad. Moguće je i drugo energijski povoljnije rješenje. Nabor treba gurati od jednog prema drugom kraju prostirača. To se može učiniti s više manjih obroka energije. Više nabora na prostiraču zahtjeva, razumije se, veći rad za njihovo izravnavanje.
6.20. Slitine
Proces u kojemu se staljivanjem miješaju dva ili više metala zove se legiranje, a dobivena se smjesa zove legura ili slitina (tal. legatura = vezanje, spajanje). Čisti se metali nikad ne rabe, ni u tehnologiji niti u običnom životu. Svi su uporabni predmeti napravljeni od slitina. Pribor za jelo je izrađen od slitina željeza, kroma i nikla. Obični čavli su od slitine željeza i ugljika. Duraluminij, najvažniji materijal u avioindustriji, je slitina aluminija, bakra, magnezija, mangana, željeza i silicija. Čuveni kipić "Oscara" je napravljen od bronce, slitine 88 % bakra i 12 % kositra. Vidi na Internetu: www.compoundchem.com/2017/02/25/oscars/
Slitine mogu biti krute otopine jednog metala u drugome. Lijep primjer su slitine bakra s cinkom, poznate pod imenom mjed (njem. Messing). Mjed, koja sadržava manje od 38 % cinka, može se kovati, valjati, izvlačiti u žice i sl. Mehanička svojstva takve mjedi slična su svojstvima bakra, osim što se tvrdoća mjedi povećava povećanjem udjela cinka u slitini. Takva mjed i bakar imaju istu kristalnu strukturu, no dio je atoma bakra zamijenjen atomima cinka, i to nasumično, bez ikakva reda. Zato govorimo o krutoj otopini.
Ako se pak načini slitina bakra i cinka koja odgovara sastavu koji se može prikazati formulom CuZn, tada se atomi bakra i cinka raspoređuju u kristalu onako kako je prikazano na slici 6.39. Atomi jednog elementa zauzimaju vrhove kocke, a atomi drugog smjestili su se u središte kocke. To više nije otopina ili smjesa dvaju metala nego kemijski spoj definiranog sastava, CuZn. Kemijski spoj između atoma metala naziva se intermetalnim spojem. U slitinama bakra i cinka pojavljuju se još dva intermetalna spoja, sastava Cu5Zn8 i CuZn3.
Slika 6.39. Kristalna struktura slitine sastava CuZn.
Intermetalni spoj sastava Cu5Zn8 ima složenu kubnu kristalnu strukturu, koja sadržava čak 52 atoma u jediničnoj ćeliji. Izvanredno je krt. Granula slitine sastava Cu5Zn8 može se udarcem čekića smrviti u najsitniji prah, što se neće dogoditi ni s bakrom niti s cinkom. Takva su svojstva uzrokovana jakim kovalentnim vezama među atomima ili skupinama atoma u kristalnoj strukturi.
Intermetalni spoj
sastava CuZn3 kristalizira u heksagonskom sustavu. Kao što se vidi
iz navedenih formula, kod intermetalnih spojeva ne vrijede uobičajena pravila valencije.
POKUS 6.6. Difuzija u metalima (golden penny)
Vidi na internetu: www.youtube.com/watch?v=UqVP3WdOqUk
Slitine najčešće imaju niže talište od tališta čistih metala. Tako se čisti kositar tali pri 232 °C, a olovo pri 327 °C. Slitina olova i kositra upotrebljavaju se za spajanje metala lemljenjem, a najniže talište, samo 183 °C, ima slitina u kojoj je maseni udio olova 38 %. Lako taljive slitine upotrebljavaju se u osiguračima protiv pregrijavanja električnih uređaja, u dojavljivačima požara i dr.
Tališta slitina mogu biti i viša od tališta čistih metala. Primjerice, slitina čiji se sastav može prikazati formulom Mg3Sb2 tali se pri 961 °C. Tališta čistih metala znatno su niža, magnezija pri 651 °C, a antimona pri 627°C. To je još jedan od mnogobrojnih primjera intermetalnih spojeva s jakim kovalentnim vezama između atoma metala.
Legiranjem se mijenjaju i kemijska svojstva metala, primjerice otpornost na koroziju. Duraluminij korodira jače od čistog aluminija. Legiranjem željeza s niklom i kromom dobivaju se slitine (legure) otporne na koroziju, tzv. nehrđajući čelik. Dodavanjem kositra u mjed, do masenog udjela oko 1 %, povećava se otpornost mjedi na koroziju, pa se takva mjed upotrebljava za izradu različitih sitnih predmeta u brodovima. Ovih nekoliko primjera pokazuje kako je važno dobro poznavanje promjena koje nastaju u strukturi metala pri legiranju s metalima i nemetalima. Legiranjem se mogu svojstva metala poboljšati, pa se za to rabe svi poznati metali i nemetali, počevši od vodika do uranija.
6.21. Recikliranje metala
Zemljina kora samo na nekim mjestima sadržava bogata ležišta minerala koji sadržavaju metale važne za suvremenu tehnologiju. Ta ležišta nisu neiscrpna pa se danas pristupa iskorištavanju ležišta sa sve manjim udjelom bakra, cinka, olova, nikla, kobalta, srebra, zlata i dr. Zato je važno iskorištene metale reciklirati a ne razbacivati po okolišu. Recikliranjem iskorištenih metala štedi se energija i voda. No, neki su metali vrlo rijetki, posebno lantanoidi (rijetke zemlje, eng. rare-earth element (REE) or rare-earth metal (REM)). Najveća ležišta lantanoida su u Kini koja proizvodi 90 % rijetkih metala i svoje blago ne želi dijeliti s drugima. Rijetkih zemalja ima u Afganistanu, Mongoliji, Grenlandu i dr. Znanstvena istraživanja dovela su do razvoja visoke tehnologije: neodimijskih magneta i neodimijskih lasera, računala, mobitela, ekrana televizora, baterija osobitih svojstava i dr. Lantanoidi su postali nezaobilazni u proizvodnji elektroničkih uređaja visoke tehnologije. Zato tehnološki razvijene zemlje nastoje svim sredstvima zadržati kontrolu nad nalazištima ovih rijetkih metala.
Moramo shvatiti da se svi elektronički uređaji mogu i moraju reciklirati jer je u njima maseni udio dragocjenih (rijetkih) metala desetak puta veći nego u prirodnim ležištima. Konačno, prirodna ležišta bit će iscrpljena. U otpadnim TP (tiskanim pločicama) može se naći do 54 različita metala. Najzastupljeniji metal u otpadnim TP je bakar (od 16,00 % do 34,45 %), a najvrednije komponente TP sadržavaju plemenite metale: Ag, Au, Pa i Pt. Maseni udio zlata u otpadnim TP je također višestruko veći nego u rudama, a podaci o udjelu kreću se u vrlo širokom rasponu. Zbog sadržaja Pb, Zn, Ni, Sb, Mn, Mg, Bi, Cr, Cd, Ba, As, Be i Hg te spojeva na bazi broma otpadne TP svrstavaju se u opasni otpad.
Ponovimo
· Ionskom vezom povezuju se elementi lijeve strane periodnog sustava, metali, s elementima desne strane, nemetalima.
· Ionska veza nastaje samo ako su produkti kemijske reakcije na nižoj energijskoj razini od reaktanata.
· Radijus kationa elementa uvijek je manji od radijusa njegova atoma.
· Radijus aniona uvijek je veći od radijusa pripadnog atoma.
· Unutar iste skupine PSE radijusi iona povećavaju se odozgo prema dolje.
· Izoelektronski ioni sadržavaju isti broj elektrona (npr. K+ i Cl−).
· U kovalentnim spojevima atomi se povezuju elektronskim parovima. Svaki zajednički elektronski par čini jednu kovalentnu vezu.
· Kada se atomi vezuju jednim elektronskim parom, kažemo da tvore jednostruke kovalentne veze. Dva zajednička elektronska para - dvostruka kovalentna veza. Tri zajednička elektronska para - trostruka kovalentna veza.
· Usmjerenost kovalentnih veza u molekulama uvjetovana je brojem elektronskih parova oko središnjeg atoma. Zamisli li se da se elektronski parovi nalaze na površini kugle, oni se na njoj razmještaju tako da budu što dalje jedan od drugoga.
· U molekulama fluorovodika, klorovodika, vode i amonijaka zajednički elektronski par više je privučen elektronegativnijem atomu. Zbog toga težišta pozitivnog i negativnog naboja u molekuli ne padaju na isto mjesto, pa je molekula polarna. Na atomu vodika pojavljuje se mali pozitivni, a na atomima halogena, kisika i dušika mali negativni naboj.
· Polarne molekule privlače se elektrostatskim silama. Zato tvari s polarno građenim molekulama imaju relativno visoka tališta i vrelišta.
· U ledu i vodi elektronski oblak nepodijeljenog para elektrona atoma kisika jedne molekule vode djelomično prekriva elektronski oblak atoma vodika iz susjedne molekule. Razmak između atoma kisika iz dviju različitih molekula vode premošten je atomom vodika te je kraći od očekivanog. Kaže se da se molekule vode povezuju vodikovim mostom ili vodikovom vezom. Molekula vode može načiniti dvije vodikove veze jer ima dva nepodijeljena elektronska para.
· U ledu je svaki atom kisika okružen četirima atomima vodika. Dva su atoma vodika vezana kovalentnim vezama s atomom kisika, dok su dva atoma vodika iz susjednih molekula vode vezana vodikovim vezama.
· Zbog vodikovih veza gustoća leda manja je od gustoće vode.
· Vodikova veza je slaba veza, mnogo slabija od kovalentne i ionske veze, ali jača od uobičajenih van der Waalsovih međumolekulskih interakcija.
· Atom vodika iz jedne molekule vode može preskočiti na susjednu molekulu pa tako u vodi i ledu nastaju ioni OH− i H3O+.
Pitanja i zadaci 6
- Što razumijete kad kažete da su dva iona izoelektronska? Navedite bar
jedan primjer.
- Nabrojite sve vama poznate ione koji
su izoelektronski s argonom.
- Koji su ioni izoelektronski s ionom N3−?
- Što razumijete pod pojmom "energija ionizacije atoma"?
- Koji od nabrojenih atoma ima najmanju energiju
ionizacije: Na, F, Li, Cl, Cs, I ?
- Koji atom ili ion u sljedećim skupinama ima najmanju energiju
ionizacije?
a) Li, Na, K, b) P, As, Sb, c) O2−, F−, Ne, d) K+, Ca2+, Sc3+. - Koja skupina elemenata u periodnom sustavu ima najveće energije
ionizacije, a koja najmanje?
- Prva energija ionizacije natrija iznosi 495 kJ mol−1. Izračunajte koja je
najveća valna duljina svjetlosti koja još može ionizirati atome natrija u
plinovitu stanju.
- Napišite formule spojeva koji se sastoje od
sljedećih parova iona:
a) Mg2+ i N3− b) Al3+ i S2− c) Fe2+ i O2− d) Fe3+ i O2− e) Al3+ i F− - Koja od nabrojenih čestica ima najveći radijus:
a) Na+, b) N3−, c) F−, d) Ne?
- Napišite redoslijed kojim se smanjuje radijus
ovih čestica: N, N+, N−, N3−.
- Koja čestica u navedenim parovima ima veći
radijus: a) Li ili F, b) F ili Ne c) Li+ ili He, d) K+
ili Cl−
- Koji atom ili ion u sljedećim skupinama ima najmanji radijus?
a) Li, Na, K. b) P, As, Sb. c) O2−, F−, Ne. d) O+, O, O−. e) K+ , Ca2+, Sc3+. Poredajte nabrojene čestice u niz u kojem se povećava radijus:
a) K, Li, Na, Na+, Li+.
b) Al3+, Na+, Mg2+, Na.
c) Li, Li+, Mg2+, Be2+.
- Koji je od navedenih spojeva najviše ionski: LiI,
CaF2, CsF, LiF?
- Koja od navedenih tvari ne
provodi električnu struju:
a) kruti natrijev klorid,
b)taljevina natrijeva klorida,
c)vodena otopina natrijeva klorida,
d)živa u krutom stanju (ohlađena do −180 °C)?
- Koji je od navedenih procesa
egzoterman:
Ca(s) → Ca(g)
F2(g) → 2F
F(g) + e− → F− (g)
F− − e− → F(g)
Ca(g) − 2e− → Ca2+(g) ?
- Zašto plemeniti plinovi ne čine molekule?
- Općenito je poznato da je topljivost metana u vodi zanemarljiva, a da se amonijak i klorovodik u vodi izvrsno otapaju. Zbog čega je tako?
- Obrazložite zašto molekule vode, amonijaka i metana imaju baš takav oblik.
- Zašto se etanol i voda dobro miješaju stvarajući homogene otopine?
- Obrazložite zašto je vrelište vode više od vrelišta sumporovodika iako je njegova relativna molekulska masa veća od relativne molekulske mase vode.
- Ima li smisla govoriti o molekulama NaCl, NH4Cl, CaO, LiF i LiH? Obrazložite!
- Obrazložite prirodu kemijske veze sljedećih hidrida: NaH, SiH4, PH3, H2S i HCl.
- Polazeći od razlika elektronegativnosti elemenata i građe molekula CCl4, CHCl3, SF6 i ICl odredite kod kojih se molekula mogu očekivati električni dipoli. Gdje se mogu očekivati težišta malog negativnog, a gdje malog pozitivnog naboja?
- Na osnovi podataka o razlikama elektronegativnosti poredajte nabrojene spojeve prema porastu ionskih svojstava veze: CH4, NaCl, HF, KF, HBr.
- Halogeni elementi spajaju se međusobno i čine interhalogene spojeve: ICl, BrCl, BrF. U kojem je spoju veza najpolarnija?
- Zašto plemeniti plinovi ne čine molekule?
7. KRUTINE
Krutine su tvari stalna oblika. U velikoj većini krutina čestice (atomi, molekule, ioni) se slažu na najgušći mogući način i to tako da njihov razmještaj bude strogo uređen na velikoj udaljenosti u sva tri smjera u prostoru. Takav uređeni razmještaj čestica nalazimo u kristalima i nazivamo kristalnom strukturom. Među česticama u krutinama djeluju jake privlačne sile. Čestice su čvrsto vezane na svojim mjestima, ne mogu se kretati neovisno jedna o drugoj pa mogu samo titrati oko ravnotežnog položaja. Zato krutine pružaju otpor svakom pokušaju promjene oblika i volumena.
Gotovo su sve krute tvari kristalaste građe, a to znači da se sastoje od vrlo sitnih kristala nevidljivih golim okom. Pri zagrijavanju kristala i kristalastih krutina čestice u njima titraju sve većom amplitudom. Pritom se povećava prosječan razmak među česticama. To dovodi do porasta volumena krutog uzorka. Kažemo da se zagrijavanjem tvari šire. To može imati čudne posljedice. Krajem srpnja 2018. u Amsterdamu se nije moglo otvoriti 12 mostova radi prolaska brodova. Zbog visokih dnevnih temperatura željezni su se mostovi produžili i zaglavili pa se nisu mogli otvoriti. Vlakovi u Velikoj Britaniji vozili te godine usporeno jer su se željezničke tračnice izdužile i deformirale.
Međuatomski razmaci u krutinama, primjerice u željezu, vrlo se malo mijenjaju povišenjem tlaka. Naime, odbojne sile među atomima nakon neke udaljenosti eksponencijalno rastu. Zato općenito kažemo da su krutine nestlačive. No, u to se opće pravilo ne uklapaju sve tvari, primjerice led. Pri tlaku višem od 20 kbar i temperaturi nižoj od 0 oC voda može postojati čak u 13 različitih kristalnih struktura. Ne postoje jasni dokazi da se kut H-O-H u bilo kojoj od tih struktura leda bitno razlikuje od onog u izoliranoj molekuli vode.
Neke krutine, kao što su stakla, smole i plastične mase imaju nasumičan razmještaj čestica. Za takve tvari kažemo da imaju amorfnu strukturu. Kristalno stanje je pravilo, dok je amorfno stanje iznimka. Među česticama u amorfnim krutinama postoji uređen razmještaj samo na kratkoj udaljenosti, reda veličine samo nekoliko atoma ili molekula. Takvi uređeni dijelovi nasumično su raspoređeni. Razmaci među česticama u amorfnim krutinama nisu svugdje jednaki pa stoga privlačne sile među česticama nisu svuda jednake. Zato pri zagrijavanju amorfne krutine, kao što su stakla, plastične mase, smole ..., postupno omekšavaju dok se potpuno ne rastale.
Slika 7.1. a) Kristal kvarca odlikuje se
strogo uređenim razmještajem tetraedara SiO4. b) Shematski prikaz
uređenog razmještaja tetraedara SiO4 u kristalnim strukturama nekih
minerala. c) Nasumičan razmještaj tetraedara SiO4 u kvarcnom i
običnom staklu.
Slike b) i c) izvor: www.quora.com/What-type-of-atomic-structure-is-glass
7.1. Morfološka svojstva kristala
U školskim ili muzejskim zbirkama mogu se vidjeti prekrasni primjerci prirodnih kristala mnogih tvari. Među njima se ističu prozirni kristali kvarca, SiO2, zlatnožuti kristali pirita, FeS2, tamnosivi kristali galenita, PbS, sfalerita, ZnS, i raznobojni kristali fluorita, CaF2. Pogledate li pažljivo kristale galenita i pirita, uočit ćete da imaju formu (oblik) kocke. Na kristalima kvarca mogu se zamijetiti plohe koje odgovaraju plohama heksagonske prizme. Promatranjem kristala drugih tvari našli biste plohe drugih geometrijskih tijela, oktaedra, tetraedra, kvadratne prizme, piramide i dr.
Prijelomno otkriće u kristalografiji načinio je 1669. danski znanstvenik Niels Stensen bolje poznat po latiniziranom imenu Nicolaus Stenonius (1638. - 1686.). On je uočio da su svi kutovi među odgovarajućim plohama kristala kvarca uvijek jednaki, neovisno o veličini, obliku i podrijetlu kristala.
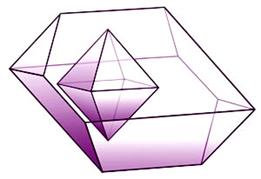
Slika 7.2. Idealna i razvučena forma oktaedra. Stenoov zakon: Kutovi među plohama jedne te iste tvari uvijek su jednaki.
Na osnovi Stenoova zakona lako se može izmijeniti vanjsko lice kristala tako da se plohe pomiču paralelno same sebi. Na slici 7.2. prikazan je pravilan oktaedar iz kojega nastaje razvučeni kristal. Obratno, od razvučenog kristala nastat će pravilan oblik kristala ako se paralelnim pomicanjem sve istovrsne plohe učine jednako velikima. Opću vrijednost zakona stalnosti kutova među plohama kristala dokazao je 1772. francuski mineralog Jean-Baptiste Louis Romé de L'Isle 1736. - 1790.). Kristali nađeni u prirodi rijetko imaju idealnu formu, no kutovi među plohama uvijek su isti.
Osnovno svojstavo kristala je simetrija (grč. symmetria = pravi razmjer). Karakteristično svojstvo simetričnih tijela ili likova je ponavljanje iste slike pošto se na tijelo primijeni operacija elementa simetrije. Na kristalima, i drugim tijelima, mogu se uočiti sljedeći elementi simetrije:
Ravnina simetrije. Kristal ima ravninu simetrije ako se može zamišljenom ravninom podijeliti na dvije polovine koje se odnose kao predmet i slika u zrcalu. Takvo preslikavanje u zamišljenoj ravnini zove se operacija ravnine simetrije. Ravnina simetrije uvijek je paralelna s nekom opaženom ili mogućom plohom na kristalu. Na kristalu može biti više ravnina simetrije, ali ima kristala bez ravnine simetrije.
Os simetrije. Kristal ima os simetrije ako se rotacijom oko zamišljenog pravca za kut 2p/n (n = 2, 3, 4, 6) pojave istovrsne plohe, bridovi i vrhovi kakvi se vide na kristalu u položaju prije rotacije. Pravac oko kojega treba kristal zarotirati zove se os simetrije. Os oko koje kristal treba zarotirati za 180° (=2p/2) da bi se pojavio isti oblik zove se digonska os simetrije (grč. dyo = dva + gony = kut), ili digira (grč. gyros = krug) ili os drugoga reda. Trigonska os simetrije, trigira ili os trećega reda, pojavljuje se na onim kristalima kod kojih se nakon rotacije od 120° (=2p/3) ponavlja istovrsni razmještaj ploha, bridova i vrhova, tri puta pri rotaciji za 360°. Na kristalima se još pojavljuju tetragire i heksagire (grč. tettares = četiri, hex = šest). Važno je zapamtiti da se kod kristala ne pojavljuju osi petoga reda ni osi višeg reda od šestoga.

Slika 7.3. a) Ravnina simetrije dijeli kristal na zrcalno
jednake dijelove. Na slici se vidi kristal pirita, FeS2, koji kristalizira u kubnom
kristalnom sustavu. Uzmite ili načinite kocku te na njoj pronađite sve elemente
simetrije. Koliko kocka ima zrcalnih ravnina te osi četvrtoga, trećega, i
drugoga reda? b) Beril, Be₃Al₂[Si₆O₁₈], kristalizira u heksagonskom sustavu. Uzmite ili
načinite heksagonsku prizmu i na njoj pronađite osi i ravnine simetrije.
Slika a) izvor:menteetmalleo.eu/piryt-duzy-krysztal-hiszpania
Slika b) izvor: www.pinterest.com
Centar simetrije. Kristal ima centar simetrije kada svakoj plohi kristala odgovara paralelna ploha na suprotnoj strani kristala. Kod kristala s takvim plohama može se zamisliti jedna točka u centru kristala, koju nazivamo centrom simetrije, i kroz koju se preslikavaju plohe kristala. To znači da svaka točka na površini ili u unutrašnjosti kristala ima svoj centrosimetrični par na jednakoj udaljenosti, ali u suprotnom smjeru od centra simetrije. Centar simetrije je i geometrijski centar kristala, ali geometrijski centar ne mora uvijek biti centar simetrije. Centar kocke ujedno je i centar simetrije, no tetraedar ima geometrijski centar, a to je težište tetraedra, ali nema centar simetrije jer na tetraedru nema nasuprotno postavljenih paralelnih ploha.
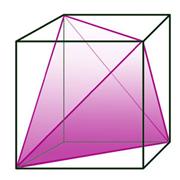
Slika 7.4. Načinite model tetraedra i na njemu pronađite sve elemente simetrije. Koliko ima ravnina i osi, kojega su reda i kojim smjerom prolaze? Usporedite elemente simetrije kocke i tetraedra.
POKUS 7.1. Rast kristala
Pribor i kemikalije: 2 staklenke za konzerviranje voća od 400 mL,
lijevak za filtriranje, filtrirni papir, vazelin, drveni štapić od sladoleda,
limunska kiselina, kalijeva ili kromova stipsa.
Vidi na internetu: www.youtube.com/watch?v=GH2fWrZfB3Y
doi.org/10.15255/KUI.2019.025

Slika 7.5. a) Kristal kromove stipse. b) Epitaksijalni rast aluminijeve stipse na kristalu od kromove stipse. Kromova i aluminijeva stipsa su izostrukturne i izomorfne.
Kalijeva i kromova stipsa imaju analogan kemijski sastav. Kristaliziraju u kubnom kristalnom sustavu u formi oktaedra. Kristalne strukture su im jednake. Načini li se smjesa kalijeve i kromove stipse, iz otopine će kristalizirati kristali koji sadržavaju ione Al3+ i Cr3+ u istom omjeru u kojemu su se nalazili u otopini. Kaže se da je nastala izomorfna zamjena iona Al3+ ionima Cr3+. Ti se ioni u kristalima stipse mogu međusobno zamjenjivati u bilo kojem omjeru. Kako su kristali kromove stipse tamnoljubičaste boje, a kristali kalijeve stipse bezbojni, to se izomorfnom zamjenom mogu dobiti kristali svakog intenziteta ljubičaste boje. Ako se kristal kromove stipse uroni u zasićenu otopinu kalijeve stipse, ili obratno, rast kristala će se nastaviti. Tako se mogu dobiti kristali izgrađeni od naizmjeničnih obojenih i bezbojnih slojeva.
7.2. Struktura ili unutarnja građa kristala
Vidi na Internetu:
www.youtube.com/e-kemija/Kristali
Kristal je uvijek omeđen plohama. O položaju ploha na kristalu ovisi njegov oblik. Postavlja se pitanje je li položaj ploha na kristalu slučajan ili se pokorava određenim pravilima? Francuski mineralog, opat Rene Just Haüy (1743. - 1822.), već je 1781. godine došao na misao da pravilne geometrijske oblike kristala objasni njihovom pravilnom unutarnjom građom. Zamišljao je da su kristali građeni od vrlo malih čestica, molekula, kojima je pripisao formu (oblik) paralelopipeda. Slažući paralelopipede poput cigala mogao je izgraditi bilo koju pravilnu geometrijsku formu kristala. Haüyeva teorija je potaknula razvoj kristalografije. Godine 1813. engleski kemičar i fizičar William Hyde Wollaston (1766. - 1826.) predložio je da se Haüyeve poliedarske molekule zamijene kuglicama, tj. matematičkim točkama. Na osnovi toga stvorena je predodžba o unutarnjoj građi kristala kao sređenom trodimenzijskom razmještaju istovrsnih čestica, atoma, iona ili molekula. Istovrsne čestice u kristalu leže na pravcima, uvijek na jednakoj udaljenosti jedna od druge.
Sigurno ste imali priliku vidjeti različite vrpce ili trake s izvezenim ili otisnutim motivima. Ako ste bolje pogledali, mogli ste uočiti da se na vrpci motiv periodički ponavlja svakih nekoliko centimetara ili milimetara. Da biste shvatili izgled vrpce, dovoljno je proučiti samo osnovni motiv. Na dekoriranom platnu ili papiru, ili na podu od dekoriranih keramičkih pločica možete uočiti dva smjera u kojima se motiv periodički ponavlja.
Kristali su trodimenzijske tvorevine pa se u njima isti razmještaj atoma, iona ili molekula periodički ponavlja u sva tri smjera u prostoru. Zakonitost tog periodičkog ponavljanja opisuje se kristalnom rešetkom. Kristalna rešetka je zamišljena beskonačna tvorevina u kojoj se polazeći iz bilo koje točke u istu takvu točku u prostoru može doći translacijom uzduž određenih smjerova (lat. translatio = prijenos). Da bismo jednoznačno definirali kristalnu rešetku, moramo znati smjer kojim se razmještaj periodički ponavlja i udaljenost nakon koje se u tom smjeru dolazi u istovrsnu točku. Taj se smjer zove os translacije ili os kristalne rešetke, a udaljenost period kristalne rešetke. Tri smjera translacije u prostoru, tri osi kristalne rešetke, označavaju se slovima a, b, c, a kutove što ih međusobno zatvaraju osi označavaju se grčkim slovima alfa, beta i gama.
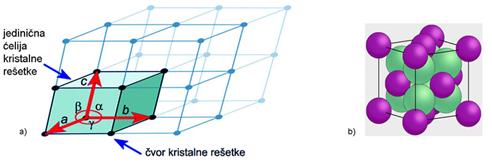
Slika 7.6. a) Shematski prikaz kristalne rešetke: debljim crtama označena je jedinična ćelija. Crvene strelice prikazuje dogovoreni način označavanja osi i kutova u jediničnoj ćeliji kristalne rešetke. b) Jedinična ćelija kristalne strukture fluorita, CaF2.
Kristalnu strukturu kemijskog elementa ili spoja dobivamo tako da svakoj točki kristalne rešetke pridružimo atom, ion ili molekulu. Dakle, kristalnom rešetkom opisujemo zakonitost po kojoj se razmještaj atoma, iona ili molekula periodički ponavlja u prostoru. Primjerice, na vrpci i dekoriranom papiru može se uočiti najmanji dio (motiv) koji se periodički ponavlja. U kristalnoj strukturi bilo koje tvari može se također naći najmanji dio (volumen) koji se periodički ponavlja u tri smjera u prostoru uzduž osi kristalne rešetke. To je jedinična ćelija kristalne strukture. Jedinične ćelije kristalnih struktura različitih tvari razlikuju se. Osi mogu biti različite duljine i ne moraju uvijek zatvarati kutove od 90°. Sve poznate i uopće moguće kristalne rešetke mogu se svrstati u sedam kristalnih sustava.
|
Kristalni sustav |
Osi |
Kutovi |
|
Kubni |
a = b = c |
a = b = g = 90o |
|
Tetragonski |
a = b ≠ c |
a = b = g = 90o |
|
Rompski |
a ≠ b ≠ c |
a = b = g = 90o |
|
Heksagonski |
a = b ≠ c |
a = b = 90o g = 120o |
|
Trigonski |
a = b = c |
a = b = g ≠ 90o |
|
Monoklinski |
a ≠ b ≠ c |
a = g = 90o b ≠ 90o |
|
Triklinski |
a ≠ b ≠ c |
a ≠ b ≠ g ≠ 90o |
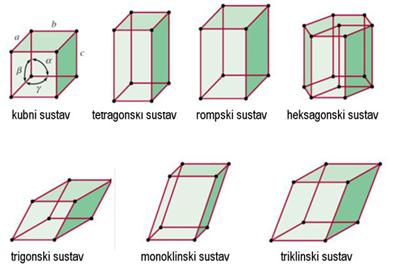
Slika 7.7. Sedam kristalnih sustava međusobno se razlikuje
duljinom osi i kutovima među osima
7.3. Alotropija i polimorfija
Neki kemijski elementi i mnogi kemijski spojevi kristaliziraju pri različitoj temperaturi i tlaku u različitim kristalnim sustavima. Primjerice, ugljik se javlja u formi dijamanta i grafita, fosfor u obliku bijelog, crvenog i crnog fosfora, kositar kao bijeli i sivi kositar. Dva ili više oblika istoga kemijskog elementa koji se razlikuju po načinu međusobnog vezivanja atoma nazivaju se alotropima (grč. allos = drugi + tropos = način). Zbog različitih kemijskih veza alotropi imaju različita fizička i kemijska svojstva. Dijamant je proziran i najtvrđa je tvar u prirodi, dok je grafit crn i mekan. Bijeli fosfor sam se od sebe zapali na zraku, dok je crveni fosfor stabilan (nalazi se kao crvenosmeđi premaz na kutijama žigica). Kisik se pojavljuje u dvije alotropske modifikacije, u obliku dvoatomnih molekula, O2, i troatomnih molekula, O3, kao ozon. Kositar je pri sobnoj i višim temperaturama tipičan metal ("bijeli kositar"). Ako ga se ohladi ispod 13,2 °C, pretvorit će se u sivi prah, najbrže pri -48 oC. U sivom kositru atomi su vezani kovalentnim vezama na jednak način kao u dijamantu. Dijamant i grafit, bijeli i sivi kositar, kisik i ozon, tipični su primjeri alotropa. Alotropija se odnosi samo na elementarne tvari.
No drugi je slučaj s rompskim i monoklinskim sumporom. Ako se otopina sumpora u ugljikovu disulfidu, CS2, pri sobnoj temperaturi pusti polako isparavati, sumpor će se izlučiti u formi rompskih kristala. No, ako se talina sumpora hladi, pri temperaturi od 115 °C sumpor se kristalizira u vidu igličastih monoklinskih kristala. To se može pokazati tako da se talina sumpora pusti hladiti u lončiću dok se na površini ne uhvati kora. Kad se kora probije a zaostali tekući sumpor izlije, na stijenkama lončića ostaju igličasti monoklinski kristali sumpora.
Obje vrste kristala,
rompskog i monoklinskog sumpora sastoje se od jednakih S8 molekula
u kojima su atomi sumpora povezani jednakim kovalentnim vezama. U rompskom i
monoklinskom sumporu iste su molekule složene na različit način. No, jesu li
rompski i monoklinski sumpor alotropi? Odgovor je: ne. Rompski i monoklinski
sumpor su polimorfi jer su izgrađeni od jednakih molekula S8.
Monoklinski kristali sumpora pri sobnoj su temperaturi nestabilni te
rekristaliziraju u rompski sumpor. Od prvotnog monoklinskog monokristala
sumpora nastaje mnoštvo sitnih rompskih kristalića različite orijentacije.
Pritom iglice zadržavaju prvotni oblik, no izgube sjaj.
Vidi na Internetu: www.youtube.com/watch?v=BTN0ZFhbraA
Pojava da se isti kemijski spoj pojavljuje u više kristalnih modifikacija zove se polimorfija (grč. poly = mnogo, morfe = oblik). Pri prijelazu iz jedne modifikacije u drugu mijenjaju se i fizička svojstva tvari, poput boje, električne provodnosti ili kristalne strukture.
POKUS 7.2. Polimorfija
Pribor i kemikalije: epruveta, plamenik, živin(II) jodid
Postupak
1. Pažljivo zagrijavajte u epruveti malo crvenoga živina(II) jodida, HgI2, tek toliko da opazite promjenu crvene boje u žutu.
2. Pustite da se epruveta ohladi. Nakon nekog vremena žuta boja živina(II) jodida promijenit će se opet u crvenu.

Slika 7.8. Polimorfija živina(II) jodida: a) živin(II) jodid pri sobnoj temperaturi crvene je boje, b) ugrijan na temperaturu višu od 127 °C postaje žut
Crveni živin(II) jodid kristalizira u tetragonskom sustavu. Zagrijan na temperaturu višu od 127 °C prelazi u žuti živin(II) jodid. Žuta modifikacija kristalizira u rompskom sustavu. Kad se epruveta ohladi, nakon duljeg stajanja, rompska modifikacija živina(II) jodida rekristalizira u tetragonsku modifikaciju što se očituje promjenom boje iz žute u crvenu.
Prijelaz iz jedne kristalne modifikacije u drugu uzrok je i promjene boje olovova(II) jodida, PbI2. Pri sobnoj temperaturi njegovi su kristali žuti, pri 230 °C postaju crvenonarančasti, pri 250 °C crveni, a pri 360 °C crvenoljubičasti. Nakon hlađenja kristali poprimaju prvotnu žutu boju.
Živin(II) jodid i olovov(II) jodid, kao i druge slične tvari, služe kao indikatori temperature. Ako se predmet koji se zagrijava premaže pogodnim indikatorom temperature, pokazuje različite boje na različito ugrijanim mjestima.
Opaska: Pokuse uvijek izvodite s manjim količinama tvari, najviše 0,1 do 0,2 g. Pazite! Spojevi žive i olova su otrovni. Najbolje je vrlo malo jednoga ili drugoga jodida zataliti u dugačku ampulu. Pažljivim zagrijavanjem uzorka na dnu ampule lako se uoči promjena boje, a da nema opasnosti od onečišćenja živom ili olovom. Jednom pripremljeni uzorak može se nebrojno puta iskoristiti za demonstraciju polimorfije.
7.4. Difrakcija rendgenskih zraka na kristalima
U doba kada su rendgenske zrake otkrivene, 1895. godine, nije se znalo jesu li one valne ili korpuskularne prirode (lat. corpusculum = tjelešce, čestica). Pokušaji dokazivanja njihove valne prirode nisu uspijevali jer se mehaničkim postupkom nije mogla načiniti optička mrežica na kojoj bi se pokazao ogib rendgenskih zraka.
Paul P. Ewald (1888. - 1985.) radio je 1911. na matematičkoj interpretaciji prolaza svjetlosti kroz kristale, za koje se već slutilo da imaju strogo uređen razmještaj čestica. U siječnju 1912. tijekom šetnje Englischerom Gartenom u Münchenu, govorio je Maxu von Laueu o svom doktorskom radu. Max von Laue (1879. - 1960.), tada privatni docent na Sveučilištu u Münchenu, zapitao je Ewalda što bi se dogodilo ako bi valna duljina svjetlosti bila manja od razmaka atoma, a ne mnogo veća, kao što je slučaj s vidljivim svjetlom. U tom je trenutku von Laue shvatio da bi taj uvjet mogle zadovoljiti rendgenske zrake. U neformalnoj raspravi W. Friedrich, u to doba asistent teorijskog fizičara Sommerfelda, ponudio se da načini eksperiment. Slika 7.9. shematski prikazuje uređaj koji su 1912. načinili Walter Friedrich i student Paul Knipping. Prvi su pokus izveli s kristalom modre galice, CuSO4 · 5H2O, te dokazali da kristali mogu poslužiti kao optičke mrežice za difrakciju rendgenskih zraka. Kada su paralelni snop rendgenskih zraka usmjerili okomito na plohu kocke kristala sfalerita (ZnS), na fotografskom filmu iza kristala dobili su nakon razvijanja simetričan skup zacrnjenih mrlja. Difrakcijska slika imala je os četvrtoga reda, baš kao i kristal sfalerita. Von Laue je tu pojavu objasnio difrakcijom valova na pravilno uređenom razmještaju atoma cinka i sumpora u kristalu. To su bili prvi eksperimentalni dokazi o valnoj prirodi rendgenskih zraka i uređenom razmještaju atoma, iona ili molekula u kristalima.
Slika 7.9. a) Shematski prikaz pokusa koji su 1912.
načinili W. Friedrich i Röntgenov student P. Knipping. b) Prvu uspješnu difrakcijsku sliku Friedrich i Knipping načinili su 23.
travnja 1912.
Izvor: www.iucr.org
Na slici 7.6 a. shematski smo prikazali kristalnu rešetku. Već smo naglasili da kristalnom rešetkom opisujemo zakonitost po kojoj se razmještaj istovrsnih točaka (atoma, iona, molekula) periodički ponavlja u prostoru, i to u tri smjera, koje smo nazvali kristalografskim osima. Ako kristalnu rešetku prikazanu na slici 7.6a. projiciramo tako da jedna od osi rešetke bude okomita na ravninu papira, sve će se točke (atomi) koje leže na toj osi projicirati kao jedna točka. Rešetku projiciranu u dvije dimenzije prikazuje slika 7.10. Kroz kristalnu rešetku može se položiti niz zamišljenih mrežnih ravnina tako da sve ravnine sadržavaju jednake točke (atome). Ako su te zamišljene ravnine paralelne s osi projekcije, one će se projicirati kao paralelni pravci s konstantnim razmakom. Takav niz mrežnih ravnina, u kojima leže istovrsni atomi u kristalu, nazivamo familija mrežnih ravnina.
Slika 7.10. Kristalna rešetka projicirana uzduž osi okomite na ravninu papira. Familije mrežnih ravnina paralelne s osi projekcije projiciraju se kao familije pravaca s konstantnim razmakom među njima.
Na sjednici Cambridge Philosophical Society 11. studenoga 1912. William Lawrence Bragg (1890. - 1971.) objasnio je Laueov eksperiment kao "refleksiju" rendgenskih zraka na skupu paralelnih mrežnih ravnina zaposjednutih atomima. Mrežne ravnine ponašaju se kao polupropustljiva zrcala. Na svakom sloju "reflektira" se dio rendgenskih zraka pod kutom koji je jednak kutu upada kao što je prikazano na slici 7.11.
Slika 7.11. Dvije paralelne zrake 1 i 2 padaju na skup mrežnih ravnina kristala pod kutom q. Razmak između mrežnih ravnina je dhkl. Zraka 2 prijeđe dulji put od zrake 1 i to za BC + CD. Kad je razlika duljine puta jednaka cjelobrojnom višekratniku valne duljine upadnih zraka, “reflektirane” su zrake u fazi pa dolazi do konstruktivne interferencije. Kut “refleksije” tad je jednak upadnom kutu. Naravno, refleksije nema. To je samo najjednostavniji opis difrakcije rendgenskih zraka na elektronima atoma koji leže u mrežnim ravninama.
Iz pokusa o ogibu i interferenciji svjetlosti poznato nam je da se svjetlost gasi ako valovi nisu u fazi. Svjetlost će se interferencijom valova pojačati kad su valovi, koji dolaze iz dva izvora, u fazi. Isto je i kod rendgenskih zraka. Difrakcijski maksimum pojavit će se samo kad razlika puta zraka "reflektiranih" na familiji mrežnih ravnina bude jednaka cijelom broju njihovih valnih duljina. Iz slike 7.11. vidi se da je taj uvjet ispunjen kad je nl = 2d sinq.
Intenziteti difrakcijskih maksimuma koji se dobivaju od različitih familija mrežnih ravnina u kristalu razlikuju se. Oni uglavnom ovise o broju i vrsti atoma koji leže u mrežnim ravninama. Danas raspolažemo automatskim četverokružnim difraktometrima kojima na kristaliću veličine 0,1 mm možemo izmjeriti parametre kristalne rešetke (osi i kutovi) te intenzitete difrakcijskih maksimuma na velikom broju familija mrežnih ravnina. Pomoću dobivenih intenziteta difrakcijskih maksimuma, putem složenog matematičkog postupka, izračunava se raspodjela (mapa) elektronske gustoće u jediničnoj ćeliji kristalne rešetke. Na mjestu gdje je elektronska gustoća veća nalazi se "teži" atom, tj. atom većega rednog broja. Iz dobivene mape elektronske gustoće možemo pretpostaviti model molekule, ili, općenitije, kristalnu strukturu spoja. Nakon toga postupamo obratno. Na temelju pretpostavljenog modela izračunavamo intenzitete difrakcijskih maksimuma. Kada se vrijednosti opaženih i izračunanih intenziteta difrakcijskih maksimuma dobro slažu, pretpostavljeni je model dobar jer prikazuje pravu kristalnu strukturu i građu molekule.
Slika 7.12. Raspodjela elektronske gustoće u ravnini presjeka
kroz molekulu naftalena, C10H8. Linije spajaju
točke jednake elektronske gustoće.
Izvor: journals.iucr.org
Metodom rendgenske strukturne analize dosad su određene
kristalne strukture gotovo milijun spojeva. Rendgenska strukturna analiza
omogućila nam je, primjerice, da doznamo strukturu inzulina,
hormona koji regulira razinu šećera u krvi. Poznavanje te kristalne strukture,
a to znači poznavanje svih duljina veza i valentnih kutova, omogućilo je
sintezu inzulina u laboratoriju. Prvu difrakcijsku sliku inzulina, točnije
intenzitete "refleksa" od mnoštva skupova mrežnih ravnina (hkl),
izmjerila je Dorothy
Hodgkin (1910. – 1994.) još 1935. godine. Tek su joj
kompjutori, koji su se pojavili početkom 1960-ih godina, omogućili da nakon 35
godina rada konačno 1969. godine odredi kristalnu strukturu inzulina. Za
određivanje kristalnih struktura biološki važnih molekula (penicilina, vitamina
B12 i dr.) Dorothy Hodgkin dobila je Nobelovu nagradu za kemiju
1964. godine. Veliki uspjeh rendgenske strukturne analize bilo je otkriće
strukture DNA (deoksiribonukleinske kiseline). Difrakcijske eksperimente izvela
je gotovo zaboravljena Rosalind
Franklin (1920. – 1958.), koja je nažalost prerano preminula
od raka. Kako se Nobelova nagrada ne dodjeljuje posmrtno, nagradu za otkriće
strukture DNA 1962. godine dobili su James Watson, Francis Crick i Maurice
Wilkins. Wilkins je bio suradnik R. Franklin koji je bez njezina znanja
konkurentskom dvojcu Crick-Watson prenosio informacije o njezinim
istraživanjima. Doznajte više na:
www.hazu.hr/kristalografi
Najvećim uspjehom kristalografije u posljednje vrijeme
možemo smatrati otkriće kristalne strukture ribosoma,
staničnih čestica koje sudjeluju u sintezi proteina u
stanicama. Ribosomi se sastoje od dvije podjedinice - velike i male. Prvu
kristalnu strukturu velikoga razlučivanja, 2,4 Å, (1 Å = 10–8
cm) velike (50S) podjedinice ribosoma jednostaničnog organizma (arheje) Haloarcula marismortui objavio
je još 2000. naš znanstvenik Nenad Ban
(r. 1966. – ) sa suradnicima, a 2014. godine objavio je trodimenzijsku strukturu
velike podjedinice svinjskog mitohondrijskog ribosoma. Ribosomi su glavne mete
antibiotika. Poznavanje kristalne strukture bakterijskih i ljudskih ribosoma
omogućuje dizajniranje novih antibiotika koji mogu inhibirati ribosome u
štetnim bakterijama, a da pritom oni u ljudskim stanicama normalno
funkcioniraju.
Doznajte više na: www.sciencedirect.com/
www.science.sciencemag.org)
www.znanostblog.com/otkrivena-detaljna-struktura-mitohondrijskog-ribosoma/
Ponovimo
· Većina krutina je kristalaste građe. Kristalno stanje krutina je pravilo, dok je amorfno stanje iznimka.
· Plohe na kristalima iste tvari uvijek zatvaraju iste kutove bez obzira na veličinu i porijeklo kristala.
· Za kristale je karakterističan visokouređeni razmještaj molekula u tri dimenzije, za razliku od neuređenog razmještaja molekula u amorfnim tvarima, tekućinama i plinovima.
· Zakonitost po kojoj se periodički ponavlja raspored istovrsnih čestica (atoma, iona ili molekula) u prostoru opisuje se kristalnom rešetkom.
· Najmanji dio kristalne rešetke koji se periodički ponavlja u prostoru zove se jedinična ćelija kristalne rešetke.
· Kristalizirane tvari mogu biti izgrađene od atoma, iona i molekula.
· Kristali izgrađeni od iona zovu se ionski kristali. Privlačna sila između iona suprotnog naboja to je veća što je njihov naboj veći, a razmak među njima manji.
· Ionski kristali ne provode električnu struju jer su pozitivni i negativni ioni elektrostatski silama međusobno čvrsto vezani.
· Taline tvari ionske građe provode električnu struju jer su u talini ioni pokretljivi poput drugih čestice u svakoj tekućini.
· Kristali s kovalentnim vezama među atomima tvrdi su i krti (dijamant, silicij, germanij i dr.).
· U molekulskim kristalima među molekulama djeluju samo slabe van der Waalsove sile. Zato tvari molekulske građe imaju nisko talište i malu tvrdoću.
· Metali najčešće kristaliziraju tako da se njihovi atomi slažu na najgušći mogući način poput kuglica jednake veličine.
· Metali dobro provode električnu struju jer je oblak delokaliziranih elektrona pokretljiv.
· Pojava da se isti kemijski element pojavljuje u dva ili više oblika koji se razlikuju po načinu vezivanja atoma naziva se alotropija (grč. allos = drugi + tropos = način).
· Pojava da se isti kemijski spoj pojavljuje u više kristalnih oblika zove se polimorfija (grč. poly = mnogo, morfe = oblik).
· Pri prijelazu jedne kristalne modifikacije u drugu mijenjaju se fizička svojstva tvari, poput boje i električne provodnosti.
Pitanja i zadaci 7
- Navedite primjere i obrazložite kakva mehanička
svojstva očekujete od:
a) tvari s ionskim kemijskim vezama,
b) tvari molekulske građe,
c) metala. - Natrijev klorid, NaCl, i litijev fluorid, LiF,
imaju jednaku kristalnu strukturu. Koja će od tih tvari imati najviše talište?
Obrazložite odgovor.
- Proučite kristalnu strukturu natrijeva klorida i
odgovorite:
a) s koliko je iona Na+ okružen svaki ion Cl−?
b) s koliko je iona Cl− okružen svaki ion Na+?
c) jesu li udaljenosti Na+ - Na+ jednaki ili različiti od udaljenosti Cl− - Cl−?- Brid jedinične ćelije magnezijeva oksida iznosi a = 420,7 pm. Izračunajte gustoću magnezijeva oksida. Kristalna struktura magnezijeva oksida jednaka je kristalnoj strukturi natrijeva klorida.
- Hoće li tališta plemenitih plinova rasti ili padati u nizu od helija do ksenona?
- Usporedite elektronske konfiguracije parova iona: F− i O2−, Cl− i S2−, Br− i Se2−. Poredajte navedene ione po rastućem radijusu. Obrazložite poredak.
- Ioni u natrijevu fluoridu i magnezijevu oksidu imaju jednake elektronske konfiguracije. Kristalne strukture su im jednake. Obrazložite zašto je talište natrijeva fluorida 997 °C, a magnezijeva oksida čak 2 640 °C.
- Kalcit kristalizira u formi romboedra. Načinite žičani model kocke pa ga rastegnite smjerom prostorne dijagonale. Tako ćete dobiti romboedar sličan jediničnoj ćeliji kalcita. Gdje ćete smjestiti karbonatne ione u jediničnoj ćeliji?
- Obrazložite zašto se kristali soli razmrve udarcem čekića, a kristali metala se deformiraju.
- Kakva sve svojstva očekujete od: a) tvari s ionskom kristalnom strukturom, b) tvari s metalnom kristalnom strukturom, c) tvari s molekulskom kristalnom strukturom, d) tvari s kovalentnom kristalnom strukturom. Navedite primjere.
- Po čemu se razlikuju amorfne krutine od kristaliziranih krutina?
- Kristalna rešetka natrija je prostorno centrirana kocka. Koliko atoma natrija sadržava jedinična ćelija kristalne strukture natrija?
- Natrij kristalizira po tipu BCC rešetke. Gustoća natrija je 0,97 g/mL. Iz gustoće natrija i Avogadrova broja izračunajte duljinu brida jedinične ćelije kristalne strukture natrija. Iz toga izračunajte radijus atoma natrija.
- Brid jedinične ćelije magnezijeva oksida iznosi a = 420,7 pm. Izračunajte gustoću magnezijeva oksida. Kristalna struktura magnezijeva oksida jednaka je kristalnoj strukturi natrijeva klorida.
8. PROMJENE AGREGACIJSKIH STANJA TVARI
Vidi na Internetu:
www.azoo.hr/Gradja_tvari
Ovisno o temperaturi i tlaku iste se tvari mogu pojaviti u više agregacijskih stanja (lat. aggregare = pridružiti). Ne treba posebno dokazivati da su led, voda i vodena para jedna te ista tvar - no agregacijska stanja su različita. Prema agregacijskom stanju dijelimo tvari na krutine, tekućine i plinove. Pri proučavanju kemijskih reakcija treba počesto znati i agregacijska stanja tvari koje u kemijskoj reakciji sudjeluju ili nastaju. Stoga se kruto stanje tvari u kemijskoj reakciji označava znakom (s), što dolazi od latinskoga solidus = krut, tekuće znakom (l), koje potječe od latinskoga liquidus = tekući, a plinovito znakom (g), što potječe od riječi gas = plin. Riječ gas izmislio je belgijski liječnik i kemičar Jan Baptist van Helmont (1584. - 1644.) polazeći od grčke riječi chaos = nered. Tako je nesvjesno jednom riječju najbolje opisao stanje čestica tvari u plinovitu stanju. Agregacijska stanja tvari odlikuju se različitim fizičkim svojstvima koja proizlaze iz različitog razmještaja čestica.
Tablica 8.1. Svojstva tvari u različitim agregacijskim stanjima
|
Agregacijsko stanje |
Svojstva |
Primjer |
|
kruto (s) |
stalna masa stalan volumen stalan oblik uređen razmještaj čestica |
kovani novčić dijamant kristal kvarca |
|
tekuće (I) |
stalna masa stalan volumen proizvoljan oblik nasumičan razmještaj čestica |
voda ili bilo koja tekućina poprima oblik posude u kojoj se nalazi |
|
plinovito (g) |
stalna masa proizvoljan oblik nasumičan razmještaj čestica |
volumen plina ovisi o temperaturi i tlaku |
Tvari s kojima se susrećemo svakodnevno, kao što su majoneza, kiselo vrhnje, gel za kosu, kreme za lice, paste za zube i sapuni, teško se mogu uklopiti u jednostavnu sliku o tri agregacijska stanja. U tim se tvarima javljaju potpuno novi fenomeni koji pokazuju da fizička svojstva tvari ovise i o veličini čestica.
Kad se kruta tvar zagrijava svaka čestica počinje titrati većom amplitudom oko svoga ravnotežnog položaja prenoseći time gibanje na susjedne čestice. Energija gibanja čestica zove se kinetička energija. Sve čestice pri tome nemaju jednaku kinetičku energiju. Čas je kinetička energija jedne čestice veća, čas manja, ovisno o tome je li energiju primila od susjedne čestice ili ju je predala. Daljnjim dovođenjem topline povećava se razmak među česticama što u konačnici dovodi do taljenja krutine, prijelaza u tekuće agregacijsko stanje.
Ako se tijekom zagrijavanja krute tvari mjeri njezina temperatura, opaža se da odjednom temperatura prestaje rasti iako se toplina i dalje dovodi. Kada zbog dovođenja topline energija titranja čestice u kristalu postane veća od energije veza koje čestice održavaju na okupu, veze se između čestica naglo kidaju. Kristalna se struktura ruši, tvar prelazi iz krutog u tekuće agregacijsko stanje. Za kidanje veza među česticama u krutinama i rušenje uređene strukture potrebna je energija i zato se unatoč dovođenju topline (energije) temperatura ne povisuje sve dok se sva kruta tvar ne rastali. Uređeni razmještaj čestica zadržava se i u tekućini, ali samo unutar vrlo malih grozdova (klastera, engl. clusters) koji su orijentirani u svim smjerovima i kreću se neovisno jedan o drugome.
Toplina koju je pri temperaturi tališta i normalnom tlaku potrebno dovesti jednom molu krute tvari za prijelaz krutine u tekućinu naziva se molarna entalpija taljenja, DHfuss. Jednaka se količina topline oslobodi pri skrućivanju jednog mola iste tvari. Primjerice, molarna entalpija taljenja leda iznosi: ΔHfuss(H2O,273.15 K) = 6009 J/mol, a molarna toplina kristalizacije vode iznosi: ΔHcryst(H2O,273.15 K) = – 6009 J/mol.
Kristali i čiste tvari kristalaste građe imaju sasvim
određenu temperaturu tališta (engl.
melting point, ili m.p.). Primjerice, pri normalnom atmosferskom
tlaku natrijev klorid tali se pri 801 oC, kvarc pri 1650 oC,
srebro pri 962 oC, bakar pri 1084 oC itd. Ako se talina
čiste tvari polagano hladi, temperatura se postupno snižava sve dok ne dostigne
temperaturu krutišta (engl. freezing
point, ili f.p.).
Temperatura tališta i temperatura krutišta jedna je te ista temperatura.
Tijekom skrućivanja (kristalizacije), oslobađa se toplina i zato se temperatura
ne snižava sve dok sva tvar ne iskristalizira. Toplina koja se oslobađa pri
kristalizaciji jednog mola tvari pri normalnom tlaku naziva se molarna entalpija
kristalizacije. Nakon dovršene kristalizacije uzorak se dalje spontano
hladi. Brzina hlađenja nije stalna, nego ovisi o razlici temperature uzorka i
okoline. Na slici 8.1a. vidi se krivulja hlađenja čistoga olova. Takav oblik
krivulje hlađenja imaju sve čiste tvari.
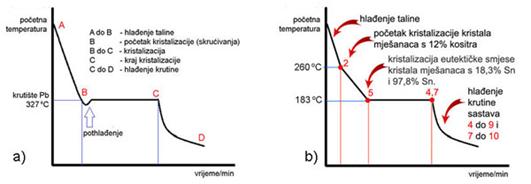
Slika 8.1. a) Krivulja hlađenja čistoga
olova. b) Krivulja hlađenja slitine od 70 % olova i 30 % kositra. Usporedite sa
slikom 8.7. Fazni dijagram sustava olovo - kositar.
Slika 8.1b. prikazuje krivulju hlađenja slitine olova s 30 % kositra.
Sličan oblik krivulje hlađenja imaju sve smjese. Smjese i tvari koje sadržavaju
nečistoće uvijek se tale pri temperaturi nižoj od temperature tališta čistih
tvari. U laboratorijskom radu često se čistoća pripremljenog uzorka nekog spoja
provjerava određivanjem tališta. Talište niže od očekivanog, tj. objavljenog u
stručnoj literaturi, siguran je znak da pripremljeni uzorak spoja nije čist. Temperaturom
tališta može se ispitati i identitet tvari! Čiste se tvari mogu (slučajno)
taliti pri istoj temperaturi, no ako se pomiješaju temperatura tališta će se
sniziti. Tako se nekoć provjeravala struktura organskih spojeva. Pomiješao bi
se naime spoj izloliran iz prirode s onim sintetiziranim u laboratoriju, uz
pretpostavku da imaju istu strukturu.
8.1. Taljenje leda
Čiste tvari pri istom (normalnom) tlaku uvijek se tale pri istoj temperaturi. Tako se led pri normalnom atmosferskom tlaku, p = 101 325 Pa, uvijek tali pri 0 °C. Temperatura pri kojoj kruta tvar prelazi iz krutog u tekuće stanje zove se, talište (engl. melting point, ili m.p.). Obratno, prilikom hlađenja tekućina prelazi u kruto stanje pri istoj temperaturi. Temperatura skrućivanja ili krutište (engl. freezing point, ili f.p.) jednaka je temperaturi taljenja. Tako je talište leda i ledište vode ista temperatura, 0 °C, pri normalnom atmosferskom tlaku. Za taljenje leda potrebno je utrošiti toplinu. Molarna entalpija taljenja leda je relativno mala, DfusH = + 6,01 kJ/mol, u odnosu na molarnu entalpiju isparavanja vode, DvapH = + 40,68 kJ/mol.
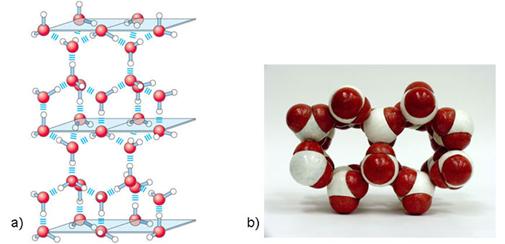
Slika 8.2. a) Kristalna struktura leda. Slika izvor: almerja.com b) Zbog usmjerenih vodikovih veza u strukturi leda nastaju prazni kanali. Zato je gustoća leda manja od gustoće vode.
U ledu je svaka molekula vode četirima vodikovim vezama vezana s četiri susjedne molekule. Kada se zbog zagrijavanja led tali, ruši se geometrijski strogo uređena struktura sa šupljinama i kanalima uzrokovanim usmjerenim vodikovim vezama. Molekule vode oslobođene čvrstog poretka mogu se gušće složiti. Zato ista količina vode nastala taljenjem leda zauzima manji volumen. Gustoća vode je zbog toga veća od gustoće leda, pa led pliva na vodi. U vodi temperature 0 °C svaka je molekula vode još uvijek vodikovim vezama povezana s prosječno 3,7 drugih molekula vode (u ledu taj broj iznosi 4). Pri zagrijavanju vode broj vodikovih veza još se više smanjuje. To znači da se molekule vode slažu gušće, pa gustoća raste. S druge strane, za pojačano gibanje molekula zbog povišenja temperature potrebno je sve više mjesta, pa se volumen vode povećava kao i kod drugih tvari. Zbog te dvije suprotne težnje voda je najgušća pri 4 °C. Činjenica da je gustoća leda manja od gustoće vode i da je pri 4 °C gustoća vode najveća, važna je za život na ZemIji. Kada se voda hladi na temperaturu nižu od 4 °C, na površini se zadržava lakši i hladniji sloj vode koji štiti donji topliji sloj od hlađenja i zamrzavanja. Led koji se stvori na površini vode sprječava pak gubitak topline iz dubljih slojeva. To ribama i drugim živim bićima omogućava da mjesecima žive ispod leda.
Struktura tekuće vode na neki je način slična strukturi
leda. Molekule vode povezuju se vodikovim vezama u klastere (grozdove).
Veličina klastera smanjuje se povišenjem temperature. Pri temperaturi tališta
klasteri sadržavaju oko 90 - 650 molekula vode dok se pri temperaturi vrelišta klasteri
sastoje od samo 25 do 75 molekula. Pri temperaturi vrelišta svaka je molekula
vode još uvijek vodikovim vezama prosječno povezana s tri druge molekule. Klasteri
su u neprekidnom gibanju, molekule vode čas pripadaju jednome čas drugome
klasteru, a vodikove veze se kidaju i ponovo stvaraju.
8.2. Fazni dijagram za vodu
Led, voda i vodena para tri su različite faze iste tvari. Pod fazom se razumije homogeni dio nekog heterogenog sustava odijeljen fizičkom granicom od drugih homogenih dijelova sustava. Faza u svakoj svojoj točki ima isti kemijski sastav i ista fizička svojstva. Bez obzira na isti kemijski sastav leda, vode i vodene pare, to su tri različite faze jer im se fizička svojstva razlikuju.
Fazni dijagram za vodu prikazan je na slici 8.3. Svakoj točki na faznom dijagramu odgovara samo jedna vrijednost tlaka i temperature. Ako se odabere bilo koja točka na dijagramu, okomica spuštena iz te točke na apscisu pokazuje temperaturu, a okomica povučena na ordinatu prikazuje pripadni tlak. Točke na krivuljama koje dijele područja faza pokazuju temperaturu i tlak pri kojima se faze s obje strane krivulje nalaze u ravnoteži.
Slika 8.3. Fazni dijagram za vodu.
Izvor podataka: en.wikipedia.org/Water
U trojnoj točki, pri 0.01 °C, i 600 Pa, led i voda imaju isti tlak para. To znači da su u trojnoj točki u ravnoteži sve tri faze, led, voda i vodena para. Svaka tvar ima samo jednu trojnu točku.
Pri normalnu atmosferskom tlaku, p = 101,325 kPa, talište leda (ili ledište vode) je pri 0 °C. Porastom temperature tlak para vode raste te je pri 100 °C jednak atmosferskom tlaku. Zato se temperatura od 100 °C uzima kao vrelište vode.
Ako se voda grije u čvrsto zatvorenoj posudi ona neće proključati. U posudi postepeno raste tlak i gustoća vodene pare jer se sve više molekula nalazi u parovitoj fazi. Pri 374 °C gustoća pare jednaka je gustoći vode, dok tlak pare iznosi 22 064 kPa. Pri tim uvjetima iščezava vidljiva granica između tekuće i parovite faze. Temperatura 374 °C, odnosno 647,1 K, zove se kritična temperatura vode, Tc(H2O), a tlak 22 100 kPa kritični tlak vode, Pc(H2O). Iznad 374 °C više nije moguće dobiti vodu u tekućem stanju bez obzira na tlak.
Kada se plin pri temperaturi višoj od kritične temperature i dalje sabija, gustoća mu raste pa se počinje ponašati slično tekućini. To ipak nije prava tekućina jer nema granične površine koja je dijeli od plinovite faze. Nije niti plin zbog velike gustoće. Takvo stanje tvari naziva se superkritični fluid (lat. fluere - teći). Superkritični fluidi (tekućine) danas se rabe kao otapala. Na primjer, superkritični ugljikov dioksid služi za ekstrakciju kofeina pri proizvodnji kave bez kofeina. Ako se kofein ekstrahira organskim otapalom u kavi će uvijek zaostati nepoželjnog i često toksičnog otapala. Ugljikov dioksid nije toksičan i ne zaostaje u kavi nakon ekstrakcije.
Svaka tvar ima svoju kritičnu temperaturu. Iznad nje ne može postojati u tekućem stanju. Poznavanje vrijednosti kritične temperature i tlaka važno je pri radu s komprimiranim plinovima. Kritična temperatura kisika, dušika i argona, tehnološki najvažnijih plinova, je ispod sobne temperature. Zato se ti plinovi transportiraju u čeličnim bocama stlačeni na 150 bara. Kritična temperatura klora, ugljikova dioksida, amonijaka, butana i propana je iznad sobne temperature. Zato se oni komprimirani u bocama pri sobnoj temperaturi nalaze u tekućem stanju. Boce s ukapljenim plinovima ne smiju se izlagati neposrednoj Sunčevoj svjetlosti ili držati blizu izvora topline. Tlak para ukapljenih plinova naglo raste s povišenjem temperature. To može dovesti do eksplozije plinske boce.
8.3. Sublimacija
Sublimacija (lat. sublimare = uzvisiti) je izravan prijelaz krutine u plin bez prethodnog taljenja. Sublimacija se događa pri tlaku i temperaturi nižoj od trojne točke na faznom dijagramu. Lijep primjer sublimacije vidi se na zasniježenim poljima s kojih snijeg nestaje sublimacijom pri vrlo niskim temperaturama, puno nižim od ledišta vode. Takvi uvjeti vladaju i na Marsu, pa stoga tamo, iako vode ima, nema je u tekućem stanju.
Sve tvari, bez obzira jesu li u krutom ili u tekućem agregacijskom stanju, imaju tlak para. Zbog vrlo jakih privlačnih sila među česticama tlak para nekih tvari pri sobnoj temperaturi toliko je malen da ga ne možemo registrirati, kao primjerice kod kuhinjske soli. Pri sobnoj temperaturi tvar će imati visok tlak para ako su privlačne sile među česticama slabe, kao u jodu. Stavimo li u bocu kristaliće joda i bocu hermetički zatvorimo, jod će sublimirati sve dok se u boci ne uspostavi ravnotežni tlak para primjeren danoj temperaturi. U zatvorenoj posudi kristali joda i jodne pare u dinamičkoj su ravnoteži, a to znači da koliko molekula joda s površine kristala pređe u paru, toliko ih se iz pare vrati na površinu kristala.
POKUS 8.1. Sublimacija joda
Pribor i kemikalije: epruveta sa staklenim čepom, čaša s vodom, željezni tronožac, staklokeramička pločica, plamenik, željezni stalak, hvataljka s mufom, jod.
Postupak
1. Složite aparaturu kao na slici 8.6. Stavite u epruvetu malo joda, tek toliko koliko stane na vrh noža.
2. Vodu u koju je uronjena epruveta zagrijte na oko 80 do 90 oC. Uočite ljubičaste pare joda koje se na hladnijim dijelovima epruvete kondenziraju u tamnoljubičaste kristale.
3. Nakon provedenog pokusa epruvetu kristalima joda sačuvajte. Istim se priborom pokus može puno puta ponoviti.
Opaska: Epruvetu s jodom nemojte neposredno zagrijavati plamenom plinskoga plamenika. Talište joda je pri 113,7 oC, pa će se pri takvu načinu zagrijavanja jod rastaliti, a to onda više nije sublimacija nego isparavanje tekućine.

Slika 8.4. Aparatura za pokus sublimacije joda
Često se kao primjer sublimacije izvodi pokus s amonijevim kloridom. Taj pokus nije prikladan jer tijekom zagrijavanja amonijev klorid disocira na amonijak i klorovodik.
NH4Cl(s) → NH3(g) + HCl(g)
Plinovi, NH3(g) i HCl(g), u hladnijem se dijelu epruvete ponovno spajaju u kruti amonijev klorid.
NH3(g) + HCl(g) → NH4Cl(s)
Sublimacija amonijeva klorida može
se izvesti brzo i bezopasno, što je važno pri odabiru učeničkih pokusa. Pod sublimacijom
se inače razumije neposredan prijelaz iz krutine u paru bez razlaganja spoja.
Tako sublimiraju naftalen, kamfor, benzojeva kiselina i mnogi drugi organski
spojevi. Sublimacija se često koristi kao metoda pročišćavanja organskih
spojeva.
Vidi na Internetu: www.youtube.com/watch?v=rcG4sugNd2o
Opaska: Neposredan prijelaz pare u krutinu (kristale) zove se depozicija, a ne desublimacija kao što piše u nekim udžbenicima. Depozicija para na krute površine primjenjuje se u proizvodnji poluvodiča (integrirani krugovi), solarnih ćelija, optičkih pribora (metalizirana stakla naočala), zrcala, zaštitnih prevlaka, dekorativnih prevlaka i dr.
Doznajte više na: en.wikipedia.org/Thin_film_Deposition
en.wikipedia.org/Physical_vapor_deposition
8.4. Fazni dijagram sustava olovo - kositar
Metalima je svojstveno da se u rastaljenom stanju miješaju u svakom omjeru. No, pri hlađenju najčešće kristaliziraju svaki za sebe, ali mogu činiti i kristale mješance. To znači da se u kristalnoj strukturi metala ograničeni broj atoma zamijeni atomima drugog metala. To su zapravo krute otopine o kojima smo već govorili u poglavlju 3.17. No, neki se metali potpuno miješaju i u krutom stanju. Takve su primjerice slitine zlata sa srebrom i bakrom od kojih se izrađuje nakit.
Vratimo se opet na slitine olova s kositrom (vidi sliku 8.1.). Pomoću krivulja hlađenja tih slitina, u kojima se udio kositra postepeno povećava sve do čistog kositra, može se konstruirati fazni dijagram za sustav olovo - kositar. Na primjeru slitine koja sadržava 30% kositra pokušat ćemo naučiti čitati taj i druge fazne dijagrame. Fazni dijagram prikazan na slici 8.5. grafički je prikaz faza koje se pojavljuju u dvokomponentnom sustavu Pb-Sn u ovisnosti o temperaturi i sastavu smjese. Već smo kazali da se pod fazom razumije dio sustava koji u svakoj svojoj točki ima isti kemijski sastav i ista fizička svojstva. Sastav smjese uvijek se prikazuje na apscisi, a temperatura na ordinati. Sve vertikalne linije u faznom dijagramu odnose se na sastav smjese. Sve horizontalne linije u faznom dijagramu linije su iste temperature.
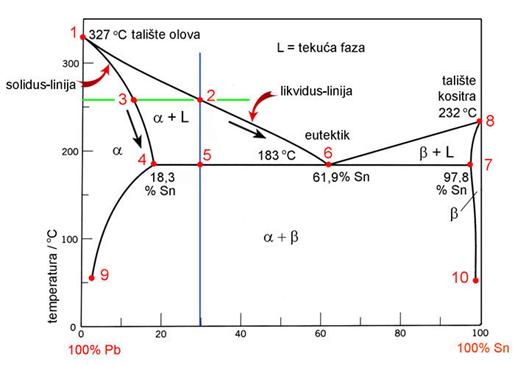
Slika 8.5. Fazni dijagram sustava olovo - kositar
Slika izvor: www.physicsforums.com/sn-pb-phase-diagram
Linija 1-2-6-8 naziva se likvidus-linija (lat: liquidus = tekući) i sve točke iznad te linije predočuju tekuću fazu. Linija 1-3-4-5-6-7-8 je solidus-linija (lat: solidus = tvrd, krut) pa sve točke ispod te linije predočuju krutu fazu.
Područje omeđeno linijama 1-3-4-5-6-2-1 je područje u kojem se u ravnoteži a-kristali i tekuća faza. Područje omeđeno linijama 6-7-8-6-je područje u kojem su u ravnoteži b-kristali i tekuća faza.
Krivulje u faznom dijagramu prikazuju sastav smjese u ravnoteži pri danoj temperaturi.
Točka 6 u faznom dijagramu je trojna točka ili eutektik koja prikazuje ravnotežu između triju faza: tekuće faze (61,9 % Sn), a-kristala (18,3 % Sn) i b-kristala (97,8 % Sn).
Nakon što smo upoznali osnovne postavke dvokomponentnog faznog dijagrama, razmotrimo što se događa tijekom hlađenja taline koja sadržava 70 % olova i 30 % kositra. Slijedite plavu vertikalnu liniju koja prikazuje sastav polazne smjese. Kad se temperatura taline snizi do točke 2 počinje izlučivanje krupnih a-kristala mješanaca olova čiji sastav, oko 13 % kositra, pokazuje točka 3 na solidus-liniji. Točke 2 i 3 leže na istoj, zelenoj liniji temperature. Izlučivanjem kristala mješanaca smanjuje se udio kositra u talini pa se sastav taline mijenja po krivulji 2-6. Istodobno, pri nižoj temperaturi a-kristali s 13 % kositra nisu više u ravnoteži s talinom pa se otapaju, a iz taline kristaliziraju novi krupni a-kristali s većim udjelom kositra. Ukratko, snižavanjem temperature sastav taline mijenja se po krivulji 2-6, a sastav a-kristala istodobno se mijenja po krivulji 3-4.
Kada se temperatura snizi na 183 oC preostala talina, eutektička smjesa sa 61,9 % Sn, kristalizira pri čemu istodobno nastaju sitni kristalići a i b faze. U eutektičkoj točki tri su faze u ravnoteži: tekuća faza koja sadržava 61,9 % Sn, a-kristali sa 18,3 % Sn i b-kristali koji sadržavaju 97,8% Sn. Važno je upamtiti da tijekom kristalizacije eutektičke smjese ne dolazi do sniženja temperature sve dok sva tekuća faza ne iskristalizira. Krivulja hlađenja eutektičke smjese izgleda kao krivulja hlađenja čiste tvari (slika 8.1a.).
No, još nije sve gotovo. Daljnjim sniženjem temperature smanjuje se topljivost kositra u olovu. Zato se unutar krupnih a-kristala olova izlučuju sitni b-kristalići kositra s oko 98 % kositra. Sastav a-kristala mijenja se po krivulji 4-9, dok se sastav b-kristala sniženjem temperature mijenja po krivulji 7-10.
Slitine olova s 10 ili 15 %
kositra nekad su se rabile za spajanje vodovodnih i kanalizacijskih olovnih
cijevi lemljenjem. Danas se olovne cijevi više ne rabe za vodovodne i
kanalizacijske instalacije. Ako su još zaostale u starim zgradama treba ih
zamijeniti suvremenim plastičnim cijevima. Olovo je otrovno. Neki znanstvenici
smatraju da je trovanje olovom jedan od uzroka propasti Rimskog carstva. (Rimljani
su sladili vino tako da su ga kuhali u olovnim posudama. Tako je nastajao
slatki, no otrovni olovov(II) acetat). Slitine s 40 % olova i 60 % kositra rabe
se za lemljenje na tiskanim pločicama.
8.5. Krivulja hlađenja stearinske kiseline
Stearinska ili oktadekanska kiselina, CH3(CH2)16COOH, je zasićena masna kiselina. To je bijeli, zrnasti prah masna opipa, netopljiv u vodi, ali topljiv u organskim otapalima. U obliku estera s glicerolom stearinska se kiselina pojavljuje praktički u svim biljnim i životinjskim mastima. Prvi put je dobivena iz loja (grč. stear - loj), pa joj otuda i potječe ime. Rabi se u proizvodnji deterdženata, sapuna i kozmetičkih proizvoda kao što su šamponi. Osim toga, starinska kiselina ima mnogobrojne primjene u različitim tehnologijama kao aditiv ili sredstvo za podmazivanje.
Ovisno o uvjetima kristalizacije stearinska
kiselina kristalizira u četiri kristalne forme. ![]() -forma
kristalizira u monoklinskom sustavu s parametrima jedinične ćelije: a =
558,7 pm, b = 738,6 pm, c = 4933 pm, b = 117,24o. Na slici 8.7. prikazana je projekcija
uzduž osi b kristalne strukture stearinske kiseline. Za sve je kristalne
forme stearinske kiseline karakteristično da su u kristalu polarne karboksilne
skupine okrenute jedna prema drugoj i međusobno povezane vodikovim vezama O–H∙∙∙O,
duljine 267 pm. Kao što se vidi na slici 8.7., nepolarni ugljikovodični lanci
leže paralelno s osi c, duljine 4933 pm. Odavde proizlazi da je molekula
stearinske kiseline dugačka oko 2500 pm.
-forma
kristalizira u monoklinskom sustavu s parametrima jedinične ćelije: a =
558,7 pm, b = 738,6 pm, c = 4933 pm, b = 117,24o. Na slici 8.7. prikazana je projekcija
uzduž osi b kristalne strukture stearinske kiseline. Za sve je kristalne
forme stearinske kiseline karakteristično da su u kristalu polarne karboksilne
skupine okrenute jedna prema drugoj i međusobno povezane vodikovim vezama O–H∙∙∙O,
duljine 267 pm. Kao što se vidi na slici 8.7., nepolarni ugljikovodični lanci
leže paralelno s osi c, duljine 4933 pm. Odavde proizlazi da je molekula
stearinske kiseline dugačka oko 2500 pm.
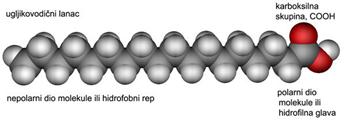
Slika 8.6. Model molekule stearinske kiseline oblikom podsjeća na žigicu. Atomi u molekuli međusobno su vezani kovalentnom vezom. Ugljikovodični lanac čini nepolarni ili hidrofobni dio molekule, dok je karboksila skupina polarne građe te čini hidrofilni dio molekule.
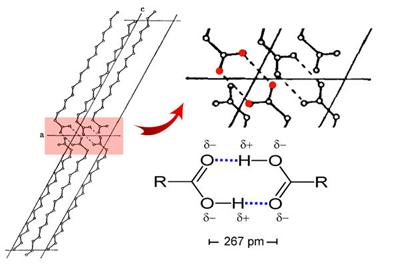
Slika 8.7. U kristalnoj strukturi molekule
stearinske kiseline složene su poput žigica u kutiji. Karboksilne skupine
okrenute su jedna prema drugoj te međusobno povezane vodikovim vezama.
Nepolarni ugljikovodični lanci leže paralelno jedni drugima.
Izvor: Bulletin of the Chemical Society of Japan, Vol 51 (9),
2456-2459 (1978).
Stearinska kiselina najčešće dolazi u smjesi ili je onečišćena palmitinskom kiselinom, CH3(CH2)14COOH. Talište čiste stearinske kiseline je pri 69,6 oC, a palmitinske pri 62,4 oC. Snimite krivulju hlađenja stearinske kiseline na način opisan u pokusu 8.2. Ustanovite je li vaš uzorak čista stearinska kiselina ili smjesa.
POKUS
8.2. Taljenje stearinske kiseline –
krivulja hlađenja
Vidi na Internetu: www.youtube.com/watch?v=yZfeKJWzLN4
www.youtube.com/watch?v=YUWJ2jGhE0M
www.youtube.com/watch?v=vJgBIvuLvgY
www.youtube.com/watch?v=5WVT5NR0iLA
Ponovimo
· Molarna entalpija taljenja je toplina koju treba utrošiti za taljenje jednog mola tvari pri normalnom tlaku.
· Molarna entalpija kristalizacije jest toplina koja se oslobodi pri kristalizaciji jednog mola tvari.
· Faza je dio sustava koji u svakoj svojoj točki ima isti kemijski sastav i ista fizička svojstva. Led, voda i vodena para tri su različite faze iste tvari no različitih fizičkih svojstava.
· Fazni dijagram za vodu je grafički prikaz ravnoteže faza (leda, vode i vodene pare) u ovisnosti o tlaku i temperaturi.
· Dvokomponentni fazni dijagram olovo-kositar je grafički prikaz ravnoteže faza u ovisnosti o sastavu smjese i temperaturi.
· Sublimacija se događa pri tlaku i temperaturi nižoj od trojne točke na faznom dijagramu.
Pitanja i zadaci 8
- Koju temperaturu nazivamo talištem i vrelištem tvari?
- Ovisi li temperatura ledišta i vrelišta o tlaku? Obrazložite to na
primjeru vode. Poslužite se faznim dijagramom.
- Što razumijete pod pojmom trojna točka u faznom dijagramu?
- Pri kojem tlaku i temperaturi može doći do sublimacije leda?
Pogledajte fazni dijagram za vodu.
- Zašto je gustoća leda manja od gustoće vode?
- Može li se iznad kritične temperature povećanjem tlaka dobiti voda u
tekućem stanju?
- Što razumijete pod pojmom kristali mješanci?
9. TEKUĆINE
Iz iskustva znamo da tekućine nemaju stalan oblik nego poprimaju oblik posude u kojoj se nalaze. Površina tekućine u posudi uvijek je ravna. No, pogledate li malo pažljivije mjesto gdje se dotiču površina tekućine i stijenka posude uočit ćete da se neke tekućine "penju" na stijenku dok se druge "odbijaju" od stijenke. Uzrok tomu je napetost površine te sile adhezije i kohezije. Zbog napetosti površine tekućina u bestežinskom stanju poprima oblik kugle jer kugla ima najmanju površinu a time i najmanju energiju površine.
Međuatomski i međumolekulski razmaci u tekućinama vrlo se malo mijenjaju povišenjem tlaka. Tekućine su praktički nestlačive. Zato se rabe u hidrauličkim dizalicama, automobilskim kočnicama, hidrauličnim prešama i drugdje.
Slika 9.1. a) Tekućina uvijek poprima oblik posude. Površina tekućine uvijek je horizontalna. b) Čestice u tekućinama nasumično su raspoređene te se mogu gibati neovisno jedna o drugoj. Čestice koje sudarima dobiju kinetičku energiju veću od energije privlačnih sila prema okolnim česticama napuštaju površinu tekućine i prelaze u plinovito stanje.
9.1. Struktura tekućina
Uređen razmještaj čestica na velikoj udaljenosti temeljno je svojstvo kristala. Kada se kristal rastali uređeni se razmještaj gubi. Uzme li se jednu česticu u tekućini kao ishodišnu, može se zaključiti da je ona u prvom sloju okružena s prosječno istim brojem čestica na prosječno jednakoj udaljenosti kao u kristalu. No, već u drugom sloju koji okružuje ishodišnu česticu broj i međusobna udaljenost čestica znatno odstupaju od vrijednosti u kristalu. To znači da u tekućinama postoji uređen razmještaj čestica na maloj udaljenosti. Uređeni dijelovi međusobno su nasumično raspoređeni i u neprekidnom su kretanju. Čestice mogu pripadati čas jednom, čas drugom uređenom dijelu tekućine. Razmještaj čestica podložan je stalnim promjenama jer među česticama tekućine djeluju slabije privlačne sile nego među česticama u krutinama. Zbog slabijih privlačnih sila tekućine se pri povišenju temperature više rastežu nego krutine. Međumolekulske privlačne sile zajedničkim se imenom zovu van der Waalsovim silama. Prisutne su u svim tvarima i u svim agregacijskim stanjima. To je opće svojstvo tvari (vidi poglavlja 6.15 do 6.17.).
Od svih tekućina najzanimljivija svojstva ima voda jer su
ona posljedica jakih vodikovih veza među molekulama. Jedno od takvih
svojstava jest električna provodnost leda i vode. Vodikovi atomi, ili
točnije protoni, H+, mogu preskočiti s jedne molekule vode na drugu
i tako stvarati privremene ione H3O+ i OH−.
Već u sljedećem trenutku pod djelovanjem električnog polja ion H3O+
preda jedan proton susjednoj molekuli. Istodobno ion OH− može
primiti proton od druge molekule koja time postaje novi ion OH−.
Električni naboj kroz vodu prenose zapravo protoni i to preskakanjem od
molekule na molekulu. Takav način provođenja električne struje naziva se protonska
provodnost. Električna provodnost leda veća je od električne provodnosti tekuće
vode (naravno, ako u njoj nije ništa otopljeno).
9.2. Viskoznost tekućina
Viskoznost je otpor tekućine prema tečenju. Uzrok tomu su međumolekulske sile kojima se molekule tekućine privlače i time opiru smicanju susjednih slojeva. Iz iskustva znamo da su neke tekućine pokretljive, poput alkohola i etera, dok su druge slabije pokretljive, poput motornog ulja ili meda. Uzrok tomu su međumolekulske sile koje česticama u tekućinama onemogućavaju potpunu slobodu kretanja. Kretanje pojedine čestice u tekućini slično je kretanju čovjeka u gomili, primjerice na prepunom trgu ili pri napuštanju stadiona poslije utakmice. Za alkohol i eter kaže se da imaju malu viskoznost dok je viskoznost vode, motornog ulja ili meda veća.
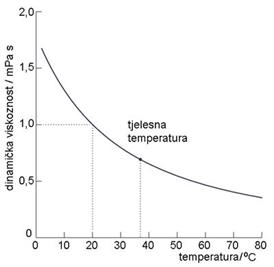
Slika 9.2. Ovisnost viskoznosti vode o temperaturi. Viskoznost tekućine smanjuje se porastom temperature. Izvor: hyperphysics.phy-astr.gsu.edu
Viskoznost tekućine određena je jakošću međumolekulskih sila, kao i oblikom te veličinom molekula. Primjerice, viskoznost vode mnogo je veća od viskoznosti benzena jer među molekulama vode djeluju jake vodikove veze a među molekulama benzena samo slabe van der Waalsove sile. Viskoznost mineralnih ulja, kakva služe za podmazivanje motora i drugih strojeva, ne ovisi samo o jakosti međumolekulskih sila nego i o obliku molekula. Općenito, tekućine čije molekule imaju kuglast oblik imat će manju viskoznost od tekućina s lančastim molekulama. Kako oblik molekula utječe na viskoznost tekućine lijepo pokazuju svojstva sumpora. Neposredno iznad temperature tališta sumpor je lako pokretljiva tekućina, koja se sastoji od prstenastih molekula S8. Viskoznost takve taline sumpora je mala. Zagrijavanjem rastaljena sumpora do oko 200 °C njegova viskoznost postupno raste pa na kraju sumpor ne teče iz preokrenute epruvete. To se događa zato što porastom temperature prstenaste molekule S8 pucaju, a njihovi se dijelovi povezuju u duge, međusobno isprepletene lance (plastični sumpor). Tek kada se sumpor ugrije skoro do temperature vrelišta, viskoznost mu se ponovo smanji jer se dugački lanci kidaju na kraće.
Vidi na Internetu: www.youtube.com/watch?v=Tv0vEoAG1-w
Viskoznost tekućina može se izmjeriti na više načina, a
jedan je mjerenje vremena potrebnog da određeni volumen tekućine isteče kroz
usku cijev. Dobiveno vrijeme podijeli se vremenom potrebnim da kroz istu cijev
isteče jednak volumen vode. Tako se dobije relativna viskoznost tekućine prema
vodi.
9.3. Napetost površine tekućina
Svi dobro znamo kakav je oblik kišnih kapi. Kad ne bi bilo gravitacije i otpora zraka kišne kapi imale bi oblik kugle. Uzrok tome su jake međumolekulske kohezijske sile (lat. cohaerere - držati se jedno drugoga). U unutrašnjosti tekućine na molekulu djeluju jednake sile u svim smjerovima. No, površinu tekućine čini desetak slojeva molekula koje su u ravnoteži s parom i tekućinom, a po svojstvima su negdje između njih. Zato je prosječan razmak između molekula na površini veći nego unutar tekućine, pa među molekulama na površini djeluju privlačne sile paralelne s površinom. Te privlačne sile nastoje smanjiti razmak među molekulama. Zbog toga se javlja površinsku napetost pa tekućina nastoji poprimiti oblik koji će imati najmanju površinu. Sve molekule "hoće" biti u sredini tekućine jer im je tamo potencijalna energija najmanja. Takva svojstva vode posljedica su jakih vodikovih veza među molekulama.
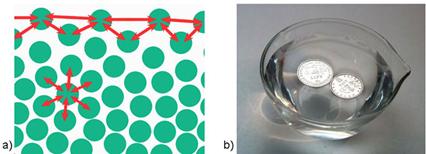
Slika 9.3. a) Shematski prikaz međumolekulskih sila u unutrašnjosti i na površini tekućine. b) Površina tekućine ponaša se poput tanke kožice koja ne dozvoljava da aluminijski novčić ili čelična britvica potonu iako im je gustoća nekoliko puta veća od gustoće vode. Kada se u vodu doda kap deterdženta površinska napetost se smanji pa aluminijski novčić i britvica potonu.
Ako se u vodu uroni kapilara lako je uočiti da je razina vode u njoj viša od razine okolne vode. To se događa zbog adhezijske sile (lat. adhaerere - prianjati) kojom se molekule vode vezuju za površinu stakla. Adhezijske sile, koje uzrokuju da voda kvasi staklo, mnogo su jače od kohezijskih sila koje nastoje povući molekule u unutrašnjost tekućine. Zato je razina vode u kapilari viša od razine okolne vode. Visina do koje će se tekućina popeti u kapilari proporcionalna je napetosti površine, a obrnuto proporcionalna gustoći tekućine. Tekućina u kapilari penje se do visine na kojoj su kapilarna i gravitacijska sila u ravnoteži.

Slika 9.4. a) Površina vode u staklenoj posudi ima meniskus oblika slova U. b) Površina žive u staklenoj posudi ima oblik obrnutog slova U. c) Ako se kapilara uroni u živu može se uočiti da se razina žive u kapilari spustila. To je zato što su kohezijske sile među atomima žive puno jače od adhezijskih sila prema staklu. Napetost površine žive je oko šest puta veća od napetosti površine vode.
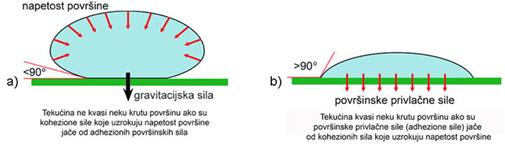
Slika 9.5. Shematski prikaz djelovanja kohezijskih i adhezijskih sila
Napetost površine vode može se smanjiti površinski aktivnim
tvarima, kao što su sapuni i deterdženti. Sapuni su soli viših masnih kiselina,
kao što su oleinska, C16H32O2, i stearinska
kiselina, C18H36O2.
9.4. Tlak para tekućina
Kada se tekućina ostavi na
zraku ona polako sama od sebe isparava. Pri tome se tekućina hladi. Zašto? Zato
što u plinovito stanje mogu prijeći samo čestice tekućine koje se nalaze na
njezinoj površini te u nekom trenutku sudarima s okolnim molekulama nakupe dovoljno
kinetičke energije da mogu svladati privlačne sile okolnih čestica. Pri tome se
prosječna kinetička energija čestica zaostalih u tekućini smanjuje, jer
su u plinovito stanje prešle čestice čija je kinetička energija veća od
prosječne. Zato se isparavanjem tekućina hladi. Što je temperatura tekućine
viša, prosječna je kinetička energija čestica veća, pa će veći broj čestica
moći svladati privlačne sile u tekućini te prijeći u plinovito stanje. To objašnjava
zašto pri višoj temperaturi tekućina brže isparava.
Doznajte više na: www.compoundchem.com/boiling-point
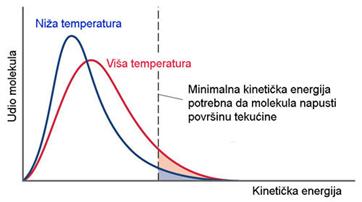
Slika 9.6. Raspodjela kinetičke energije
čestica pri dvjema temperaturama. Prosječna kinetička energija čestica raste s
povišenjem temperature. Pri višoj temperaturi veći broj čestica ima najmanju
kinetičku energiju potrebnu za napuštanje površine tekućine i prijelaz u paru.
Zato tlak para tekućine raste povišenjem temperature.
Slika izvor: slideplayer.com
Iznad tekućine u posudi uvijek se nalazi određeni broj čestica u plinovitu stanju. Kaže se da tekućina ima tlak para. Tlak para tekućine ovisi o temperaturi i raste s povišenjem temperature. Kad se tlak para tekućine izjednači s atmosferskim tlakom, tekućina proključa ili zavre. Vrelište tekućine je ona temperatura pri kojoj je tlak para tekućine jednak normalnom atmosferskom tlaku, p = 101 325 Pa. Pri normalnom tlaku čista voda vrije pri 100 °C.
POKUS 9.1. Tlak para
Pribor i kemikalije: Suha okrugla ili Erlenmeyerova
tikvica od 250 mL, probušeni gumeni čep, manometar s U-cijevi napunjen vodom
ili parafinskim uljem, injekcijska štrcaljka od 5 mL, injekcijska igla, etanol.
Postupak
1. Pripremite aparaturu kao na slici 9.6. Injekcijsku iglu zabijte u gumeni čep. Suhu tikvicu začepite probušenim čepom. Priključite manometar s vodom ili parafinskim uljem. (Opaska! Na slici je prikazan manometar sa živom. Živa je otrovna. Prolivenu živu teško je pokupiti. Zato se ne preporučuje rad sa živom u školskom laboratoriju.) Razina vode u oba kraka manometarske cijevi bit će jednaka jer se tlak u tikvici kroz injekcijsku iglu izjednači s atmosferskim tlakom.
2. U injekcijsku štrcaljku usišite oko 0,5 mL etanola. Nataknite injekcijsku štrcaljku na injekcijsku iglu i istisnite etanol u tikvicu. Pratite manometar i obrazložite uočene promjene.
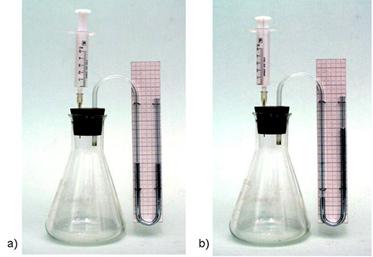
Slika 9.7. Aparatura za demonstraciju tlaka para etanola. a) Tlak u aparaturi jednak je atmosferskom tlaku. b) Kad se iz injekcijske štrcaljke doda malo etanola tlak u aparaturi poraste za iznos tlaka para etanola pri danoj temperaturi.
Kada se u zatvorenu posudu ispunjenu samo zrakom injekcionom štrcaljkom unese malo etanola, tlak u posudi poraste za iznos tlaka para etanola pri danoj temperaturi. Etanol isparava, u početku brže a poslije sve sporije. Nakon nekog vremena uspostavi se dinamička ravnoteža, tj. broj molekula koje napuštaju površinu tekućine postane jednak broju molekula koje se iz plinovite faze vraćaju na površinu tekućine. Ovaj jednostavan pokus dokazuje da tekućine imaju tlak para.
Kada se tekućini koja ključa dovodi toplina ona nastavlja isparavati ali joj se temperatura ne mijenja. Vrelište ovisi o tlaku. Snizi li se tlak iznad tekućine, tako da se posuda s tekućinom evakuira, tekućina će proključati pri nižoj temperaturi. Povisi li se tlak iznad tekućine, ona će proključati pri višoj temperaturi nego pri normalnom atmosferskom tlaku. Primjerice, da bi se brže pripremio obrok, hrana se kuha u Papinovu ili ekspres loncu kojeg je još 1679. izumio Denis Papin (1647. -1712.). Pri povišenom tlaku voda ključa pri višoj temperaturi. Brzina kemijske reakcije raste porastom temperature i zato se pri višoj temperaturi hrana brže skuha.
POKUS 9.2. Ovisnost vrelišta vode o tlaku
Vidi na Internetu: www.youtube.com/watch?v=Ag4lLUXKuSM
9.5. Otapalo i otopljena tvar
U tekućinama se otapaju krutine, druge tekućine i plinovi. No, nije svaka tekućina dobro otapalo za svaku tvar. Iskustvo nas uči da se neke tekućine međusobno miješaju u svakom omjeru, a da se neke uopće ne miješaju. Primjerice, etanol ili obični alkohol, glicerol, "antifriz" (etan-1,2-diol), tekući deterdženti, octena kiselina i mnoge druge tekućine miješaju se s vodom u svakom omjeru. Benzin, ulje za loženje, motorno ulje, maslinovo i suncokretovo ulje ne miješaju se s vodom. Kako god ih pokušali pomiješati, razdvojit će se u dva sloja. Međutim, benzin, ulje za loženje i motorno ulje, ili maslinovo i suncokretovo ulje, miješaju se međusobno u svakom omjeru. Postavlja se pitanje zašto se neke tekućine uopće ne miješaju, zašto se neke djelomično miješaju, a neke se miješaju u svakom omjeru?
Različita topljivost tvari proistječe iz različite građe molekula. Molekule vode su polarne, a usto se mogu povezivati vodikovim vezama. Prema tome, valja očekivati da će se u vodi dobro otapati sve tvari čije se molekule mogu polarizirati. Naprotiv, molekule ugljikovodika (ulja za loženje, motornog ulja, benzina i sl.) nepolarne su, pa se benzin i drugi ugIjikovodici ne miješaju s vodom. Međutim, oni se međusobno neograničeno otapaju jer među njihovim nepolarnim molekulama djeluju samo slabe van der Waalsove sile.
U otopinama valja razlikovati otapalo i otopljenu tvar. Ako su otapalo i otopljena tvar tekućine, otapalom se najčešće naziva onaj sastojak kojeg u otopini ima više. Inače, pod otapalom se razumije tekućina, a pod otopljenom tvari kruta, tekuća ili plinovita tvar koja se u toj tekućini otapa. Osim etanola, sastavnog dijela svih alkoholnih pića te smjese acetona, CH3COCH3, s etil-acetatom, CH3COOC2H5, koja služi za otapanje laka za nokte, voda je najčešće, najvažnije i najzanimljivije otapalo. Otopine u kojima je otapalo voda zovu se vodene otopine. Otopine koje sadržavaju relativno velike količine otopljene tvari zovu se koncentrirane, a one koje sadržavaju malo otopljene tvari razrijeđene otopine. Otopina koja je u ravnoteži s neotopljenim kristalima je zasićena otopina. Takva otopina pri danoj temperaturi ne može otopiti nove količine tvari. Osnovno svojstvo svih otopina je da su one homogen sastav (homogene smjese). To znači, primjerice, da je svuda u otopini etanola u vodi omjer broja molekula etanola i vode stalan.
Doznajte više na: www.visionlearning.com/Properties-of-Liquids
9.5.1. Otapanje soli u vodi
Svojstvo vode da dobro otapa soli uzrokovano je polarnošću njezinih molekula, tj. velikom relativnom permitivnošću vode. Privlačna ili odbojna sila F, između dvaju električnih naboja, obrnuto je proporcionalna relativnoj dielektričnoj permitivnosti prostora u kojemu naboji djeluju jedan na drugoga.
![]()
![]()
gdje je: Q1 - naboj jednog tijela (ili iona),
Q2 - naboj drugog tijela (ili iona),
r - razmak među tijelima (ili ionima),
εr - relativna dielektrična permitivnost svojstvena svakoj tvari.
Pri sobnoj temperaturi zrak ima relativnu permitivnost oko 1, a voda 81. To znači da se dva suprotna električna naboja u vodi međusobno privlače 81 puta manjom silom nego u zraku. Kad se kristali natrijeva klorida ubace u vodu molekule vode svojim se pozitivnim krajem naslanjaju na negativno nabijene ione Cl−, a negativnim krajem na pozitivno nabijene ione Na+. Zbog toga se oslabljuju privlačne sile između iona na površini i iona u unutrašnjosti kristala. Potpomognute toplinskim gibanjem, molekule vode izvlače ione s površine kristala. Već postojeći ioni u kristalnoj strukturi otapanjem se samo razdvajaju, pa se kaže da tvari s ionskom građom pri otapanju disociraju (lat. dissociare - razdvojiti).
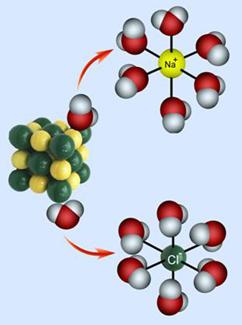
Slika 9.8. Shematski prikaz otapanja natrijeva klorida u vodi. Molekule vode izvlače ione s površine kristala. U vodenoj otopini kationi i anioni okruženi su molekulama vode i nasumično se gibaju otopinom.
Privlačna sila među ionima Na+ i Cl− u vodi je 81 puta manja nego u vakuumu, što proizlazi iz velike relativne dielektrične permitivnosti vode. Zato je mala vjerojatnost da će se ioni iz otopine vraćati na površinu kristala sve dok je otopina nezasićena. Tek se u zasićenoj otopini uspostavlja dinamička ravnoteža, kad broj iona koji s površine kristala prelaze u otopinu postane jednak broju iona koji se iz otopine vraćaju na površinu kristala.
U vodenoj otopini ioni se okružuju molekulama vode. Svaki negativno nabijeni ion (anion) privlači pozitivno nabijene krajeve molekula vode te ih nastoji zadržati oko sebe. Pozitivno nabijeni ioni (kationi) redovito su manji od aniona i još većom silom privlače molekule vode te ih čvrsto vežu. Tako nastaju hidratizirani ioni.
Broj molekula vode koje okružuju kation (koordinacijski broj kationa) ovisi o njegovoj veličini. Oko malog kationa Be2+ mogu se smjestiti samo četiri molekule vode pa on čini tetrahidrat Be(OH2)4+. Nešto veći kationi, Mg2+, Al3+, Fe3+, čine heksahidrate, Mg(OH2)62+, Al(OH2)63+, Fe(OH2)63+. Privlačne sile između molekula vode i kationa mogu biti tako velike da mnogi kationi zadržavaju oko sebe sloj molekula vode čak i u kristalima. Za takve se kristale kaže da sadržavaju kristalizacijsku vodu. U kristalima BeCl2·4H2O, BeSO4·4H2O i BeCO3·4H2O četiri molekule vode okružuju katione berilija. U kristalima MgCl2·6H2O, AlCl3·6H2O, FeCl3·6H2O šest molekula vode okružuje katione Mg2+, Al3+ i Fe3+. U kristalima stipse, KAl(SO4)2·12H2O, šest molekula vode okružuje ione Al3+, a drugih šest molekula vode okružuje ione K+.
Iskustvo pokazuje da se u vodi dobro otapaju svi nitrati, svi acetati, svi kloridi, bromidi i jodidi osim AgCl, AgBr, AgI, CuCl, CuI i Hg2Cl2. Sve su to od reda soli izgrađene od jednovalentnih kationa i jednovalentnih aniona. U vodi su dobro topljivi svi sulfati osim CaSO4, SrSO4, BaSO4 i PbSO4. Dobro su topljivi karbonati i fosfati alkalijskih metala, ali karbonati i fosfati zemnoalkalijskih i prijelaznih metala u vodi su netopljivi. Sulfidi alkalijskih i zemnoalkalijskih metala su topljivi dok su sulfidi prijelaznih metala netopljivi. Ovi nas primjeri navode na zaključak da topljivost soli u vodi ovisi o više faktora, a jedan od njih je sigurno naboj i veličina kationa i aniona.
Topljivost tvari mijenja se s promjenom temperature te se prikazuje krivuljom topljivosti. Na apscisu se redovito nanosi temperatura, a na ordinatu masa bezvodne tvari koja se otapa u 100 g otapala. Tako se u 100 g vode pri 0°C otapa 5 g Na2SO4. Ako se zasićenoj otopini doda još natrijeva sulfata, on se pri toj temperaturi neće dalje otapati.
Promjena topljivosti tvari s promjenom temperature često se prikazuje krivuljama topljivost.
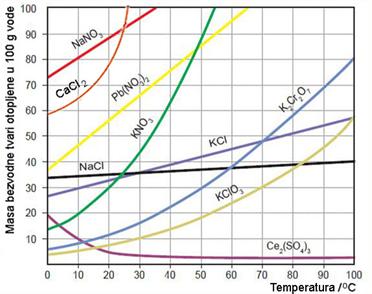
Slika 9.9. Krivulje topljivosti nekih soli
u vodi. Svaka točka na krivulji pokazuje masu bezvodne tvari (ordinata) koja se
pri danoj temperaturi (apscisa) otapa u 100 g vode.
Slika izvor: socratic.org/what-are-solubility-curves
Kad govorimo o topljivosti tvari uvijek se mora naznačiti temperaturu, jer ona ovisi o temperaturi. Kada se pri otapanju tvari otopina hladi, tj. kada je otapanje endoterman proces, topljivost raste porastom temperature. (Primjeri: KCl, NH4Cl, CaCl2). Ako se pri otapanju tvari otopina grije, tj. kada je otapanje egzoterman proces, topljivost se smanjuje porastom temperature. (Primjeri: Ce2(SO4)3, Ca(CH3COOH)2, CaCrO4). Te su pojave u skladu s Le Chatelierovim načelom : "Ako se u sustavu koji je u ravnoteži promijeni jedan od uvjeta (temperatura, tlak ili koncentracija) onda se u njemu događaju takvi procesi koji se protive promjeni." (Le Chatelierovo načelo vrijedi općenito, ne samo u kemiji. Očituje se u mehanici, elektrotehnici, fiziologiji, pa čak u ekologiji i politici. Loše posljedice klimatskih promjena možemo shvatiti kao pokušaj prirode da uništi onoga, čovjeka, koji ih izaziva.)
Topljivost natrijeva tiosulfata jako raste porastom temperature. Pri oko 40 - 50 °C praktički se otapa u vlastitoj kristalizacijskoj vodi. Ako se zasićena otopina polako hladi može nastati prezasićena otopina. U prezasićenoj otopini nalazi se otopljeno više tvari nego što odgovara ravnotežnom stanju. Takva je otopina nestabilna, pa i najmanje zrnce prašine ili potresanje otopine može izazvati kristalizaciju. Ako se u otopinu ubaci kristalić natrijeva klorida, bez miješanja ili potresanja otopine, obično se ne događa ništa. Kristalna struktura natrijeva klorida razlikuje se od kristalne strukture natrijeva tiosulfata pentahidrata. Zato kristalić natrijeva klorida ili neke druge soli neće potaknuti proces kristalizacije. Naprotiv, kristalić natrijeva tiosulfata služi kao centar kristalizacije. Na njemu počinje kristalizacija i kristali rastu od njega u dubinu otopine. Pritom se sustav ugrije, što se može osjetiti rukom.
POKUS 9.3. Prezasićena otopina natrijeva acetata
Vidi na Internetu: www.youtube.com/watch?v=h9yVfm3b7NI
www.youtube.com/watch?v=BLq5NibwV5g
POKUS 9.4. Prezasićena otopina limunske
kiseline
Vidi na Internetu: www.youtube.com/watch?v=Z4i_nXVyxl4
9.5.2. Topljivost plinova u vodi
Otapanje većine plinova u vodi je egzotermna promjena. Prema tome, topljivost plinova mora se smanjivati porastom temperature. Iskustvo pokazuje da kad pitka voda neko vrijeme stoji u staklenoj čaši, na stijenkama se skupljaju sitni mjehurići plina. Taj plin je zrak koji je bio otopljen u vodi. Stajanjem se voda zagrijavala, a topljivost zraka u vodi smanjivala. Zato se dio otopljenog zraka izlučio u obliku sitnih mjehurića na stijenkama čaše.
Zbog upotrebe vode za hlađenje industrijskih postrojenja zagrijavaju se prirodni vodni tokovi. Primjerice, temperatura Save za niska vodostaja poraste i za 4 °C zbog hlađenja nuklearne elektrane Krško. To uzrokuje manju topljivosti kisika u vodi rijeka i jezera. Pojava je osobito izražena u mirnim jezerskim vodama. Topla voda ima naime manju gustoću od hladne pa se zato zadržava na površini. Kao što je rečeno, topljivost kisika manja je u toploj vodi nego u hladnoj. Sloj tople vode sprječava prodiranje kisika u niže, hladnije slojeve. Smanjenje koncentracije kisika u vodi izaziva gušenje svakog oblika života za koji je potreban kisik. Drugi uzrok smanjenju koncentracije kisika su otpadne organske tvari koje industrija šalje u riječne tokove. Da bi se povećala koncentracija kisika na riječnim tokovima se grade umjetni vodopadi na kojima voda dolazi u bolji doticaj sa zrakom.
Topljivost plinova u tekućinama proporcionalna je parcijalnom tlaku plina (W. Henry, 1775. - 1836.). Poveća li se, na primjer, tlak kisika iznad vode dva puta, i količina (množina) kisika koji se otapa u vodi povećat će se dva puta. To vrijedi samo za plinove koji kemijski ne reagiraju s vodom. Plinovi koji reagiraju s vodom (HF, HCl, H2S, SO2, SO3, CO2, NH3 i drugi) ne pokoravaju se Henryjevu zakonu. Njihova je topljivost u vodi vrlo velika.
Topljivost plinova koji ne reagiraju s vodom, kisika, dušika i helija vrlo je mala. Pri temperaturi 0 °C i tlaku 1 bar, 1 L vode otapa samo 48,9 mL kisika. Poveća li se tlak na 2 bara, volumen otopljenog kisika bit će opet 48,9 mL, ali zbog dvostruko većeg tlaka količina (množina) otopljenog kisika dvostruko je veća. Smanji li se tlak, otopljeni kisik će se izluči u obliku mjehurića.
Povećana topljivost plinova pri povišenom tlaku može biti uzrokom nezgoda. Primjerice, ronilac na dubini od 50 m udiše zrak pod tlakom od oko 5 bara. Pri tom je tlaku topljivost kisika i dušika u krvi pet puta veća nego na površini. Ako ronilac prenaglo izroni, otopljeni dušik se u krvnim žilama izluči u obliku brojnih sitnih mjehurića, što je smrtonosno (zračna embolija). Zato se, prije nego izrone, ronioci zadržavaju neko vrijeme na manjim dubinama. Da bi se skratilo vrijeme »dekompresije«, odnosno zadržavanje na manjim dubinama, profesionalnim se roniocima boce s komprimiranim »zrakom« pune smjesom helija i kisika. Topljivost helija u krvi upola je manja od topljivosti dušika, pa se potrebno vrijeme do izronjavanja upola skraćuje.
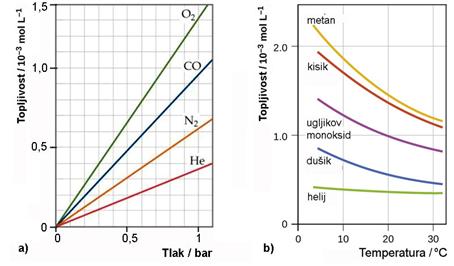
Slika
9.10.
Ovisnost topljivosti kisika, dušika i helija u vodi o tlaku (a) i temperaturi
(b). Uočite da je topljivost plina proporcionalna tlaku i da se smanjuje s porastom
temperature. Henryev zakon.
Slika izvor: socratic.org/questions
Zanimljivo je svojstvo didušikova oksida, N2O, da se otapa u slatkom vrhnju. Bočice sa slatkim vrhnjem punjene su didušikovim oksidom, N2O, pod tlakom. Kad se tlak smanji, didušikov oksid se izluči u obliku mjehurića pa se dobije šlag. To je dobra ilustracija procesa koji se događaju u krvi i tjelesnim tekućinama pri nagloj dekompresiji. Didušikov oksid nije otrovan. Što više, koriste ga kao anestetičko sredstvo u smjesi s drugim plinovima pri totalnoj anesteziji.
9.6. Voda i život kakav poznajemo
Bez tekuće vode, leda i vodene pare na Zemlji ne bi bilo života kakav poznajemo. Zemlja se nalazi u naseljivom području Sunčevog sustava. Kad bi Zemlja bila malo bliže Suncu ili dalje od njega vjerojatno ne bi postojali uvjeti koji omogućuju istovremeno pojavljivanje vode u sva tri agregacijska stanja.
Voda pokriva oko 71 % Zemljine površine. Život na Zemlji počeo je u vodi pa stoga nije iznenađujuće da je ona potrebna svim živim organizmima. Voda je stanište milijuna vrsta, od onih najsitnijih organizama veličine mikrona do 30 metarskih kitova mase 200 tona. Svake godine u dubinama oceana otkrivaju se nove vrste i drukčiji oblici života kojih bez vode ne bi bilo.
Oceani i mora imaju ključnu ulogu u održanju klime na Zemlji. Klimatske promjene, koje upravo osjećamo, posljedica su povećanja koncentracije ugljikova dioksida u atmosferi. Krajem 19. stoljeća koncentracija CO2 u atmosferi bila je 290 čestica na milijun (ppm). No, očekuje se da će ove godine koncentracija CO2 u atmosferi premašiti 417 ppm. Ugljikov dioksid, kao staklenički plin, ima značajan utjecaj na globalno zagrijavanje. Zbog zagrijavanja oceanske struje mijenjaju tok što uzrokuje klimatske promjene, ali i izumiranje nekih vrsta Povećanje koncentracije CO2 u atmosferi dovelo je do povećanja koncentracije otopljenog CO2 u morima i oceanima što je pak uzrokovalo zakiseljavanje oceana. Povećanje kiselosti u oceanima predstavlja najveću opasnost za koraljne grebene, jer uzrokuje njihov nestanak. Koraljni su grebeni staništa brojnih biljnih i životinjskih vrsta, pa izumiranje prijeti i njima. Različiti organizmi različito reagiraju na zakiseljavanje, no svi se znanstvenici slažu da zakiseljavanje oceana i svjetskih mora utječe na ključne kemijske i biološke procese. Nastavi li se povećanje emisije CO2 doći će do ozbiljnih poremećaja u morskom ekosistemu. Mogle bi nestati vrste koje igraju važnu ulogu u hranidbenim lancima, poremetio bi se život i produkcija fitoplanktona, došlo bi do nestanka koraljnih grebena, a sve to dovelo bi do nepovratnih promjena u morskom okolišu i dramatičnih posljedica za čovječanstvo. Znanstvenici upozoravaju da je postojeća razina kiselosti oceana “bez presedana u posljednjih 300 milijuna godina”,
Ljudsko tijelo sadržava oko 70 % vode. Bez vode nema nam života. No, od sve vode na Zemlji samo je 2,5 % slatka voda. Većina te vode nalazi se zarobljena u ledenjacima i podzemlju. Rijeke i jezera sadržavaju samo 0,013 % vode na Zemlji. Vode raspoložive za piće ima još manje. Oko 1,1 mlrd ljudi nema dovoljno pitke vode. Srećom, zbog kruženja vode u prirodi (hidrološki ciklus) pitka se voda stalno obnavlja. U razvijenim zemljama dnevna potrošnja pitke vode po glavi stanovnika kreće se od 120 do gotovo 300 litara. Primjerice, SAD su na čelu zemalja s najvećom potrošnjom pitke vode od oko 295 litara vode na dan po stanovniku. U Njemačkoj je prosječna potrošnja 130 litara dok se u Hrvatskoj za prosječnu potrošnju uzima vrijednost od 140-160 litara vode na dan po osobi.
Hrvatska se nalazi među trideset vodom najbogatijih zemalja u svijetu. Zaštita okoliša i opskrba pitkom vodom postaju glavni problem i izazov za opstanak i razvoj civilizacije. Pitka voda postaje glavni resurs u 21. stoljeću zbog porasta broja stanovnika i rasta standarda. Danas smo suočeni sa svakodnevnim usporedbama kako pitka voda postaje "nova nafta" te da nam slijede ratovi za pitku vodu. Zato se izvori pitke vode ne smiju prodavati. Multinacionalne kompanije nastoje na sve moguće načine postići kontrolu nad izvorima pitke vode.
Ujedinjeni narodi su 2008. godine proglasili pravo na vodu – temeljnim ljudskim pravom. Međutim, s izuzetkom Slovenije, koja je prema Ustavu zabranila prodaju vlastitih vodnih resursa, čini se da zemlje u regiji nisu svjesne da loše i neodgovorno upravljanje vodama ugrožava jedno od temeljnih ljudskih prava njihovih građana. Tako se npr., privatizacija izvora pitke vode u Srbiji, ali i u ostatku regije provodila gotovo nezapaženo.
Ponovimo
· Čestice tvari u tekućinama također su najgušće složene, ali se uređeni razmještaj čestica održava samo na maloj udaljenosti.
· Međuatomski i međumolekulski razmaci u tekućinama vrlo malo se mijenjaju povišenjem tlaka. Tekućine su praktički nestlačive.
· Viskoznost je otpor tekućine prema tečenju. Uzrok tomu su međumolekulske sile kojima se molekule tekućine privlače i time opiru smicanju susjednih slojeva.
· Površinsku napetost tekućina uzrokuju adhezijske sile paralelne s površinom tekućine. One nastoje smanjiti razmak među česticama na površini.
· Tekućina će kvasiti krutu površinu ako su adhezijske sile tekućina-krutina jače od kohezijskih sila među česticama tekućine. Primjerice, voda kvasi čisto staklo.
· Tekućina neće kvasiti neku krutu površinu ako su adhezijske sile tekućina - krutina slabije od kohezijskih sila među česticama tekućine. Primjerice, voda ne kvasi zamašćenu površinu ili površinu prevučenu teflonom i drugim plastičnim masama.
· Tlak para tekućine ovisi o temperaturi i uvijek raste povišenjem temperature.
· Vrelište tvari je temperatura pri kojoj je tlak para tekućine jednak normalnom atmosferskom tlaku.
· Otopine su homogene, što znači da u svakom svom dijelu imaju jednak kemijski sastav i ista fizička svojstva. Često se homogene smjese zovu otopinama, bez obzira na agregacijsko stanje (krute otopine metala ili minerala).
· Tvari polarne građe (soli, kiseline, baze) dobro se otapaju u polarnim otapalima kao što je voda.
· Tvari nepolarne građe (vosak, motorno ulje, naftalin) dobro se otapaju u nepolarnim otapalima, kao što su benzen, benzin i ugljikov tetraklorid.
· Otopina je zasićena kada se nalazi u dinamičkoj ravnoteži sa suviškom neotopljene tvari.
· Pri otapanju tvari ionske građe molekule vode razdvajaju ione od kojih je izgrađen kristal.
· Ioni se u vodenoj otopini okružuju većim ili manjim brojem molekula vode, tako da nastaju hidratizirani ioni (npr. [Fe(OH2)6]3+, [Ni(OH2)6]2+, [Be(OH2)4]2+, [Al(OH2)6]3+).
· Ako je otapanje endoterman proces, topljivost tvari raste porastom temperature. Ako je otapanje egzoterman proces, topljivost tvari se smanjuje porastom temperature.
Pitanja i zadaci 9
- Obrazložite uzroke neočekivano visokog vrelišta vode. Zašto su vrelišta
fluorovodika, klorovodika i amonijaka niža od vrelišta vode, a viša od vrelišta
ugljikovodika s istom relativnom molekulskom masom?
- Zašto je
sumporovodik pri sobnoj temperaturi plin iako mu je relativna molekulska masa
skoro dvostruko veća od relativne molekulske mase vode?
- Što uzrokuje
napetost površine? Obrazložite.
- Dvije kapilare
različitih promjera uronjene su u vodu i živu. Prikažite crtežom i obrazložite
razliku između razina vode i žive u kapilarama.
- Zašto je
viskoznost vode veća od viskoznosti benzena?
- Raste li ili
pada tlak para krutina i tekućina s porastom temperature? Obrazložite!
- Zašto se povrće u hladnjaku osuši ako u njemu dulje stoji nezamotano?
10. PLINOVI
U plinu su čestice daleko jedna od druge. Čestice plina su u stalnom nasumičnom kretanju, sudaraju se međusobno i sa stijenkama posude, stvarajući tlak. Među česticama plina djeluju vrlo slabe privlačne sile. Zato plinovi nemaju određen oblik ni volumen. Volumen neke količine plina, primjerice jednog mola ili 6,022 × 1023 čestica plina, ovisi samo o volumenu posude u kojoj se nalazi. Pri normalnom atmosferskom tlaku, 101 325 Pa, i temperaturi 0 oC (273,15 K) jedan mol ili 6,022 × 1023 čestica plina zauzima volumen 22,414 L. Pri dvostruko većem tlaku isti broj čestica plina zauzima upola manji volumen. Između tlaka, p, i volumena, V, stalne količine plina pri stalnoj temperaturi vrijedi odnos:
p V = konstanta
Tu je zakonitost još 1662. godine otkrio irski znanstvenik i filozof Robert Boyle (1627. - 1691.). Istu je zakonitost 1677. neovisno pronašao i francuski prirodoslovac Edme Mariotte (1620. - 1684.). Promjenu volumena i tlaka plina pri promjeni temperature proučavali su francuski znanstvenici J. A. Charles (1746. - 1823.) i J. L. Gay-Lussac (1778. - 1850.). Kao što je pokazano u poglavlju 2.4.1. sva tri zakona mogu se objediniti u opću plinsku jednadžbu:
pV = nRT
Točna su mjerenja pokazala da opća plinska jednadžba vrijedi samo za idealne plinove kakvih u prirodi nema. Prema općoj plinskoj jednadžbi pri temperaturi bliskoj apsolutnoj nuli tlak i volumen plina trebao bi biti jednak nuli. No, molekule stvarnih ili realnih plinova imaju volumen, a među njima djeluju slabe van der Waalsove sile. Zato ponašanje realnih plinova ne slijedi opću plinsku jednadžbu, osobito pri visokom tlaku i niskoj temperaturi. No, u običnim laboratorijskim uvjetima, pri sobnoj temperaturi i normalnom atmosferskom tlaku, nećemo učiniti veliku pogrešku ako na rezultate mjerenja primijenimo zakone koji vrijede za idealne plinove.
Pri pokusima u školskom laboratoriju plinovi se gotovo uvijek skupljaju u preokrenutoj menzuri iznad vode. Pri očitavanju volumena plina treba podizanjem ili spuštanjem menzure izjednačiti razine vode u menzuri i posudi s vodom. Voda ima tlak para koji raste porastom temperature. Da bismo doznali tlak "suhoga plina" od atmosferskog tlaka uvijek treba oduzeti parcijalni tlak vodene pare, p(H2O).
p(plin) = p(ukupni) - p(H2O)
10.1. Kinetička teorija plinova
Kinetičku teoriju plinova postavio je 1738. godine švicarski matematičar
i fizičar
Danijel Bernoulli
(1700. - 1782.). Njegov je rad ostao nezapažen sve do 19. stoljeća. Osnovne su
pretpostavke kinetičke teorije plinova:
- Plin se sastoji od sitnih tvrdih savršeno elastičnih čestica (molekula).
- Broj molekula u plinu je vrlo velik.
- Molekule plina gibaju se nasumično velikim brzinama.
- Za molekule vrijedi klasična mehanika.
- Sudari čestica plina sa stijenkom posude stvaraju tlak plina.
- Trajanje sudara je vrlo kratko.
- Sudari su savršeno elastični.
- Volumen molekula zanemarivo je mali prema volumenu plina.
- Uzajamno djelovanje molekula plina je zanemarivo.
Na temelju gibanja čestica plina (molekula ili atoma) kinetička teorija plinova tumači makroskopska svojstava plinova: tlak, temperaturu, volumen, viskoznost, toplinsku provodnost. No, izvodi i dokazi koji proizlaze iz kinetičke teorije plinova premašuju okvire ovog udžbenika. Zato ćemo se u daljnjem tumačenju svojstava plinova poslužiti gotovim rezultatima koji proizlaze iz kinetičke teorije plinova.
Tlak plina, P, je posljedica udaraca čestica plina na stijenke posude. Udarci su to jači što je veća kinetička energija čestica. Vjerojatnost udaraca o stijenku posude raste porastom broja čestica u jedinici volumena plina. Ukratko, tlak plina, P, ovisi prosječnoj kinetičkoj energiji čestica i njihovom broju, N, u jedinici volumena, V.
![]()
Kinetička energija, Ek, čestica mase m, koja se giba brzinom v, jednaka je:
![]()
Odnos između prosječne kinetičke energije i temperature plina, T, dan je jednadžbom:
![]()
U ovoj je jednadžbi: Ek - prosječna kinetička energija čestica, m - masa čestica, v - prosječna brzina čestica plina, k - Boltzmanova konstanta = 1,38 · 10-23 J K-1, T - apsolutna temperatura (T/K = t/oC + 273,15).
Iz molekularno kinetičke teorije plinova proizlazi da je mjera za prosječnu kinetičku energiju čestica temperatura sustava. U sustavu za koji kažemo da ima visoku temperaturu prosječna kinetička energija čestica veća je nego u sustavu s niskom temperaturom. Prosječna kinetička energija molekula plina ne ovisi o vrsti plina, nego samo o apsolutnoj temperaturi, T.
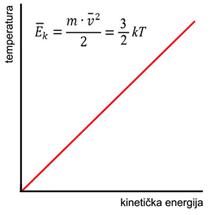
Slika 10.1.Prosječna kinetička energija čestica plina proporcionalna je temperaturi i ne ovisi o vrsti plina
Iz ove se jednadžbe proizlazi da je srednja kvadratna brzina, vrms, (engl. root mean square speed) ili efektivna brzina molekula plina:
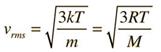
U ovoj je jednadžbi: vrms
- srednja kvadratna brzina molekula plina (m/s), m - masa molekula (kg),
T - apsolutna
temperatura (K),
k -
Boltzmanova konstanta = 1,38 · 10-23
J K-1, R - univerzalna plinska konstanta = 8,314 J K-1 mol-1, M - molarna masa plina
(kg/mol).
10.2. Raspodjela brzina molekula plina
Pri istoj temperaturi sve molekule plina nemaju jednaku brzinu. Na slici 10.2. vidi se raspodjela brzina atoma plemenitih plinova pri sobnoj temperaturi. Maksimum na krivulji pokazuje najvjerojatniju brzinu, vm. To je ona brzina kojom se giba najveći broj molekula.
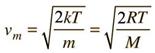
Slika 10.2. Grafički prikaz raspodjele
brzina atoma plemenitih plinova pri 25 oC. (Maxvell-Boltzmannova
raspodjela). Pri istoj temperaturi molekule manje relativne molekulske mase
imaju veću najvjerojatniju brzinu i veći raspon brzina.
Izvor: opentextbc.ca/kinetic-molecular-theory-of-gases
Raspodjela brzina molekula ovisi o temperaturi. Naime, zagrijavanjem plina povećava se prosječna kinetička energija molekula pa se mijenja i vjerojatnost raspodjele njihovih brzina. Na slici 10.3. dan je grafički prikaz raspodjele brzina molekula kisika pri dvije temperature. Vidimo da se povišenjem temperature povećava raspon brzina (zvonolika se krivulja širi) a maksimum najvjerojatnije brzine pomiče se prema većim brzinama.
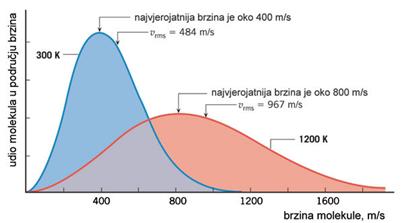
Slika 10.3. Raspodjela brzina molekula kisika
pri različitim temperaturama
Slika izvor:www.slideshare.net
Primjer 10.1. Izračunajte srednju kvadratnu brzinu (efektivnu brzinu) molekula kisika pri 20 oC.
Rješenje
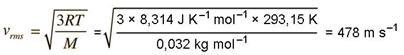
Ponovimo
· Čestice idealnog plina su zamišljene matematičke točke koje imaju masu, ali nemaju volumen (materijalne točke) i među njima ne djeluju privlačne sile.
· Čestice realnog plina imaju masu, imaju volumen i među njima djeluju slabe van der Walsove sile.
· Pri normalnom atmosferskog tlaku i sobnoj ili višoj temperaturi nećemo pogriješiti ako pri interpretaciji rezultata mjerenja upotrijebimo opću plinsku jednadžbu pV = nRT.
· Veće odstupanje opaženih vrijednosti od onih izračunanih općom plinskom jednadžbom opaža se pri visokim tlakovima i niskim temperaturama.
· Kad se plin skuplja u posudama s vodom od izmjerenog ukupnog tlaka plina treba oduzeti parcijalni tlak vodene pare.
· Tlak para vode uvijek raste s porastom temperature.
Pitanja i zadaci 10
- Obrazložite razlike između strukture krutina, tekućina i plinova. Zašto
su krutine i tekućine praktički nestlačive?
- Pri kritičnoj temperaturi i kritičnom tlaku tekućina i para imaju
jednaku gustoću. Pogledajte fazni dijagram
za vodu na slici 8.5. i odgovorite što će
se dogoditi pri kritičnoj temperaturi i kritičnom tlaku:
a) ako se povisi tlak,
b) ako se snizi tlak,
c) ako se povisi temperatura,
d) ako se snizi temperatura
Pogovor
Kristalografskim rječnikom rečeno, svaka je tiskana knjiga "zatvorena forma". Tiskana knjiga ili udžbenik ima konačan sadržaj koji se izvan korica može proširiti samo posezanjem za sličnom drugom knjigom ili udžbenikom. Zato su tu još i radne bilježnice za koje kažu "da potiču znatiželju, istraživački duh i pozitivan stav prema učenju". Ali i drugi školski pribor. Stoga učenička torba teži više od sedam kilograma, što nažalost nikoga ne čudi. Mora li biti tako?
Živimo u "informatičkom dobu" koje je digitalne tehnologije unijelo u sve pore ljudske djelatnosti, osim u đačke torbe. Za razliku od tiskanog udžbenika, digitalni udžbenik je "otvorena forma". Učeniku je prepušteno na volju. Može se zadovoljiti onim što piše u digitalnom udžbeniku, ali u svakom trenutku može bez poteškoća posegnuti za sadržajima navedenim pod "doznajte više". Digitalni udžbenik je knjiga koja se može proširivati onoliko koliko je to učeniku potrebno ili koliko to sam želi. Uz to, za tiskanje knjiga potreban je papir, a to znači sječu šuma koje nam osiguravaju kisik, čuvaju zemlju od erozije i zadržavaju vodu u tlu. Tako digitalne tehnologije pridonose i očuvanju okoliša.
U svim prirodnim i društvenim procesima vrijedi zakon evolucije (lat. evolutio: razvoj, razvitak). Zato udžbenici i sadržaj đačke torbe trebaju evoluirati. Tehnologije i društva koja ne evoluiraju, zaostaju i polako nestaju s lica Zemlje.
Redaktor
- dr. sc . Nenad Raos
Fotografije
- Prof. dr. sc. Milan Sikirica
Udžbenik je besplatan. Nastao je nesebičnim radom autora i redaktora. Zato se ni jedan dio ovog udžbenika i njegovih sastavnih dijelova ne smije ni u kojem obliku i na bilo koji način koristiti u komercijalne svrhe. Dozvoljeno je korištenje za osobne potrebe i za nastavu u školama. Slobodno smijete besplatno umnožavati, dijeliti, distribuirati i prerađivati ovaj udžbenik za potrebe nastave uz obvezno citiranje izvornika. Sva su autorska prava zadržana.
Autor neće biti odgovoran ni za kakve izravne, slučajne, posljedične, neizravne ili kaznene štete nastale korištenjem ovog udžbenika i njegovih sastavniih dijelova.
Webmaster - kontakt e-mail