Milan Sikirica
e-Kemija 3
Digitalni
udžbenik za znatiželjne učenike
3. razreda srednjih škola
Redaktor
- dr. sc. Nenad Raos
Fotografije
- prof. dr. sc. Milan Sikirica
Udžbenik je besplatan. Nastao je nesebičnim radom autora i redaktora. Zato se niti jedan dio ovog udžbenika i njegovih sastavnih dijelova ne smije ni u kojem obliku i na bilo koji način koristiti u komercijalne svrhe. Dozvoljeno je korištenje za osobne potrebe i za nastavu u školama. Slobodno smijete besplatno umnožavati, dijeliti, distribuirati i prerađivati ovaj udžbenik za potrebe nastave uz obvezno citiranje izvornika. Sva su autorska prava zadržana.
Autor neće biti odgovoran ni za kakve izravne, slučajne, posljedične, neizravne ili kaznene štete nastale korištenjem ovog udžbenika i njegovih sastavnih dijelova.
Predgovor
Zašto digitalni udžbenik?
· zato što živimo u dobu digitalnih tehnologija,
· zato što svaki srednjoškolac ima pristup pametnom telefonu i/ili računalu,
· zato što svi papirnati srednjoškolski udžbenici „stanu“ u mobitel lakši od 250 g,
· zato što je đačka naprtnjača (koju su spretni trgovci natrpali bespotrebnim stvarima) nepotrebna jer u suvremenoj školi papirnati udžbenici i pribor ostaju u đačkim ormarićima,
· zato što se u suvremenoj školi sve aktivnosti izvršavaju tijekom cjelodnevne nastave, bez domaćih zadaća i nepotrebnog tegljenja naprtnjača tamo i natrag,
· zato što se moramo doživotno samoobrazovati, jer su znanja stečena u školi nedostatna, a tu nam pomažu digitalne tehnologije,
· zato što je internet riznica znanja i informacija kojima svatko može pristupiti u svakom trenutku putem mobitela ili računala i tako proširiti svoje znanje,
· zato što su mnoge novine i časopisi već odustali od tiska te su dostupni samo u digitalnom obliku,
· zato što se digitalnim udžbenicima, novinama i časopisima spašavaju šume, pluća Zemlje, i sprječava zagađivanje voda kemikalijama iz proizvodnje papira i tiskarskih boja,
· zato što šume i pitka voda moraju opstati, jer je u protivnom čovječanstvo je osuđeno na propast,
· zato što se na internetu može besplatno pristupiti svim nastavnim sadržajima iz papirnatih udžbenika, i još mnogo više.
Zašto za znatiželjne učenike?
· zato što je znatiželja urođeno svojstvo većini pripadnika vrste Homo sapiens sapiens,
· zato što je znatiželja pojedinaca, od prapovijesnog doba do danas, dovela do materijalnih i duhovnih stečevina suvremenog društva (civilizacije),
· zato što će znatiželja pojedinaca, sada znatiželjnih učenika, dovesti do novih tehnologija, znanstvenih spoznaja i društvenih promjena,
· zato što su društva i pojedinci, kojih nije briga, i koji se ne prilagođavaju promjenama (društvenim, klimatskim, geopolitičkim, znanstvenim itd.) osuđeni na zaostajanje i izumiranje.
Zašto toliko pokusa?
· zato što se pokusima razvijaju vještine, uči opažati i donositi zaključke na temelju rezultata vlastitih opažanja i mjerenja te razvija sposobnost predviđanja,
· zato što su gore navedene vještine i sposobnosti potrebne u svakom zanimanju, pa su samim time „vježbe za praktičan život“,
· zato što se izvođenjem pokusa upoznaju različite tvari i stječu znanja o njihovim svojstvima i međusobnim kemijskim reakcijama,
· zato što se znanjima o kemijskim svojstvima tvari mogu izbjeći nepromišljeni postupci u radu, skladištenju i uporabi kemikalija, kako u proizvodnji tako i u kućanstvu.
Zašto ovakav redoslijed i ovakvi nastavni sadržaji?
· zato što redoslijed nastavnih sadržaja mora poštivati prirodni razvoj kemije kao znanosti te poštivati pedagoška načela; „od konkretnoga prema apstraktnome“ i „od jednostavnijega ka složenijem“,
· zato što svaki nastavnik može odabrati strategiju i redoslijed obrade nastavnih sadržaja koji smatra najučinkovitijim,
· zato što se suvremeni nastavni program kemije (NN 10/2019) temelji na konceptima: tvari, promjene i procesi, energija i prirodoznanstveni pristup, ali su nastavni sadržaji razbacani bez ikakva reda tj. sustava i ne slijede logiku kemije kao znanosti,
· zato što koncepti tvari, promjene i procesi, energija i prirodoznanstveni pristup ne mogu postojati odvojeno sami za sebe, već se mogu i moraju ostvarivati na konkretnim nastavnim sadržajima redoslijedom koji proizlazi iz hijerarhije sadržaja kemije kao znanosti,
· zato što je STEM (Science, Technology, Engineering, Mathematics) suvremena odgojno-obrazovna paradigma (model).
U Zagrebu sušno ljeto prolazi, a jesenske kiše možda dolaze 2022. godine.
1. ORGANSKI KEMIJSKI SPOJEVI
Ruski kemičar Friedrich Konrad Beilstein (1838. – 1906.), (Фёдор Фёдорович Бейльштейн), prvi je počeo prikupljati sustavne bilješke o organskim spojevima što je konačno dovelo do njegovog poznatog priručnika Handbuch der organischen Chemie (Priručnik za organsku kemiju). Prvo izdanje ovog djela, objavljeno 1881., obuhvatilo je 1500 spojeva na 2200 stranica. Ovaj priručnik, poznat kao Beilsteinova baza podataka pokriva znanstvenu literaturu od 1771. do danas i sadržava eksperimentalno potvrđene podatke iz izvornih znanstvenih publikacija o milijunima kemijskih reakcija i tvari. Od 2009. godine sadržaj ove baze podataka (na engleskom jeziku) održava i distribuira Elsevier Information Systems iz Frankfurta pod nazivom "Reaxys“.
Drugi izvor informacija o svim poznatim organskim i anorganskim spojevima jest baza podataka američkog kemijskog društva (American Chemical Society) poznata kao Chemical Abstracts Service. Ova baza podataka obuhvaća 194 milijuna organskih i anorganskih tvari, objavljenih u znanstvenim časopisima od ranih od 1800-ih godina. Osim organskih i anorganskih spojeva uključuje slitine, koordinacijske spojeve, minerale, smjese, polimere i soli. Nadalje, tu je i oko 70 milijuna sekvenci proteina i nukleinskih kiselina. Baza se svakodnevno nadopunjava podacima o tisućama novih tvari te se svakoj dodjeljuje jedinstveni CAS-broj (CAS-number).
Sažecima znanstvenih radova, prema imenu pojedinog znanstvenika, možete pristupiti OVDJE i OVDJE.
1.1. Podjela organskih spojeva
Tablica 1.1. Podjela i nazivi važnijih organskih spojeva prema funkcijskim skupinama
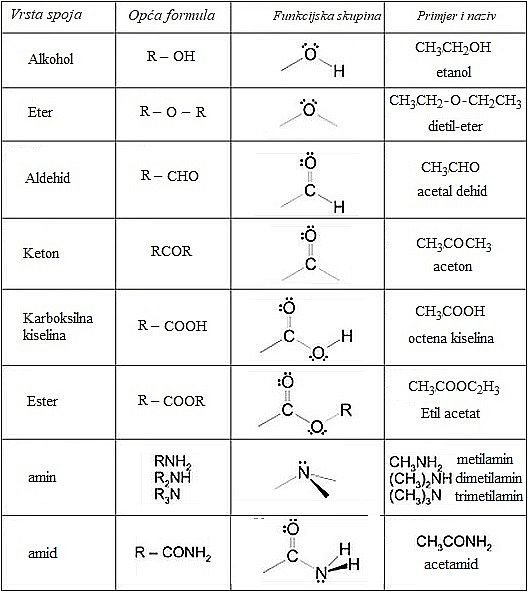
Iako u načelu nema razlike između anorganske i organske kemije, organska kemija je postala znanost sama za sebe. Osim ugljika i vodika u sastav organskih spojeva ulaze i drugi kemijski elementi. U tvarima prirodnog podrijetla to su najčešće dušik, kisik i sumpor. Ti su atomi, ili skupine atoma, vezani na osnovni skelet ugljikovih atoma. Na tim se skupinama najlakše događaju kemijske reakcije, pa se stoga nazivaju se funkcijskim skupinama. Svi organski spojevi koji imaju istu funkcijsku skupinu svrstavaju se zajedno, jer imaju slična kemijska svojstva. Preostali dio molekule, tj. skupina atoma vezana na funkcijsku skupinu, najčešće se ne mijenja tijekom reakcije. Taj se dio molekule često označava simbolom R, što je skraćena oznaka za radikal (lat. radix = korijen).
1.2. Određivanje formule spoja
Prvi i najvažniji korak u određivanju molekulske strukture bilo kojeg spoja jest izolacija čistoga uzorka i njegova kvalitativna i kvantitativna analiza, tj. određivanje empirijske formule spoja.
Sljedeći korak u istraživanju je određivanje relativne molekulske mase, tj. molekulske formule koja pokazuje pravi broj atoma pojedinih elemenata u molekuli..
Na kraju treba doznati strukturnu formulu, koja pokazuje vrstu veze i redoslijed kojom su atomi vezani u molekuli. Kojiput i to nije dovoljno, pa je potrebno odrediti kristalnu i molekulsku strukturu, koja uključuje podatke o međuatomskim udaljenostima, valentnim kutovima i međusobnom razmještaju pojedinih dijelova i cijelih molekula u prostoru.
Većina organskih spojeva sadržava ugljik, vodik, dušik i kisik. Određivanje omjera tih elemenata u spoju nekad je bio mukotrpan posao. Radilo se tako da se točno izvagana masa organskog spoja, oko 5 mg, spali u atmosferi kisika pri temperaturi 600 do 800 °C. Produkti spaljivanja, ugljikov dioksid i voda, nošeni strujom kisika vezali su se u prethodno izvaganim apsorpcijskim cijevima. Masa nastale vode određivala se iz prirasta mase apsorpcijske cijevi punjene bezvodnim magnezijevim perkloratom, koji nakon što veže vodu prelazi u heksahidrat, Mg(ClO4)2×6H2O. Ugljikov dioksid vezao se u apsorpcijskoj cijevi punjenoj smjesom kalcijeva oksida i natrijeva hidroksida na azbestu, koji nakon vezivanja ugljikova dioksida prelaze u kalcijev karbonat, CaCO3, i natrijev karbonat, Na2CO3. Iz prirasta masa apsorpcijskih cijevi izračunavao se maseni udio vodika i ugljika u spoju.

Slika 1.1. Povijesni način određivanja sadržaja ugljika i vodika u organskom spoju. Aparatura je sadržavala peć za spaljivanje i cijevi za apsorpciju nastale vodene pare i ugljikova dioksida. Slika izvor: elementar.com
Takvi pribori za određivanje sastava organskih spojeva danas se ne rabe. Zamijenili su ih automatizirani uređaji za CHN analizu (CHN Elemental Analyzer) koji za minutu mogu odrediti udio ugljika, vodika, dušika u organskom spoju.
Molarne mase moguće je odrediti na više načina. U industrijskim i istraživačkim laboratorijima danas se molarne mase organskih spojeva mnogo točnije određuju spektrografom masâ. No najčešće se rabe instrumenti koji u sebi uključuju plinski kromatograf i spektrometar masa.
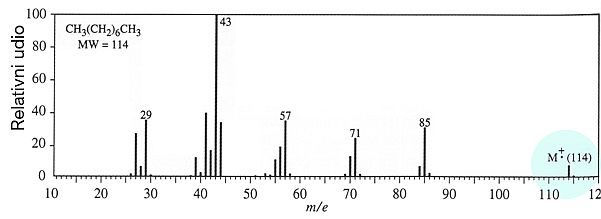
Slika 1.2. Spektrogram masa n-oktana
Uzorak se injektira u instrument u obliku pare. Pri tlaku od 10−3 Pa, koji vlada u instrumentu, brzi elektroni bombardiraju molekule i proizvode niz pozitivno nabijenih iona. Primjerice, ako molekula n-oktana, C8H18, u sudaru izgubi jedan elektron, nastat će pozitivni ion, C8H18+. U detektoru će zato biti registriran pozitivan ion s masenim brojem 114. Istodobno u instrumentu dolazi i do cijepanja molekula na manje čestice, kao što su C6H13+, C5H11+, i druge manje ione. Relativna molekulska masa ispitivanog spoja jednaka je najvećoj opaženoj vrijednosti masenog broja, a ta je u ovom slučaju 114.
Važno je znati da svaki spoj ima karakterističan spektrogram masa, jer se pri sudaru s brzim elektronima njegove molekule pri istoj energiji elektronskog snopa uvijek raspadaju na jednak način. Spektrogram masa je kao otisak prsta na osnovi kojeg se može identificirati kemijski spoj.
Podatak o relativnoj molekulskoj masi spoja ipak ništa ne govori o tome kako su atomi međusobno povezani u molekuli jer više različitih spojeva može imati istu molekulsku formulu. Zato je krajnji cilj svakog istraživanja nepoznatog spoja doznati njegovu strukturnu formulu ili, još bolje, prostorni razmještaj atoma u molekuli. U određivanju strukturne formule spoja samo donekle pomaže spektrogram masa jer se iz njega mogu pročitati mase fragmenata nastalih cijepanjem polazne molekule. Slažući te fragmente može se u jednostavnijim slučajevima rekonstruirati molekulu iz koje su oni nastali.
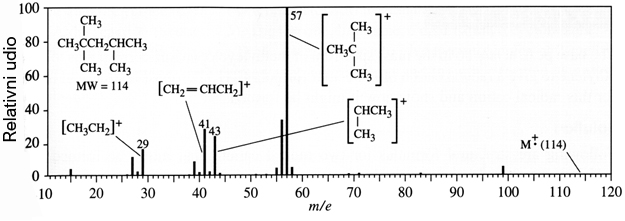
Slika 1.3. Spektrogram masa izooktana (2,2,4-trimetilpentana)
Primjerice, 2,2,4-trimetilpentan je ugljikovodik iste relativne molekulske mase i iste bruto formule kao i n-oktan. No njegov se maseni spektar razlikuje od spektra n-oktana jer se u masenom spektrografu cijepa na drukčije fragmente. Primjerice, ne opaža se molekulski ion koji bi odgovarao omjeru m/e = 114. U masenom spektru 2,2,4-trimetilpentana vidi se i kation, CH3CH2+, iako molekula ne sadržava CH3CH2-skupinu. To se može objasniti tako da je taj kation nastao spajanjem nekih fragmenata. Za ispravnu interpretaciju masenog spektra potrebno je veliko iskustvo.
Da bi se odredila strukturna formula organskog spoja, potrebno je kombinirati različite kemijske i spektroskopske metode. Kemijske metode temelje se na kemijskim reakcijama s funkcijskim skupinama spoja. Od fizikalnih metoda najčešće se rabe metode molekulske spektroskopije: infracrvena spektroskopija (IR, infrared), ultraljubičasta/vidljiva spektrofotometrija, (UV/Vis, ultraviolet–visible), spektrometrija masa (MS, Mass spectrometry), NMR spektroskopija (Nuclear magnetic resonance spectroscopy). O vrstama i metodama molekulske spektroskopije više doznajte OVDJE.
Kristalnu i molekulsku strukturu, odnosno valentne kutove, duljine veza među atomima u molekuli i međusobnu orijentaciju molekula u prostoru može se doznati samo metodama difrakcije rentgenskih zraka ili difrakcije neutrona na monokristalnom uzorku spoja.
Zadaci i teme za vlastite aktivnosti i samoobrazovanje
Pronađite na internetu i proučite sadržaje u
svezi s metodama kemijske analize i određivanja strukture
organskih spojeva.
N. Raos, Kako definirati organsku kemiju?, Kem. Ind. 71 (7-8) (2022) 507-512.
Izradite plakat, PowerPoint prezentaciju, snimite video, održite predavanje u razredu, organizirajte raspravu ili pišite u školskom listu o kemijskoj analizi i određivanju strukture organskih spojeva.
2. MEHANIZAM KEMIJSKE REAKCIJE
Pri planiranja izvođenja kemijske reakcije obično se postavlja više pitanja. Prvo: hoće li tom reakcijom uopće nastati željeni produkti? Drugo: koliko će brzo doći do reakcije? Treće: koliko će se dobiti željenog produkta, tj. koliko će biti iskorištenje? Četvrto: što se događa na molekulskoj razini tijekom odvijanja reakcije? U ovom ćemo se poglavlju baviti mehanizmima prema kojima se odvijaju neke najvažnije kemijske reakcije.
Mehanizam reakcije opisuje uzastopne korake na molekulskoj razini koji se odvijaju tijekom neke kemijske reakcije. To je teorijska pretpostavka kojom se pokušava detaljno opisati što se događa u svakoj fazi kemijske reakcije, tj. kako pojedini atomi, ioni, elektroni, slobodni radikali i molekule međusobno reagiraju kako bi nastali određeni produkti. Kemijske reakcije uključuju promjene u načinu vezivanja molekula, tj. promjene u relativnim položaja atoma u i među molekulama, kao i pomake u elektronima koji drže atome zajedno u kemijskim vezama. Stoga mehanizmi reakcija moraju uključivati opise svih tih kretanja obzirom na vrijeme i prostorni razmještaj atoma u molekulama.
Pri istraživanju reakcijskih mehanizama od posebne su važnosti energijske promjene koje se događaju tijekom reakcija. Da bi molekule kemijski reagirale moraju se sudariti, ali svaki sudar ne će rezultirati kemijskom reakcijom. Međusobno mogu reagirati samo one molekule koje imaju energiju veću od energije aktivacije. Energija aktivacije, Ea, je minimalna kinetička energija koju moraju imati reaktanti da bi kemijska reakcija započela. Čak i egzotermne reakcije zahtijevaju određenu količinu energije da bi uopće krenule prije nego što mogu nastaviti s oslobađanjem energije. Ovaj početni unos energije kasnije se vraća napredovanjem reakcije. Reakcija započinje kad molekule reaktanata sudarima apsorbiraju dovoljno energije. Pri tome nastaje aktivirani kompleks ili prijelazno stanje. (Vidi sliku 2.1.) Aktivirani kompleks može prijeći u produkte reakcije bez daljnjeg unosa energije, ali se može i raspasti natrag na reaktante. Svaka se reakcija odvija onim putem koji zahtijeva najmanju energiju aktivacije. Aktivirani kompleks ne može se izolirati.
Poznato je mnogo vrsta kemijskih reakcija, ali mi ćemo se pozabaviti samo mehanizmima nekih najvažnijih: fotokemijska reakcija, reakcija slobodnih radikala, reakcija adicije, reakcija supstitucije i reakcija eliminacije.
2.1. Fotokemijska reakcija: H2 + Cl2 → 2 HCl
U udžbeniku e-Kemija 2, u poglavlju 7,2.2. Klor, doznali smo da smjesa vodika i klora u mraku može stajati neograničeno dugo. Do kemijske reakcije, tj. žestoke eksplozije, doći će tek kad se ova smjesa obasja jakom sunčevom ili plavom svjetlošću.
Pokus 2.1. Eksplozija smjese vodika i klora
Vidi na internetu:
Chris Cramer - Hydrogen Chloride Cannon
Primjer 2.1. Energija veze klor-klor iznosi 243,36 kJ mol−1. Izračunajte valnu duljinu svjetlosti koja može prouzročiti fotodisocijaciju molekula klora na atome klora.
Rješenje. Energija mola fotona potrebna za cijepanje mola veza klor-klor je:
Odavde za valnu duljinu svjetlosti dobivamo:
To je upravo valna duljina plave svjetlosti. Stoga je razumljivo zašto crvena i zelena svjetlost lasera ne izaziva eksploziju smjese vodika i klora kao i smjese metana i klora.
Osnovne spoznaje о fotokemijskim reakcijama sadržane su u dva fotokemijska zakona. Prvi zakon formulirali su T . D. Grotthuss (1817.) i J. W. Draper (1843.): fotokemijske reakcije uzrokuje samo ono svjetlo koje je apsorbirano u toj tvari. Drugi zakon formulirali su J. Stark (1908.— 1912.) i A. Einstein (1912.—1913.): svaka molekula koja sudjeluje u fotokemijskoj reakciji apsorbira jedan kvant zračenja. Hoće li molekula apsorbirati UV, ili vidljivo svjetlo ovisi o energiji fotona i elektronskoj konfiguraciji molekule. U primjeru 2.1. izračunali smo: kad molekula klora apsorbira kvant svjetlosti valne duljine 491,5 nm ili kraće, pokidat će se kemijska veza Cl-Cl, pri čemu će nastati atomi klora. No atomi klora imaju jedan nespareni elektron. Atomi, molekule ili ioni koji imaju jedan ili više nesparenih elektrona nazivaju se slobodni radikali, ili, jednostavno radikali. Kemijski su vrlo reaktivni.
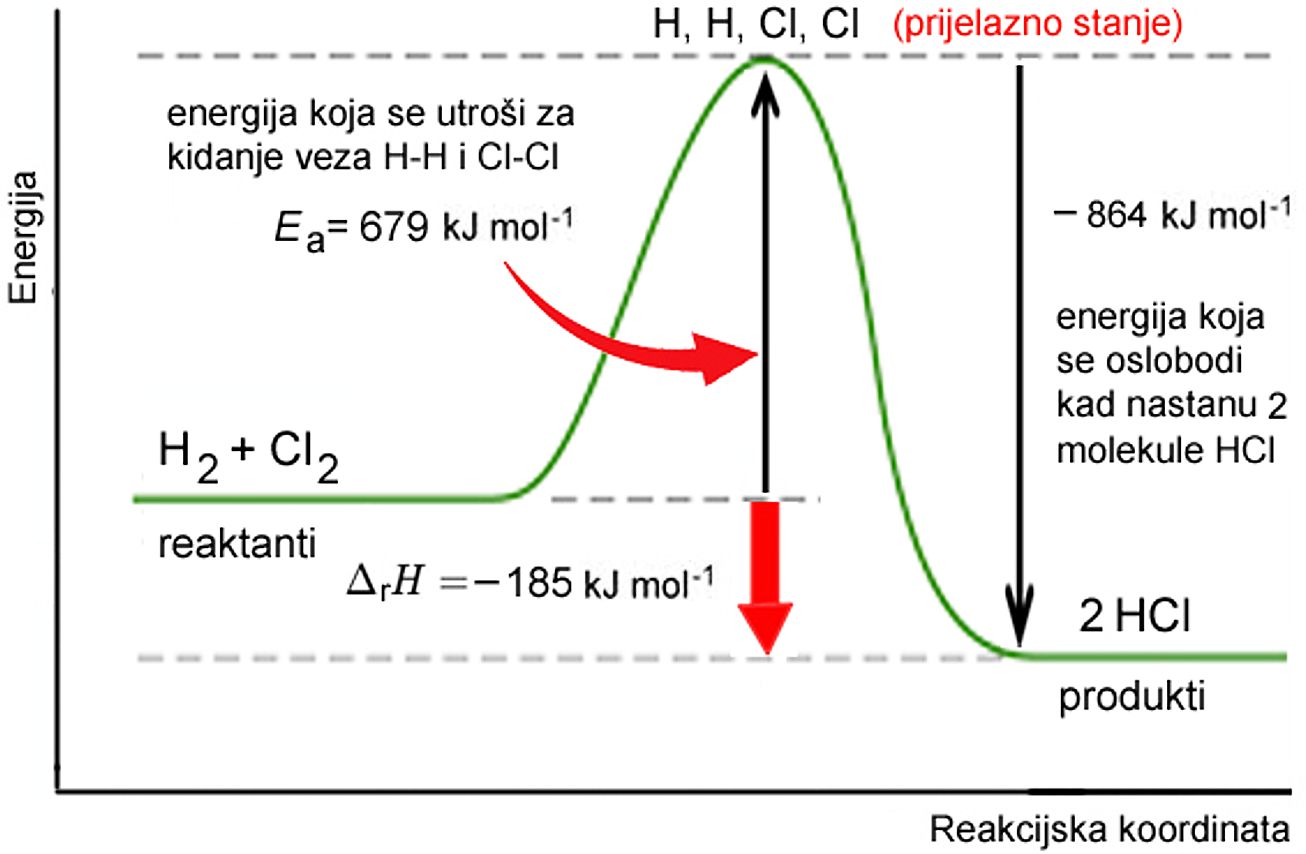
Slika 2.1. Energijske promjene u reakciji H2 + Cl2 → 2 HCl
Reakcija između vodika i klora započinje tako da molekula klora apsorbira kvant svjetlosti. Taj se prvi korak naziva inicijacija:
Cl2 + hν → 2 Cl·
Nastali slobodni radikali Cl·(g) reagiraju s molekulama vodika pri čemu nastaju novi slobodni radikali, H·(g). Stoga dolazi do lančane reakcije. Taj se korak naziva propagacija:
Cl· + H2 → H· + HCl
H· + Cl2 → Cl· + HCl
H· + HCl → Cl· + H2
Lančana reakcija se prekida zbog rekombinacije međuprodukta, djelovanja kakva vanjskoga čimbenika ili potpunog utroška reaktanata.
Cl· + Cl· → Cl2
H· + H· → H2
H· + Cl· → HCl
Taj se korak naziva terminacija
Primjer 2.2. Izračunajte
energiju aktivacije i reakcijsku entalpiju za reakciju
H2 + Cl2 → 2 HCl ako su energije veza:
Cl―Cl = 243 kJ mol−1, H―H = 436 kJ mol−1, H―Cl = 432 kJ mol−1.
Rješenje. Kao što smo već pokazali u reakciji H2 + Cl2 → 2 HCl međusobno reagiraju slobodni radikali Cl·(g) i H·(g). Stoga je energija aktivacije jednaka zbroju energija potrebnih za kidanje veza C―C i H―H.
Ea = (243 +436) kJ mol−1 = 679 kJ mol−1
Energija koja se oslobodi kad nastanu 2 HCl: = - 864 kJ mol−1
Odavde proizlazi:
H2 + Cl2 → 2HCl DrH = - 185 kJ mol−1
Vidi na internetu: Photochlorination - The Reaction between Methane and Chlorine
2.2. Katalitičko hidrogeniranje etena
U udžbeniku e-Kemija 2, u poglavlju 7.5.5. Alkeni doznali smo da su zbog dvostrukih veza u molekulama alkeni vrlo reaktivni. Za njih su karakteristične reakcije adicije pri kojima se neki atom ili skupina atoma veže na ugljikove atome s dvostrukom vezom. Pritom umjesto dvostruke nastaju dvije jednostruke veze. Tako se adicijom vodika na eten dobije etan:
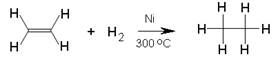
Slika 2.2. Shematski prikaz reakcije hidrogeniranja etena
Hidrogeniranje dvostruke veze termodinamički je povoljna reakcija jer nastaje energijski stabilniji produkt, tj. energija produkata manja je od energije reaktanata. Stoga je hidrogeniranje alkena egzotermna reakcija, a oslobođena toplina naziva se toplinom hidrogeniranja. Iako je hidrogeniranje alkena termodinamički povoljna reakcija, ona se neće odvijati bez dodatka katalizatora.
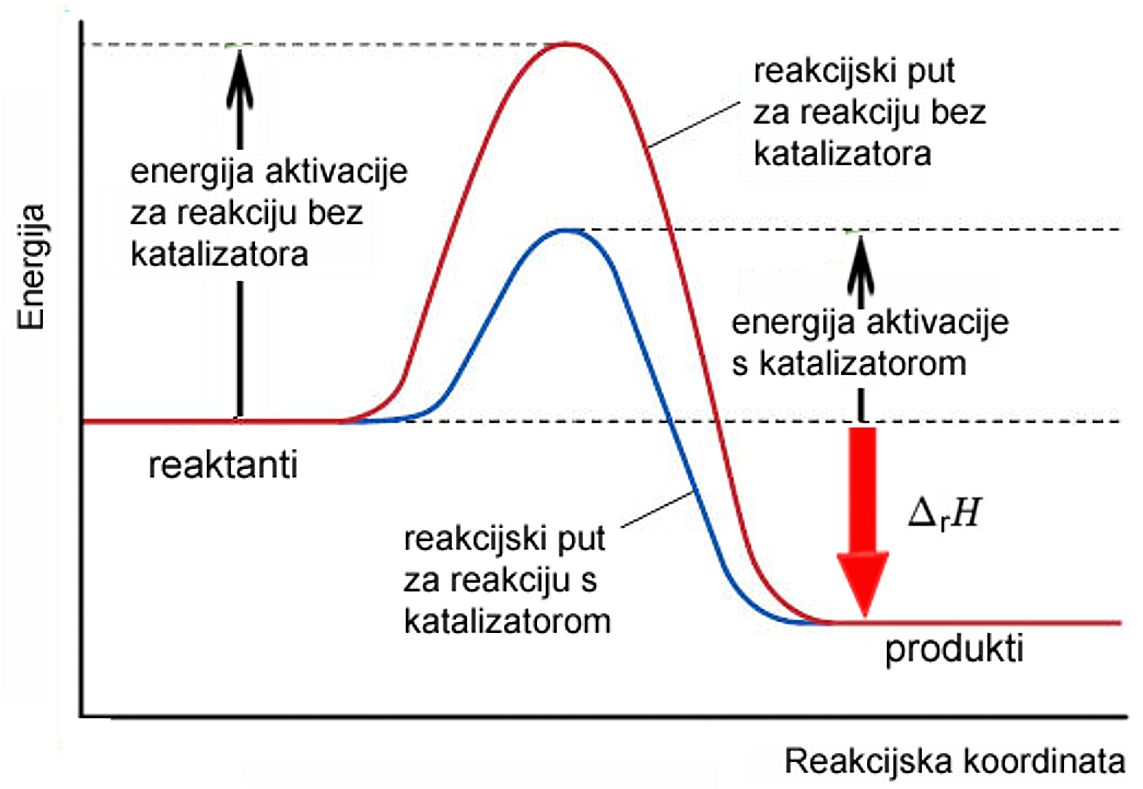
Slika 2.3. Energija aktivacije hidrogeniranja etena sa i bez katalizatora
Katalizatori su spojevi koji ubrzavaju odvijanje kemijske reakcije. Oni sudjeluju u kemijskoj reakciji, ali iz nje izlaze nepromijenjeni. Djelovanjem katalizatora smanjuje se energija aktivacije te tako povećava brzina reakcije. Katalizatori ne utječu na kemijsku ravnotežu već samo ubrzavaju postizanje ravnotežnog stanja.
Ako su reaktanti, produkti i katalizator u istom agregacijskom stanju, tad je riječ o homogenoj katalizi. U slučaju kad je katalizator u nekom drugom agregacijskom stanju u odnosu na reaktante i produkte, tad je riječ o heterogenoj katalizi. Oko 90 % svih procesa u kemijskoj industriji izvodi se pomoću katalizatora, pri čemu oko 80 % katalizatora čine kruti katalizatori. Uobičajeni katalizatori su metali kao što je paladij na aktivnom ugljiku, platina u obliku PtO2 i nikal u obliku spužvastog nikla (Raney nickel). Uz prisutnost metalnog katalizatora, H―H veza u H2 se cijepa, a atomi vodika se važu na površinu metalnog katalizatora pri čemu nastaju veze metal―vodik. Slično se na površinu katalizatora vežu molekule etena.
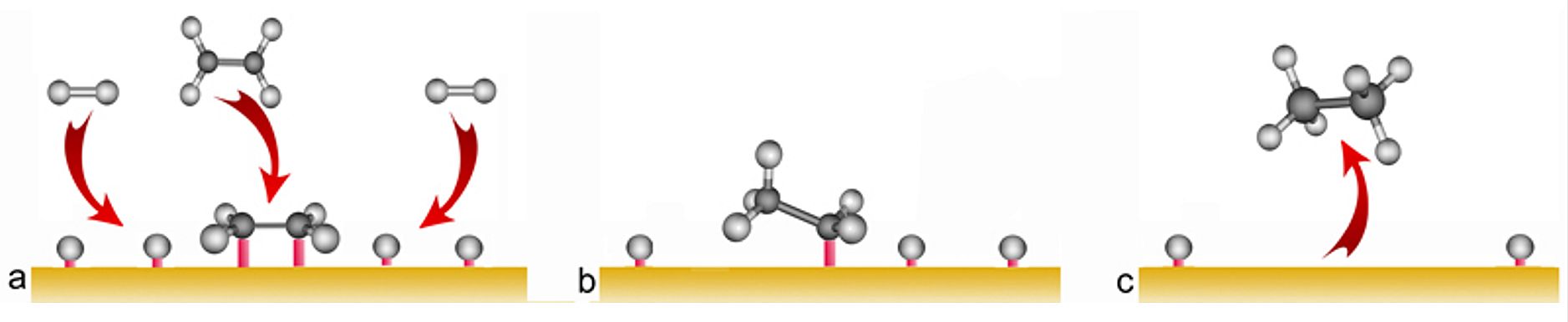
Slika 2.4. Shematski prikaz hidrogeniranja etena na površini metalnog katalizatora. a) Reaktanti se adsorbiraju na površinu metala. Pritom se veza H―H cijepa pa nastaju veze metal―vodik. Dvostruka veza u etenu također se cijepa pa nastaju dvije veze metal―eten. b) Jedan , a potom i drugi atom vodika, prenosi se na eten pa nastaje etan. c) Produkti reakcije se desorbiraju a aktivno mjesto na površini katalizatora se oslobađa tako da može adsorbirati nove reaktante.
Kod heterogene katalize zahtijeva se što veća površina katalizatora, jer je prvi korak u heterogenoj katalizi adsorpcija reaktanata na površinu. Kao katalizatori najčešće se rabe prijelazni metali ili njihovi oksidi. To je zato što prijelazni metali imaju polupopunjene d-orbitale pomoću kojih čine vrlo reaktivne međuprodukte s molekulama adsorbiranih tvari. Pri tome se jedne veze kidaju a druge nastaju. Da bi se održao stalan omjer adsorbiranih tvari na površini katalizatora (reaktanata, međuprodukata i produkata) mora doći do desorpcije produkata reakcije. Kažemo da se na površini katalizatora uspostavlja dinamička ravnoteža. Što je veća površina katalizatora, to će se više reaktanata adsorbirati i međusobno reagirati, pa će se reakcija odvijati brže.
Reakcije hidrogeniranja koriste se primjerice u prehrambenoj industriji kako bi se od tekućih ulja napravio veliki izbor industrijskih proizvoda, poput namaza. Tako se dobivaju polukruti produkti poput margarina i dr.
Vidi na internetu: Catalytic Reactor: Hydrogenation
Zadaci i teme za vlastite aktivnosti
i samoobrazovanje
- Istražite građu automobilskog katalizatora.
- Koje se kemijske reakcije događaju unutar automobilskog katalizatora?
- Kakav utjecaj imaju ispušni plinovi automobila bez katalizatora na zdravlje stanovnika i atmosferu u velikim gradovima?
- Izradite plakat, PowerPoint prezentaciju, snimite video, održite predavanje u razredu, organizirajte raspravu ili pišite u školskom listu o katalizatorima.
2.3. Adicija halogenovodika na alkene
U udžbeniku e-Kemija 2, u poglavlju 7.5.5. Alkeni, kazali smo da se adicija halogenovodika na dvostruku vezu odvija tako da se vodik adira na onaj ugljikov atom koji je vezan s većim brojem vodikovih atoma. Tu je zakonitost 1868. otkrio ruski kemičar Vladimir Vasiljevič Markovnikov pa se njemu u čast naziva Markovnikovljevo pravilo. Primjerice, adicijom bromovodika na but−1−en nastat će 2−brombutan, a ne 1−brombutan:
CH2=CH−CH2−CH3 + HBr → CH3−CHBr−CH2−CH3.
No nismo objasnili zašto se reakcija baš tako događa. U organskoj kemiji ima mnogo kemijskih reakcija, no najviše pažnje posvetit ćemo mehanizmima reakcija adicije i supstitucije koje nalazimo u programima kemije za 3. razred srednjih škola. Razumijevanje mehanizma ovih reakcija pomoći će vam razumijevanju i drugih reakcija u organskoj kemiji.
Suvremena škola ne traži samo poznavanje činjenica nego i njihovo razumijevanje, tj. zašto i kako se kemijske reakcije događaju. Da bismo bolje razumjeli mehanizam adicije halogenovodika na dvostruku vezu, moramo više doznati o prirodi dvostruke veze. U udžbeniku e-Kemija 1, u poglavlju 5.2.8. Kvantno mehanički model atoma vodika, sramežljivo smo spomenuli elektronske oblake p-orbitala, jer je taj nastavni sadržaj predviđen za četvrti razred (gdje je sam sebi svrha). U poglavlju 6.8. Kovalentna veza pokazali smo da se u molekuli vodika elektronski oblaci s-orbitala prekrivaju i tako čine jednostruku kovalentnu ili s-vezu. Pritom je najveća vjerojatnost nalaženja elektrona u prostru između atomskih jezgara. No dvostruka veza sastoji se od s-veze i p-veze koja nastaje bočnim prekrivanjem elektronskih oblaka p-atomskih orbitala. Prekrivanje elektronskih oblaka u dvostrukoj vezi C=C shematski je prikazano na slici 2.5.
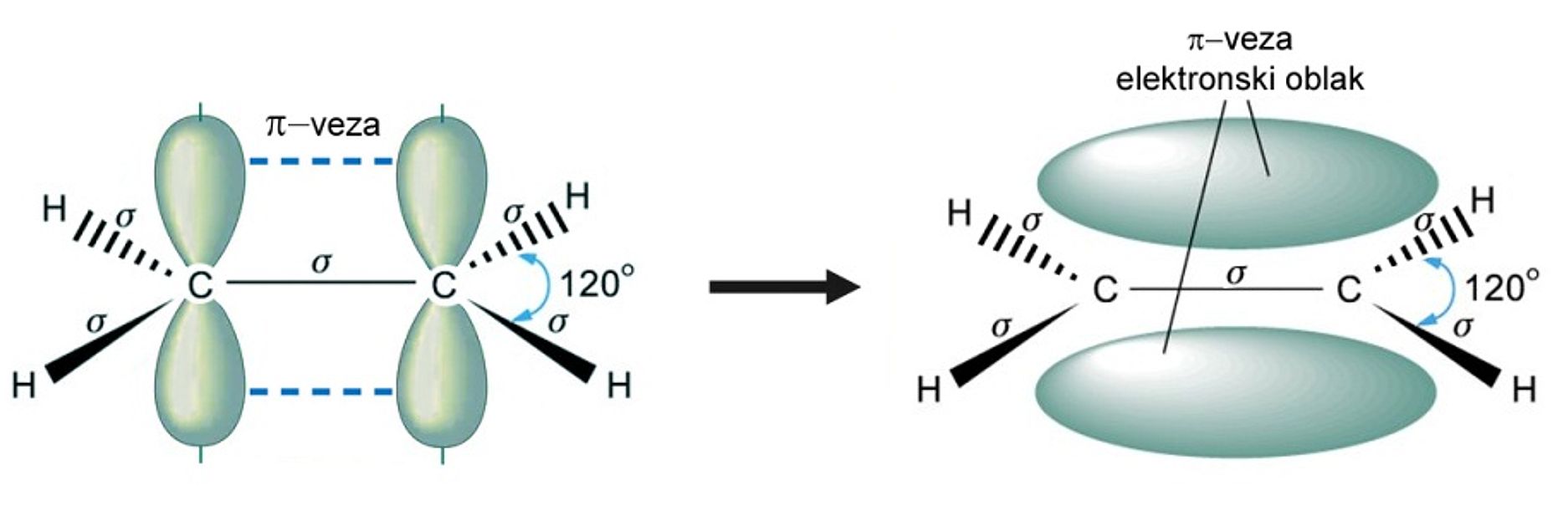
Slika 2.5. Prekrivanje elektronskih oblaka u molekuli etana. Uočite da se dvostruka veza sastoji od sigma i p-veze. P-veza nastaje bočnim prekrivanjem elektronskih oblak p-atomskih orbitala. Elektronski oblak p-veze rasprostire se iznad i ispod ravnine koju čine atomi ugljika i vodika.
Da bismo razumjeli mehanizam adicije na alkene, moramo se najprije prisjetiti da je klor elektronegativniji od vodika. Stoga je molekula klorovodika dipol u kojem je mali negativni naboj koncentriran na atomu klora, a mali pozitivni naboj na atomu vodika. Reakcija adicije halogenovodika na alken događa se u dva koraka. U prvom koraku, p-elektroni alkena djeluju kao nukleofili, tj. privlače djelomično pozitivno nabijeni vodik (elektrofil) iz molekule klorovodika. Kako se p-elektroni alkena kreću prema vodiku, tako se atom Cl odmiče s veznim elektronima pa veza H―Cl puca. Pritom nastaje nova s-veza između vodika i jedne dvostruke veze na ugljiku. Tako u prvom koraku nastaju karbokation i kloridni ion Cl―. Karbokation nastaje na onom ugljikovu atomu na kojemu je vezano više alkilnih skupina. Takav je karbokation najstabilniji. U drugom koraku, kloridni ion, Cl― napada pozitivno nabijeni karbokation dajući konačni produkt.
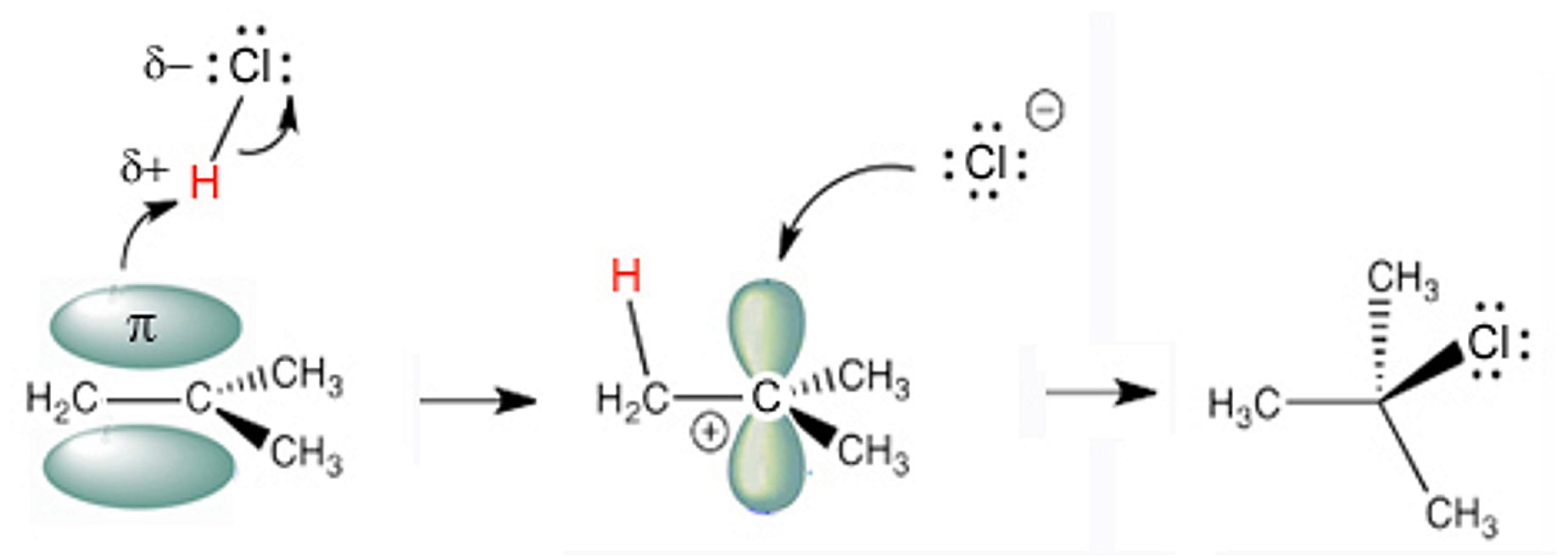
Slika 2.6. Shematski prikaz adicije klorovodika na dvostruku vezu. Karbokation nastaje na onom ugljikovu atomu na kojemu je vezano više alkilnih skupina. Takav je karbokation najstabilniji. To znači da će se vodik vezati na onaj C-atom na koji je vezano više atoma vodika (Markovnikovljevo pravilo).
Nukleofili su sve molekule i ioni koji imaju nepodijeljeni elektronski par. Nukleofili tvore kemijske veze s elektrofilima tako da im doniraju elektronski par. Elektrofili tvore kemijske veze s nukleofilima tako da prihvaćaju elektronski par. Većina elektrofila ima pozitivan naboj ili ima atom koji nema oktet elektrona. Karbokation je organska molekula s pozitivnim formalnim nabojem na ugljikovu atomu.
Zadaci i teme za vlastite aktivnosti i samoobrazovanje
Predložite mehanizam reakcije adicije vode u kiselim uvjetima na eten, propen i 2-metil-1-buten. Koji produkti pritom nastaju? Napišite strukturne formule i imena produkata.
Provjerite svoje odgovore OVDJE i OVDJE.
Izradite plakat, PowerPoint prezentaciju, snimite video, održite predavanje u razredu, organizirajte raspravu ili pišite u školskom listu o mehanizmima kemijskih reakcija,
2.4. Reakcija supstitucije
U udžbeniku e-Kemija 2, u poglavlju 7.5.3. Zasićeni ugljikovodici ili alkani doznali smo da smjesa metana i klora može neograničeno dugo stajati u mraku. No ako se tu smjesu obasja UV svjetlošću doći će do žestoke eksplozije. Pritom se jedan ili više vodikovih atoma u molekuli metana zamijeni (supstituira) atomima klora. Reakcije u kojima se atom ili dio molekule zamjenjuje nekim drugim atomom ili skupinom atoma nazivaju se reakcijama supstitucije.
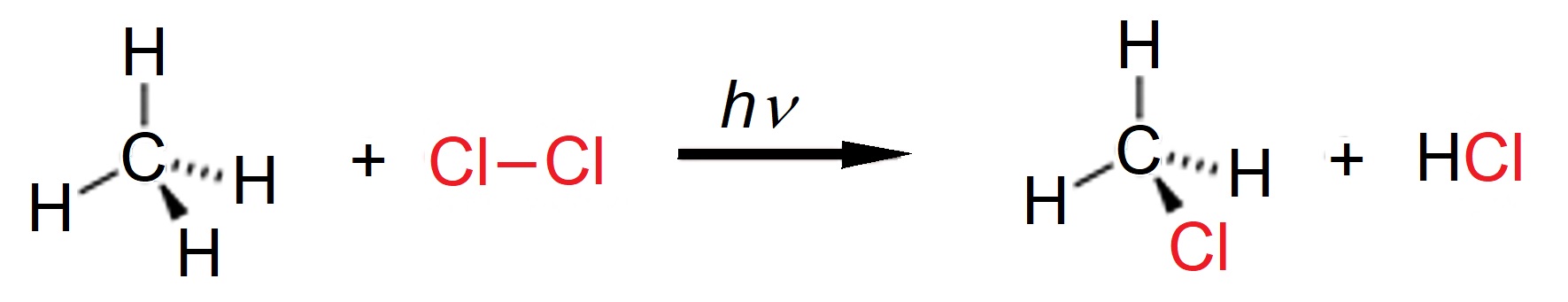
Slika 2.7. Shematski prikaz reakcije supstitucije
Pokus 2.2. Eksplozija smjese metana i klora
Vidi na internetu: Science Skool - Photochlorination
Metan i klor međusobno reagiraju tek kad ih se obasja ultraljubičastom svjetlošću. Pritom dolazi do žestoke eksplozije.
CH4 + Cl2 → CH3Cl + HCl DH = ―184,6 kJ mol−1
Unatoč tomu što je reakcija egzotermna do kemijske reakcije između molekula s kovalentnim vezama potrebno je najprije neke veze pokidati da bi nove mogle nastati. Kloriranje metana tipičan je primjer fotokemijske reakcije u kojoj molekula klora apsorbira jedan kvant svjetlosti. Ako je energija apsorbirane svjetlosti veća od energije veze Cl―Cl, doći će do kidanja veze i nastajanja slobodnih radikala.
hn + Cl2 → Cl· + Cl· DH = 243,36 kJ mol−1
Nastali slobodni radikali, tj. atomi klora, bogati su energijom te brzo reagiraju s molekulama metana pa nastaje klorovodik i metilni radikal, ·CH3
CH4 + Cl· → HCl + CH3·
Nastali metilni radikal dalje reagira s molekulom klora pri čemu se oslobodi novi klorov radikal, Cl·, koji pak reagira s molekulom alkana:
CH3· + Cl2 → CH3Cl + Cl·
Cl· + CH4 → HCl + CH3·
Slijedi lančana reakcija jer se u svakoj reakciji oslobodi novi radikal koji reagira s molekulom klora, metana ili klormetana. Stoga pri kloriranju metana nastaje više produkata: CH3Cl, CH2Cl2, CHCl3 i CCl4. U načelu jedan bi radikal mogao uzrokovati neograničen broj daljnjih reakcijskih stupnjeva u lančanoj reakciji, ali se u stvarnosti to ne događa. Najčešće reakcija završava spajanjem dvaju slobodnih radikala pri čemu nastaje stabilan produkt:
Cl· + Cl· → Cl : Cl
Cl· + CH3· → CH3Cl
CH3· + CH3· → H3C–CH3
Vidi na internetu:
Kwantlen Polytechnic University - Halogenation reaction of alkanes/
2.5. Nukleofilna supstitucija - SN2 mehanizam
Najčešće reakcije u organskoj kemiji jesu reakcije nukleofilne supstitucije. Reakcija supstitucije je bilo koja kemijska reakcija u kojoj se atom, ion ili skupina atoma ili iona u molekuli zamijeni drugim atomom, ionom ili skupinom.
U reakciji nukleofilne supstitucije molekula ili ion bogat elektronima (nukleofil) zamjenjuje funkcijsku skupinu unutar druge molekule s nedostatkom elektrona (elektrofil).
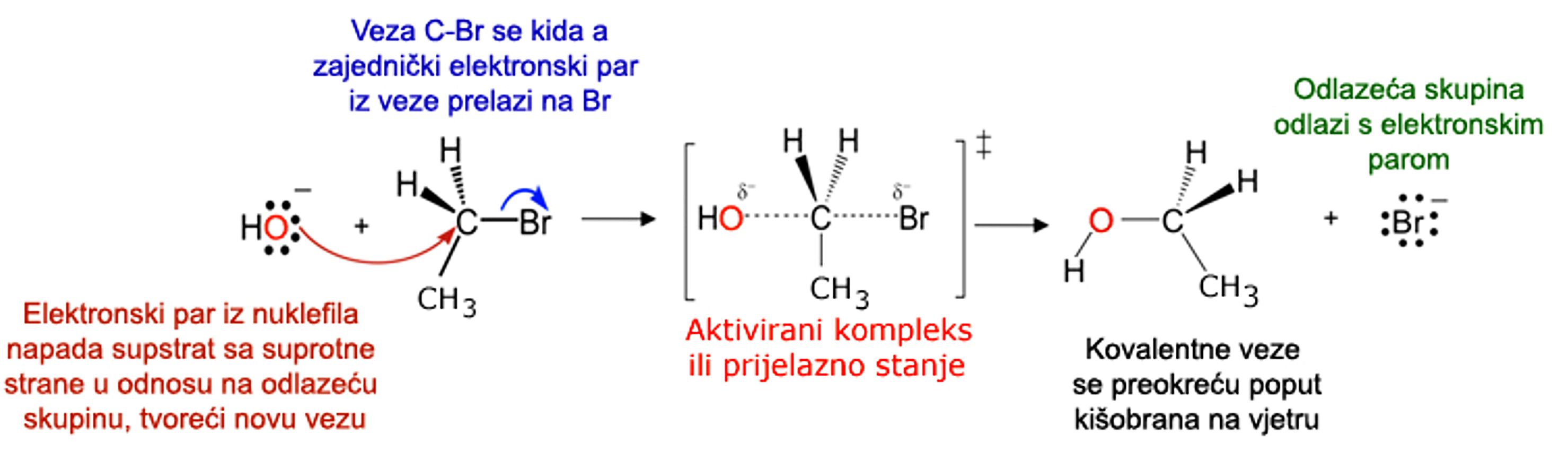
Slika 2.8. Shematski prikaz kidanja i nastajanja kemijskih veza u reakciji brometana s hidroksidnim ionima. Slika izvor: University of Texas - Chemistry 302
Slika 2.9. shematski prikazuje reakcijski put SN2 nukleofilne supstitucije. Veliko slovo S znači da se radi o reakciji supstitucije, slovo N označava nukleofilnu supstituciju, a broj 2 kazuje da na brzinu reakcije utječu koncentracije supstrata i elektrofila. Molekula koja sadržava elektrofil i odlazeću funkcijsku skupinu naziva se supstrat. Dvije su molekule uključene u prijelazno stanje u kojem se istodobno raskida jedna i nastaje druga veza.
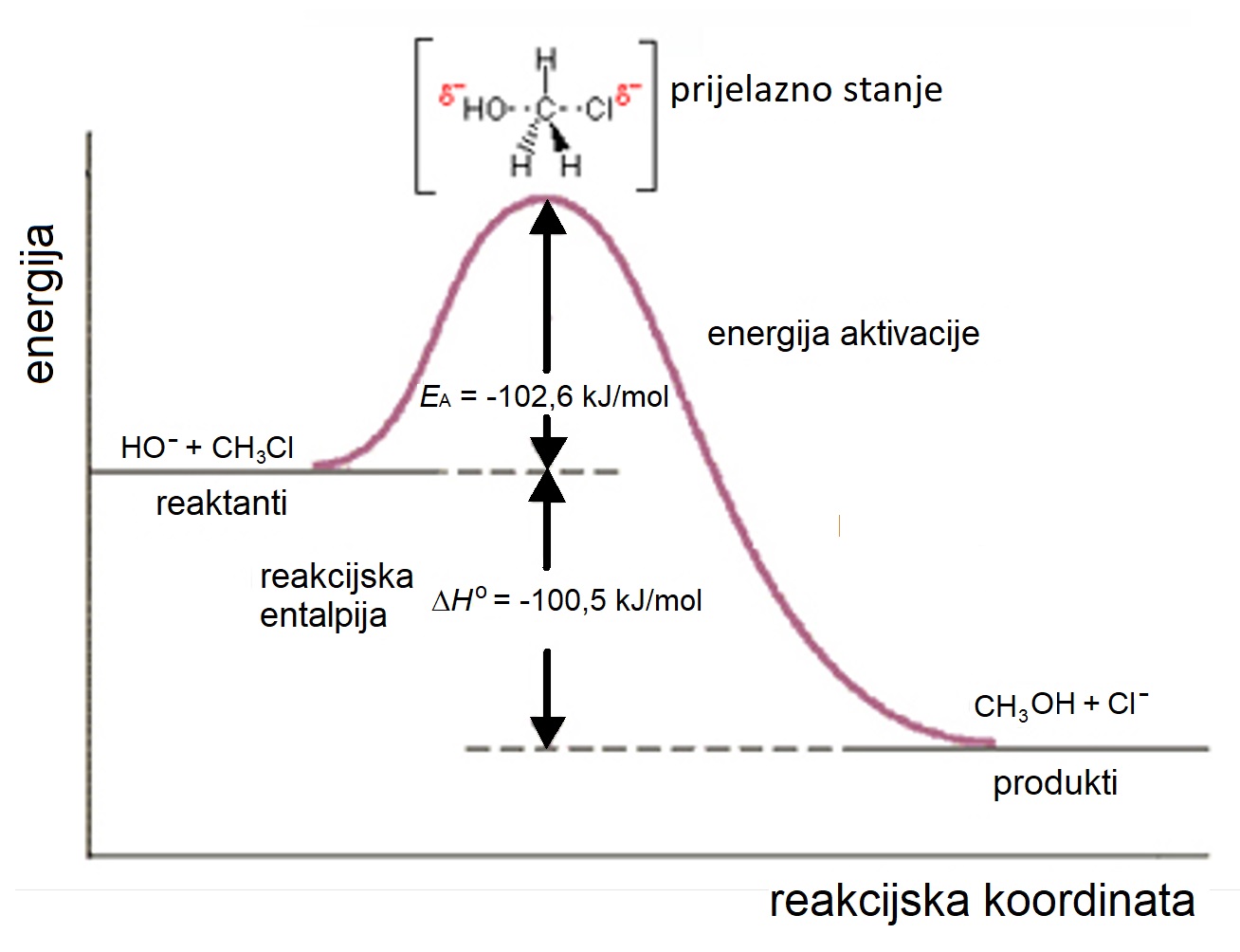
Slika 2.9. Shematski prikaz tijeka SN2 nukleofilne supstitucije koja se odvija putem
prijelaznoga stanja. Energija aktivacije, EA, ovisi o strukturi supstrata,
nukleofila i odlazeće skupine. Reakcija hidroksidnog iona s klormetanom
odvija se u jednom koraku. Brzina reakcije ovisi o koncentraciji oba reaktanata.
Slika izvor: pressbooks.pub - organic chemistry
2.6. Nukleofilna supstitucija - SN1 mehanizam
SN1 reakcije imaju tri koraka; započinju uklanjanjem odlazeće skupine, što rezultira nastajanjem planarnog karbokationa, a potom slijedi napad nukleofila. Kako nukleofil planarnom karbokationu može pristupiti s obje strane nastat će dva produkta koji se međusobno odnose kao predmet i slika u zrcalu. Brzina reakcije nukleofilne supstitucije određuje najsporiji korak te ovisi samo o koncentraciji supstrata.
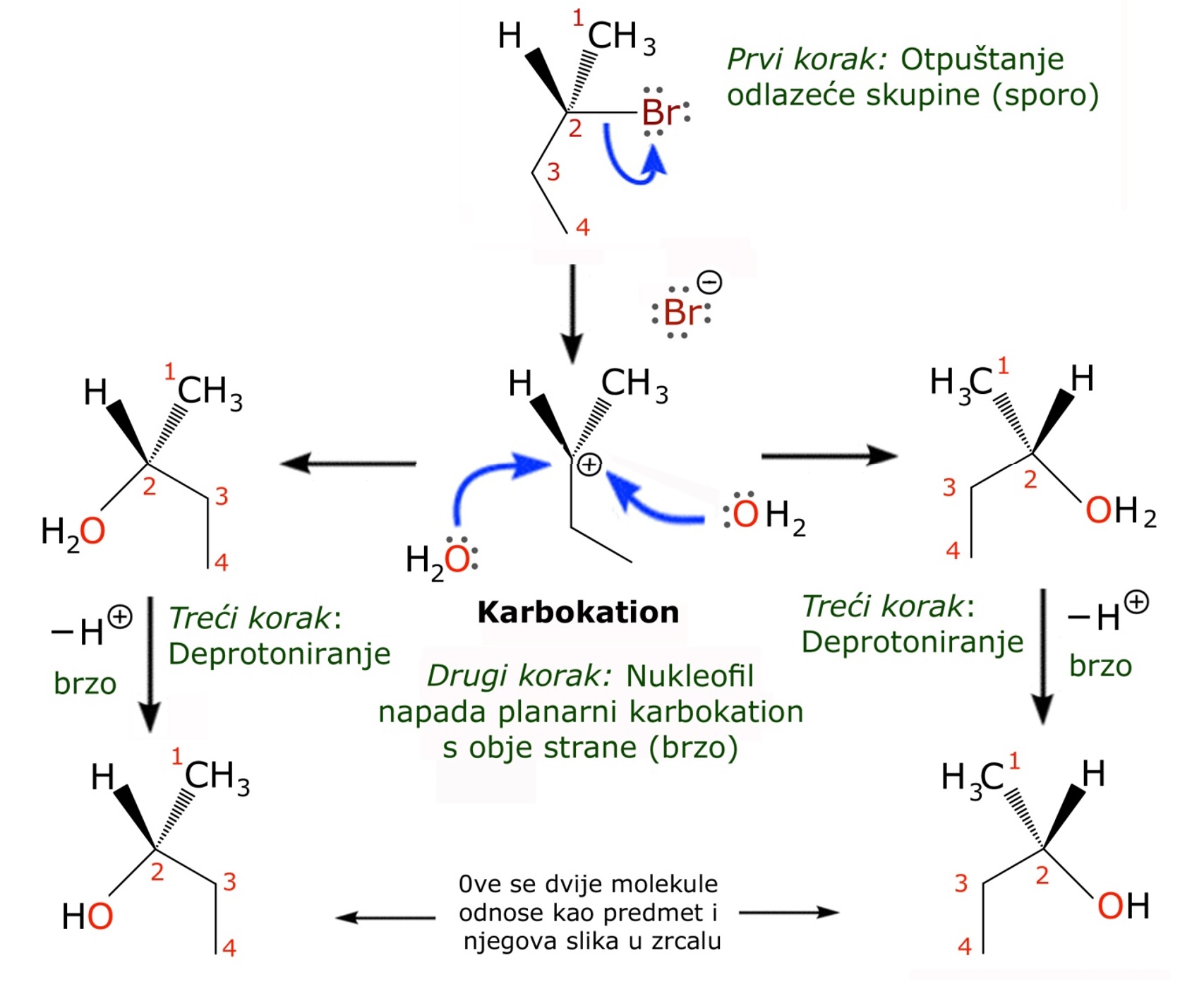
Slika 2.10. Shematski prikaz
tijeka SN1 nukleofilne supstitucije koja se odvija preko karbokationa.
Slika izvor: Master Organic Chemistry - The SN1 Mechanism
2.7. Reakcije eliminacije
Eliminacija je obrnuta reakcija od adicije. U reakcijama eliminacije dolazi do uklanjanje manje molekule iz organskog spoja, i to najčešće HO, HCl, HBr ili HI. Reakcija se najčešće događa u prisustvu baze. Reakcije eliminacije od velike su važnosti za kemijsku industriju, primjerice za proizvodnju polietena, osnovne sirovina od koje se izrađuju predmeti od „plastike“. Na reakcijama eliminacije temelji se termička razgradnja (piroliza) organskih tvari, koja na kraju dovodi do nastajanja ugljena (karbonizacija).
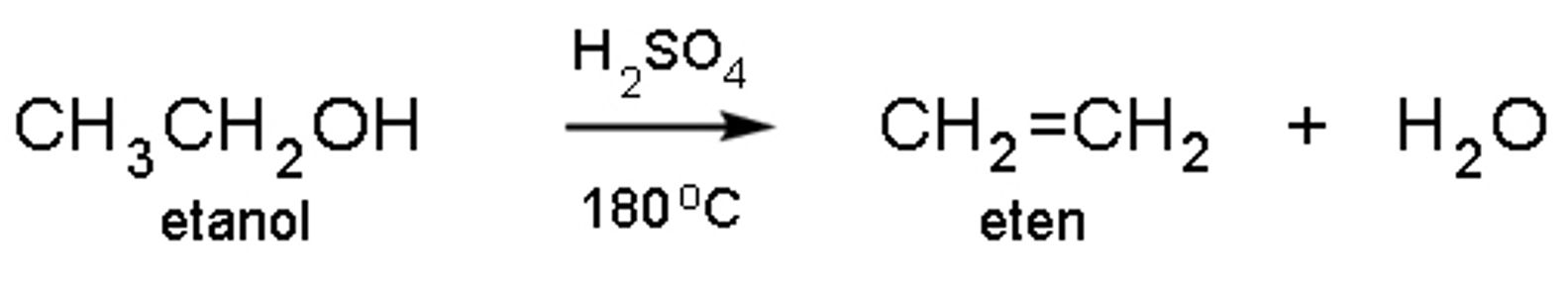
Slika 2.11. Dehidratacijom alkohola dobije se eten.
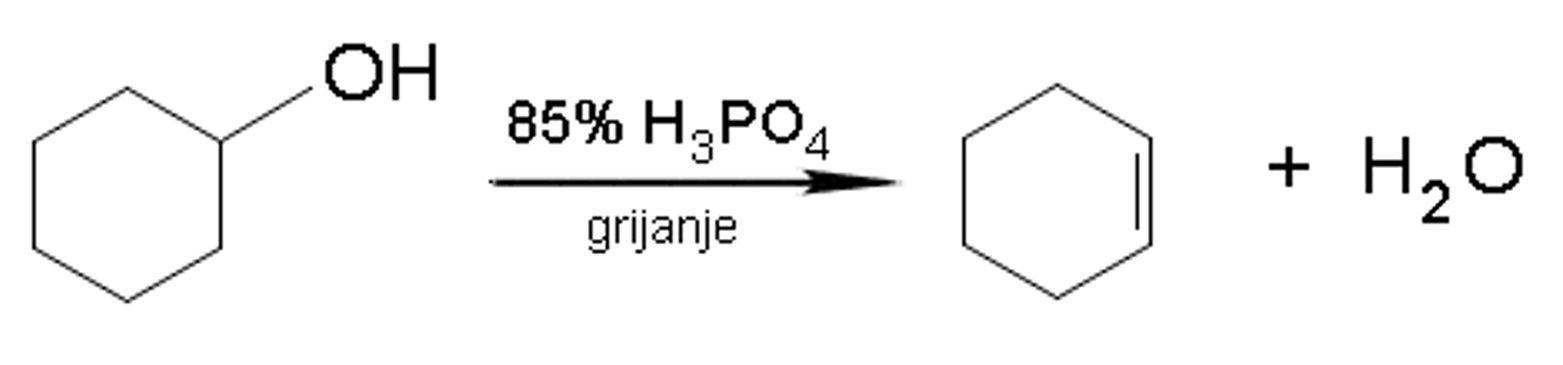
Slika 2.12. Dehidratacijom cikloheksanola dobije se cikloheksen.
Kiselom dehidratacijom butan-2-ola dobiju se dva produkta: but-2-en i but-1-en. Proučavajući reakcije eliminacije ruski kemičar Aleksandar Zajcev došao je do sledećeg zaključka: alken koji nastaje u najvećoj količini je onaj u kojemu je dvostruka veza između ugljika odlazeće skupine i susjednog C atoma s manjim brojem vodikovih atoma (Zajcevljevo pravilo).
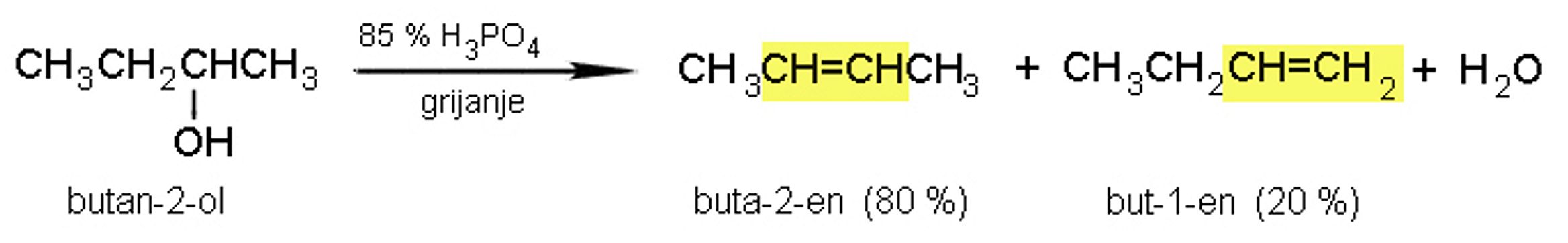
Slika 2.13. Zajcevljevo pravilo.
U prisustvu jake baze kod alkilhalogenida dolazi do izdvajanja halogenovodika, HX, pri čemu nastaju alkeni. Reakcijom eliminacije obuhvaćen je halogen vezan na atom ugljika i vodik na susjednom ugljikovom atomu. Ugljikov atom na koji je vezan halogen označava se a, a onaj neposredno vezan na njega b. Stoga se ovakve reakcije nazivaju reakcijama b-eliminacije.
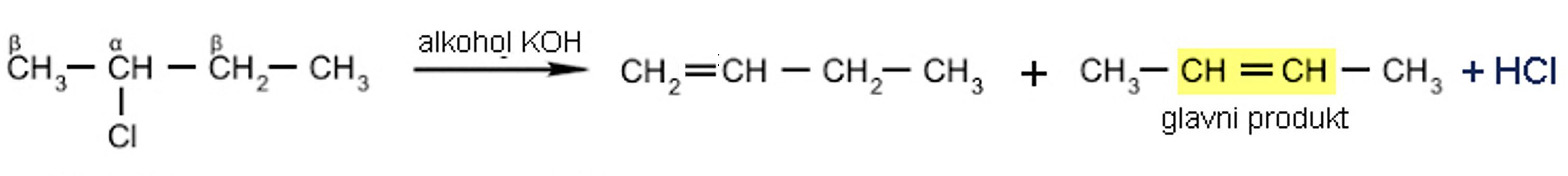
Slika 2.14. b-eliminacijom kao glavni produkt nastaje alken s dvostrukom vezom između ugljikovih atoma na koje je vezan manji broj atoma vodika.
Ponovimo
Mehanizam reakcije opisuje uzastopne korake na molekulskoj razini koji se odvijaju tijekom neke kemijske reakcije.
Energija aktivacije, Ea, je minimalna kinetička energija koju moraju imati reaktanti da bi kemijska reakcija započela.
Fotokemijske reakcije uzrokuje samo ono svjetlo koje je apsorbirano u toj tvari.
Svaka molekula koja sudjeluje u fotokemijskoj reakciji apsorbira samo jedan kvant zračenja.
Katalizatori su spojevi koji ubrzavaju odvijanje kemijskih reakcija, ali u njima ne sudjeluju.
Markovnikovljevo pravilo: adicija se halogenovodika na dvostruku vezu odvija tako da se vodik adira na onaj ugljikov atom koji je vezan s većim brojem vodikovih atoma.
Nukleofili su sve molekule i ioni koji imaju nepodijeljeni elektronski par.
Elektrofili su ioni ili molekule koje mogu primiti elektronski par, tj. nemaju oktet elektrona.
Nukleofili tvore kemijske veze s elektrofilima tako da im doniraju elektronski par.
Elektrofili tvore kemijske veze s nukleofilima tako da prihvaćaju elektronski par.
Karbokation je organska molekula s formalnim pozitivnim nabojem na ugljikovu atomu.
Karbokation nastaje na onom ugljikovu atomu na kojemu je vezano više alkilnih skupina.
Reakcije u kojima se atom ili dio molekule zamjenjuje nekim drugim atomom ili skupinom atoma nazivaju se reakcijama supstitucije.
Reakcije u kojima dolazi do uklanjanja male molekule (H2O, HCl, HBr. HI) iz organskog spoja nazivaju se reakcijama eliminacije.
Hidrolizom halogenalkana dobiju se alkoholi.
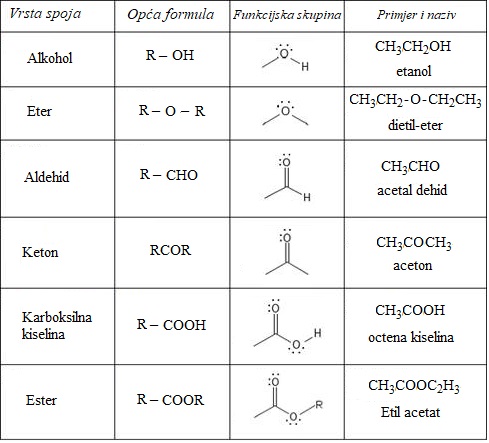
3. ORGANSKI SPOJEVI S KISIKOM
Tablica 3.1. Podjela i nazivi organskih spojeva s kisikom
3.1. Alkoholi
Alkoholi su spojevi koji sadržavaju jednu ili više hidroksilnih skupina, -OH. Oni alkoholi koji sadržavaju jednu -OH skupinu zovu se jednovalentni, oni s dvije dvovalentni, s tri trovalentni itd.
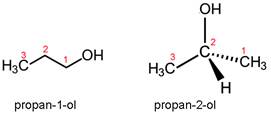
Slika 3.1. Izomeri propanola.
Nazivi alkohola tvore se tako da se nazivu odgovarajućeg ugljikovodika doda nastavak -ol. Prema tome, nazivi alkohola su metanol, etanol, propanol, butanol itd. Budući da su u propanolu tri ugljikova atoma vezana u lanac, -OH skupina može biti vezana na dva različita mjesta u lancu. Zato postoje dva izomera propanola, propan-1-ol i propan-2-ol.
Butanol ima čak četiri izomera.
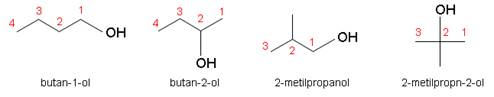
Slika 3.2. Strukturne formule butanola i nazivi njegovih izomera.
Navedeni primjeri pokazuju da -OH skupina može biti vezana na različitim mjestima u molekuli alkohola. Prema položaju -OH skupine jednovalentne alkohole dijelimo na primarne, sekundarne i tercijarne.
Primarni alkoholi su oni kojima je -OH skupina vezana na onaj atom ugljika koji je neposredno vezan samo s jednim atomom ugljika.
Sekundarni alkoholi su oni kojima je -OH skupina vezana na onaj atom ugljika koji je neposredno vezan za još dva atoma ugljika.
Tercijarni alkoholi su oni kojima je -OH skupina vezana za onaj atom ugljika koji je neposredno vezan za još tri atoma ugljika.
![]()
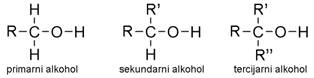
Slika 3.3. Primarni, sekundarni i tercijarni alkoholi.
Po istom načelu nazivamo i atome ugljika u bilo kojoj molekuli. Primarni je onaj C-atom koji je neposredno vezan za jedan atom ugljika, i td.
3.1.1. Primjena nekih alkohola
Metanol, CH3OH, najviše se rabi za sinteze organskih spojeva. Rabi se kao otapalo a može se dobiti oksidacijom metana ili sintezom iz ugljikova monoksida i vodika uz cinkov oksid i kromov(III) oksid kao katalizator pri 300 °C i uz tlak od 200 bara.
![]()
Slika 3.4. Industrijski postupak sinteze metanola.
Vrlo je otrovan. Simptomi trovanja su vrtoglavica, povraćanje i smetnje vida, a može izazvati sljepoću i smrt. Letalna doza je 25 g.
Etanol, C2H5OH,
sastojak je svih alkoholnih pića. Kad se u razgovoru spomene riječ alkohol
uvijek se podrazumijeva etanol ili etilni alkohol. Smatra se neotrovnim, ali uzrokuje
mnogo više vrtoglavica, povraćanja i smrti nego metanol. Maksimalna dozvoljena
koncentracija etanola u krvi vozača u nas iznosi 0,5 ‰, osim za mlade i profesionalne vozače koji ne
smiju konzumirati alkohol. Jedna krigla piva ili čaša vina ili čašica
žestokog alkoholnog pića sadržava oko 12 g čistog etanola. Kad odrasla
osoba mase 80 kg konzumira 12 g etanola (čaša vina), pod pretpostavkom da se
etanol jednolično raspodijeli u organizmu, koncentracija etanola je
12/80 000 = 0,15 ‰. Naravno, koncentracija etanola u krvi je nekoliko puta veća
i iznosi oko 0,8 ‰. Etanol se vrlo polagano razgrađuje u jetri i njegova se
koncentracija smanjuje za oko 0,1 ‰ na sat.
Naziv alkohol dao je švicarski liječnik i alkemičar Paracelzus (1493.–1541.) upotrijebivši arapsku riječ al-kohl za vrlo fini prah neke tvari, pa ga je zvao alcohol vini, najsuptilniji sastojak vina. Naziv aqua vitae, voda života, za alkohol uveo je liječnik i alkemičar Arnaldo iz Vilanove u 13. stoljeću. Pisao je da se dobiva iz vina i vinskog koma, da je najfiniji dio vina, da je zovu aqua ardens (voda koja gori) ali da zaslužuje ime aqua vitae, jer liječi bolesti i produžuje život; da ju je najbolje čuvati u zlatnoj posudi, jer se u svim drugim, osim u staklenim posudama, može pokvariti. (Izvor: D.Grdenić, Povijest kemije. Novi Liber–Školska knjiga, Zagreb 2001. str. 108.)
Pokus 3.1. Alkoholno vrenje
Vidi na internetu:
e-Kemija: Sikirica - Alkoholno vrenje
Etanol znatno oslabljuje psihomotoričke funkcije, a utjecaj se počinje osjećati već pri 0,5 %o u krvi. Manifestira se produljenjem vremena reakcije, a to znači da su u tom stanju sposobnosti vozača smanjene. 1 %o etanola u krvi već utječe na osjećaj ravnoteže, pri 2 %o nastupa teturanje, a pri 3 %o gubi se prisebnost. S 4 %o etanola u krvi zdrav čovjek je "mrtav pijan". Osobe koje imaju zdravstvene probleme ili uzimaju neke lijekove to će stanje dostići mnogo prije. Zanimljivo je da se žene lakše opiju od muškaraca, pa i onih iste tjelesne težine, jer žene imaju više masnog tkiva, pa stoga i manje vode u organizmu.

Slika 3.5. Alkohol je najčešći uzročnik
saobraćajnih nezgoda, često sa smrtnim ishodom.
Izvor: 24 sata, 16.01.2022.
Velike količine etanola proizvode se alkoholnim vrenjem šećera iz voća. Tako proizvedeni etanol uglavnom se utroši u alkoholnim pićima. Još više etanola proizvodi se iz etena adicijom vode pri povišenoj temperaturi i tlaku uz katalizator.
CH2 = CH2 + H2O ® CH3CH2OH
1,2-etandiol, CH2(OH)-CH2(OH), poznat pod imenom glikol ili etilenglikol, najviše se rabi kao antifriz (grč.engl. anti...+ freeze), tj. sredstvo protiv zamrzavanja u hladnjacima automobila. Smjesa jednakih volumnih dijelova etilenglikola i vode ima najniže ledište, približno -40 °C. Antifriz je otrovan! (To je potrebno naglasiti jer antifrizom, zbog njegove slatkoće, vinari znaju patvoriti vino.)
1,2,3-propantriol, CH2(OH)-CH(OH)-CH2(OH), glicerol, nastaje kao sporedni produkt u proizvodnji sapuna iz masnoća biljnog i životinjskog porijekla. To je higroskopna tekućina, slična sirupu, slatkasta okusa. Nalazi primjenu u kozmetici, prehrambenoj industriji, industriji boja, tiskarstvu, ali još više za dobivanje eksploziva poznatog pod nazivom nitroglicerin.
3.1.2. Svojstva alkohola
Alkoholi općenito imaju viša vrelišta od vrelišta pripadnih alkana. To je posljedica građe molekula alkohola. Zbog velike elektronegativnosti kisika, veza kisik-vodik u hidroksilnoj skupini je polarna. Na atomu kisika javlja se mali negativni, a na atomu vodika mali pozitivni naboj. Zato se molekule alkohola, slično molekulama vode, međusobno povezuju vodikovim vezama. U vodikovoj vezi može sudjelovati samo vodik hidroksilne skupine. Zato se molekule alkohola međusobno povezuju dvjema vodikovim vezama, za razliku od molekula vode koje se mogu međusobno povezivati četirima vodikovim vezama.
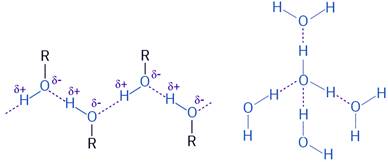
Slika 3.6. Molekule alkohola međusobno se povezuju dvjema, a molekule vode četirima vodikovim vezama.
Molekule alkohola međusobno se privlače slabijim silama nego molekule vode. Zato su vrelišta metanola (64 °C) i etanola (78 °C) niža od vrelišta vode. Vrelište propan-1-ola je pri 98 °C, a butan-1-ola pri 118 °C. Općenito, vrelišta alkohola rastu s porastom broja atoma ugljikovodičnog lanca. No alkoholi s istim brojem C-atoma, ali s razgranatim lancem, imaju niže vrelište od odgovarajućeg n-alkohola.
Topljivost alkohola u vodi također ovisi o duljini alkilnog lanca. Dok se metanol i etanol neograničeno miješaju s vodom, alkoholi, koji redom slijede, sve su manje topljivi u vodi. Što je alkilni lanac dulji to više prevladava njegov utjecaj, pa su alkoholi s 11 i više C-atoma krutine netopljive u vodi.
Alkohol koji nalazimo u laboratoriju ili trgovini smjesa je 96 volumnih dijelova etanola i 4 volumna dijela vode. U toj se smjesi nikakvom destilacijom ne može povećati udio alkohola. Njezino je vrelište (78,15 °C) niže od vrelišta čistog etanola (78,4 °C). Ako se želi dobiti bezvodni ili apsolutni alkohol, vodu treba kemijski vezati, primjerice kalcijevim oksidom, CaO. Alkohol se kuha sa "živim vapnom" u tikvici s povratnim hladilom. Na vrh hladila stavlja se klorkalcijeva cjevčica da bi se spriječio ulazak vlage iz zraka u reakcijsku smjesu. Smjesa se zatim destilira, a destilat se čuva od utjecaja vlage jer je higroskopan.
Alkoholi reagiraju s natrijem slično kao voda, ali je reakcija manje burna. Stoga se neupotrebljivi ostaci elementarnog natrija u laboratoriju uklanjaju tako da ih se prelije otpadnim alkoholom.
2R—OH + 2Na → 2R—O‒Na+ + H2
alkohol natrijev alkoksid
Slika 3.7. Alkoholi s alkalijskim metalima tvore alkokside.
Svojstva alkohola da tvore alkokside mogu se objasniti polarnošću veze kisik-vodik u hidroksilnoj skupini. Ona alkoholima daje svojstva slabe kiseline. Vodik -OH skupine najlakše se odcjepljuje kod primarnih, a najteže kod tercijarnih alkohola. Osim natrija, alkokside prave i drugi metali, npr. magnezij, aluminij i dr.
Pokus 3.2. Priprava alkoksida
Vidi na internetu: Preparation of sodium ethoxide and its hydrolysis
Pribor i kemikalije: 2 epruvete, gumeni čep za epruvete, satno staklo, kapalica s gumicom, pinceta, nož, komad filtrir-papira, 96-postotni etanol, bezvodni bakrov(II) sulfat, kalcijev oksid, natrij, univerzalni indikatorski papir.
Postupak:
- Ulijete u epruvetu 3 do 4 mL alkohola (etanola) i dodate 0,1 do 0,2 g bezvodnoga bakrova(II) sulfata. Bezvodni bakrov(II) sulfat je blijedoplavičasta ili skoro bijela krutina. Ako etanol sadržava vodu, bakrov(II) sulfat će poplaviti. Obrazložite promjenu.
- Pripremite bezvodni etanol. Ulijete u epruvetu 5 do 8 mL alkohola i dodate 2 do 3 g dobro usitnjenog kalcijeva oksida. Začepite epruvetu gumenim čepom i snažno mućkajte nekoliko minuta. Postavite epruvetu u stalak i pustite da se zaostali kalcijev oksid i nastali kalcijev hidroksid istalože.
- Pažljivo dekantirajte 3 do 4 mL bistrog sloja bezvodnoga etanola u drugu suhu epruvetu.
- Pincetom izvadite mali komadić natrija iz petroleja i postavite na filtrir-papir. Pridržavajući natrij pincetom čistim i suhim nožem odrežite komadić natrija, ne veći od zrna graška. Ostatak natrija vratite u bocu. Odrezani komadić natrija stavite u epruvetu s bezvodnim etanolom. Uočite i zabilježite promjene.
- Kapalicom s gumicom prenesite na satno staklo malo dobivene otopine i uparite iznad zagrijane staklokeramičke pločice. Ustanovite izgled tvari zaostalih na satnom staklu.
- Ostatku na satnom staklu dodajte kap dvije vode. Je li se talog otapa? Ispitajte dobivenu otopinu univerzalnim indikatorskim papirom. Objasnite opažanja. Napišite jednadžbe reakcija.
Hidroksilna skupina ima nepodijeljene parove elektrona na kisikovu atomu. U jako kiseloj otopini hidroksilna skupina može vezati proton, a to znači da alkoholi pokazuju i bazna svojstva. U jako kiseloj sredini proton se veže na nepodijeljeni par elektrona u -OH skupini pa tako nastane protonirani alkohol, ROH2+.
Alkoholi lako reagiraju s halogenovodicima. Ako se u alkohol uvodi suhi halogenovodik, ili se alkohol grije s vodenom otopinom sumporne kiseline i natrijeve soli neke halogenovodične kiseline, nastaju halogenalkan i voda. U takvoj jako kiseloj smjesi nastaje protonirani alkohol koji reagira s halogenidnim ionima. To je nukleofilna supstitucija, a može se prikazati jednadžbom:
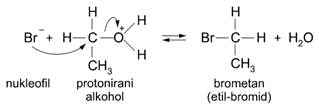
Slika 3.8. Mehanizam reakcije dobivanja brometana.
Nastajanje halogenalkana ubrzava se prisutnošću jake kiseline, jer protonirani alkohol lakše otpušta molekulu vode nego samu hidroksilnu skupinu, te s halogenidninm ionom tvori halogenalkan. Obratno, u lužnatoj otopini halogenalkani daju alkohole i pripadne soli.
Pokus 3.3. Priprava brometana
Vidi na internetu: Tine Willis - Bromoethane preparation
Zadaci i teme za vlastite aktivnosti i samoobrazovanje
Proučite biokemijske reakcije koje se događaju pri alkoholnom vrenju.
Važan izvor državnih prihoda je porez na alkoholna pića. Istražite koliki su državni prihodi iz tog poreza i usporedite ih s izdacima za liječenje i naknadu šteta koje uzrokuju alkoholičari.
Kako konzumiranje alkohola utječe na psihomotoričke funkcije čovjeka.
Doznajte što su alkohol dehidrogenaze i kakva im je uloga u metabolizmu alkohola. Zašto neke etničke skupine ne podnose alkohol?
Zašto je alkohol pomogao bljedolikim kolonizatorima „pobijediti Indijance“, oteti im zemlju te preostale skupine indijanskih plemena stjerati u rezervate na neplodnoj zemlji?
Što su zeotropne a što azeotropne smjese?
Frakcijskom destilacijom dobije se smjesa koja sadržava 96 vol.% etanola i 4 vol.% vode. U toj se smjesi nikakvom destilacijom ne može povećati udio alkohola. Njezino je vrelište (78,15 °C) niže od vrelišta čistoga etanola (78,4 °C). Kojim ćete sredstvom kemijski vezati vodu i kako ćete iz te smjese pripremiti 100-postotni etanol?
Vidi na internetu: NileRed - How to make anhydrous ethanol (100% alcohol)
Usporedite vrelišta primarnih alifatskih alkohola s 1 do 6 ugljikovih atoma i usporedite ih vrelištima odgovarajućih sekundarnih i tercijarnih alkohola.
Usporedite topljivost u vodi gore navedenih alkohola. Što zaključujete?
Izradite plakat, PowerPoint prezentaciju, snimite video, održite predavanje u razredu, organizirajte raspravu ili pišite u školskom listu o svojstvima i zloporabi alkohola.
3.2. Fenoli
Fenolima nazivamo spojeve koji imaju jednu ili više -OH skupina neposredno vezanih na ugljikove atome aromatske jezgre. Na aromatskom prstenu mogu biti istodobno vezane i druge skupine, stoga su fenoli, općenito govoreći, hidroksiderivati aromatskih spojeva. Veza kisik-vodik u -OH skupini kod fenola više je polarna nego kod alkohola. Stoga su vodikove veze među molekulama fenola jače. To se može vidjeti i po vrelištima fenola, koja su mnogo viša od vrelišta pripadnih alkohola.
Fenoli se često nalaze u otpadnim vodama raznih industrija, kao što su industrije umjetnih smola, boja, lijekova, papira, pesticida itd. Vrlo su otrovni i ozbiljno narušavaju kvalitetu vodâ.
Fenol, C6H5OH,
još se naziva i karbolnom kiselinom, derivat je benzena. To je bezbojna higroskopna
kruta tvar koja na zraku dobiva žutu ili crvenu boju. Slabo je topljiv u hladnoj,
a mnogo bolje u vrućoj vodi. Otrovan je i djeluje baktericidno, pa se nekad
upotrebljavao kao dezinfekcijsko sredstvo. Oštećuje kožu i ostala tkiva jer
koagulira (taloži) stanične bjelančevine. Zbog toga su u radu s fenolom
potrebne zaštitne naočale i rukavice. Slaba je kiselina, jača od alkohola.
S lužinama daje fenokside, dok alkoholi daju alkokside tek reakcijom s elementarnim
natrijem. Razliku uzrokuje p-elektronski
sustav aromatske jezgre koji uključuje i p-orbitalu atoma kisika. Time
veza kisik vodik postaje jače polarna, pa se proton lakše odcijepi iz skupine
-OH u fenolu nego u alkoholu.
C6H5OH + NaOH ® C6H5O- Na+ + H2O
natrijev fenoksid
Hidroksilna skupina u fenolima značajno utječe na svojstva benzenske jezgre. Reakcije elektrofilne supstitucije mnogo se brže odvijaju na fenolu nego na benzenu. Primjerice, brom vrlo sporo reagira s benzenom dok fenol već s bromnom vodom brzo reagira dajući 2,4,6-tribromfenol. Hidroksilna skupina je ortho- i para-usmjeravajuća i zato se bromom supstituiraju atomi vodika u ortho- i para-položaju.
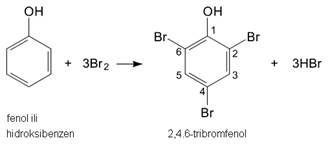
Slika 3.9. Bromiranje fenola.
Pokus 3.4. Dobivanje 2,4,6-tribromfenola
Vidi na internetu: Oleksii Antypenko - The formation of tribromophenol
Pokus 3.5. FeCl3 test na fenole
Vidi na internetu:
Practical Experiments - Phenol Identification Test Organic Compounds
CEEA Erasmus - The ferric chloride test for phenols
Ako su na benzensku jezgru vezane dvije -OH skupine, one mogu međusobno zauzeti tri različita položaja tako da postoje tri različita dihidroksibenzena:
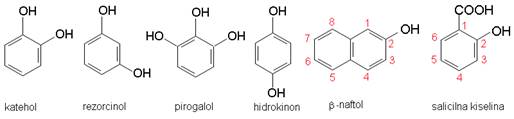
Slika 3.10. Uobičajena (trivijalna) imena nekih najvažnijih fenola.
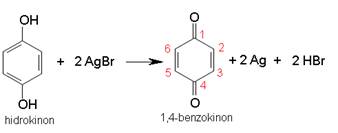
Slika 3.11. Hidrokinon, tj. 1,4-dihidroksibenzen, je redukcijsko sredstvo. Rabi se primjerice za razvijanje crnobijelih fotografija pri čemu se oksidira u 1,4-benzokinon.
3.3. Eteri
Eteri su spojevi opće formule R-O-R˘, gdje su R i R˘ alkilne ili arilne skupine. Ako su R i R˘ jednaki, za eter se kaže da je jednostavan ili simetričan, primjerice dimetil-eter, CH3-O-CH3. Mješoviti ili asimetrični eteri imaju različite skupine R i R˘, primjerice etil-metil-eter, CH3-O-C2H5.
Eteri se najčešće nazivaju tako da se abecednim redoslijedom navedu alkilne skupine koje molekula sadržava i doda riječ eter, kao što je već na spomenutim primjerima pokazano. Nazivi nekih, po građi jednostavnijih etera navedeni su u tablici 3.2.
Tablica 3.2. Neki jednostavniji eteri
|
Naziv |
Formula |
Vrelište t/°C |
|
dimetil-eter |
CH3-O-CH3 |
24 |
|
etil-metil-eter |
CH3-O-CH2-CH3 |
11 |
|
dietil-eter |
CH3-CH2-O-CH2-CH3 |
35 |
|
fenil-metil-eter |
CH3-O-C6H5 |
154 |
Jednostavni (simetrični) eteri mogu se prirediti iz alkohola oduzimanjem vode (dehidratacijom) pomoću koncentrirane sumporne kiseline. Grijanjem etanola i koncentrirane sumporne kiseline nastaje dietil-eter. Etanol se dodaje postupno u reakcijsku smjesu i uvijek se mora nalaziti u suvišku. Za tu je reakciju nužna kiselina. Utjecajem jake kiseline najprije nastaje protonirani alkohol:
R-OH + H+ ® R-OH2+
To je primjer nukleofilne supstitucije, gdje molekula protoniranog alkohola reagira sa sljedećom molekulom alkohola koja je nukleofil.
R-OH2+ + HO-R ® R-O-R + H2O + H+
Naime, iako su alkoholi slabe kiseline, u prisutnosti jakih kiselina, kao što je sumporna kiselina, oni se ponašaju kao slabe baze. Skupina -OH ima dva nepodijeljena para elektrona, pa u jako kiseloj sredini jedan od parova elektrona može prihvatiti proton.
Mješoviti (asimetrični) eteri mogu se prirediti reakcijom alkilhalogenida i natrijeva alkoksida.
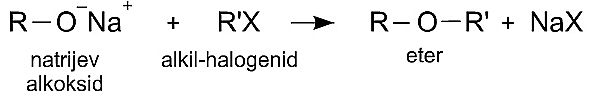
Slika 3.12. Dobivanje asimetričnog etera.
Dimetil-eter je plin, dok su drugi eteri malih molekulskih masa bezbojne lakohlapljive tekućine svojstvenog "eterskog" mirisa. Vrelišta su im mnogo niža od vrelišta odgovarajućih alkohola jer se molekule etera ne mogu međusobno povezivati vodikovim vezama poput alkohola. Stoga se eteri slabo otapaju u vodi.
Kemijski su inertni pa služe kao prikladna otapala za izvođenje mnogih organskih sinteza. Ne reagiraju čak ni s elementarnim natrijem pa se eteri suše natrijem isprešanim u tanku žicu.
Eteri su vrlo zapaljivi, a smjese sa zrakom žestoko eksplodiraju. U laboratorijskom radu najviše se koristi dietil-eter. Gustoća njegovih para veća je od gustoće zraka pa se eterske pare lako nakupljaju u podrumskim prostorima. To može biti uzrok vrlo opasnih eksplozija. Pri radu s dietil-eterom ne smije se rabiti otvoreni plamen.
Zadaci i teme za vlastite aktivnosti i samoobrazovanje
Istražite primjenu etera kao anestetika.
Što razmijete kad voditelj radijskog programa pita; jesmo li u eteru?
Izradite plakat, PowerPoint prezentaciju, snimite video, održite predavanje u razredu, organizirajte raspravu ili pišite u školskom listu o svojstvima i uporabi dietil-etera.
3.4. Aldehidi i ketoni
Aldehidi i ketoni su organski spojevi koji sadržavaju karbonilnu funkcijsku skupinu, >C=O. Opća formula aldehida je R-CHO, dok je opća formula ketona R-CO-R.
Kod aldehida karbonilna skupina uvijek se mora nalaziti na kraju ugljikovodičnog lanca, stoga je ona broj 1 te određuje smjer numeriranja.
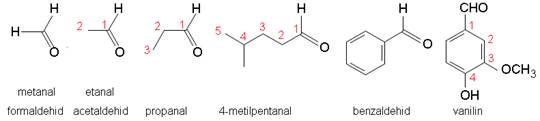
Slika 3.13. Strukturne formule i nazivi nekih aldehida. Imajte na umu da se aldehidna funkcijska skupina često piše kao –CHO u sažetim ili strukturnim formulama.
U ketonima karbonilna skupina može se nalaziti bilo gdje unutar lanca ili prstena. Numeriranje lanca obično počinje od kraja najbližeg karbonilnoj skupini. U cikličkim ketonima karbonilnoj skupini je dodijeljen položaj 1, a ovaj broj se ne navodi u nazivu, osim ako je prisutno više od jedne karbonilne skupine.
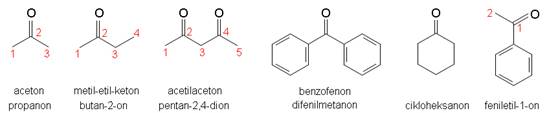
Slika 3.14. Strukturne formule i nazivi nekih ketona.
Aldehidi i ketoni su rašireni u prirodi, uglavnom u biljkama ili mikroorganizmima, često u kombinaciji s drugim funkcijskim skupinama (vanilin, cinamaldehid, benzaldehid i dr. Glukoza i drugi takozvani reducirajući šećeri su aldehidi.
Aldehidi se mogu dobiti na više načina. Ako se pare primarnog alkohola prevode preko bakra ugrijanog na oko 500 °C, dolazi do dehidrogeniranja, tj. do izdvajanja vodika iz molekule alkohola. Takav su alkohol nekad zvali „alcohol dehydrogenatus“, pa je uzimanjem početnih dijelova ove dvije riječi dobiven naziv aldehid.
Pokus 3.6. Katalitička oksidacija etanola u etanal
Vidi na internetu:
e-Kemija: Sikirica - Oksidacija etanola
Etanal (acetaldehid) može se dobiti oksidacijom etanola.
CH2CH2OH + ˝ O2 → CH3CHO + H2O
Etanal je lakohlapljiva tekućina intenzivna mirisa i topljiva u vodi. Aldehidi su reducensi i pritom se oksidiraju u karboksilne kiseline.
Karbonilna skupina je presudna za svojstva aldehida i ketona. U određenim uvjetima svi aldehidi i ketoni koji imaju jedan a-vodik u ravnoteži su s odgovarajućim enolnim oblikom.
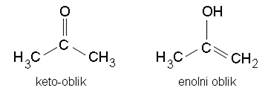
Slika 3.15. Keto-enolna tautomerija.
Metanal (formaldehid) se dobiva oksidacijom metanola. To je plin oštrog mirisa topljiv u vodi. U trgovini i laboratoriju dolazi kao 30 do 40 postotna otopina pod nazivom formalin. Otrovan je jer izazva koagulaciju bjelančevina. Rabi se za konzerviranje medicinskih i bioloških preparata.
Metanal se rabi za proizvodnju bakelita, jedne od prvih plastičnih masa. Ako se smjesa fenola i metanala zagrije uz prisutnost bazičnih katalizatora, kao što su amonijak i natrijev hidroksid, dolazi do polimerizacije. Reakcija se može promatrati kao nukleofilna adicija aromatskog prstena na karbonilnu skupinu. Baza uzrokuje nastajanje fenoksidnog iona koji je nukleofilni reagens. Zbog razlike elektronegativnosti kisika i ugljika na ugljiku karbonilne skupine javlja se mali pozitivni, a na kisiku mali negativni naboj. Stoga nukleofilni reagens napada ugljik karbonilne skupine.
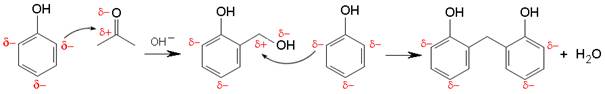
Slika 3.16. Shematski prikaz nukleofilne adicije aromatskog prstena na karbonilnu skupinu. Reakcija se nastavlja dalje i grana tako da se dobije trodimenzijska mreža, tj. fenolformaldehidna smola.
Dodaju li se u reakcijsku smjesu „punila“ (suha piljevina, suho drvo, tekstil, papir, mljeveni vapnenac i dr.) i reakcijska smjesa uz zagrijavanje preša u željeni oblik, dobiju se različiti proizvodi poznati kao bakelit, tekstolit, pertinaks, šperploče, vodootporne šperploče i td.
Pokus 3.7. Dobivanje fenolformaldehidne smole
Vidi na internetu:
Random Experiments - Preparation of a phenol formaldehyde resin
Pokus 3.8. Dobivanje srebrnog zrcala
Vidi na internetu: e-škola: Kemija - Posrebrivanje
Propanon, CH3COCH3, poznatiji pod nazivom aceton, najjednostavniji je i ujedno najviše upotrebljavani keton. Dobiva se oksidacijom propan-2-ola zrakom pri temperaturi 360 °C. Pritom nastaje i vodikov peroksid, H2O2. Stoga reakciju treba provoditi brzo da se vodikov peroksid, vrijedan sporedni produkt, ne raspadne.
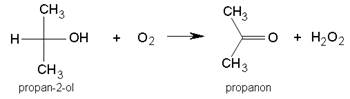
Slika 3.17. Ketoni nastaju oksidacijom sekundarnih alkohola. Oksidacija propan-2-ola u propanon.
Propanon je bezbojna lako hlapljiva tekućina karakteristična mirisa slabo topljiva u vodi. Rabi se kao otapalo za nitrolakove te pri proizvodnji bezdimnog baruta. Zbog niska vrelišta lako hlapi i tvori eksplozivne smjese sa zrakom.
Ketoni se oksidiraju u karboksilne kiseline tek jakim oksidacijskim sredstvima, primjerice lužnatom otopinom kalijeva permanganata ili vrućom dušičnom kiselinom. Pritom se cijepa veza između karbonilne skupine i susjednog ugljikova atoma tako da nastaju dvije karboksilne kiseline s manjim brojem C-atoma.
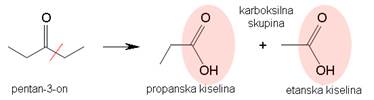
Slika 3.18. Oksidacijom ketona nastaju karboksilne kiseline.
3.5. Karboksilne kiseline
Sve karboksilne kiseline sadržavaju karboksilnu skupinu -COOH.
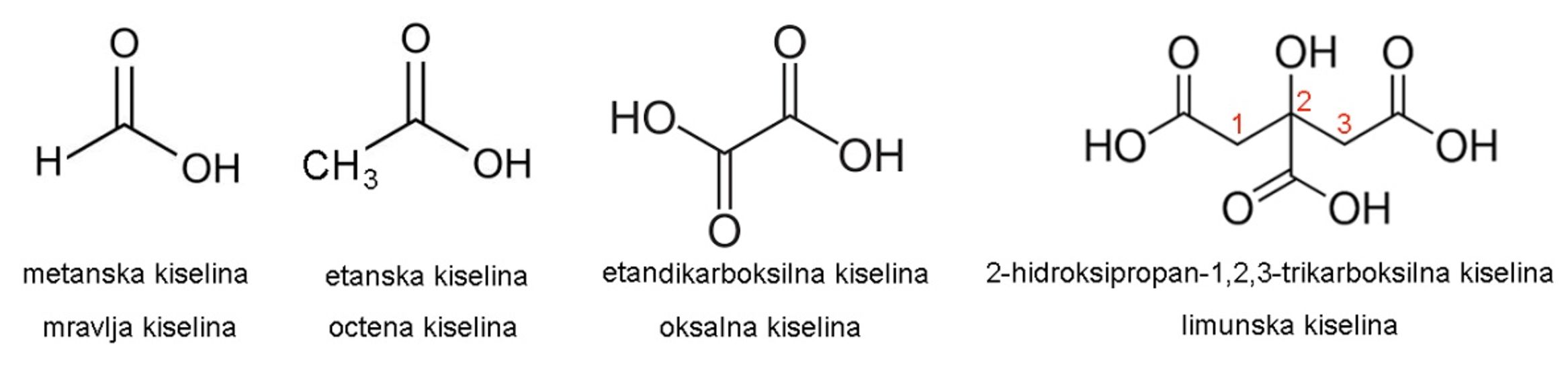
Slika 3.19. IUPAC i trivijalna imena nekih karboksilnih kiselina.
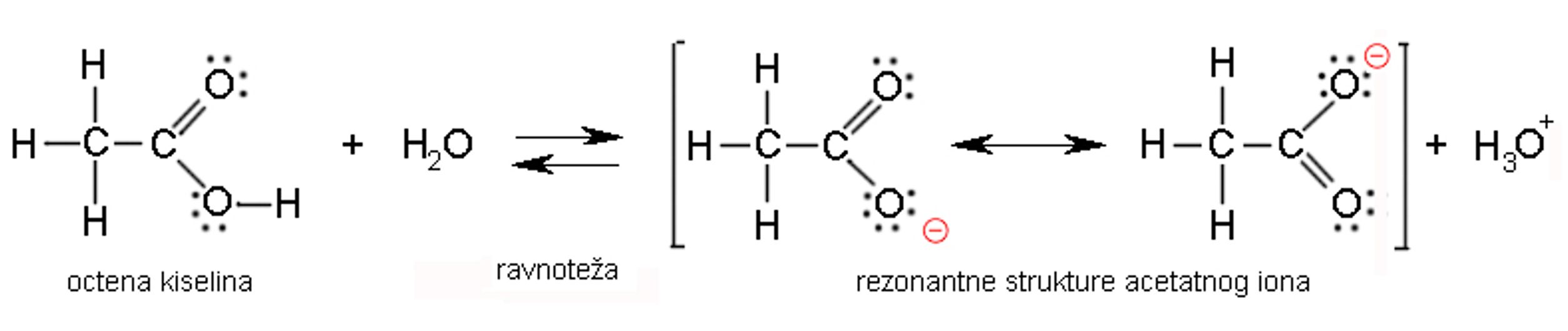
Slika 3.20. Kisela svojstva karboksilnih kiselina proizlaze od oksonijevih iona koji nastaju disocijacijom karboksilne skupine. U vodenoj otopini octena kiselina je slabo disocirana. Koncentracije nedisocirane octene kiseline i acetatnih iona nalaze se u dinamičkoj ravnoteži. Strukturu acetatnih iona prikazujemo dvjema formulama. Prava struktura acetatnog iona je rezonantni hibrid između obje prikazane formule. Naime, mjerenja su pokazala da su u karboksilatnom anionu oba kisika na jednakoj udaljenosti.
Karboksilne kiseline s manjim brojem C-atoma dobro su topljive u vodi. Naime, karboksilna skupina je jako polarna te tvori vodikove veze s drugim polarnim molekulama, primjerice s vodom, alkoholima i karboksilnim kiselinama. To ujedno objašnjava njihova relativno visoka vrelišta: metanska kiselina vrije pri 100 °C, etanska kiselina pri 118 °C, propanska kiselina pri 141 °C, butanska kiselina pri 164 °C i td. Karboksilne kiseline s većim ugljikovodičnim dijelom dobro su topljive u nepolarnim otapalima, no pritom se polarne karboksilne skupine iz dviju molekula međusobno povežu vodikovim vezama. Takvi dimeri su nepolarni te se stoga dobro otapaju u nepolarnim otapalima.
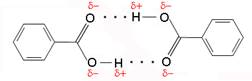
Slika 3.21. Benzojeva kiselina (benzenkarboksilna kiselina) topljiva je u ugljikovu tetrakloridu, kloroformu i drugim nepolarnim otapalima.
Metanaska kiselina, HCOOH, najjednostavnija je karboksilna kiselina. Naziv mravlja kiselina dobila je po tome što je prvi put izolirana iz crvenih mrava. To je bezbojna tekućina oštra mirisa. Na koži uzrokuje plikove. Rabi se pri štavljenju koža, bojenju tekstila, za dezinfekciju vinskih bačava, sprječavanje vrenja voćnih sokova itd.
Etanska kiselina, CH3COOH, ili octena kiselina poznata je od davnina kao vinski ocat (lat. acetum = ocat). Vinski ocat nastaje tako da se alkohol sadržan u vinu oksidira kisikom iz zraka pomoću u prirodi raširene skupine bakterija koje pripadaju rodu Acetobacter. Ovaj rod uključuje više vrsta bakterija od kojih se za proizvodnju octene kiseline najviše rabi Acetobacter aceti.
CH3CH2OH + O2 ® CH3COOH + H2O
Soli octene kiseline nazivaju se acetati. Dobiju se otapanjem metalnih oksida u octenoj kiselini.. Primjerice, olovo se ne otapa dok se olovov(II) oksid otapa u octenoj kiselini pri čemu nastaje olovov(II) acetat. Slatka je okusa pa su ga zvali olovni šećer, pa su njime (čak) sladili vino. Olovov(II) oksid najvažniji je sastojak „kristalnog stakla“ i glazura glinenog posuđa izrađenog u primitivnim radionicama. Te su glazure topljive u octenoj kiselini i zato se salata i druga hrana ne smije pripremati u glinenim posudama kupljenim na seoskim sajmovima. Možete ih rabiti samo kao ukras. Svi su spojevi olova otrovni. Stoga je još 1921. Međunarodna organizacija rada zabranila za unutarnje ličenje upotrebu olovovog bjelila (Pb(OH)2 · 2PbCO3) i olovova sulfata (PbSO4) te svih proizvoda koji sadržavaju ove pigmente.
Pokus 3.9. Oksidacija etanola u octenu kiselinu
Vidi na internetu:
Giulio Ronconi - Oxidation of Ethanol
Yeo Yong Kiat - Oxidation of Ethanol to Ethanoic Acid
Propanska kiselina, CH3CH2COOH, ili propionska kiselina ima baktericidna svojstva pa se njene natrijeve, kalijeve ili kalcijeve soli rabe kao konzervansi za kruh, pecivo, sir i druge prehrambene proizvode.
Butanska kiselina, CH3CH2CH2COOH, ili maslačna kiselina neugodna je mirisa. Miris pokvarenog maslaca potječe od ove kiseline. U svježem maslacu vezana je s glicerolom, a u pokvarenome se oslobađa te uzrokuje njegov neugodan miris. Sastavni je dio ljudskog znoja. Esteri maslačne kiseline rabe se u kozmetici, u proizvodnji umjetnih aroma (miris ananasa potječe od etilnog butirata) te plastičnih materijala.
2-hidroksipropionska ili mliječna kiselina, CH3CH(OH)COOH, pripada grupi hidroksikarboksilnih Molekula ima jedan asimetrični ugljikov atom (kiralni centar) pa se pojavljuje u dvjema optički aktivnim modifikacijama, kao desna mliječna i lijeva mliječna kiselina te kao njihova racemična, optički neaktivna smjesa (racemat). Lijeva mliječna kiselina nastaje u mišićima pod opterećenjem i uzrok je umora. Desna mliječna kiselina nastaje vrenjem šećera i drugih ugljikohidrata djelovanjem anaerobnih bakterija. Stoga se nalazi u kiselome mlijeku, kiselom zelju, siru, siliranom krmivu itd. Soli mliječne kiseline zovu se laktati (lat. lac = mlijeko).
3.5.1. Optička aktivnost
Svjetlost ima svojstva elektromagnetskog vala. U običnoj svjetlosti titranje električnog polja je okomito na smjer širenja svjetlosti. Ima bezbroj ravnina koje se mogu postaviti u smjeru širenja svjetlosti, a u običnoj svjetlosti električno polje titra u svim tim ravninama. Svjetlost koja titra samo u jednoj od mogućih ravnina zove se linearno polarizirana svjetlost. (Slika 3.22a)
Pokus 3.10. Polarizacija svjetlosti
Pribor: polaroidne naočale za sunce ili polaroidna folija
Postupak:
Suvremene naočale za sunce načinjene su od plastične folije koja ima svojstvo polarizacije svjetlosti, tj. takve naočale propuštaju svjetlost u kojoj električno polje titra samo u jednoj ravnini.
Imaju li “stakla” naočala za sunce svojstvo polarizacije svjetlosti lako ćete se uvjeriti. Kad kupujete naočale uzmite dva jednaka para naočala. Postavite naočale jedne na druge i pogledajte kroz njih prema izvoru svjetlosti. Uočit ćete da svjetlost kroz njih prolazi jer su ravnine polarizacije stakala oba para naočala paralelne.
Ukrstite naočale tako da jedne od njih zakrenete za 90°. Uočit ćete da kroz “ukrštena stakla” polaroidnih naočala svjetlost ne prolazi. Ako svjetlost ipak prolazi, tad su to obične zatamnjene plastične folije. Ne dozvolite da vas varaju.
Za dobivanje snopa linearno polarizirane svjetlosti može se upotrijebiti polaridna folija, primjerice iz „polaroid“ naočala za sunce. Sva optička sredstva ili uređaji koji polariziraju svjetlost nazivaju se polarizatori. Kad se snop polarizirane svjetlosti propusti kroz otopinu optički aktivne tvari (svježe otopine običnog šećera ili otopine vitamina C), dolazi do zakretanja ravnine polarizacije. Drugom polaroidnom folijom može se odrediti (analizirati) kut i smjer zakretanja ravnine polarizacije svjetlosti. Stoga tu drugu foliju nazivamo analizator. Ta su svojstva svjetlosti iskorištena u uređaju koji nazivamo polarimetar, a načelo njegova rada objašnjava slika 3.22.
Zakretanje ravnine polarizirane svjetlosti u smjeru kretanja kazaljke na satu, odnosno udesno, označava se znakom (+), a zakretanje u suprotnom smjeru znakom (-). Mliječna kiselina izolirana iz mišićnog tkiva zakreće ravninu polarizirane svjetlosti udesno pa je to (+)-mliječna kiselina. Neki šećeri, dekstroza (lat. dexter = desni) i levuloza (lat. laevus = lijevi), dobili su ime upravo prema smjeru zakretanja ravnine polarizirane svjetlosti. Većina tvari prirodnog podrijetla ima asimetrični ugljikov atom, stoga pokazuje optičku aktivnost u otopini.
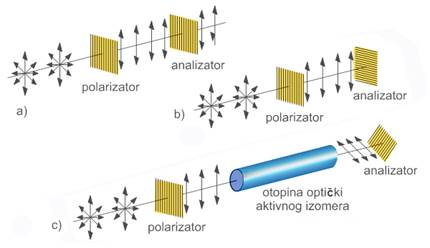
Slika 3.22. Načelo rada polarimetra. a) Linearno polarizirana svjetlost prolazi kroz polarizator i analizator ako su njihove ravnine polarizacije paralelne. b) Ukršteni polarizator i analizator. Svjetlost se potpuno gasi ako su ravnine polarizacije polarizatora i analizatora pod kutom 90°. c) Kad se između ukrštenih polarizatora i analizatora umetne kiveta s optički aktivnom tvari, zbog zakretanja ravnine polarizacije svjetlost prolazi kroz analizator. Ako analizator treba zakrenuti u smjeru kretanja kazaljke na satu da bi došlo do gašenja svjetlosti, tad se kaže da je ta tvar desnozakrećuća. Ako analizator treba zakrenuti u smjeru suprotnom od kretanja kazaljke na satu, tad je dotična tvar lijevozakrećuća.
Iznos kuta zakretanja ravnine polarizirane svjetlosti ovisi o valnoj duljini upotrijebljene svjetlosti, duljine kivete i koncentraciji otopine. Općenito, ako se upotrijebi svjetlost kraće valne duljine, zakretanje će biti veće. U polarimetriji obično se rabi svetlost vrlo bliskih D-linija „natrijske svjetiljke“ (l = 589,0 i 589,6 nm).
3.5.2. Enantiomeri
Već je nekoliko puta naglašeno da su zasićene kovalentne veze, što ih čine atomi ugljika, usmjerene prema uglovima tetraedra. Načinimo li model neke molekule koja ima četiri različita supstituenta na jednom ugljikovu atomu, primijetit ćemo da se mogu načiniti dva modela koji se međusobno odnose kao predmet i njegova slika u zrcalu koji se ne mogu međusobno preklopiti.
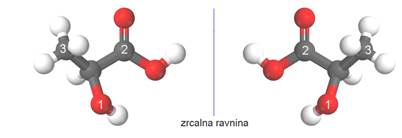
Slika 3.23. Enantiomeri mliječne kiseline. Ova dva modela molekula mliječne kiseline odnose se kao predmet i njegova slika u zrcalu, ili, kao lijeva i desna ruka.
Za predmete, kao i za molekule, koji se odnose kao predmet i njegova slika u zrcalu kaže se da su kiralni (grč. cheir = ruka). Ugljikov atom na koji su vezane četiri različite skupine jest kiralni centar. Takav ugljikov atom često se naziva asimetrični ugljikov atom. Kiralna je velika je većina prirodnih spojeva biljnog i životinjskog podrijetla Najpoznatiji takvi spojevi su mliječna, vinska i limunska kiselina.
Molekule koje imaju istu molekulsku formulu i slijed vezanih atoma, ali se razlikuju po usmjerenosti tih atoma ili skupina u prostoru nazivaju se stereoizomeri. Izomeri koji su jedan drugome zrcalne slike zovu se enantiomeri (grč. enantios = nasuprot + meros = dio). Enantiomeri imaju ista fizikalna i kamijska svojstva osim smjera zakretanja ravnine polarizirane svjetlosti. Mliječna kiselina izolirana iz mišića zakreće ravninu linearno polarizirane svjetlosti udesno. Ona se sastoji od samo jednog enantiomera. Sve molekule jednog enantiomera zakreću ravninu polarizacije u istom smjeru. Ti se sićušni efekti neprestano zbrajaju, tako da se na kraju puta opaža značajno zakretanje ravnine polarizacije svjetlosti. Kut zakretanja enantiomera ovisi o valnoj duljini upotrijebljene svjetlosti, temperaturi, koncentraciji otopine i debljini sloja. Da bi se mogli uspoređivati različiti uzorci, valja izmjeriti specifično zakretanje, tako da se upotrijebi svjetlost iste valne duljine (najčešće svjetlost natrijeve lampe, D-linije 589 i 589,6 nm), kiveta duga 1 dm, a koncentracija spoja treba biti 1 g/mL.
Mliječna kiselina izolirana iz kiselog mlijeka ne zakreće ravninu linearno polarizirane svjetlosti. To je zato što je to smjesa jednakih dijelova oba enantiomera, tj. lijevozakrećućih i desnozakrećućih molekula mliječne kiseline. Kada zraka polarizirane svjetlosti prođe pokraj jedne molekule, ravnina polarizacije neznatno se zakrene u jednom smjeru. Na svom daljem putu ona će naići na molekulu koja je zrcalna slika prve molekule. Prema tome, efekt izazvan jednom molekulom poništava se drugom molekulom. Smjesa jednakih količina enantiomera zove se racemična smjesa. Prolazeći kroz otopinu racemata svjetlost nailazi na mnoge bilijune molekula, ali kako je broj lijevozakrećućih molekula jednak broju desnozakrećućih, racemična smjesa je optički inaktivna.
Optički inaktivna vinska kiselina, kojom se je poslužio Pasteur u svojim istraživanjima, bila je racemična smjesa. Običnim povećalom i pincetom Pasteur je zrcalno simetrične kristale vinske kiseline iz racemične smjese rastavio na enantiomere. Nažalost, to nije uvijek moguće.
U spojevima koji imaju više kiralnih centara javlja se više stereoizomera. Spojevi s dva kiralna centra mogu imati 4 stereoizomera. Spojevi s tri kiralna centra mogu imati najviše 8, a oni s četiri kiralna centra najviše šesnaest stereoizomera. Maksimalan broj stereizomera jednak je 2n, gdje je n broj kiralnih centara.
3.5.3. Apsolutna konfiguracija
Razmještaj skupina atoma nekog spoja u prostoru zove se konfiguracija. Dvije zrcalno simetrične molekule mliječne kiseline, tj. dva enantiomera, imaju prema tome suprotne konfiguracije. Da bi se znalo o kojem se enantiomeru radi, dogovorena su pravila označavanja apsolutne konfiguracije. Ta su pravila postavila tri kemičara, Cahn, Ingold i naš nobelovac Prelog, pa se po njima zovu CIP-pravila.
- Četiri atoma vezana na kiralni centar označe se brojevima tako da atom s najvećim rednim brojem u periodnom sustavu dobije broj 1, a atom s najmanjim rednim brojem broj 4. Prioriteti u ovom nizu rastu od lijeva nadesno: ‒H, ‒CH2, ‒NH2, ‒OH, ‒SH, ‒Cl, ‒Br, ‒I, itd.
- Ako su na kiralni centar vezana dva istovrsna atoma, prednost se određuje prema sljedećem redoslijedu atoma u skupini: -CH2-H, -CH2-CH3, -CH2-NH2, -CH2-OH, -CH2-Cl itd.
- Atom vezan dvostrukom ili trostrukom vezom smatra se jednako vrijedan kao dva, odnosno tri jednostruko vezana atoma.
- Molekula se promatra kroz kiralni centar tako da je skupina s najmanjom prednošću usmjerena od nas. Ako su skupine 1, 2 i 3 poredane tako da slijede smjer kretanja kazaljke na satu, onda se takva konfiguracija označava slovom R (lat. rectus = desno). Ako su skupine 1, 2 i 3 poredane u smjeru suprotnom od smjera kretanja kazaljke na satu, tad je konfiguracija pripadnog enantiomera S (lat. sinister = lijevo). Označavanje apsolutne konfiguracije enantiomera mliječne kiseline prikazuje slika 3.24.
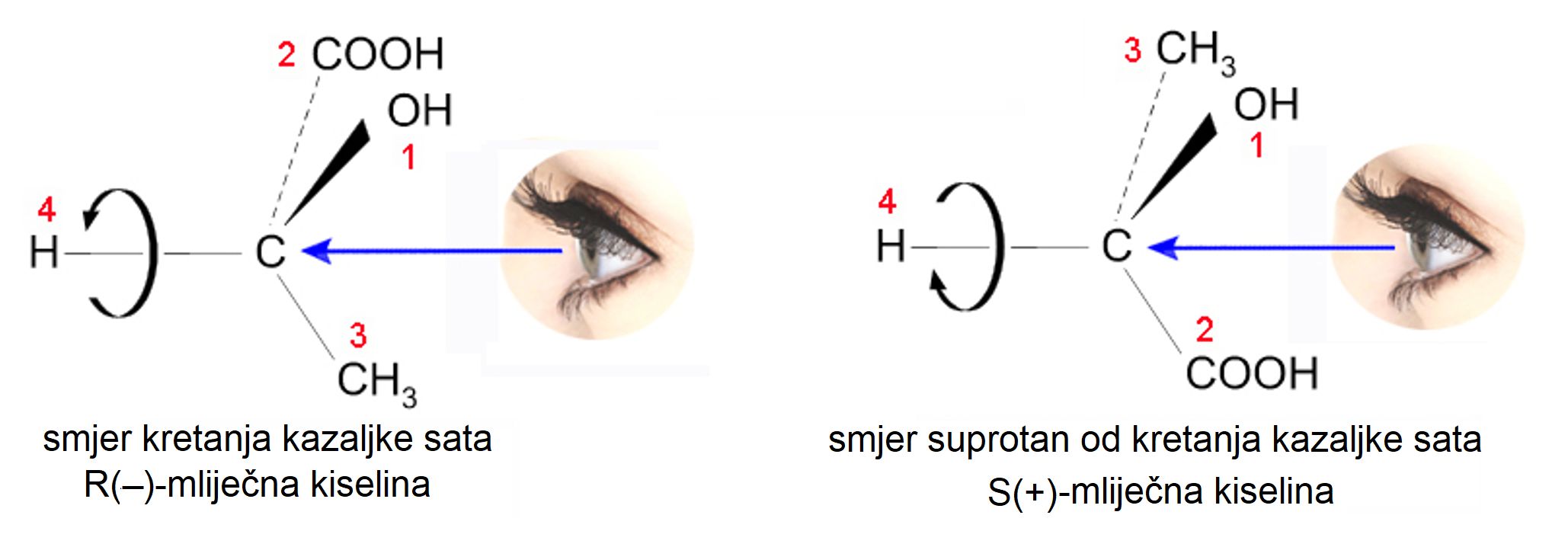
Slika 3.24. Označavanje apsolutne konfiguracije enantiomera mliječne kiseline.
R-mliječna kiselina zakreće ravninu polarizirane svjetlosti suprotno od kretanja kazaljke na satu i zato je označena kao R(-)-mliječna kiselina. S-mliječna kiselina zakreće ravninu polarizirane svjetlosti u smjeru kretanja kazaljke na satu i zato je označena kao S(+)mliječna kiselina. Ne smije se brkati apsolutna konfiguracija i zakretanje ravnine polarizirane svjetlosti. To su dvije različite i neovisne pojave.
Valja naglasiti da enantiomeri na jednak način reagiraju s reagensima koji nemaju kiralni centar (akiralni reagensi). No u biokemijskim reakcijama u živom organizmu to nije tako. Uzmimo kao primjer enzime. Enzimi su velike molekule složene strukture, ali je samo mali dio molekule aktivno mjesto (koje je često kiralno) na koje se veže supstrat, tj. tvar na kojoj se događa kemijska promjena. Da bi došlo do biokemijske reakcije, enzim i supstrat moraju pristajati jedan uz drugi poput ključa i brave. Prema tome, samo jedan enantiomer može sudjelovati u biokemijskoj reakciji, dok drugi, koji ne pristaje na aktivno mjesto na enzimu, ostaje nepromijenjen. Enzimi razlikuju enantiomere i zato se mliječna kiselina izolirana iz mišića sastoji samo od jednog enantiomera. To je primijetio još Pasteur 1858. god. Ako se otopini racemata mliječne kiseline doda Bacillus laktici acidi, samo će molekule lijevozakrećuće mliječne kiseline biti razgrađene, dok će molekule desnozakrećuće mliječne kiseline zaostati u otopini. Gljivica Penicillium glaucum iz racemata vinske kiseline razgrađuje samo desnozakrećuće molekule vinske kiseline, dok lijevozakrećuće ostaju netaknute. Ta se metoda može iskoristiti za razdvajanje enantiomera. Na žalost, nije baš uvijek praktična, jer gljivice "pojedu" polovicu uzorka. Zato su kemičari razradili druge, čisto kemijske postupke razdvajanja enantiomera. Čak što više, razrađeni su i postupci u kojima prigodom sinteze nastaje samo jedan ili pretežito jedan od enantiomera (stereoselektivna sinteza).
Zadaci i teme za vlastite aktivnosti i samoobrazovanje
T. Portada i T. Klačić, Polarimetar kao nastavno pomagalo, Kem. Ind. 65 (5-6) (2016) 291-296.
Doznajte gdje se i u koju svrhu u prehrambenoj industriji rabe karboksilne kiseline.
O karboksilnim
kiselinama u mlijeku i mliječnim proizvodima doznajte više iz članka:
B. Perko i sur.: Organske kiseline kao mogući parametri kvalitete parmezana.
Opišite karakteristična svojstva karboksilnih kiselina (vrelište, topljivost, miris …).
Doznajte koje se polikarboksilne kiseline javljaju u prirodi (oksalna, limunska…).
Koje od tih kiselina imaju stereoizomere?
Doznajte koje su nezasićene karboksilne kiseline najčešće u prirodi (palmitinska …).
Opišite svojstva nekih aromatskih karboksilnih kiselina (benzojeva, salicilna, ftalna …).
O karboksilnim
kiselinama više doznajte iz članka:
Encyclopadia Britannica - Carboxylic acid.
Izradite plakat, PowerPoint prezentaciju, snimite video, održite predavanje u razredu, organizirajte raspravu ili pišite u školskom listu o svojstvima i primjeni karboksilnih kiselina.
3.6. Esteri
Esteri su najvažniji derivati karboksilnih kiselina. Nastaju reakcijom kiselina i alkohola uz izdvajanje vode. Primjerice, reakcijom octene kiseline i etanola nastaje etilni ester octene kiseline ili etil-etanoat (etil-acetat):
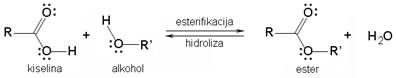
Slika 3.25. Reakcija nastajanja estera naziva se esterifikacija. No ester i voda međusobno reagiraju te ponovo daju kiselinu i alkohol. Ta reakcija suprotna smjera je hidroliza ili saponifikacija estera. Kad broj molekula estera koji nastaje esterifikacijom postane jednak broju molekula estera koje se razgrađuju hidrolizom (saponifikacijom), u reakcijskoj smjesi uspostavit će se stalan omjer koncentracija estera, kiseline, alkohola i vode. Kaže se da je reakcija u stanju dinamičke ravnoteže.
Pokus 3.11. Priprema estera octene kiseline
Pribor i kemikalije: epruvete, kapaljke s gumicom, manje plastične ili staklene čašice, plamenik, bezvodni natrijev acetat, koncentrirana sumporna kiselina, različiti alkoholi (etanol, propanol butanol…)
Postupak:
- Uspite u epruvetu malo bezvodnoga natrijeva acetata, tek toliko da dobijete sloj visine 2 do 3 mm.
- U epruvetu s bezvodnim natrijevim acetatom dodajte 2 do 3 kapi izabranog alkohola (etanola ili propanola ili butanola…) i čistom suhom kapalicom dodajte 2 kapi koncentrirane sumporne kiseline.
- Reakcijsku smjesu ugrijte do vrenja i ostavite u stalku za epruvete dok se ohladi.
- Hladnoj reakcijskoj smjesi dodajte nekoliko kapi hladne vode, a potom sadržaj epruvete izlijte u čašu s oko 20 mL hladne vode.
- Pažljivo pomirišite sadržaj čaše. Esteri su netopljivi u vodi pa isplivaju na površinu. Tako se njihov karakterističan miris može bolje osjetiti. Višak octene kiseline i alkohola otopi se u vodi pa se njihov miris ne miješa s mirisom estera.
- Estere benzenkarboksilne kiseline (benzojeva kiselina, C6H5COOH)
i
2-hidroksibenzojeve kiseline (salicilna kiselina, C7H6O3 ili HOC6H4COOH) možete gore opisanim postupkom pripremiti neposrednom reakcijom tih kiselina i različitih alkohola.
Reakcija esterifikacije je relativno spora reakcija. Može se ubrzati dodatkom kiseline kao katalizatora. Esteri organskih kiselina obično su ugodna mirisa koji najčešće podsjeća na voće. Stoga se mnogi od njih rabe kao voćne esencije. Tako etil-etanoat (etil-acetat, CH3COOC2H5) podsjeća na staro vino. Ester octene kiseline i 3-metilbutan-1-ol-a (izoamilnog alkohola, CH3CH(CH3)CH2CH2OH) miriše na kruške. Etanol i maslačna kiselina daju ester koji ima miris ananasa.
Esteri mineralnih kiselina primjenjuju se u mnogim organskim sintezama. Esteri dušične kiseline mogu se dobiti neposrednim djelovanjem smjese koncentrirane sumporne i koncentrirane dušične kiseline na alkohol, primjerice:
C2H5OH + HNO3
→ ![]() C2H5ONO2
+ H2O
C2H5ONO2
+ H2O
Etil-nitrat, C2H5ONO2, je vrlo osjetljiva tekućina koja eksplodira pri udarcu. Od svih estera dušične kiseline najvažniji je 1,2,3-trinitrooksipropan, C3H5(ONO2)3, (glicerol-trinitrat ili nitroglicerin). To je uljasta tekućina, netopljiva u vodi, vrlo osjetljiva na udar, no ipak ne toliko kako se priča. Nitrolicerin se naime pali pri udaru čeličnog čekića mase 2 kg koji pada s visine od 4-5 cm, pa nema opasnosti da bi se upalio kada se prelijeva iz boce u bocu (kako se na filmu prikazuje).
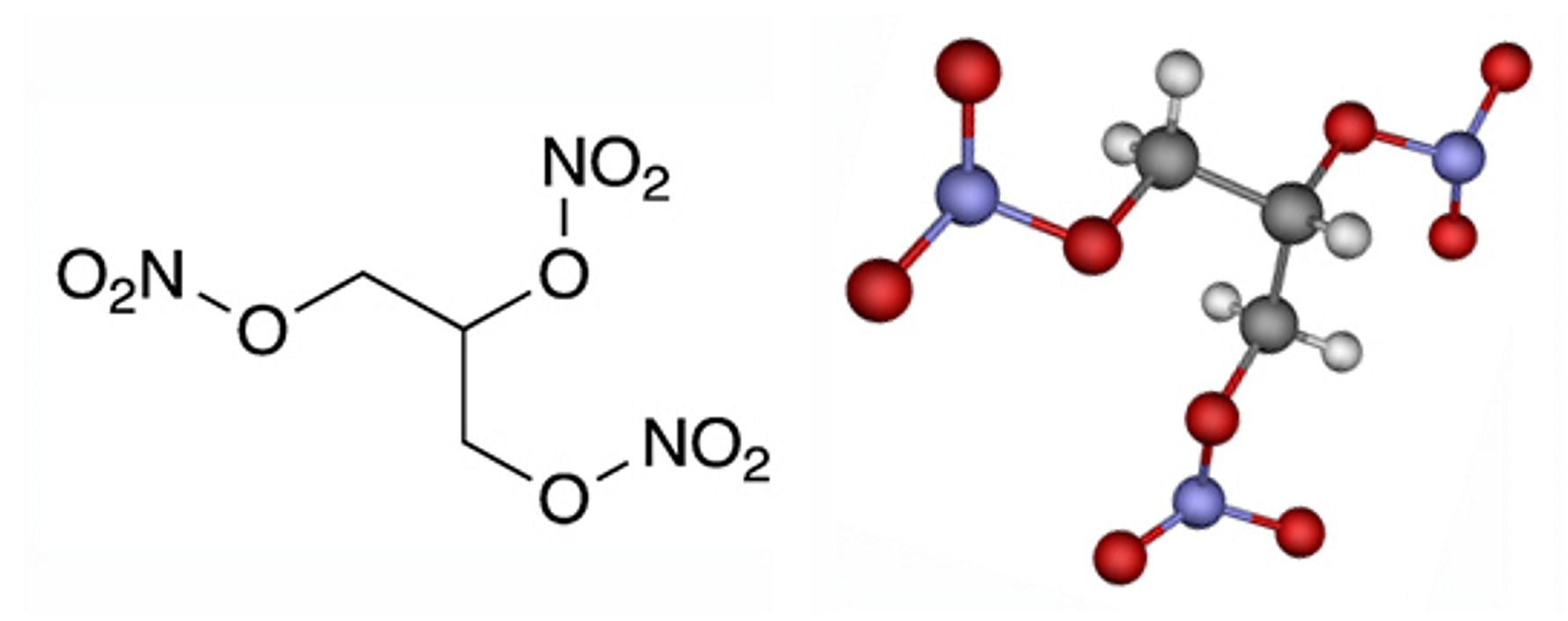
Slika 3.26. Strukturna formula i model molekule nitroglicerina.
Alfred Nobel (1833. – 1896.) je 1866. otkrio da se nitroglicerin može apsorbirati u infuzorijskoj zemlji te dobiti masu mnogo manje osjetljivu na udar. Tu je masu Nobel nazvao dinamitom te upotrijebio kao privredni eksploziv. Danas se proizvode dinamiti s nešto izmijenjenim sastavom. Zanimljivo je da nitroglicerin širi krvne žile, pa se primjenjuje kao lijek kod stenokardije.
Zadaci i teme za vlastite aktivnosti i samoobrazovanje
Napišite strukturne formule lako hlapljivih estera, karakteristična ugodna mirisa, koje nalazimo u voću: izoamil etanoat (kruške), butil butanoat (ananas), etil metanoat (rum), etil etanoat (mlado vino) i-amil etanoat, i-butil etanoat (aroma banane), etil heksanoat (aroma jabuke), 2-feniletil etanoat (med, voćna, cvjetna aroma) i td.
Izradite plakat, PowerPoint prezentaciju, snimite video, održite predavanje u razredu, organizirajte raspravu ili pišite u školskom listu o svojstvima i uporabi nitroglicerina.
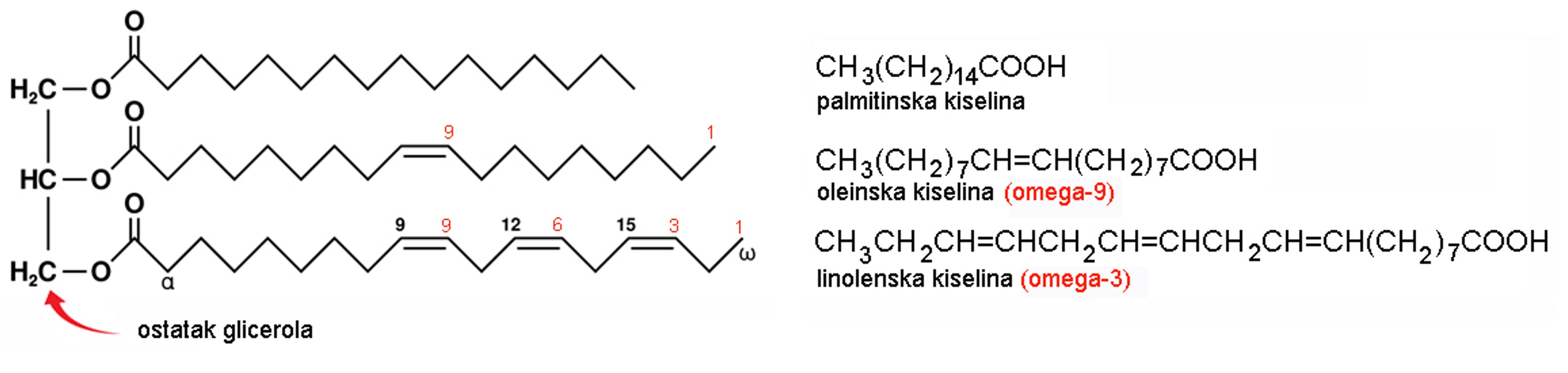
3.6.1. Masti i ulja
Masti i ulja su triesteri glicerola i masnih kiselina. Masne kiseline koje ulaze u sastav masti i ulja su monokarboksilne kiseline s dugim nerazgranatim lancem te parnim brojem ugljikovih atoma, od 14 do 22. Masne kiseline mogu biti zasićene i nezasićene.
Slika 3.27. Opća formula masti i ulja. Masne kiseline koje ulaze u sastav masti i ulja mogu biti zasićene i nezasićene. Dvostruke veze u prirodnim nezasićenim masnim kiselinama imaju cis-konfiguraciju, a to znači da su dva atoma vodika na istoj strani dvostruke veze.
Nezasićene masne kiseline imaju važnu ulogu u očuvanju zdravlja. Stoga se preporučuje prehrana uljima koja sadržavaju omega-3 i omega-6 nezasićene masne kiseline. Omega-3 masne kiseline imaju dvostruku vezu na trećem, a omega-6 na šestom C-atomu brojeći od –CH3 skupine, tj. od kraja lanca. Procjenjuje se da je prethistorijski razvoj roda Homo i kasniji razvoj modernog čovjek kao vrste, tekao uz prehranu koja je sadržavala podjednaku količinu esencijalnih omega-6 i omega-3 masnih kiselina. U prehrani današnjih ljudi taj je odnos znatno promijenjen u korist omega-6 kiselina i iznosi 10 do 20 : 1. Gubitak ravnoteže omega-6 i omega-3 polinezasićenih masnih kiselina u prehrani ljudi može dijelom objasniti porast tipičnih bolesti modernog čovjeka: krvožilno-srčane bolesti, alergije i različita maligna oboljenja. To je sasvim nova pojava u dugoj evoluciji ljudske vrste.
Slika 3.28. Linolna kiselina dolazi u lanenom ulju (lat. linum: lan + oleum: ulje) u obliku estera s glicerolom. To je dvostruko nezasićena omega-6 masna kiselina (crveni brojevi). Bitna je za prehranu sisavaca jer je oni ne mogu sintetizirati. Inače ugljikovi atomi u karboksilnim kiselinama dobivaju brojeve počem od ugljika karboksilne skupine koji ima broj 1.
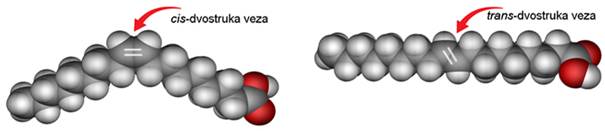
Slika 3.29. Računalno generirani modeli molekula cis- i trans-oleinske kiseline. Cis konfiguracija znači da su dva atoma vodika na istoj strani dvostruke veze. Krutost dvostruke veze uzrokuje savijanje lanca i sprječava rotaciju dijelova molekule oko dvostruke veze. U trans-konfiguraciji dva su atoma vodika na suprotnim stranama dvostruke veze.
Masti koje sadržavaju trans masne kiseline nastaju pri djelomičnom hidrogeniranju ulja uz katalizatore, tj. vezanju vodika na dvostruke veze nezasićenih masnih kiselina sadržanih u ulju. Tako se iz tekućih ulja dobivaju polukrute masti, primjerice margarin. Trans masne kiseline također mogu nastati pri pečenja ili prženju hrane na biljnim uljima. Načelno treba paziti da se niti jedno ulje ne zagrijava pri temperaturi koja uzrokuje pojavu „dima“. Kad se to dogodi dolazi do kemijskih promjena u ulju i mogućem nastajanju trans masnih kiselina.
Trans masne kiseline nisu dobre za zdravlje jer povećavaju koncentraciju lipoproteina niske gustoće tj. LDL kolesterola, a smanjuju koncentraciju lipoproteina visoke gustoće tj. HDL kolesterola. LDL kolesterol je „loš“ kolesterol jer začepljuje krvne žile. HDL kolesterol je „dobar“ jer čisti krvne žile te smanjuje mogućnost nastajanje naslaga i suženja u njima.
Američka agencija za kontrolu hrane i lijekova (FDA) je 2018. god. uvela potpunu zabranu trans masti u proizvodnji hrane. Time nisu zabranjene trans masti koje se prirodno pojavljuju, ali su zabranjeni bilo kakvi postupci u proizvodnji hrane koji dovode do nastajanja trans masnih kiselina.
Zadaci i teme za vlastite aktivnosti i samoobrazovanje
N. Raos, Znanstvenici upozoravaju: globano zatopljenje izgladnjuje more, Bug-online, 1-08-202,
Napišite IUPAC imena sljedećih kiselina: maslačna, kapronska, kaprilna, laurinska, miristinska, palmitinska, stearinska, oleinska (omega-9), linolna (omega-6), linolenska (omega-3).
Potražite odgovarajuću literaturu o utjecaje zasićenih i nezasićenih masnih kiselina na ljudsko zdravlje.
Izradite plakat, PowerPoint prezentaciju, snimite video, održite predavanje u razredu, organizirajte raspravu ili pišite u školskom listu o uljima i mastima.
3.6.2. Soli viših masnih kiselina - sapuni i detergenti
Vidi na internetu: e-Kemija: Sikirica - Sapun
Hidrolizom masti i ulja, tj. zagrijavanjem s otopinama jakih lužina, dobije se glicerol i kalijeve ili natrijeve soli masnih kiselina, poznatije kao sapuni. Kalijevi sapuni su mekani i rabe se u tekstilnoj industriji za pranje vune. Natrijevi sapuni su kruti pa se koriste za pranje u domaćinstvu.
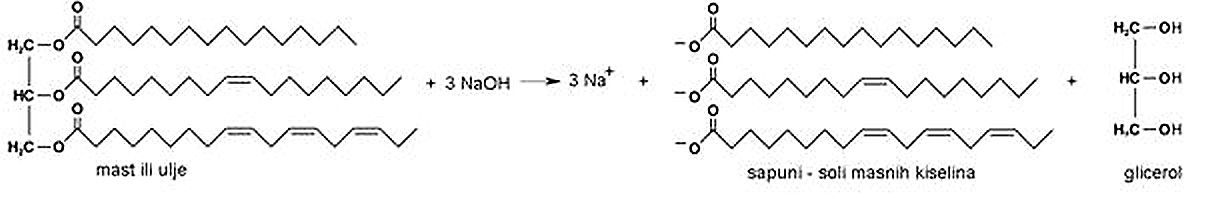
Slika 3.30. Hidrolizom masti ili ulja dobiju se soli masnih kiselina i glicerol.
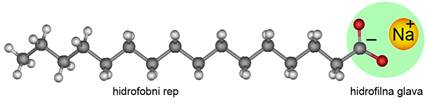
Slika 3.31. Molekule sapuna sastoje se od hidrofobnog ugljikovodičnog dijela (rep) i hidrofilne karboksilne skupine (glava).
Sapun je anionski tenzid. Tenzidi su tvari koje snizuju napetost površine vode. Svi tenzidi sadržavaju hidrofilnu skupinu (koja „voli“ vodu) i hidrofobni ugljikovodični lanac (koji se „boji“ vode). Svojstva sapuna da tvore netopljive soli s ionima zemnoalkalijskih metala čine ih neprikladnima za pranje u tvrdoj, a posebno u morskoj vodi. Stoga se danas umjesto sapuna rabe druge površinski aktivne tvari proizvedene od derivata nafte. Unatoč njihovim izvanrednim svojstvima kao sredstava za pranje, imaju i loša obilježja jer onečišćuju vodotokove i otrovni su za ribe. Naime, sapuni sadržavaju samo ravnočlane ugljikovodične lance s parnim brojem ugljikovih atoma koji se mogu potpuno biološki razgraditi. Mikroorganizmi pomoću enzima mogu razgraditi alifatske dijelove molekula tenzida odcjepljujući dva po dva ugljikova atoma ugljikovodičnog lanca sve do ugljikovih atoma vezanih na sekundarne ili tercijarne ugljikove atome. Zato se pri proizvodnji tenzida mora osigurati što manji udio molekula tenzida s razgranatim ugljikovodičnim lancem. Nekad se o tome nije brinulo pa su svi vodotokovi bili preplavljeni pjenom.
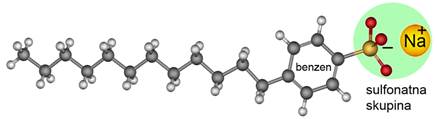
Slika 3.32. Za pranje su najvažniji anionski tenzidi, ponajprije alkilbenzensulfonati (R–C6H4–SO3H), alkilsulfonati (R–SO3H) i alkilsulfati (R-OSO3H).
Pokus 3.12. Monomolekulski sloj tenzida na površini vode
Vidi na internetu:
e-Kemija: Sikirica - Monomolekulski sloj
Molekule površinski aktivnih tvari, tj. tenzida, smanjuju napetost (energiju) površine na granicama dviju faza. Primjerice u „mjehuriću od sapunice“ cijelu površinu, s vanjske i unutarnje strane mjehurića, prekrivaju molekule tenzida u monomolekulskom sloju. Molekule tenzida orijentirane su tako da je hidrofilni dio okrenut prema vodi a hidrofobni prema zraku.
Tenzidi djeluju kao emulgatori. Primjerice, majoneza je emulzija ulja u vodi. Kao emulgator služi lecitin iz žumanca jaja. Maslac i margarin su emulzije vode u ulju. Micele u emulziji vode u ulju, maslacu i margarinu sastoje se od „kapljica“ vode okruženih molekulama emulgatora, najčešće lecitina dobivena iz soje.
Pokus 3.13. Emulzija
Vidi na internetu: Heli Levy - water oil emulsion
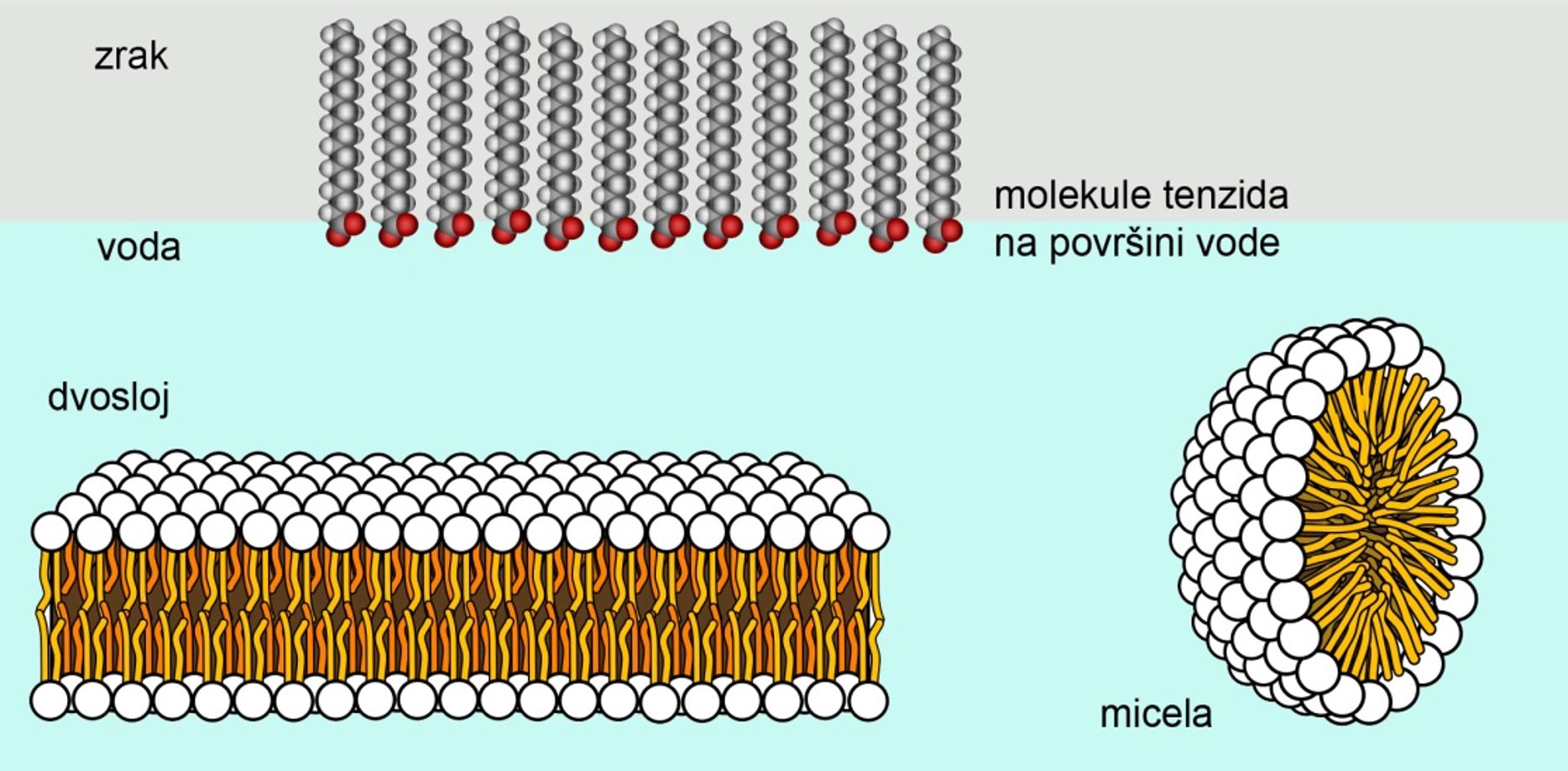
Slika 3.33. Na površini vode molekule tenzida orijentiraju se tako
da hidrofilni dio okrenu prema vodi a hidrofobni prema zraku. U vrlo
razrijeđenim otopinama tenzidi tvore prave otopine. No pri većim
koncentracijama tenzida u vodenim otopinama nastaju koloidne otopine koje se
sastoje od micela. Micele su velike
nakupine molekula tenzida u kojima su nepolarni (hidrofobni) dijelovi molekula
okrenuti jedni prema drugima, a polarni (hidrofilni) dijelovi prema vodi. U
nepolarnim otapalima događa se obratno. Prema unutrašnjosti micele (voda)
okrenuti su polarni dijelovi tenzida a nepolarni prema nepolarnom otapalu.
Natrijevi ioni su izostavljeni.
Slika izvor: Wikipedia - Micelle
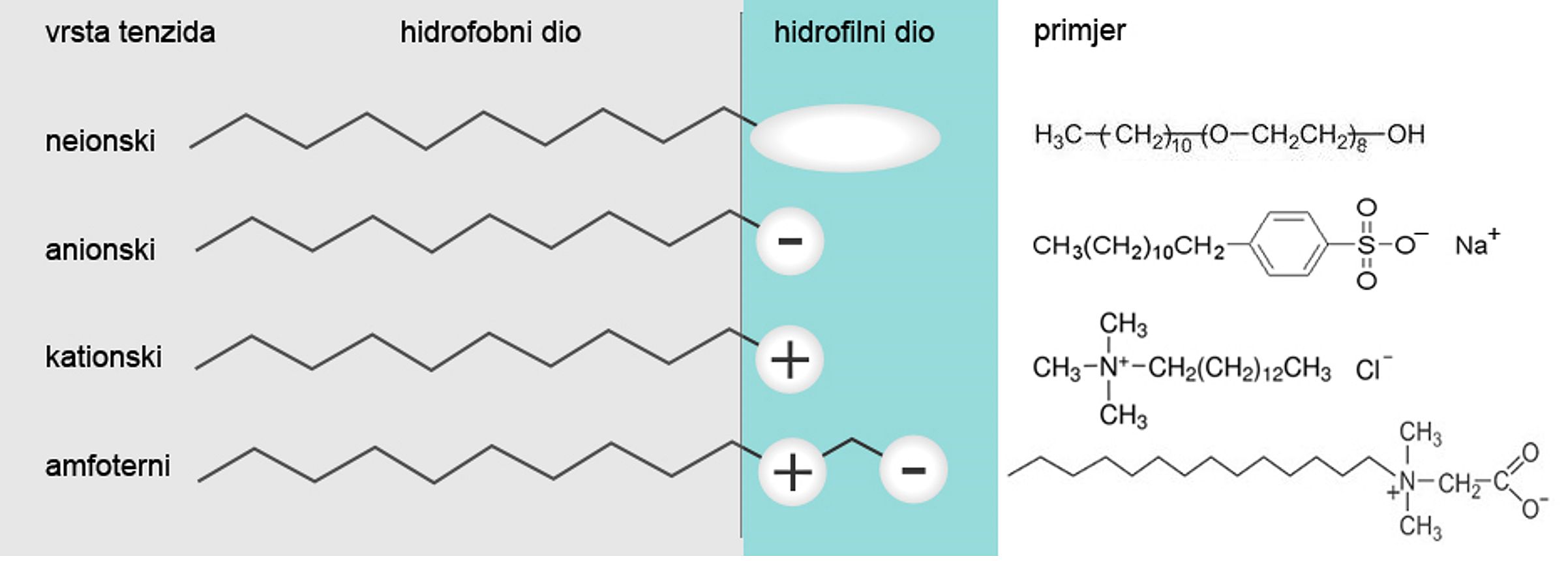
Slika 3.34. Tenzidi mogu biti neionski, anionski, kationski i amfoterni. Za pranje su najvažniji anionski tenzidi, ponajprije alkilbenzensulfonati (R–C6H4–SO3Na), alkilsulfonati (R–SO3Na) i alkilsulfati (RO–SO4Na). R je ugljikovodična skupina.
Pokus 3.14. Kako detergenti peru
Vidi na internetu:
Science Ready - Action of Soaps and Detergents
Pokus 3.15. Usporedba svojstava sapuna i detergenata
Vidi na internetu:
e-Kemija: Sikirica - Sapun
Zadaci i teme za vlastite aktivnosti i samoobrazovanje
Obrazložite razlike strukture i svojstava neionskih, anionskih, kationskih i amfoternih tenzida.
Zašto se ne preporučuje miješanje različitih sredstava (tenzida) za pranje i čišćenje?
Što će se dogoditi ako rublje pokušate oprati smjesom anionskog i kationskog tenzida?
Zašto su naše bake nakon pranja sapunom, kosu ispirale vrlo razrijeđenom otopinom octa ili limunova soka?
Kako se u domaćinstvu od otpadnih masnoća „kuha sapun“. Zašto se nakon kuhanja sapuna u reakcijsku smjesu dodaje znatna količina kuhinjske soli?
Što je napetost površine i zašto se ona smanji dodatkom nekoliko kapi tenzida?
Na što se sve troši sapun pri pranju u tvrdoj vodi.
Kakav je utjecaj tenzida na okoliš? Pročitajte na ambalaži sastav „deterdženta“ za pranje rublja i obrazložite ulogu njegovih sastojaka u procesu pranja.
Izradite plakat, PowerPoint prezentaciju, snimite video, održite predavanje u razredu, organizirajte raspravu ili pišite u školskom listu o sapunima i detergentima.
3.6.3. Voskovi
Biljni i životinjski voskovi su esteri viših masnih kiselina i viših alkohola. Za razliku od masti, njihova alkoholna komponenta nije glicerol, već viši alifatski alkoholi sa 24 do 36 ugljikovih atoma. Primjerice, glavni sastojak pčelinjeg voska je miricil palmitat, ester palmitinske kiseline i miricil alkohola, C15H31COOC30H61.
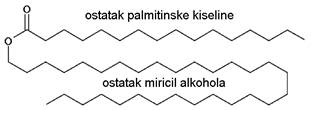
Slika 3.35. Molekulska struktura miricil palmitata, tipičnog estera iz pčelinjeg voska.
Prirodni voskovi mogu sadržavati estere nezasićenih masnih kiselina i alkohola. Na područjima s toplom klimom biljke izlučuju voskove, primjerice karnauba vosak, radi sprječavanja isparavanja vode. Montan vosak dobiva se ekstrakcijom benzenom iz smeđeg ugljena i lignita. Sadržava visoku koncentraciju estera zasićenih masnih kiselina i alkohola. U voskove se ubraja i vosak u ljudskom uhu.
Voskovi se rabe u farmaceutskoj, prehrambenoj (žvakaće gume, čokoladni bomboni), kozmetičkoj (ruževi, maskare, učvršćivači kose, proizvodi za depilaciju), i tekstilnoj (impregnacija) industriji te za proizvodnju svijeća, sredstava za poliranje itd.
3.7. Lipidi
Lipidi (grč. Lípos - mast) su heterogena skupina organski spojeva koja nema zajednička kemijska svojstva, ali im je zajedničko svojstvo netopljivost u vodi te izuzetno dobra topljivost u organskim otapalima. Imaju važnu ulogu u svim živim organizmima. Primarna im je zadaća dugotrajno skladištenje energije, izgradnja bioloških membrana te prijenos signala među stanicama. Lipide dijelimo u sljedeće najvažnije kategorije: triacilglicerole (triestere glicerola i masnih kiselina – masti i ulja), fosfolipide, voskove i steroide.
3.7.1. Fosfolipidi
Fosfolipidi jedna su od više vrsta membranskih lipida, tj. onih koji tvore biološke membrane. Najveću skupinu fosfolipida tvore derivati glicerola u kojima je jedna terminalna hidroksilna skupina esterificirana fosfornom kiselinom, a preostale dvije hidroksilne skupine masnim kiselinama. Za razliku od triestera glicerola i masnih kiselina koji su hidrofobni, fosfolipidi imaju hidrofilnu "glavu" koja sadržava fosfatnu skupinu i dva hidrofobna "repa".
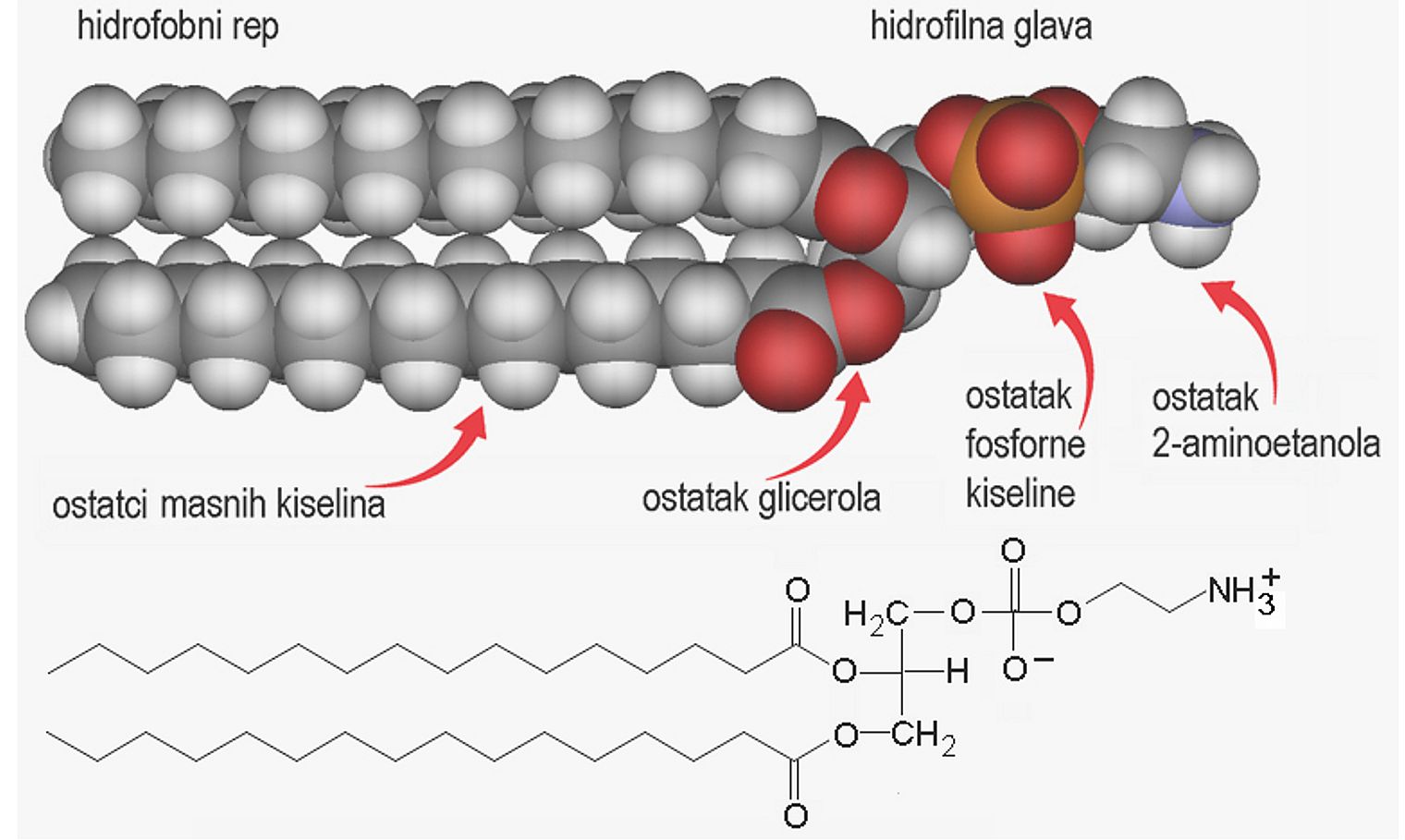
Slika 3.36. Model molekule i shematski prikaz građe jednog fosfolipida.
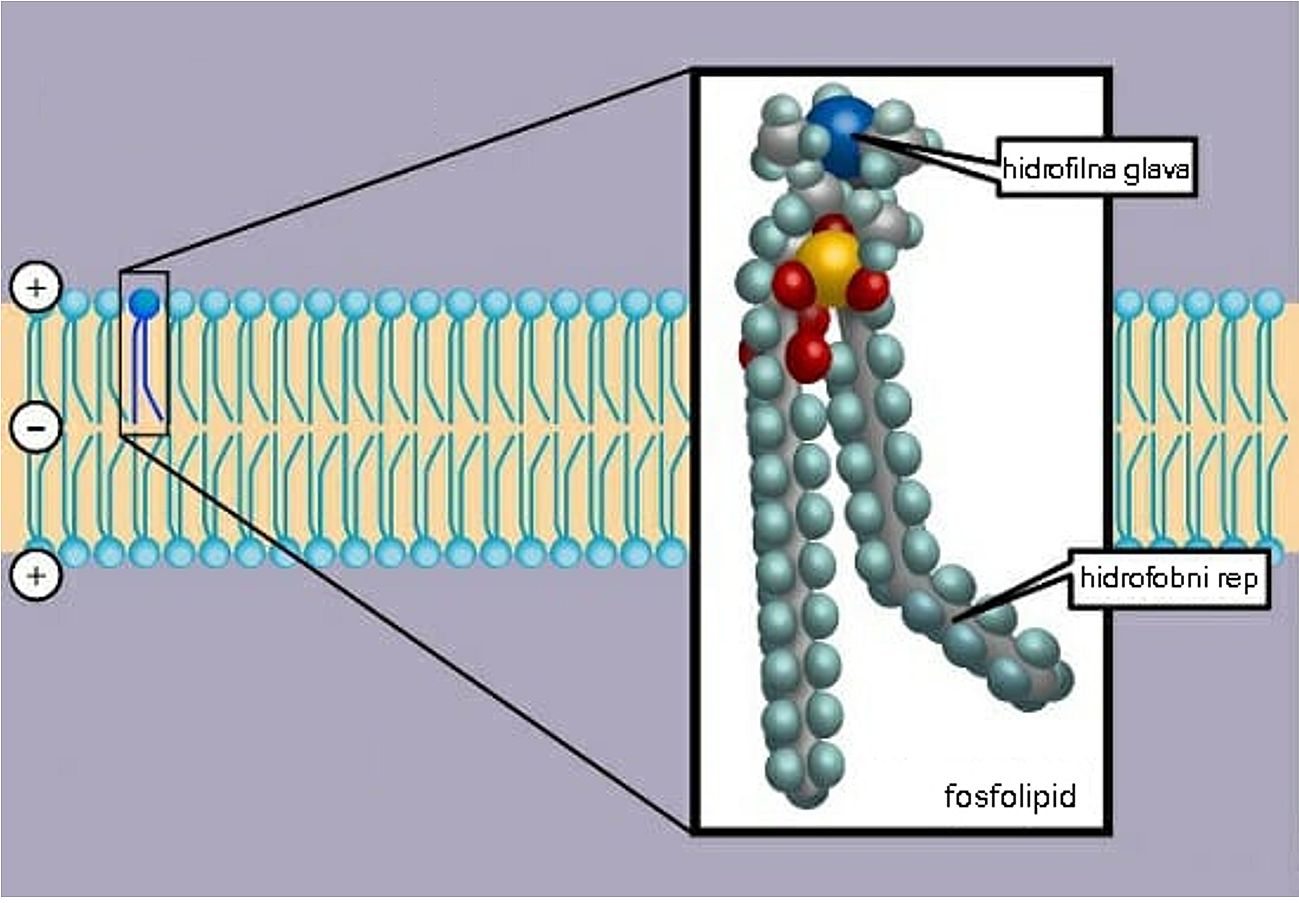
Slika 3.37. Fosfolipidi u staničnoj membrani čine lipidni dvosloj
debljine dviju molekula. Pritom su
polarni dijelovi molekula okrenuti prema vodi, a nepolarni ili hidrofobni
dijelovi okrenuti su jedni prema drugima. Takvi dvosloji okosnica su
staničnih membrana.
Slika izvor: Wikipedia - Phospholipid
Lipidne membrane su izolatori. Kroz takve dvostruke slojeve ne mogu proći polarne molekule i ioni. Iznimku čini voda. Molekule vode prolaze kroz staničnu membranu kao molekulski grozd (engl. cluster), koji je još uvijek manji od hidratiziranih iona. To je moguće zbog promjenjive konformacije ugljikovodičnih lanaca. Kroz stanične membrane mogu difundirati i tvari topljive u lipidima.
3.7.2. Steroidi
Steroidi su lipidi koji imaju dvije glavne biološke funkcije: kao važne komponente staničnih membrana koje mijenjaju viskoznost lipidne membrane, i kao signalne molekule. Stotine steroida nalaze se u biljkama, životinjama i gljivama. Strukturne formule najpoznatijih steroida prikazane su na sljedećim slikama:
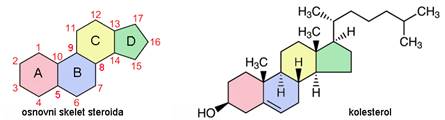
Slika 3.38. Osnovni skelet steroida sastoji se sedamnaest ugljikovih atoma, vezanih u četiri sljubljena prstena, tri cikloheksanska A, B i C i jednog ciklopentanskog D. Steroidi se razlikuju po funkcijskim skupinama vezanim na pojedinim mjestima osnovnog skeleta. Kolesterol je nužan za funkcioniranje organizma. Nalazi se u staničnim membranama svih tkiva, a najviše u mozgu i leđnoj moždini.
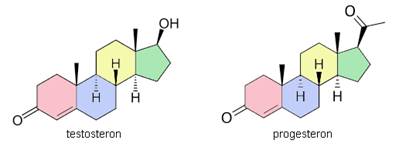
Slika 3.39. a) Testosteron, glavni muški spolni hormon i anabolički steroid b) Progesteron, steroidni hormon uključen u ženski menstrualni ciklus, trudnoću i embriogenezu.
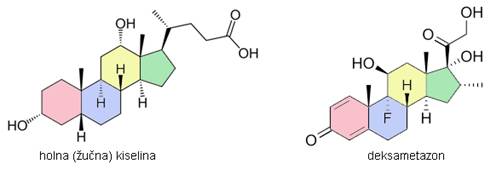
Slika 3.40. Holna ili žučna kiselina sadržava karboksilnu skupinu i dodatne hidroksilne skupine. Deksametazon je sintetski kortikosteroidni lijek.
Žučne kiseline čine oko 80 % organskih spojeva u žuči (drugi su fosfolipidi i kolesterol). Povećano lučenje žučnih kiselina dovodi do povećanja protoka žuči. Žučne kiseline omogućuju probavu jestivih masti i ulja. Služe kao tenzidi tvoreći micele koje uključuju hranjive tvari te olakšavaju njihovu apsorpciju. Žučne kiseline također imaju hormonsko djelovanje u cijelom tijelu.
Deksametazon se rabi za liječenje reumatskih problema, brojnih kožnih bolesti, teških alergija, astme, oticanje mozga, boli u oku nakon operacije oka te zajedno s antibioticima kod tuberkuloze. Dugotrajna primjena deksametazona može dovesti do gubitka koštane mase, katarakte, lakih modrica ili slabosti mišića.
Slično lipidima, steroidi su visoko koncentrirani izvori energije. No kod sisavaca obično nisu izvori energije, već se metaboliziraju i izlučuju.
Steroidi igraju ključnu ulogu u brojnim poremećajima, uključujući maligne bolesti poput raka prostate, gdje proizvodnja steroida unutar i izvan tumora potiče agresivnost stanica raka
Zadaci i teme za vlastite aktivnosti i samoobrazovanje
Razgradnja lipida i masnih kiselina.
Primjeri zloporabe anaboličkih steroida u sportu.
Upoznajte zdravstvene rizike zloporabe anaboličkih steroida.
Izradite plakat, PowerPoint prezentaciju, snimite video, održite predavanje u razredu, organizirajte raspravu ili pišite u školskom listu o zloporabi stereoida u sportu.
4. UGLJIKOHIDRATI
Ugljikohidrati su molekule sastavljene od ugljikovih, vodikovih i kisikovih atoma. Sastav mnogih ugljikohidrata može se izkazati formulom Cm(H2O)n. U doba kad se još nije poznavala građa molekula ugljikohidrata smatralo ih se spojevima ugljika i vode. Odatle im i potječe naziv koji se zadržao sve do danas. Ugljikohidrate dijelimo na monosaharide, oligosaharide i polisaharide. Riječ saharid potječe od grčke riječi σάκχαρον (sákharon). Monosaharidi i disaharidi dobro su topljivi u vodi, slatkog su okusa i nazivamo ih šećeri (tur. seker) ili sladori. Ugljikohidrati izvršavaju mnoge uloge u živim organizmima. Polisaharidi služe kao spremišta energije (npr. škrob i glikogen) i elementi krutih struktura (npr. celuloza u biljaka i hitin u člankonožaca).
4.1. Monosaharidi
Monosaharidi su aldehidi ili ketoni koji u svojoj strukturi sadržavaju najmanje dvije skupine –OH. Ovisno broju ugljikovih atoma monosaharidi zovu se treoze, tetroze, pentoze, heksoze itd. Ovisno o funkcijskim skupinama –CHO ili >C=O, razlikujemo aldoze i ketoze. Nazivi svih monosaharida završavaju nastavkom –oza.
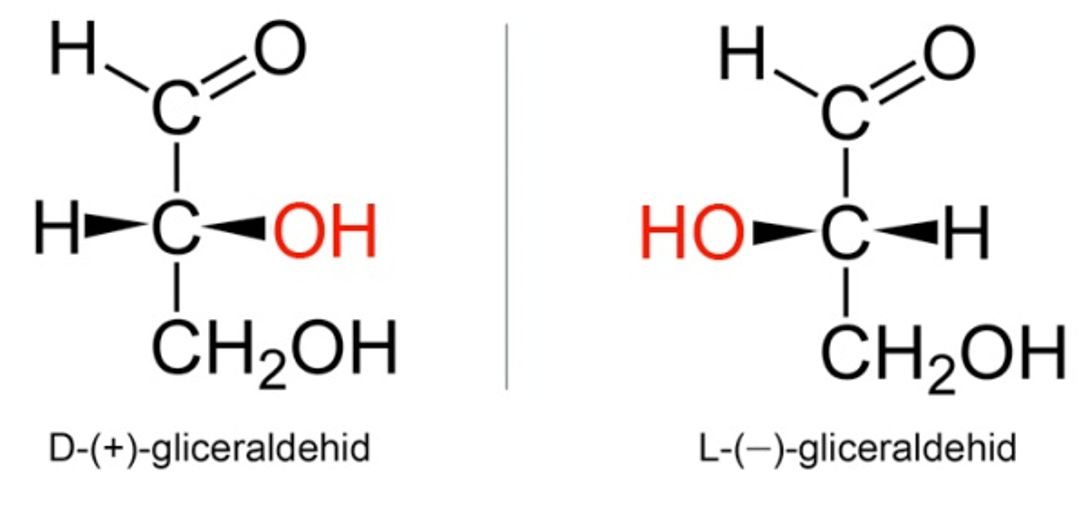
Slika 4.1. Najjednostavniji monosaharid s tri ugljikova atoma je gliceraldehid. Njegove su molekule kiralne jer sadržavaju jedan asimetrični ugljikov atom s dvama enantiomerima. Gliceraldehid predstavlja konfiguracijsku osnovu za označivanje ostalih ugljikohidrata.
Prema dogovoru svi srodni kiralni spojevi koji imaju konfiguraciju kao D-gliceraldehid imaju D-konfiguraciju. Te se oznake primjenjuju samo za ugljikohidrate, aminokiseline i spojeve koji se na jednostavan način mogu izvesti iz ugljikohidrata i aminokiselina.
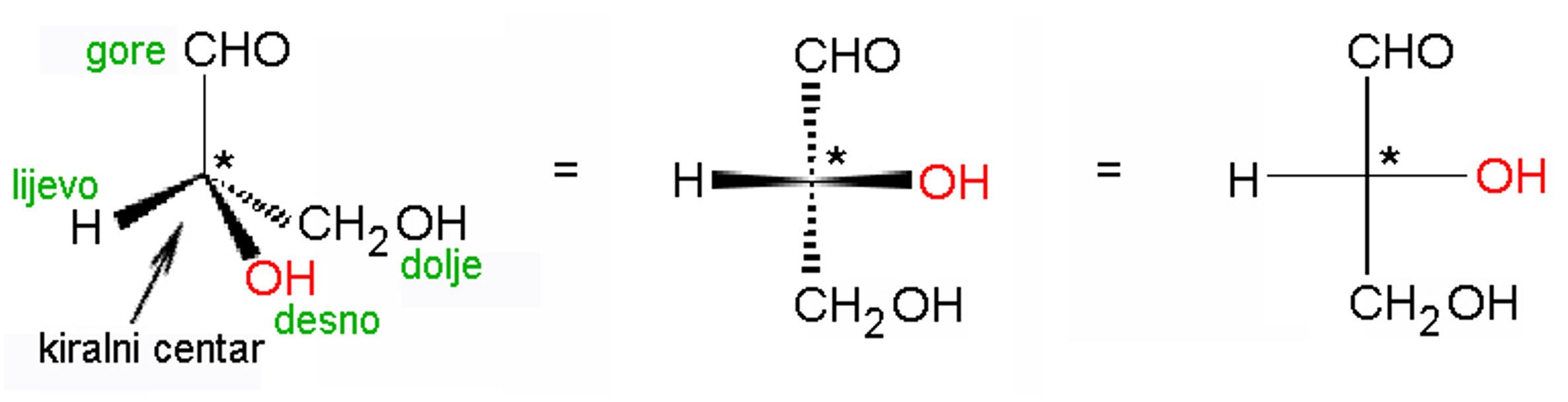
Slika 4.2. Prikaz odnosa između prostornog razmještaja funkcijskih skupina, klinaste i Fischerove projekcijske formule D-gliceraldehida.
Konfiguracije ugljikohidrata najčešće se prikazuju Fischerovim projekcijama. Konfiguracija kiralnog spoja uspoređuje se s konfiguracijom gliceraldehida. Po dogovoru najviše oksidirani ugljikov atom, tj. aldehidna skupina, u projekcijskoj formuli piše se gore. Monosaharid koji na predzadnjem ugljikovom atomu ima raspred skupina –H i –OH kao i D-gliceraldehid pripadaju D-nizu. Kod monosharida s više kiralnih centara najdonji asimetrični ugljikov atom određuje pripadnost D ili L-nizu.
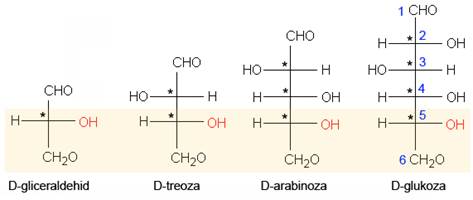
Slika 4.3. Fischerove projekcijske formule nekih monosaharida D-niza. Uočite jednak raspored -H i -OH skupina na predzadnjem ugljikovu atomu u svim članovima D-niza. Ugljikovi atomi u lancu dobivaju brojeve tako da aldehidna skupina ima broj 1. Asimetrični ugljikovi atomi označeni su zvjezdicom.
Svi prirodni monosaharidi pripadaju D-nizu. Svi monosaharidi prikazani na slici 4.3. sadržavaju aldehidnu skupinu –CHO, pa ih stoga svrstavamo u aldoze. One pokazuju reakcije svojstvene aldehidima. S Fehlingovim reagensom pri povišenoj temperaturi aldoze daju crvenosmeđi talog bakrova(I) oksida. S amonijakalnom otopinom srebrova nitrata (Tollensov reagens) tvore srebrno zrcalo. Pritom se aldehidna skupina oksidira u karboksilnu skupinu.
Glukoza, C6H12O6, najvažniji je monosaharid, kristalna tvar slatka okusa. Molekula glukoze sadržava četiri asimetrična ugljikova atoma, koji se u projekcijskoj formuli obično označuju zvjezdicom. Monosaharid s 4 asimetrična ugljikova atoma ima 24 = 16 mogućih stereoizomera. Od njih se samo jedan, D-(+)-glukoza, nalazi u prirodi u golemim količinama. Molekula glukoze u prirodi nije ravan lanac kako bismo mogli zaključiti iz Fischerove projekcijske formule. Veze među ugljikovim atomima čine tetraedarske kutove. Stoga se hidroksilna skupina vezana na atom C-5 može naći blizu karbonilnog kisika aldehidne skupine. Pritom dolazi do adicije hidroksilne skupine na karbonilnu skupinu pa nastaje šesteročlani heterociklički (piranski) prsten sa stoličastom konformacijom, sličnoj stoličastoj konformaciji cikloheksana. Tako nastaje još jedan asimetrični centar na atomu C-1, čime se broj stereoizomera poveća na 32.
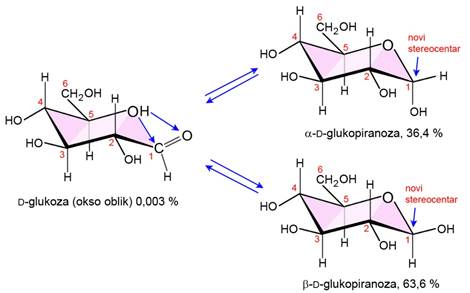
Slika 4.4. Stoličaste konformacije a-D-glukopiranoze i b-D-glukopiranoze mogu prelaziti jedna u drugu preko aldehidnog oblika. Šesteročlani prsten s jednim kisikovim atomom naziva se piranski prsten.
Za prikazivanje konfiguracija prstenatsih molekula monosaharida češće se rabe Haworthove projekcijske formule. U tim se formulama piranoze prikazuju šesterokutom postavljenim gotovo okomito na ravninu papira tako da se dobije perspektivni crtež. Radi jasnoće crteža često se izostavljaju atomi vodika vezani na prsten. U a-D-glukopiranozi skupina –OH na atomu C-1 nalazi se ispod ravnine prstena, a u b-D-glukopiranozi iznad ravnine prstena.
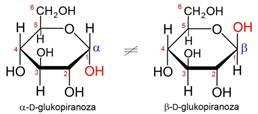
Slika 4.5. Haworthove projekcijske formule a-D-glukopiranoze i b-D-glukopiranoze.
Ako se a-D-glukopiranoza ili b-D-glukopiranoza grije s metanolom, uz malo klorovodične
kiseline kao katalizatora, nastaje smjesa dvaju acetala, metil-a-D-glukozida i metil-b-D-glukozida. Acetali glukoze zovu se glikozidi.
Monosaharidi u
kojima je poluacetalna skupina -OH zamijenjena skupinom -OR općenito se nazivaju glikozidima, a ta vrsta veze naziva
se glikozidnom vezom.
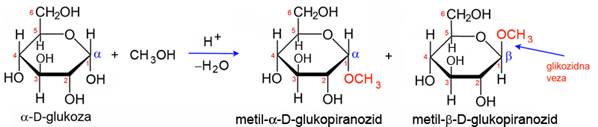
Slika 4.6. Monosaharidi u kojima je poluacetalna skupina -OH zamijenjena -OR skupinom općenito se nazivaju glikozidi, a ta vrasta veze naziva se glikozidnom vezom.
Fruktoza, C6H12O6, jedan je od najslađh monosaharida. U prirodi se nalazi slobodna, zajedno s glukozom u voću i medu, a vezana na glukozu čini disaharid, saharozu, poznatu kao obični šećer.
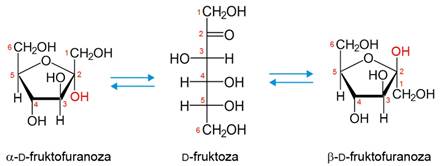
Slika 4.7. U vodenoj otopini ravnoteža između a-D-fruktofuranoze i b-D-fruktofuranoze uspostavlja se preko keto oblika. Peteročlani prsten s jednim kisikovim atomom naziva se furanskim prstenom.
Fruktoza ima istu molekulsku formulu kao i glukoza. Fruktoza je monosaharid izomeran s glukozom, ali na drugom ugljikovu atomu ima karbonilnu, >C=O, tj. keto-skupinu. Takvi se monosaharidi nazivaju ketozama. Za razliku od ketona fruktoza je jak reducens. Fruktoza se pojavljuje u cikličkoj poluketalnoj formi. Poluketali nastaju reakcijom alkohola i ketona. Naime, hidroksilna skupina na atomu C-5 može unutar molekule D-fruktoze reagirati s karbonilnom skupinom na atomu C-2. Pritom nastaje stabilan poluketal u obliku peteročlanog prstena. Kako pritom nastaje novi kiralni centar, dobiju se a-D-fruktofuranoza i b-D-fruktofuranoza. Obje poluketalne forme u međusobnoj su ravnoteži, preko D-fruktoze.
Pokus 4.1. Dokazivanje glukoze Trommerovim reagensom
Vidi na internetu: e-Kemija: Sikirica - Dokazivanje glukoze
Pokus 4.2. Tollensova reakcija na aldehide - srebrno zrcalo
Vidi na internetu:
Random Experiments - Tollensprobe (Tollens' test)
4.2. Disaharidi
Disaharidi su ugljikohidrati u kojima su dvije molekule monosaharida međusobno povezane glikozidnom vezom. U slobodnom stanju u prirodi javljaju se dva disaharida, saharoza i laktoza.
Saharoza, C12H22O11, poznata kao obični šećer, dobiva se iz šećerne repe i šećerne trske. U molekuli saharoze molekula glukoze povezana je a-1,2-glikozidnom vezom s molekulom fruktoze. Disaharidi se mogu lako hidrolizirati toplom otopinom razrijeđenih kiselina ili djelovanjem enzima. Saharoza ne pokazuje reakciju na aldehide, no otopina koja se dobije nakon hidrolize pokazuje reakciju na aldehide. Hidrolizom saharoze u jednakim količinama dobiju se glukoza i fruktoza, tzv. invertni šećer. Ima ga u većini biljnih plodova. Med sadržava 80 % a ponekad i više invertnog šećera. Pčele razgrađuju saharozu na invertni šećer pomoću enzima koji se nalazi u njihovim žlijezdama.
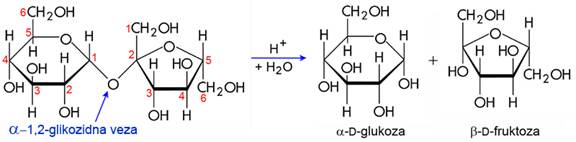
Slika 4.8. Hidrolizom saharoze dobiju se glukoza i fruktoza.
Pokus 4.3. Saharoza
Vidi na internetu:
e-Kemija: Sikirica - Saharoza
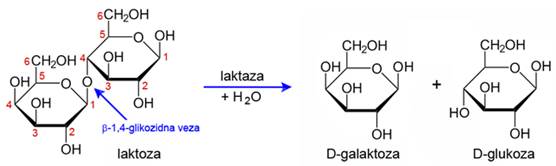
Slika 4.9. Hidrolizom disaharida laktoze dobiju se dva monosaharida, D-galaktoza i D-glukoza. Kao što je uobičajeno zbog jasnoće prikaza izostavljeni su vodikovi atomi vezani na atome ugljika.
Maltoza, C12H22O11,
je disaharid
sastavljen od dviju molekula glukoze međusobno povezanih
a-(1-4)-glikozidnom vezom. Nije nađena slobodna u
prirodi. Dobiva se hidrolizom
škroba pomoću enzima α-amilaze prisutnog u sladu. Slad se proizvodi kontroliranim klijanjem
zrna žitarica, većinom ječma. Proizvodnja slada temelji se
na razgradnji škroba u jednostavnije saharide pomoću enzima
koji nastaju tijekom klijanja ječma. Nepotpunim vrenjem vodenog ekstrakta ječmenog, rjeđe
pšeničnog slada, dobije se pivo, koje neki
tretiraju kao „tekuću hranu“. Energetska vrijednost jedne litre standardnog piva odgovara
energetskoj vrijednosti jedne litre punomasnog mlijeka. To ne znači da je pivo zamjena za
mlijeko.
4.3. Polisaharidi
Polisaharidi su građeni od mnogo molekula monosaharida međusobno povezanih glikozidnom vezom. Polisaharidi su netopljivi u vodi, ne kristaliziraju, nisu slatka okusa i nisu reducensi. Najvažniji polisaharidi su škrob, glikogen i celuloza.
Pokus 4.4. Dobivanje škroba iz krumpira
Vidi na internetu:
e-Kemija: Sikirica - Škrob
Škrob se nalazi u zrnju žitarica, gomoljima krumpira i drugdje. To je smjesa dvaju različitih polimera, amiloze i amilopektina. Amiloza je netopljiva u vodi dok je amilopektin topljiv.
Amiloza čini 20 do 30 % prirodnog škroba, a sastoji se od 200 do 400 ostataka glukoze međusobno povezanih a-(1-4)-glikozidnim vezama. Molekule amiloze čine uzvojnicu sa šest ostataka glukoze u jednom uzvoju. S otopinom joda u kalijevu jodidu amiloza daje intenzivno plavoljubičasto obojenje. Ono potječe od kompleksa amiloze i trijodidnog iona, I3⎻, ugrađenog u uzvojnicu.
Amilopektin se sastoji od nekoliko stotina do
nekoliko tisuća ostataka molekula glukoze međusobno povezanih a-(1-4)-glikozidnim vezama u duge
lance koji su međusobno povezani
a-(1-6)-glikozidnim vezama tako da
su njegove molekule razgranate. Grananje se obično događa u
intervalima od 25 ostataka glukoze. S otopinom joda u
kalijevu jodidu amilopektin daje blijedo crveno ili smeđe obojenje.
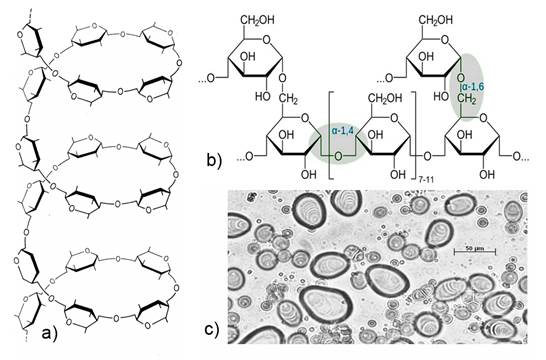
Slika 4.10. a) Molekula amiloze sadržava 200 do 400 ostataka glukoze koji čine uzvojnicu. b) U amilopektinu je nekoliko stotina ili tisuća ostataka glukoze povezano u razgranate lance. c) Zrnca škroba iz gomolja krumpira slojevita su i asimetrične građe. Svaka vrsta žitarica ima samo njoj svojstven oblik zrnaca škroba.
Pokus 4.5. Hidroliza škroba enzimima
Vidi na internetu:
e-Kemija: Sikirica - Hidroliza skroba
Pokus 4.6. Gorenje brašna
Vidi na internetu: Royal Society Of Chemistry - Burning Flour
Glikogen je polisaharid koji služi kao kratkoročno skladište energije kod životinja gljiva i bakterija. Analogan je škrobu pa ga često nazivaju životinjskim škrobom. Struktura mu je slična strukturi amilopektina, ali je više razgranat. Grananje se događa svakih osam do 12 ostataka glukoze. Kod ljudi glikogen nastaje i skladišti se u jetri i mišićnom tkivu. Jetra odrasle osobe teži 1,5 kg te može pohraniti oko 100-120 grama glikogena. U skeletnim mišićima glikogen čini 1-2 % mišićne mase, pa odrasla osoba pohranjuje približno 400 grama glikogena u mišićima. Glikogen je najpristupačniji rezervni ugljikohidrat u životinjskom organizmu. Služi kao lako dostupan izvor energije pri naglim potrebama jer se zbog velike razgranatosti na krajevima lanaca brzo cijepa u glukozu. (Za dugoročno skladištenje energije služe masti.)
Celuloza je najrašireniji organski spoj u prirodi. U celulozi su molekule glukoze međusobno povezane b-(1-4)-glikozidnim vezama. Osnovni građevni element celuloze je celobioza.
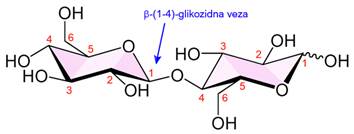
Slika 4.11. Celobioza je osnovni građevni element celuloze
Pamuk je najčišća celuloza, 98 %. Drvo sadržava 30 do 40 % celuloze. Molekule celuloze sadržavaju 8 do 12 tisuća ostataka glukoze. Lanci celuloze međusobno su vezani vodikovim vezama što vlaknima celuloze daje osobitu čvrstoću. Celuloza je strukturni polisaharid od kojega su izgrađene stanične stijenke i potporni elementi svih biljaka.
Celuloza ima važnu ulogu u prehrani jer pomaže peristaltiku (grč. peristaltikos = koji sažima) crijeva. Ljudi i mesojedi ne mogu celulozu iskoristiti za hranu jer nemaju enzime kojima bi je mogli razgraditi na glukozu. Biljojedi celulozu iskorištavaju posrednim putem. U probavnom traktu preživača simbiotske bakterije pomoću enzima celulaze hidroliziraju celulozu na monosaharide, kao što je b-glukoza, te jednostavnije polisaharide i oligosaharide. Isto tako termiti, koji se hrane drvom, ne hidroliziraju celulozu neposredno već to za njih radi određena vrsta protozoa i mikroba koji žive u njihovu probavnom traktu. Danas se mnogo radi na tome ne bi li se umjetnim putem, djelovanjem enzima, iz celuloze dobila glukoza koja bi se potom koristila za proizvodnju alkohola, obnovljivog goriva za automobile (bioetanol).
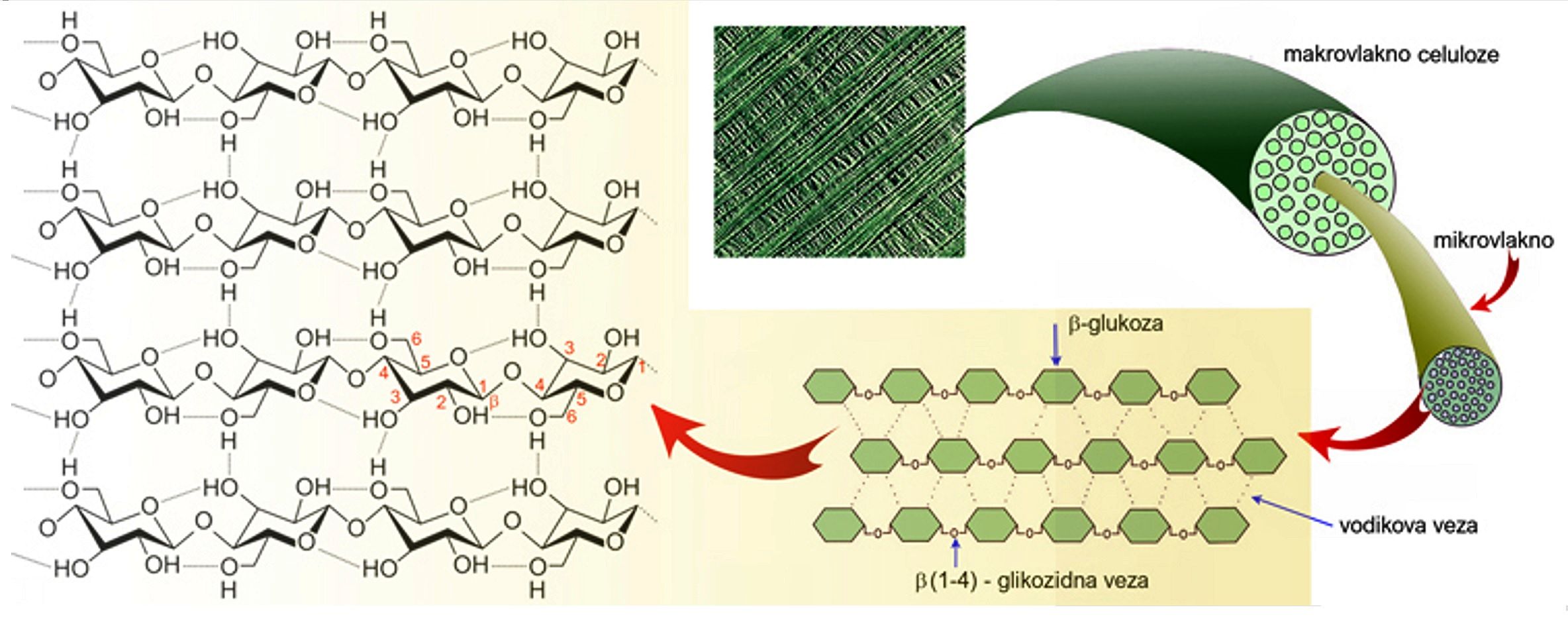
Slika 4.12. Vlakna celuloze promatrana elektronskim mikroskopom i shematski prikaz njihove strukture. Polimerni lanci molekula celuloze u vlaknu su poredani paralelno i međusobno povezani vodikovim vezama (prikazanim crtkanim linijama).
Kao što se iz strukture polimernih lanaca celuloze vidi, svaki ostatak molekule glukoze sadržava tri skupine –OH koje mogu reagirati s kiselinama pri čemu nastaju esteri. Djelovanjem smjese dušične i sumporne kiseline na celulozu, ovisno o uvjetima reakcije, dobije se mononitroceluloza, dinitroceluloza ili trinitroceluloza. Trinitroceluloza rabi se kao eksploziv. Brzo izgara pri čemu nastaju samo plinoviti produkti.
Vidi na internetu: Royal Society Of Chemistry - Nitrocellulose
Celuloid je čvrsta plastična masa, smjesa mononitroceluloze i kamfora kao plastifikatora. Rabio se skoro 50 godina za izradu kinematografskih filmova, prozirnih folija, loptica za stolni tenis, trzalica za žičane instrumente i dr. Zbog zapaljivosti danas je zamijenjen drugim plastičnim masama.
Zadaci i teme za vlastite aktivnosti i samoobrazovanje
O ugljikohidratima doznajte više iz članka: Boris Mildner - Ugljikoidrati (pdf)
Potražite detaljnije informacije o intoleranciji na laktozu. Uzroci i posljedice.
Ugljikohidrati u prehrani i njihov metabolizam.
Upoznajte uzroke i posljedice inzulinske rezistencije.
Steknite osnovna znanja o enzimima: biološki katalizatori, amilaze, lipaze, proteaze, transferaze, esteraze i td.
Izradite plakat, PowerPoint prezentaciju, snimite video, održite predavanje u razredu, organizirajte raspravu ili pišite u školskom listu o šećernoj bolesti i metabolizmu ugljikohidrata,
5. EKVIVALENTI I DOSEG REAKCIJE
Što je doseg reakcije te kako se stehiometrijski zadaci rješavaju dosegom reakcije doznajte iz članka objavljenog u časopisu KEMIJA U INDUSTRIJI:
T. CVITAŠ: Novi pristup stehiometrijskom računu, Kem. Ind. 55 (4) 175–181 (2006)
U ovom poglavlju želimo pokazati kako se ekvivalentne množine reaktanata u nekoj kemijskoj reakciji mogu izračunati putem dosega reakcije. Doseg reakcije je veličina korisna pri razmatranju tijeka, brzine i ravnoteže kemijskih reakcija.
Doseg reakcije možemo definirati kao množinu kemijskih pretvorbi, tj. broj jediničnih kemijskih pretvorbi, Nr, podijeljen Avogadrovom konstantom, NA.
Primjerice, jednadžba
prikazuje jediničnu pretvorbu. U jednoj pretvorbi potrošit će se jedna molekula dušika i tri molekule vodika, a nastat će dvije molekule amonijaka. Uzmemo li da se dogodilo Nr jediničnih pretvorbi tad je množina takvih pretvorbi:
Ta se veličina zove doseg reakcije. Međunarodni znak za doseg reakcije je malo grčko slovo ksi, ξ. Broj jediničnih pretvorbi može biti samo pozitivna veličina, stoga je i doseg reakcije uvijek pozitivna veličina i jednaka za sve reaktante i produkte u bilo kojoj kemijskoj reakciji.
Kad
se dogodi 6,022·1023 jediničnih pretvorbi, kažemo da je
reakcija napredovala za jedan mol, tj. da je doseg reakcije jedan mol. Pri
dosegu od 1 mol reakcija N2 + 3 H2 ![]() 2 NH3, potrošit će se jedan mol
molekula dušika i tri mola molekula vodika, pri čemu će nastati dva
mola molekula amonijaka.
2 NH3, potrošit će se jedan mol
molekula dušika i tri mola molekula vodika, pri čemu će nastati dva
mola molekula amonijaka.
Stehiometrijske koeficijente u kemijskoj jednadžbi možemo definirati kao kvocijente promjene broja molekula DN(B), i broja jediničnih pretvorbi DNr. No isto tako možemo ih definirati kao kvocijente promjene množine jedinki Dn(B), i promjene dosega Dξ:
Za početni doseg obično se uzima da je ξ = 0, pa je promjena dosega jednaka samom dosegu. Stoga se doseg praktički određuje na temelju jednadžbe:
Važno je razumjeti da Dn(B) i n(B) imaju jednak predznak. Primjerice kad reakcija teče s lijeva nadesno, reaktanti se troše pa promjena množine reaktanta B,
Δn(B) = nkonačno - npočetno
ima negativan predznak. Stoga i stehiometrijski koeficijent n(B) ima negativan predznak. Istodobno produkti nastaju, stoga promjena množine i stehiometrijski koeficijenti za njih imaju pozitivan predznak. Vidi na internetu stoichiometric number, n
Doseg reakcije jednak je za bilo koju tvar koja sudjeluje u nekoj kemijskoj reakciji. Za bilo koje dvije tvari u istoj kemijskoj reakciji vrijedi:
Primjer 5.1. Neki učenik je istraživao brzinu otapanja cinka u kiselinama. Za pokus je upotrijebio 0,654 g opiljaka cinka i 50 mL razrijeđene klorovodične kiseline. Složio je aparaturu kao na slici 5.1 te svakih 30 sekunda očitao volumen vodika. Dobio je sljedeće rezultate:
|
t/s |
0 |
30 |
60 |
90 |
120 |
150 |
180 |
210 |
240 |
270 |
|
V(H2)/mL |
0 |
104 |
166 |
198 |
221 |
232 |
238 |
240 |
240 |
240 |
Izračunajte doseg reakcije u zadanim vremenskim razmacima.
Rješenje. Najprije napišimo jednadžbu reakcije otapanja cinka u klorovodičnoj kiselini:
Na temelju jednadžbe za doseg reakcije možemo napisati:
Da bismo izračunali doseg reakcije, zadanu masu cinka moramo preračunati u množinu.
Protekom vremena sav se cink otopi pa je nkonačno(Zn) = 0. Stoga za promjenu množine cinka, Dn(Zn), dobivamo:
Δn(Zn) = nkonačno − npočetno = 0 mol − 0,0100 mol = −0,0100 mol.
Uvrstimo dobivenu vrijednost Δn(Zn) u izraz za doseg reakcije pa dobivamo:
Vodik je produkt kemijske reakcije, stoga njegov stehiometrijski koeficijent ima pozitivan predznak. Iz jednadžbe reakcije vidimo da je množina nastalog vodika proporcionalna množini utrošenog cinka. Prema tome, doseg reakcije u pojedinom trenutku možemo izračunati iz volumena dobivena vodika. Na temelju rezultata mjerenja za doseg reakcije u zadanim vremenskim razmacima dobivamo:
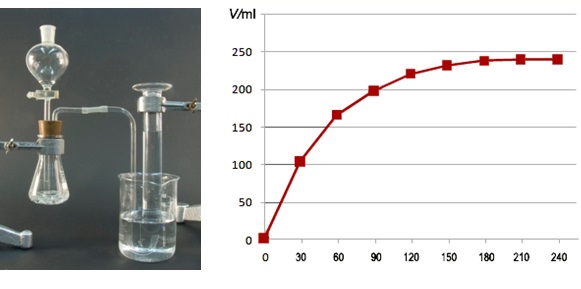
Slika 5.1. a) Aparatura za mjerenje volumena vodika dobivena otapanjem cinka u razrijeđenoj klorovodičnoj kiselini. b) Prirast volumena vodika protekom vremena.
Već smo kazali da je doseg reakcije jednak za sve reaktante i produkte u reakciji. Prema tome množine utrošenog cinka u odabranim vremenskim odsječcima jednake su množini dobivena vodika.
Odavde proizlazi da za množine svih tvari koje sudjeluju u kemijskoj reakciji vrijedi:
što je temeljna jednadžba stehiometrije.
Primjer 5.2. Termitna smjesa, kakvom se primjerice zavaruju željezničke tračnice, je smjesa prahova aluminija i magnetita. Koliko kilograma aluminija treba uzeti na svaki kilogram Fe3O4 za pripremu termitne smjese?
Rješenje. Napišimo jednadžbu reakcije:
Na temelju jednadžbe za doseg reakcije možemo napisati:
Da bismo izračunali doseg reakcije, zadanu masu Fe3O4 moramo preračunati u množinu:
Uvrstimo dobivenu vrijednost za množinu Fe3O4 u izraz za doseg reakcije pa za doseg reakcije dobivamo::
Odavde proizlazi:
Za masu aluminija utrošena u reakciji dobivamo:
m(Al) = n(Al) × M(Al) = 11,524 mol × 26,98 g mol−1 = 310,7 g.
Pri pripremi termitne smjese na svaki kilogram upotrijebljenog magnetita treba uzeti 311 g aluminija u prahu.
Primjer 5.3. Koliko kalcijeva klorida i kalijeva fosfata treba uzeti da se dobije 100 g kalcijeva fosfata?
Rješenje. Napišimo jednadžbu reakcije:
Doseg reakcije je:
Zadanu masu kalcijeva fosfata preračunamo u množinu:
Uvrstimo dobivenu vrijednost množine kalcijeva fosfata u izraz za doseg reakcije pa dobivamo:
Odavde proizlazi:
Mase reaktanata izračunat ćemo tako da njihove množine pomnožimo pripadnim molarnim masama:
m(CaCl2) = n(CaCl2) × M(CaCl2) = 0,9672 mol × 110,99 g mol−1 = 107,3 g,
m(K3PO4) = n(K3PO4) × M(K3PO4) = 0,6448 mol × 212,27 g mol−1 = 136,9 g.
Za dobivanje 100 g kalcijeva fosfata potrebno je uzeti 107,3 g kalcijeva klorida i 136,9 g kalijeva fosfata.
Primjer 5.4. Jedan učenik je smjesu od 3,002 g octene kiseline i
2,303 g etanola zagrijavano jedan sat pri 100 ![]() te potom reakcijsku smjesu
naglo ohladio u smjesi leda i kuhinjske soli. Reakcijsku smjesu potom je titrirao otopinom NaOH
poznatog titra te je za neutralizaciju neizreagirane octene kiseline utrošio 0,
0167 mola NaOH. Izračunajte iskorištenje reakcije:
te potom reakcijsku smjesu
naglo ohladio u smjesi leda i kuhinjske soli. Reakcijsku smjesu potom je titrirao otopinom NaOH
poznatog titra te je za neutralizaciju neizreagirane octene kiseline utrošio 0,
0167 mola NaOH. Izračunajte iskorištenje reakcije:
Iskorištenje
je omjer stvarnog i maksimalnog mogućeg dosega reakcije. Označava se
malim grčkim slovom eta, η.
Rješenje.
Preračunajmo zadane mase octene kiseline i etanola u množine Ako od početne množine
octene kiseline, npočetno(CH3COOH) = 0,0500 mol, odbijemo množinu slobodne octene kiseline, nslobodno(CH3COOH) = 0,0167 mol dobit ćemo množinu utrošene octene kiseline: nutrošeno(CH3COOH) = npočetno − nslobodno = (0,0500 − 0,0167) mol = 0,0333 mol Odavde
proizlazi da je množina nastalog etil-etanoata jednaka množini utrošene octene kiseline: n(CH3COOC2H5) = n(H2O) = (0,0500 − 0,0167) mol = 0,0333 mol Teoretski doseg navedene reakcije je 0,0500 mol.
Odavde proizlazi da je iskorištenje reakcije:
Primjer 5.5. Drugi učenik je smjesu od 3,002 g octene kiseline i
4,606 g etanola zagrijavano jedan sat pri 100 ![]() te potom reakcijsku smjesu
naglo ohladio u smjesi leda i kuhinjske soli. Reakcijsku smjesu potom je
titrirao otopinom NaOH te je za neutralizaciju slobodne (neizreagirane) octene
kiseline utrošio 7,5 mL otopine c(NaOH) = 1,00 mol L-1. Izračunajte
iskorištenje reakcije:
te potom reakcijsku smjesu
naglo ohladio u smjesi leda i kuhinjske soli. Reakcijsku smjesu potom je
titrirao otopinom NaOH te je za neutralizaciju slobodne (neizreagirane) octene
kiseline utrošio 7,5 mL otopine c(NaOH) = 1,00 mol L-1. Izračunajte
iskorištenje reakcije:
Rješenje. Preračunajmo zadane mase octene kiseline i etanola u množine:
Množina slobodne octene kiseline je:
nslobodno(CH3COOH) = n(NaOH) = V × c = 7,5·10−3 L × 1 mol L−1 = 7,5·10−3 mol.
Ako od početne množine octene kiseline, npočetno(CH3COOH) = 0,0500 mol, odbijemo množinu slobodne octene kiseline dobit ćemo množinu utrošene octene kiseline:
nutrošeno(CH3COOH) = npočetno − nslobodno = (0,0500 − 0,0075) mol = 0,0425 mol.
Odavde proizlazi da je množina nastalog etil-etanoata jednaka množini utrošene octene kiseline:
n(CH3COOC2H5) = n(H2O) = 0,0425 mol
Teoretski doseg navedene reakcije određuje množina octene kisene, n(CH3COOH) = 0,0500 mol. Odavde proizlazi da je iskorištenje reakcije:
Zadaci i teme za vlastite aktivnosti i samoobrazovanje
Putem dosega reakcije riješite zadatke iz poglavlja 3. KEMIJSKI EKVIVALENTI u priručniku: Sikirica, Stehiometrija, Školska knjiga, Zagreb 2022.
6. KINETIKA KEMIJSKIH REAKCIJA
Kemijske se reakcije odvijaju vrlo različitom brzinom. Iskustvo pokazuje da smjesa vodika i kisika pri sobnoj temperaturi može „neograničeno“ dugo stajati. (Ništa u prirodi nije neograničeno. Procjenjuje se da će se 15 % volumena praskavca pri sobnoj temperaturi pretvoriti u vodu – nakon 1011 godina!) No, propustimo li električnu iskru kroz smjesu vodika i kisika, doći će do žestoke eksplozije. Slično je i smjesa klora i vodika stabilna u mraku pri sobnoj temperaturi. Osvijetli li se ta smjesa jakom Sunčevom svjetlošću dolazi do eksplozije (tzv. klorni praskavac). (Vidi Primjer 2.1.)
6.1. Kako se mjeri napredovanje kemijske reakcije
Koliko je kemijska reakcija napredovala može se utvrditi kemijskom analizom, ali to je moguće samo za reakcije koje se odvijaju relativno sporo. Reakcija se u tom slučaju provodi pri stalnoj temperaturi (u termostatu ili vodenoj kupelji). Otopine reaktanata poznate koncentracije se pomiješaju i pokrene zaporni sat. U pogodnim vremenskim razmacima pipetom se uzme uzorak reakcijske smjese, ohladi smjesom leda i vode ili razrijedi na veliki volumen te titracijom odredi koncentracija jednog od reaktanata ili produkata. Primjerice, tako se može mjeriti brzina hidrolize estera.
CH3COOC2H5(aq) + NaOH(aq) → CH3COONa(aq) + C2H5OH(aq)
Hlađenjem ili razrjeđivanjem kemijska reakcija se praktično zaustavlja. Koncentracija natrijeva hidroksida u danom trenutku odredi se titracijom otopinom kiseline poznate koncentracije uz fenolftalein kao indikator.
Kod nekih se kemijskih reakcija među plinovima povećava broj čestica. Ako se reakcija provodi u zatvorenoj posudi stalnog volumena, doći će do porasta tlaka. Mjerenjem tlaka u reakcijskoj smjesi u određenim vremenskim razmacima dobivamo podatke o napredovanju reakcije. Tako se, na primjer, može pratiti reakcija raspada didušikova pentoksida.
2N2O5(g) → 2N2O4(g) + O2(g)
Mnoge tvari apsorbiraju svjetlost, kako u vidljivom tako i u ultraljubičastom dijelu spektra. Instrument kojim se mjeri apsorpcija svjetlosti željene valne duljine zove se spektrofotometar.
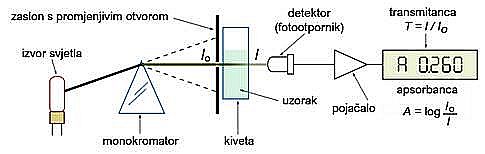
Slika 6.1. Pojednostavnjena shema spektrofotometra.
Više doznajte iz How does a Spectrophotometer work?.
Svaka tvar apsorbira neke njoj svojstvene valne duljine svjetlosti. Tvar ili njezina otopina bit će obojena ako apsorbira u vidljivom dijelu spektra, a intenzitet boje otopine ovisi o koncentraciji otopljene tvari. To se svojstvo može iskoristiti za mjerenje koncentracije tvari u otopini. Primjerice, međusobnom reakcijom bromata i jodida nastaje crvenosmeđa otopina.
BrO3−(aq) + 9 I−(aq) + 6 H+(aq) → 3 I3−(aq) + Br−(aq) + 3 H2O(I)
Boja otopine potječe od iona I3−. Uzimanjem uzorka reakcijske smjese u pogodnim vremenskim razmacima i mjerenjem apsorpcije svjetlosti odgovarajuće valne duljine, može se doznati kolika je koncentracija pojedinog reaktanta ili produkta u danom trenutku.
Tijekom reakcije može doći do smanjenja ili povećanja broja iona pa se napredovanje reakcije može pratiti mjerenjem električne provodnosti otopine.
6.2. Brzina kemijske reakcije
Za opću kemijsku reakciju:
aA + bB → pP + qQ + . . .
u uvjetima konstantnog volumena, brzina kemijske reakcije, ν, (rate of reaction, ν) definira se kao:
gdje simboli smješteni unutar uglastih zagrada označuju koncentracije tvari izražene jedinicom mol dm−3, pa se brzina reakcije iskazuje jedinicom mol dm−3 s−1. Umjesto ν za brzinu reakcije također se rabe simboli R i r. Preporučuje se da jedinica za vrijeme bude sekunda.
Brzina reakcije, v, razlikuje se od brzine povećanja koncentracije produkta P za konstantan faktor 1/p, jednak recipročnoj vrijednosti njegova koeficijenta, p, u stehiometrijskoj jednadžbi. Isto tako brzina reakcije, v, razlikuje se od brzine smanjenja koncentracije reaktanta A za faktor 1/a, jednak recipročnoj vrijednosti njegova koeficijenta a u stehiometrijskoj jednadžbi.
Vidi na internetu: IUPAC Gold Book - rate of reaction, ν
Primjer 6.1. U vodenoj otopini, koja sadržava velik suvišak mravlje kiseline, elementarni brom reagira s mravljom kiselinom prema jednadžbi:
Br2(aq) + HCOOH(aq) → 2 Br−(aq) + 2 H+(aq) + CO2(g)
Brom ima njemu svojstvenu crvenosmeđu boju pa se promjena njegove koncentracije može mjeriti spektrofotometrom. Na temelju rezultata mjerenja (prva i druga kolona u tablici 6.1.) izračunajte prosječnu brzinu reakcije broma i mravlje kiseline u vremenskim razmacima od 50 s.
Rješenje
Brom je reaktant pa se protekom reakcije njegova koncentracija smanjuje. Uočite da je stehiometrijski koeficijent broma u jednadžbi kemijske reakcije jednak 1. Stoga se pripadne prosječne brzine reakcije (kolona 3 u tablici 6.1.) za pojedini vremenski period izračunaju prema jednadžbi:
Tablica 6.1. Eksperimentalni podaci za reakciju broma sa suviškom mravlje kiseline
|
t/s |
[Br2] / mol L−1 |
prosječna brzina mol L−1 s−1 |
trenutna brzina mol L−1 s−1 |
konstanta b. r. s−1 |
|
0 |
0,0120 |
|
4,20·10−5 |
3,50·10−3 |
|
|
|
3,80·10−5 |
|
3,44·10−3 |
|
50 |
0,0101 |
|
3,52·10−5 |
3,49·10−3 |
|
|
|
3,28·10−5 |
|
3,53·10−3 |
|
100 |
0,00846 |
|
2,96·10−5 |
3,50·10−3 |
|
|
|
2,72·10−5 |
|
3.50·10−3 |
|
150 |
0,00710 |
|
2,49·10−5 |
3,51·10−3 |
|
|
|
2,28·10−5 |
|
3,49·10−3 |
|
200 |
0,00596 |
|
2,09·10−5 |
3,51·10−3 |
|
|
|
1,92·10−5 |
|
3.50·10−3 |
|
250 |
0,00500 |
|
1,75·10−5 |
3,50·10−3 |
|
|
|
1,60·10−5 |
|
3.48·10−3 |
|
300 |
0,00420 |
|
1,48·10−5 |
3,52·10−3 |
|
|
|
1,34·10−5 |
|
3.47·10−3 |
|
350 |
0,00353 |
|
1,23·10−5 |
3,48·10−3 |
|
|
|
1,14·10−5 |
|
3,51·10−3 |
|
400 |
0,00296 |
|
1,04·10−5 |
3,51·10−3 |
Na temelju podataka iz tablice 6.1. može se zaključite da se smanjenjem koncentracije broma smanjuje i brzina reakcije. Ako podatke o trenutnoj brzini reakcije (kolona 4 u tablici 6.1.) podijelimo pripadnom koncentracijom mravlje kiseline (kolona 2 u tablici 6.1.) dobivamo uvijek isti broj, 3,50·10−3 s−1. Drugim riječima, brzina reakcije proporcionalna je koncentraciji broma. Konstanta proporcionalnosti je 3,50·10−3 s−1. Ona se naziva konstanta brzine reakcije, k.
v = k [Br2]
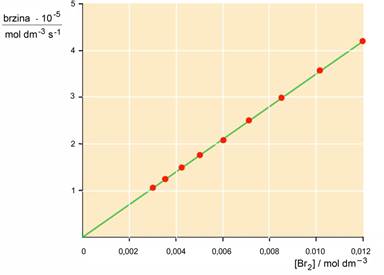
Slika 6.2. Ako se ovisnost trenutne brzine reakcije (kolona 4 u tablici 6.1.) o koncentraciji broma (kolona 2 u tablici 6.1.) prikaže grafički, dobije se pravac. Iz koeficijenta smjera pravca izračuna se konstanta brzine reakcije.
Izračunana vrijednost prosječne brzine reakcije ovisi o veličini odabranog intervala. Zato treba vremenski interval u kojem se mjeri promjena koncentracije skratiti kolikogod je moguće. Da bi se mogla izračunati trenutna brzina reakcije treba za svaki pojedini trenutak nacrtati tangentu na dobivenoj krivulji. Trenutna brzina reakcije izračuna se iz koeficijenta smjera tangente na krivulji promjene koncentracije u odabranom trenutku. Početna brzina reakcije izračuna se iz koeficijenta smjera tangente na početnom, linearnom, dijelu krivulje promjene koncentracije reaktanta.
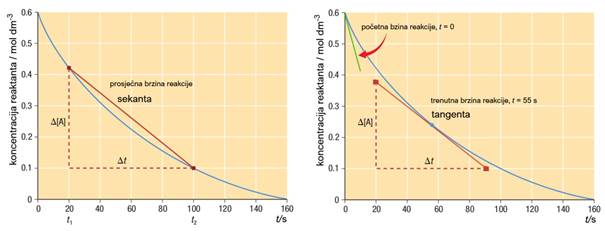
Slika 6.3. Shematski prikaz određivanja prosječne trenutne i početne brzine trošenja reaktanta.
Zadatak 6.1.
Prikažite grafikonom kako se u reakciji broma s mravljom kiselinom mijenja koncentracija broma protekom vremena (kolona 1 i 2 u tablici 6.1.). Na ordinatu nanesite koncentraciju broma, [Br2]/mol dm−3, a na apscisu vrijeme proteka reakcije, t/s. Upotrijebite EXCEL ili neki sličan program.
6.3. Red reakcije
Reakcije kod kojih je brzina reakcije proporcionalna koncentraciji samo jednog reaktanta, [A], kao u reakciji broma sa suviškom mravlje kiseline (tablica 6.1.), nazivaju se reakcijama prvoga reda.
v = k [B]
Najveća praktična korist od poznavanja jednadžbe i konstante brzine reakcije jest mogućnost da se predvidi (izračuna) koncentracija reaktanta ili produkta u bilo kojem trenutku odvijanja reakcije. Za reakcije prvog reda ta jednadžba glasi:
[B] = [B]o e―kt
U ovoj je jednadžbi:
[B]o – početna koncentracija tvari B,
[B] –trenutna koncentracija tvari B,
e – baza prirodnih logaritama,
k – konstanta brzine reakcije,
t – vrijeme.
6.3.1. Radioaktivni raspad – reakcija prvoga reda
Kao primjer reakcije prvoga reda možemo uzeti radioaktivni raspad. Zakon radioaktivnog raspada obično se iskazuje u ovom obliku:
U ovoj je jednadžbi:
No – početni broj jezgara radioaktivnog izotopa,
Nt – trenutačni broj neraspadnutih jezgara radioaktivnog izotopa,
e – baza prirodnih logaritama,
l – konstanta radioaktivnog raspada,
t – vrijeme.
Ova nam jednadžba omogućuje da odredimo starost uzoraka biogenog porijekla. Naime, ugljik se u prirodi nalazi u obliku 3 izotopa, 12C (98,9 %), 13C (1,1 %) i 14C (10–10 %), od kojih je jedino 14C radioaktivan. Ugljik-14 nastaje u gornjim slojevima troposfere i u stratosferi, na visinama od 9 do 15 km iznad površine Zemlje. Kad kozmičke zrake uđu u atmosferu, one u sudaru s jezgrama atoma među ostalim proizvode neutrone. Oni reagiraju s atomima dušika:
1n + 14N → 14C + 1p
:U živim bićima udio izotopa ugljika 14C je stalan jer se gubitak 14C uslijed radioaktivnog raspada nadoknađuje iz atmosfere. Nakon smrti organizma prestaje i izmjena tvari, pa se koncentracija 14C smanjuje radioaktivnim raspadom. Mjerenjem trenutne aktivnosti 14C možemo izračunati približno vrijeme proteklo od smrti organizma.
Primjer 6.2. Koliko su stari svitci s Mrtvog mora? Mjerenjem je nađeno da se događa 10,8 raspada nuklida C-14 u minuti po gramu ugljika. Početna aktivnost C-14 iznosi 13,6 raspada u minuti po gramu ugljika. Vrijeme poluraspada nuklida C-14 je 5730 godina.
Rješenje: Svaki radioaktivni izotop ima karakteristično vrijeme poluraspada, t1/2, to jest vremenski interval u kojem se raspadne polovina jezgara radioaktivne tvari, pa vrijedi:
Logaritmiranjem ove jednadžbe dobivamo:
ln No − ln 2 = ln No − lt1/2
− ln 2 = − lt1/2
Kako vrijeme poluraspada za C-14 iznosi t1/2 = 5730 a (a = godina), za konstantu radioaktivnog raspada, λ, dobivamo:
Ako preuredimo jednadžbu Nt = Noe-λt1/2 te umjesto Nt uvrstimo trenutnu aktivnost C-14, a umjesto No početnu aktivnost C-14, dobivamo:
Metoda datiranja pomoću C-14 daje približnu vrijednost starosti materijala biogenog porijekla(drvo, platno, papir), ali ne i godinu nastanka svitaka s Mrtvog mora. Nadalje, pažljivim mjerenjima dokazano je i da tok kozmičkog zračenja, koje uzrokuje nastanak nuklida C-14, u prošlosti nije bio jednolik. Stoga ni brzina nastajanja 14C u atmosferi nije bila uvijek jednaka. To znači da ni ravnotežna koncentracija 14C u trenutku smrti živih bića nije bila uvijek jednaka. Stoga metoda C-14 ne daje kao rezultat pojedinačnu godinu, već raspon godina (s određenom vjerojatnošću) starosti materijala biogenog porijekla. Dobivene rezultate uvijek treba usporediti s drugim metodama određivanja starosti.
6.3.2. Reakcije drugoga reda
Primjer 6.3. U reakciji dušikova dioksida, NO2(g), s ugljikovim monoksidom, CO(g), nastaje dušikov monoksid, NO(g), i ugljikov dioksid, CO2(g):
NO2(g) + CO(g) → NO(g) + CO2(g).
Mjerenjem je uočeno da brzina reakcije ne ovisi o koncentraciji CO(g), već samo o koncentraciji NO2(g). Dobivene su sljedeće vrijednosti brzine reakcije:
|
[NO2]/ mol dm−3 |
brzina /mol dm−3 s−1 |
|
0,15 |
0,011 |
|
0,30 |
0,045 |
|
0,60 |
0.18 |
Iz dobivenih podataka lako je zaključiti: kad se koncentracija NO2 udvostruči tad brzina reakcije poraste 4 puta. Očito je da je brzina ove reakcije proporcionalna kvadratu koncentracije NO2.
v = k[NO2]2
Reakcije u kojima je brzina proporcionalna kvadratu koncentracije reaktanata, ili umnošku koncentracija dvaju reaktanata, v = [A]×[B], nazivaju se reakcijama drugoga reda.
Red reakcije određuje na temelju rezultata eksperimenta, a ne na temelju jednadžbe kemijske reakcije. Primjerice, ako brzina reakcije, A + B → P, ovisi o koncentracijama tvari A i B na sljedeći način:
v = k[A]x × [B]y
tad je
red reakcije = x + y.
U ovoj je jednadžbi:
x - red reakcije u odnosu na
reaktant A,
y - red reakcije u odnosu na
reaktant B.
Red reakcije ne mora biti cijeli broj. Primjerice, ako brzina reakcije slijedi izraz: v=[A]1/3, tad je red rekcije 1/3.
Reakcije mogu biti nultoga reda. Brzina reakcije nultoga reda je konstantna i neovisna o koncentraciji reaktanata. Kao primjer reakcije nultoga reda možemo uzeti elektrolizu modre galice. Brzina izlučivanja bakra na katodi ne ovisi o koncentraciji iona Cu2+(aq), nego o jakosti struje.
Red reakcije može biti negativan. Negativna vrijednost reda reakcije pokazuje da porast koncentracija reaktanata smanjuje brzinu reakcije.
Vidi na internetu: Mike Sugiyama Jones - Graphical representations for reactions
6.4. Čimbenici koji utječu na brzinu reakcije
Brzina kemijskih reakcija ponajviše ovisi o prirodi reaktanata. Primjerice, kemijske reakcije u vodenim otopinama elektrolita (ionskih spojeva) odvijaju se trenutno. Vodene otopine elektrolita sadržavaju hidratizirane ione koji u svim smjerovima djeluju jednakim privlačnim silama. Pomiješamo li npr. otopine srebrova nitrata i natrijeva klorida trenutno će nastati talog srebrova klorida. Pritom miješanje otopina pospješuje nastajanje taloga.
Nasuprot tome, reakcije između molekula kovalentnih spojeva odvijaju se sporo zato što je potrebno pokidati postojeće da bi mogle nastati nove kovalentne veze. Osim prirode reaktanata na brzinu kemijskih reakcija utječe koncentracija reaktanata, tlak smjese plinova, temperatura reakcijske smjese, prisustvo katalizatora i inhibitora, površina reaktanata i dr.
6.4.1. Teorija sudara
Zašto se kemijske reakcije događaju različitim brzinama objašnjava teorija sudara. Naime, da bi se dogodila kemijska reakcija, čestice koje reagiraju moraju se sudariti jedna s drugom s dovoljnom kinetičkom energijom i pravilnom orijentacijom.
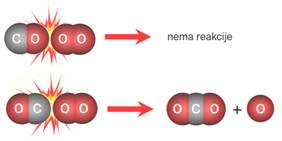
Slika 6.4. Kad dvije molekule A i B trebaju reagirati, moraju se u sudaru toliko približiti da se neke od postojećih veza pokidaju i nove veze nastanu. Uspješni su samo oni sudari s pogodnom orijentacijom molekula reaktanata.
Pri sobnoj temperaturi i normalnom atmosferskom tlaku u svakom se cm3 plina svake sekunde dogodi oko 1033 sudara. Kad bi svaki sudar između dviju molekula reaktanata dao produkte, sve bi se reakcije događale trenutno. Najvjerojatniji ishod sudara između molekula A i B sličan je sudaru dvije biljarske kugle koje se redovito odbiju jedna od druge. Da bi došlo do kemijske reakcije između molekula A i B njihovi elektronski oblaci moraju pri sudaru prodrijeti jedni u druge kako bi se elektroni mogli preurediti i formirati nove veze, tj. nove kemijske spojeve. No i to nije sve. U mnogim reakcijama, osobito onima koje uključuju složenije molekule, reagirajuće čestice moraju biti orijentirane na način prikladan za određeni proces, kao što smo shematski prikazali na slici 6.3.
6.4.2. Koncentracija reaktanata
Pokus 6.1. Utjecaj koncentracije reaktanata na brzinu kemijske reakcije
Vidi na internetu:
e-Kemija: Sikirica - Brzina reakcije konc
Općenito, brzina kemijske reakcije raste povećanjem koncentracije reaktanata. Naime, povećanjem koncentracije bilo kojeg reaktanta, povećaju se izgledi za učinkovite sudare između molekula A i B. Ako se udvostruči koncentracija tvari A, učestalost sudara AB će se udvostručiti. Udvostručenje koncentracije tvari B ima isti učinak. Nadalje, kinetička teorija plinova kaže da se na svakih 1000 binarnih sudara događa samo jedan sudar u kojem se istodobno sudare tri molekule. Zato se većina reakcija odvija putem binarnih sudara molekula reaktanata, a kemijske reakcije u kojima istodobno sudjeluju tri molekule malo su vjerojatne pa stoga vrlo rijetke.
6.4.3. Temperatura
Pokus 6.2. Utjecaj temperature na brzinu kemijske reakcije
Vidi na internetu: e-Kemija: Sikirica - Brzina reakcije temp
Energija potrebna za kidanje kemijskih veza reaktanata i nastajanje produkta dobiva se sudarom molekule jednog reaktanta s molekulom drugog reaktanta. Minimalna energija potrebna za nastajanje produkta tijekom sudara između reaktanata naziva se energija aktivacije (Ea). Ako je energija aktivacije mnogo veća od prosječne kinetičke energije molekula, reakcija će se odvijati sporo. Ako je energija aktivacije manja od prosječne kinetičke energije molekula, udio molekula koji posjeduju potrebnu kinetičku energiju bit će velik. Stoga će. većina sudara molekula rezultirati reakcijom. Reakcija se odvija brzo. (Vidi poglavlje 2. 2. Mehanizam kemijske reakcije i sliku 2.1. Energijske promjene u reakciji H2 + Cl2 → 2 HCl.)
Iz molekularno kinetičke teorije plinova proizlazi da je mjera za prosječnu kinetičku energiju čestica temperatura sustava. U sustavu za koji kažemo da ima visoku temperaturu prosječna kinetička energija čestica veća je nego u sustavu s niskom temperaturom. Prosječna kinetička energija molekula plina ne ovisi o vrsti plina, nego samo o apsolutnoj temperaturi, T. Istraživanjem utjecaja temperature na brzinu reakcije nađeno je da se pri sobnoj temperaturi brzina kemijskih reakcija poveća dva do četiri puta ako se temperatura povisi za 10 °C.
Ovisnost konstante brzine reakcije o temperaturi istraživao je švedski kemičar Svante Arrhenius. Tu je ovisnost 1889. godine iskazao jednadžbom koju danas zovemo Arrheniusova jednadžba:
gdje je:
Ea ― energija aktivacije,
R ― univerzalna plinska konstanta,
T ― termodinamička temperatura.
A ― predeksponencijalni faktor karakterističan za dani reakcijski sustav koji predstavlja udio sudara s povoljnom orijentacijom molekula.
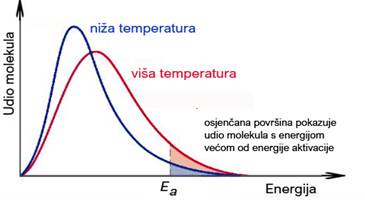
Slika 6.5. Grafički prikaz raspodjele kinetičke energije molekula plina pri dvije temperature. Povišenjem temperature zvonolika krivulja se širi. Pri višoj temperaturi veći broj molekula ima energiju veću od energije aktivacije Ea.
Član e−Ea/RT predstavlja udio sudara s energijom dovoljnom da dođe do kemijske reakcije. Određivanjem konstante brzine reakcije pri različitim temperaturama na temelju Arrheniusove jednadžbe može se izračunati energija aktivacije, Ea. Naime. energija aktivacije je neovisna o temperaturi, a predeksponencijalni faktor A se vrlo polagano mijenja promjenom temperature pa se može smatrati konstantom.
6.4.4. Svjetlost
Pokus 2.1. Eksplozija smjese vodika i klora
Vidi na internetu:
Chris Cramer - Hydrogen Chloride Cannon
Pokus 2.2. Eksplozija smjese metana i klora
Vidi na internetu: Science Skool - Photochlorination
U prethodnom poglavlju bavili smo se problemom energije aktivacije te utjecajem temperature na brzinu kemijske reakcije. No, potrebnu energiju aktivacije reakcijski sustav može dobiti i apsorpcijom svjetlosti prikladne valne duljine. Reakcije koje se događaju djelovanjem svjetlosti nazivaju se fotokemijskim reakcijama. Tipičan primjer fotokemijske reakcije je raspad srebrovih halogenida djelovanjem svjetlosti na kojem se temelji klasični fotografski postupak.
6.4.5. Katalizatori i inhibitori
Pokus 6.3. Katalitički raspad vodikova peroksida
Vidi na internetu:
e-Kemija: Sikirica - Raspad H2O2
Katalizatori povećavaju brzinu reakcije, a da se pritom sami ne mijenjaju do kraja reakcije. Naime, katalizatori smanjuju energiju aktivacije, pa se zato kaže da se s katalizatorom reakcija događa drugim putem. (Vidi sliku 2.3.) Kod heterogene katalize zahtijeva se što veća površina katalizatora, jer je prvi korak u heterogenoj katalizi adsorpcija reaktanata na površinu. Kao katalizatori najčešće se rabe prijelazni metali ili njihovi oksidi. To je zato što mnogi prijelazni metali imaju prazne d-orbitale pomoću kojih čine vrlo reaktivne međuprodukte s molekulama adsorbiranih tvari. Pri tom se jedne veze kidaju a druge nastaju. Time se neprestano remeti ravnoteža na površini katalizatora, jer se povećava količina adsorbiranih produkata reakcije. Da bi se održao stalan omjer adsorbiranih tvari na površini katalizatora (reaktanata, međuprodukata i produkata kemijske reakcije) mora doći do desorpcije produkata reakcije. Kažemo da se na površini katalizatora uspostavlja dinamička ravnoteža. (Vidi sliku 2.4.) Što je veća površina katalizatora, to će se više reaktanata adsorbirati i međusobno reagirati, tj. reakcija će se odvijati brže. Zato se metalni katalizatori izrađuju u obliku finih mrežica. Ako se azbest natopi platinskom soli i užari, sol će se raspasti, a na površini azbesta će se izlučiti metalna platina. Takav platinirani azbest često se rabi kao katalizator u industriji i laboratoriju.
Pokus 6.4. Katalitički raspad kalijeva klorata
Vidi na internetu: HysickChem - Decomposition of Potassium Chlorate
Pokus 6.5. Katalaza
Vidi na internetu:
e-Kemija: Sikirica - Katalaza
Zadaci i teme za vlastite aktivnosti i samoobrazovanje
T. Portada i T. Klačić, Polarimetar kao nastavno pomagalo, Kem. Ind. 65 (5-6) (2016) 291-296.
N. Raos, Fiksacija dušika: brzina i ravnoteža kemijskih reakcija, Kem. Ind. 70 (3-4) (2021) 179 – 185.
Proučite tekst i riješite zadatke iz područja brzine kemijskih reakcija.
OpenStax - Chemical Reaction Rates
The University of Rhode Island - Rates and Mechanisms of Chemical Reactions
Izradite plakat, PowerPoint prezentaciju, snimite video, održite predavanje u razredu, organizirajte raspravu ili pišite u školskom listu o brzini kemijskih reakcija.
7. ZAKON O DJELOVANJU MASA
Prije skoro 160 godina, točnije 15. ožujka 1864., norveški kemičar Peter Waage i matematičar Cato Guldberg objavili su rad u kojem su predložili ono što danas poznajemo kao Zakon o djelovanju masa. Njihov rad, napisan na norveškom jeziku, ostao je zanemaren sve do 1867. kada je prevede na francuski.
Zakon o djelovanju masa kaže da je brzina kemijske reakcije proporcionalna umnošku koncentracija reaktanata. Uzmimo kao primjer općenitu kemijsku reakciju:
A + B ⇄ C + D.
Prema zakonu o djelovanju masa, brzina napredne reakcije (s lijeva nadesno) proporcionalna je umnošku koncentracija A i B. Prema tome za brzinu napredne reakcije možemo napisati:
v → = k → [A]×[B].
Jednako vrijedi za povratnu reakciju (s desna nalijevo), pa možemo napisati:
v ← = k ← [C]×[D].
Uglate zagrade označuju koncentraciju reaktanta navedenog unutar zagrada, dok su k →i k ← konstante napredne i povratne reakcije. Konstante reakcija neovisne su o koncentraciji, ali ovise o temperaturi. Temperaturnu ovisnost konstante brzine reakcije opisuje Arrheniusova jednadžba (vidi poglavlje 6.4.3. Temperatura).
7.1. Konstanta ravnoteže
U zatvorenom sustavu uspostavlja se dinamička ravnoteža između koncentracija reaktanata i produkata. To znači da su brzine napredne i povratne reakcije jednake, pa vrijedi:
k → [A]×[B] = k ← [C]×[D]
Odavde za koncentracijsku konstantu ravnoteže, Kc, dobivamo:
Općenito za kemijsku reakciju:
aA + bB ⇄ cC + dD,
za koncentracijsku konstantu ravnoteže vrijedi:
Ova je jednadžba poznata kao zakon o djelovanju masa. Valja upamtiti da se u brojniku uvijek navode koncentracije produkata, a u nazivniku reaktanata. Napišemo li jednadžbu reakcije obrnutim smjerom, konstanta ravnoteže te reakcije bit će recipročna vrijednost originalne konstante, tj. Kc* = 1/Kc.
Koncentracijska konstanta ravnoteže, Kc, govori nam o relativnim koncentracijama reaktanata i
produkata u stanju ravnoteže:
― ako je Kc > 1010, kažemo da je reakcija otišla do kraja, tj. reakcija nije reverzibilna,
― ako je Kc< 10−10, kažemo da se reakcija ne događa.
Ako su reaktanti produkti reakcije u plinovitu stanju tad se zakon o djelovanju masa može napisati tako da umjesto koncentracija upotrijebimo parcijalne tlakove plinova. Primjerice za reakciju
2 NO2(g) ⇄ N2O4(g),
Možemo napisati tlačnu konstantu ravnoteže Kp:
Zakon o djelovanju masa vrijedi i ako se umjesto koncentracija upotrijebe množinski udjeli tvari u ravnotežnoj smjesi.
U poglavlju 7.4.1. udžbenika e-Kemija 2 doznali smo da je dušikov dioksid, NO2, pri sobnoj temperaturi crvenosmeđi plin. Kao što slika 7.1. pokazuje, tri su ampule pod jednakim uvjetima napunjene dušikovim dioksidom. Prva je ampula uronjena u čašu sa smjesom vode i leda. Pritom je sadržaj ampule izblijedio. Treća je ampula uronjena u vruću vodu, a sadržaj ampule potamnio.

Slika 7.1. Utjecaj temperature na ravnotežu 2NO2 ⇄ N2O4. Dušikov dioksid apsorbira vidljivu svjetlost u plavom području spektra (400 - 500 nm), a propušta ostali dio Sunčeva spektra. Stoga ima boju komplementarnu plavoj.
Pokus 7.1. Utjecaj temperature na ravnotežu: N2O4(g)
⇄ 2NO2(g)
Vidi na internetu: Science Skool - The Effect of Temperature on Equilibrium
Rezultat ovog pokusa lako
je objasniti Le Chatelierovim načelom:
ako sustavu
promijenimo neku intenzivnu veličinu, sustav će nastojati tu
promjenu umanjiti.
Reakcija ![]() je egzotermna.
je egzotermna.
2 NO2 ⇄ N2O4 DH = ―57,23 kJ mol−1
Hlađenjem potičemo reakciju kojom se toplina oslobađa, a to je nastajanje N2O4. Stoga boja plina u ampuli postupno blijedi dok pri temperaturi nižoj od −11 °C konačno ne prijeđe u bezbojnu krutinu. Naprotiv, zagrijavanjem potičemo nastajanje dušikova dioksida jer se tom reakcijom toplina troši. Stoga se boja plina u ampuli mijenja u tamnu smeđecrvenu. Očito je da udjeli, tj. ravnotežne koncentracije NO2 i N2O4 u reakcijskoj smjesi ovise o temperaturi. To ujedno znači da se i koncentracijska konstanta ravnoteže mijenja promjenom temperature.
No, što se događa na molekulskoj razini opisuje slika 7.2.
Slika 7.2. a) Građa molekule dušikova dioksida. b) Strukturu molekule dušikova dioksida razumijemo kao rezonantni hibrid između obje prikazane formule, jer molekula sadržava dvije ekvivalentne N−O veze. Uočite da molekula NO2 ima jedan nespareni elektron. c) Strukturna formula molekule didušikova tetroksida, N2O4. Sve četiri N−O veze jednake su duljine, 121 pm. Molekula je planarna.
Lewisova
strukturna formula kazuje da molekula dušikova dioksida sadržava jedan nespareni
elektron. Dušikov dioksid je slobodni
radikal, stoga bi njegovu formulu trebalo
pisati kao ![]() NO2.
Upravo taj nespareni elektron uzrokuje boju i paramagnetska svojstva dušikova dioksida. Slobodni radikali su vrlo reaktivni
pa se pri sobnoj temperaturi dio molekula dušikova dioksida dimerizira u
bezbojni didušikov tetroksid, N2O4.
NO2.
Upravo taj nespareni elektron uzrokuje boju i paramagnetska svojstva dušikova dioksida. Slobodni radikali su vrlo reaktivni
pa se pri sobnoj temperaturi dio molekula dušikova dioksida dimerizira u
bezbojni didušikov tetroksid, N2O4.
Primjer 7.1. Pri 100 °C konstanta ravnoteže za reakciju
a) 2 NO2(g) ⇄ N2O4(g) je Kp = 4,72 bar.
Izračunajte konstante ravnoteže za reakcijeb) N2O4(g) ⇄ 2 NO2(g) i
c) 2 N2O4(g) ⇄ 4 NO2(g).
Rješenje: Za povratnu reakciju, N2O4(g) ⇄ 2 NO2(g), konstanta ravnoteže jednaka je recipročnoj vrijednosti napredne reakcije.
Ako jednadžbu reakcije pomnožimo faktorom „n“ tad je nova konstanta ravnoteže jednaka n-toj potenciji prvotne konstante ravnoteže.
Primjer 7.2. U reakcijsku posudu volumena 0,5 dm3 najprije je stavljeno 0,2 mola joda. Potom je u posudu upumpano 0,1 mol vodika. Posuda s reakcijskom smjesom ugrijana je na 448 °C. Izračunajte ravnotežne koncentracije joda, vodika i jodovodika ako konstanta ravnoteže pri toj temperaturi iznosi 50.
Rješenje: Napišimo najprije jednadžbu reakcije.
H2(g) + I2(g) ⇄ 2 HI(g)
Reakcija se odvija u posudi stalnog volumena. Stoga za početne koncentracije dobivamo:
[I2]= 0,2 mol/0,5 dm3 = 0,4 mol dm−3,
[H2]= 0,1 mol/0,5 dm3 = 0,2 mol dm−3,
Iz jednadžbe reakcije proizlazi da x mol
I2 reagira s x mol
H2, pri čemu nastaje 2 x mol
HI.
Uzmemo li da je u stanju ravnoteže:
[HI] / mol dm−3 = 2 x,
[H2] / mol dm−3 = 0,2 − x,
[I2] / mol dm−3 = 0,4 − x,
Uvrstimo te vrijednosti u izraz za koncentracijsku konstantu ravnoteže
pa dobivamo:
Dobili smo kvadratnu jednadžbu, a njezino rješenje daje koncentraciju jodovodika. Prevedimo jednadžbu u uobičajeni oblik:
ax2 + bx + c = 0
pa dobivamo:
46 x2 – 30 x + 4 = 0
Rješenja ove jednadžbe jesu:
x1 = 0,465 x2 = 0,187
Od ova dva rješenja treba odabrati realno. Kako iz 0,2 mol vodika ne može nastati 0,465 mol jodovodika, realno rješenje je x2 = 0,187 mol. Odavde proizlazi da su ravnotežne koncentracije:
[HI]/ mol dm−3 = 2x = 2×0,187 = 0,374
[H2]/ mol dm−3 = 0,2 − x = 0,2 − 0,187 = 0,013
[I2]/ mol dm−3 = 0,4 − x = 0,4 − 0,187 = 0,213
Dobro je na kraju provjeriti rješenje tako da se dobivene vrijednosti uvrste u izraz za konstantu ravnoteže.
Malo odstupanje nastalo je zbog zaokruživanja rezultata na tri značajne znamenke.
Primjer 7.3. U smjesi dušika vodika i amonijaka pri 540 K parcijalni tlakovi plinova su: p(NH3) = 0,454 bar, p(N2) = 0,773 bar, p(H2) = 2,319 bar. Izračunajte tlačnu konstantu ravnoteže. Što će se dogoditi ako parcijalni tlak vodika u reakcijskoj smjesi povisimo za 1 bar?
Rješenje: Napišimo izraz za tlačnu konstantu ravnoteže reakcije
N2(g) + 3H2(g) ⇌ 2NH3(g).
Ravnotežni parcijalni tlakovi su:
p(NH3) / bar = 0,454
p(N2) / bar = 0,773
p(H2) / bar = 2,319
Za Kp pri navedenim uvjetima dobivamo:
Promjena parcijalnog tlaka jednog reaktanta uzrokuje promjenu parcijalnih tlakova svih reaktanata. Ako parcijalni tlak vodika u reakcijskoj smjesi povisimo za 1 bar, ravnotežna smjesa će sadržavati više amonijaka (Le Chatelierovo načelo).
Primjer 7.4. Smjesa N2, H2 i NH3 ugrijana je na 700 K.
Naglim hlađenjem zamrznute su ravnotežne koncentracije reaktanata te je nađeno da je
[N2]/mol dm−3 = 0,036 i [H2]/mol dm−3 = 0,150.
Pri toj temperature koncentracijska konstanta ravnoteže za reakciju
N2(g) +3H2(g) ⇌ 2NH3(g) je 0,29 mol−2 dm6.
Kolika je koncentracija NH3?
Rješenje:
Primjer 7.5. U vodi je pomiješano je 2,00 mol etanola i 0,50 mol etanske kiseline. Volumen otopine je 1 dm3. Nakon uspostavljanja ravnoteže titracijom je ustanovljeno da otopina sadržava 0,17 mol etanske kiseline. Izračunajte koncentracijsku konstantu ravnoteže za reakciju:
C2H5OH(aq) + CH3COOH(aq) ⇌ CH3COOC2H5(aq) + H2O(l)
Rješenje: Napišimo najprije izraz za koncentracijsku konstantu ravnoteže.
Odavde proizlazi:
Zadaci i teme za vlastite
aktivnosti i samoobrazovanje
Upoznajte osnove industrijskog postupka (Haber-Bosch) dobivanja amonijaka.
N. Raos, Fiksacija dušika: brzina i ravnoteža kemijskih reakcija, Kem. Ind. 70 (3-4) (2021) 179 – 185.
Na koju se stranu pomiče ravnoteža sljedećih kemijskih reakcija ako se: a) povisi tlak, b) povisi temperatura:
N2+ 3 H2 ⇄ 2 NH3 DrH < 0
N2 + O2 ⇄ 2 NO DrH > 0
2 H2O ⇄ 2H2 + O2 DrH > 0
H2 + I2 ⇄ 2 HI DrH < 0
CaCO3 ⇄ CaO + CO2 DrH < 0
Doznajte u kakvu su odnosu Kc, Kp i Kx?
Chemical Equilibrium - Equilibrium Constants (pdf)
Chemical Equilibrium - Relation between Kp, Kc and Kx (pdf)
Equilibrium in Chemical Processes (pdf)
Izradite plakat, PowerPoint prezentaciju, snimite video, održite predavanje u razredu, organizirajte raspravu ili pišite u školskom listu o ravnoteži kemijskih reakcija.
7.2. Ravnoteža u vodenim otopinama
Voda je tvar neobičnih svojstava. Ona je najvažnija tvar na Zemlji. Ima je i u svemiru, posebice na planetima i kometima. Bez vode ne bi bilo života.
Voda je polarna. Molekule vode polarne su građe s djelomičnim pozitivnim nabojem na atomima vodika i djelomičnim negativnim nabojem na kisiku. To je zato što je kisik elektronegativniji od vodika pa jače privlači zajednički elektronski par iz veze O―H. Zbog međusobnog odbijanja nepodijeljenih elektronskih parova molekula vode ima oblik slova V. Valentni kut H―O―H veza iznosi 104,5°.
Voda ima visoko vrelište, puno više od tvari slične relativne molekulske mase. Zbog polarne građe molekule vode međusobno se povezuju vodikovim vezama, H2O···H―O―H. Vodikove veze su mnogo (oko 10 puta) slabije od ionske i kovalentne veze, ali jače od međumolekulskih privlačnih sila.
Gustoća vode veća je od gustoće leda. Molekule vode u ledu su povezane usmjerenim vodikovim vezama dok je u tekućoj vodi razmještaj molekula manje uređen. Stoga se u tekućem stanju molekule bolje pakuju pa je gustoća vode veća od gustoće leda. Ovakva svojstva vode omogućuje život ispod površine leda oceana, rijeka i jezera.
Voda ima velik specifični toplinski kapacitet, cp(H2O(l)) = 4181,3 J kg−1 K―1, mnogo veći od toplinskog kapaciteta metala, primjerice cp(Cu(s)) = 380 J kg−1 K−1, ili toplinskog kapaciteta tvari mineralnog podrijetla, primjerice cigle ili betona, cp = 700 do 900 J kg−1 K−1. Stoga voda oceana regulira klimu na Zemlji. Dok se kopno danju brzo zagrijava i noću hladi, temperatura oceana ostaje gotova stalna tijekom dana i noći.
Voda je izvrsno otapalo. U vodi se otapaju soli i mnoge tvari polarne građe. Naime, voda ima veliku relativnu dielektričnu permitivnost. Pri sobnoj temperaturi zrak ima relativnu dielektričnu permitivnost oko 1, a voda 81. To znači da se dva suprotna električna naboja u vodi međusobno privlače 81 puta manjom silom nego molekule dušika i kisika u zraku. Stoga je voda dobro otapalo za polarne (hidrofilne) tvari i ione s kojima može činiti vodikove veze. Nepolarne (hidrofobne) tvari slabo se otapaju u vodi.
Kad se kristal ionske građe nađe u vodi, molekule vode svojim se pozitivnim krajem naslanjaju na negativno nabijene ione, a negativnim krajem na ione pozitivnog naboja. Time se slabe privlačne sile između iona na površini i iona u unutrašnjosti kristala. Potpomognute toplinskim gibanjem, molekule vode "otkidaju" ione s površine kristala. Postojeći ioni u kristalnoj strukturi otapanjem se razdvajaju, pa se kaže da tvari s ionskom građom pri otapanju disociraju (lat. dissociare – razdružiti, rastaviti). To je važno za sav živi svijet, kako za biljke tako i za životinje, jer se vodom prenose sve hranjive tvari.
Voda slabo provodi električnu struju. Električni naboj u otopinama prenose ioni. To znači da i najčišća voda sadržava ione.
7.2.1. Autoionizacija vode
Pri sobnoj temperaturi dio molekula vode međusobno je povezan vodikovim vezama tako da tvori grozdove (engl. clusters). Neki klasteri obuhvaćaju tisuće molekula. Pri sobnoj temperaturi najčešći su klasteri od 6 ili 9 molekula vode međusobno povezanih vodikovim vezama. Najjednostavniji klaster, shematski prikazan na slici 7.3., sadržava dvije molekule vode. Vodikov atom iz vodikove veze može preskočiti s jedne molekule na drugu. Pritom će nastati oksonijev ion H3O+ i hidroksidni ion, OH―. Ova vrsta reakcije u kojoj ioni nastaju kad jedna molekula tvari reagira s drugom molekulom iste tvari, naziva se autoionizacija. Sustav je dinamičan. Molekule vode su u stalnom gibanju, međusobno se sudaraju, a vodikovi atomi s jednih molekula preskaču na druge molekule vode, i obratno.
Slika 7.3. Voda se može istodobno mogu ponašati kao kiselina i kao baza. Kad djeluje kao kiselina, drugoj tvari predaje hidrone, H+, a kao baza prima hidrone. (Brřnsted-Lowry teorija kiselina i baza).
U čistoj vodi koncentracija oksonijevih iona, H3O+, jednaka je koncentraciji hidroksidnih iona, OH―. Kao što smo za svaku reverzibilnu kemijsku reakciju mogli napisati izraz za konstantu ravnoteže, možemo je napisati i za autoionizaciju vode.
2 H2O(l) ⇄ H3O+(aq) + OH−(aq) DH = 55,95 kJ mol−1
gdje je a ― aktivitet nabrojenih vrsta čestica. Voda je
otapalo, pa možemo pretpostaviti da je njezin aktivitet jednak aktivitetu
čiste vode i da ima vrijednost 1. Koncentracije iona H3O+
i OH― vrlo su male, pa stoga možemo pretpostaviti da su i
aktiviteti ![]() jednaki molarnim
koncentracijama iona H3O+ i OH―. Odavde proizlazi
da za konstantu ravnoteže autoionizacije vode, Kw, vrijedi:
jednaki molarnim
koncentracijama iona H3O+ i OH―. Odavde proizlazi
da za konstantu ravnoteže autoionizacije vode, Kw, vrijedi:
Ovaj je izraz poznat kao ionski produkt vode. Eksperimentalno je određeno da su pri 24,87 °C koncentracije iona H3O+ i OH― jednake 10−7 mol dm−3, pa za ionski produkt vode dobivamo:
Konstanta ravnoteže autoionizacije (disocijacije) vode ovisi o temperaturi. Pri višoj temperaturi veći udio molekula vode disocira. Ravnotežne koncentracije iona H3O+ i OH― su veće, stoga je i ionski produkt vode veći.
Tablica 7.1. Ovisnost ionskog produkta vode o temperaturi
|
t/°C |
10 |
15 |
20 |
25 |
30 |
50 |
|
Kw/ |
0,29·10−14 |
0,45·10−14 |
0,68·10−14 |
1,01·10−14 |
1,47·10−14 |
5,48·10−14 |
Pod aktivitetom razumije se djelotvorna koncentracija neke tvari u otopini elektrolita. U idealnim otopinama na čestice otopljene tvari djeluju samo molekule otapala, dok u otopinama elektrolita između iona suprotna naboja djeluju privlačne sile, veće što je veća koncentracija otopine i veći naboj iona. Stoga je aktivitet iona u otopini manji od njihove molarne koncentracije. Aktivitet, a, tvari u otopini elektrolita obično se iskazuje umnoškom faktora aktiviteta, f, i njezine koncentracije, tj. a = f·c. Faktor aktiviteta je neimenovani broj manji od 1. Za aktivitete otapala, krutina i taloga u vodenoj otopini, također se uzima da su jednaki 1.
7.2.2. pH, pOH i pKw
U čistoj vodi koncentracije oksonijevih i hidroksidnih iona jednake su, pa je otopina stoga neutralna. Ako je koncentracija iona H3O+, veća od koncentracije iona OH−, otopina je kisela. Vrijedi i obratno. Ako je koncentracija iona OH−, veća od koncentracije iona H3O+, otopina je lužnata.
Danski kemičar S. P. L. Sřrensen uveo je 1909. godine veličinu pH (čitaj pe-ha) kao mjeru za koncentraciju iona H3O+ u vodenim otopinama. Naime, koncentracije oksonijevih i hidroksidnih iona u vodenim otopinama tako su male da uvijek uključuju negativni eksponent. Stoga je Sřrensen predložio da se koncentracije oksonijevih i hidroksidnih iona iskazuju pH i pOH jedinicama, tj. negativnim logaritmom koncentracije iona H3O+ i OH−.
pH = −lg([H3O+]/mol dm−3).
Analogno možemo koncentraciju iona OH― iskazati pOH jedinicom:
pOH = −lg([OH− ]/mol dm−3).
Na jednak način možemo konstantu autoionizacije vode. Kw, iskazati kao pKw:
pKw = −lg(Kw/mol2 dm−6) = −lg10−14 = 14.
Ako izraz za ionski produkt vode:
podijelimo s mol2 dm−6, tj. mjernom jedinicom lijeve i desne strane jednadžbe, tad dobivamo izraz koji možemo logaritmirati. Primijenimo pravilo za logaritmiranje umnoška pa slijedi:
Pomnožimo jednadžbu s −1 pa dobivamo:
Na lijevoj strani jednadžbe prepoznajemo pKw, a na desnoj strani definicije za pH i pOH, pa slijedi:
14 = pH + pOH
Prema IUPAC Gold Book pH je definiran kao aktivitet vodikovih iona, H+, u otopini:
pH = −lg[a(H+)] = −lg[m(H+)γm(H+)/m⦵]
gdje je:
a(H+) ― aktivitet vodikovih iona u otopini, H+(aq),
m(H+) ― molalitet vodikovih iona u otopini,
gm(H+) ― koeficijent aktiviteta pri molalitetu m(H+),
m⦵ = 1 mol kg−1, tj. standardni molalitet.
Primjer 7.6. Izračunajte pH i pOH otopine klorovodične kiseline, [HCl] = 0,15 mol dm−3.
Rješenje: Klorovodična kiselina je jaka kiselina i u vodenoj otopini potpuno disocirana na ione.
HCl(aq) + H2O(l) → H3O+(aq) + Cl―(aq)
Stoga možemo pretpostaviti da je koncentracija iona H3O+ u vodenoj otopini jednaka koncentraciji klorovodične kiseline, tj. [H3O+l] = 0,15 mol dm−3.
Kako je pH = ―lg([H3O+]/mol dm−3), slijedi:
pH = ―lg([H3O+]/mol dm−3) = ―lg0,15 = 0,82,
pOH = 14 – pH =13,18.
Primjer 7.7. Izračunajte pH i pOH otopine ako je pri 25 °C koncentracija iona H3O+(aq) = 10−5 mol dm−3.
Rješenje: Kako je pH = ―lg([H3O+]/mol dm−3), slijedi:
pH = ―lg10−5 = 5,
pOH = 14 – pH = 14 – 5 = 9.
Primjer 7.8. Izračunajte koncentracije iona H3O+(aq) i OH―(aq) u čistoj vodi pri 50 °C, ako je Kw(50 °C) = 5.48 ·10−14 mol2 dm−6. Koliki je pH i pOH otopine?
Rješenje: Kako je Kw = [H3O+][OH―], proizlazi da su koncentracije iona H3O+(aq) i OH―(aq) pri 50 °C jednake drugom korijenu ionskog produkta vode:
pH = ―lg([H3O+]/mol dm−3) = ―lg(2,34 × 10−7) = 6,63
pOH = ―lg([OH―],/mol dm−3) = ―lg(2,34 × 10−7) = 6,63
U čistoj vodi koncentracije oksonijevih i hidroksidnih iona su jednake. Pri 50 °C voda je jače disocirana. (Vidi tablicu 7.1.). Odavde proizlazi drukčija vrijednost ionskog produkta vode:
pKw(50 °C) = −lgKw = −lg(5.48 × 10−14) = 13,26.
Primjer 7.9. Izračunajte koncentraciju iona H3O+ u otopini ako je izmjeren pH = 8,44.
Rješenje:
pH = ―lg([H3O+]/mol dm−3),
―8,44 = lg([H3O+]/mol dm−3),
7.2.3. Disocijacija kiselina i baza
Kiseline i baze dijele se na jake i slabe. Jake kiseline su one koje u vodenoj otopini potpuno disociraju. Primjerice klorovodik, HCl, se u vodi potpuno disocira na vodikove i kloridne ione:
Slika 7.4. Shematski prikaz disocijacije klorovodika u vodi. Otopina klorovodika u vodi je jaka kiselina.
Slaba kiselina slabo disocira u vodenoj otopini. Primjerice, octena kiselina, sastojak kuhinjskog octa, vrlo je slaba kiselina. Ona u vodenoj otopini slabo disocira:
CH3COOH(aq) + H2O(l) ⇄ H3O+(aq) + CH3COO−(aq).
Jakost kiseline ili baze procjenjujemo na osnovi konstante disocijacije kiselina, Ka, i konstante disocijacije baza, Kb. Primjerice, konstanta disocijacije octene kiseline pišemo ovako:
Iz vrijednosti konstante disocijacije octene kiseline možemo zaključiti da je to slaba kiselina, dakle kiselina koja u vodenoj otopini slabo disocira u vodenoj otopini slabo disocira. Stupanj disocijacije slabih kiselina varira, ali je općenito manji od 10 %. Primjerice, u otopini octene kiseline, [CH3COOH] = 0,1 mol dm−3, samo je oko 1,3 % kiseline disocirano. Stoga smo jednadžbu disocijacije octene kiseline prikazali dvostranom strelicom jer je ravnoteža pomaknuta prema reaktantima.
Tablica 7.2. Konstante disocijacije i pKa nekih kiselina
|
Naziv kiseline |
Jednadžba disocijacije |
Ka |
pKa |
|
Klorovodična kiselina |
HCl ⇄ H+ + Cl― |
≈ 104 |
≈ ―4 |
|
Sumporna kiselina |
H2SO4 ⇄ H+ + HSO4− HSO4− ⇄ H+ + SO42− |
≈ 103 1,3·10−2 |
≈ ―3 1,89 |
|
Dušična kiselina |
HNO3 ⇄ H+ + NO3― |
≈ 1 |
≈ ―1 |
|
Oksalna kiselina |
H2C2O4 ⇄ H+ + HC2O4− HC2O4− ⇄ H+ + C2O42− |
6,5·10−2 6,1·10−5 |
1.19 4,21 |
|
Sumporasta kiselina |
H2SO3 ⇄ H+ + HSO3― HSO3― ⇄ H+ + SO32― |
1,4·10−2 6,3·10−8 |
1,85 7.20 |
|
Fosforna kiselina |
H3PO4 ⇄ H+ + H2PO4− H2PO4− ⇄ H+ + HPO42― HPO42— ⇄ H+ + PO43− |
7,5·10−3 6,2·10−8 4,8·10−13 |
2.12 7.21 12,32 |
|
Fluorovodična kiselina |
HF ⇄ H+ + F− |
7,1·10−4 |
3,15 |
|
Dušikasta kiselina |
HNO2 ⇄ H+ + NO2− |
4,5·10−4 |
3,35 |
|
Benzojeva kiselina |
C6H5COOH ⇄ H+ + C6H5COO− |
6,5·10−5 |
4,19 |
|
Octena kiselina |
CH3COOH ⇄ H+ + CH3COO− |
1,8×10−5 |
4,74 |
|
Ugljična kiselina |
H2CO3 ⇄ H+ + HCO3− HCO3− ⇄ H+ + CO32− |
4,2·10−7 4,8·10−11 |
6,38 10.32 |
|
Cijanovodična kiselina |
HCN ⇄ H+ + CN− |
4,9·10−10 |
9.31 |
Slabe kiseline, poput jakih kiselina, disocijacijom daju ione H3O+(aq) i konjugiranu bazu. Budući da je HCl jaka kiselina, njena konjugirana baza Cl―(aq) izrazito je slaba. Kloridni ion ne može prihvatiti ion H3O+(aq) i ponovno postati HCl(aq). Općenito, što je kiselina jača, to je njezina konjugirana baza slabija. Isto tako, što je kiselina slabija, to joj je konjugirana baza jača.
Promotrimo li pažljivije tablicu 7.2. lako ćemo uočiti da je kod svih kiselina, koje disociraju u dva stupnja, prva konstanta disocijacije za nekoliko redova veličine veća od konstante disocijacije drugog stupnja. Drugim riječima, gotovo sva “kiselost” potječe od prvog stupnja disocijacije. To se najbolje vidi na primjeru fosforne kiseline, kojom zakiseljuju Coca-Colu i druge osvježavajuće napitke.
Primjer 7.10. Izračunajte stupanj disocijacije octene kiseline koncentracije 0,1 mol dm−3, ako je konstanta disocijacije octene kiseline, Ka = 1,8·10−5 mol dm−3. Koliki je pH otopine?
Koncentracije iona H3O+ u sljedećim zadacima uvijek ćemo navoditi kao [H+] podrazumijevajući da je riječ o hidratiziranom protonima.
Rješenje: Uzmimo da su ravnotežne koncentracije:
[CH3COOH]⧸mol dm−3 = 0,1 − x
[H+]⧸mol dm−3 = x
[CH3COOH] mol dm−3 = x
Uvrstimo ravnotežne koncentracije u izraz za konstantu ravnoteže, pa dobivamo kvadratnu jednadžbu:
Preuredimo i riješimo jednadžbu:
Drugo rješenje nema fizičkog smisla.
Za sve slabe kiseline možemo pretpostaviti da je ravnotežna koncentracija jednaka njihovoj analitičkoj koncentraciji. Stoga za octenu kiselinu možemo uzeti da je [CH3COOH]=0,1 mol dm−3. Stoga za [H+] dobivamo:
Odavde proizlazi da je u otopini octene kiseline, [CH3COOH] = 0,1 mol dm−3, oko 1,3 % kiseline disocirano na ione H+(aq) i CH3COO−(aq), kao što smo to već ranije kazali.
Za pH otopine dobivamo:
Primjer 7.11. Izračunajte stupanj disocijacije i pH otopine cijanovodične kiseline, [HCN]= 0,1 mol dm−3. Ka(HCN) = 4,9·10−10 mol dm−3.
Rješenje: Cijanovodična kiselina je slaba kiselina, ali jak otrov. Pri koncentraciji 300 ppm cijanovodika u zraku smrt nastupa za nekoliko minuta.
Napišimo izraz za konstantu ravnoteže:
Cijanovodična kiselina je slabo disocirana pa možemo uzeti da je ravnotežna koncentracija jednaka njezinoj analitičkoj koncentraciji, tj. 0,1 mol dm−3. Odavde proizlazi:
Kao primjere jakih baza možemo uzeti topljive hidrokside alkalijskih metala kao što u litijev, natrijev i kalijev hidroksid. Kalcijev, stroncijev i barijev hidroksid slabo su topljivi u vodi, ali su u otopini potpuno disocirani pa i njih možemo svrstati u jake baze.
Slaba baza tek neznatno disocira u vodenoj otopini. Prisjetimo se da se baza može definirati kao tvar koja prihvaća vodikov ion od druge tvari. Kada se slaba baza kao što je amonijak otopi u vodi, ona prihvaća ion H+ iz vode, tvoreći hidroksidni ion i konjugiranu kiselinu baze, amonijev ion.
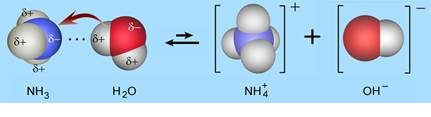
Slika 7.5. Shematski prikaz disocijacije amonijaka u vodi. Otopina amonijaka u vodi je slaba baza.
Nekad, davno, otopinu amonijaka u vodi zvali su amonijevom lužinom i pisali formulu NH4OH. To je pogrešno, jer vrlo malo molekula amonijaka reagira s vodom pri čemu nastaju ioni NH4+(aq) i OH―(aq). Amonijak je u vodi otopljen kao plin, poput drugih plinova koji ne reagiraju s vodom. Stoga na boce s otopinom amonijaka treba stavljati natpis NH3(aq).
Primjer 7.12. Izračunajte stupanj disocijacije amonijaka u otopini koncentracije 0,1 mol dm−3, ako je konstanta disocijacije amonijaka, Kb = 1,8 × 10−5 mol dm−3. Koliki je pH otopine?
Rješenje: Napišimo najprije jednadžbu disocijacije amonijaka:
NH3(aq) + H2O(l) ⇄ NH4+(aq) + OH―(aq)
Budući da je koncentracija vode iznimno velika i praktički konstantna, voda nije uključena u izraz za konstantu ravnoteže. Stoga za konstantu ravnoteže otopine amonijaka u vodi vrijedi:
Uzmimo da su ravnotežne koncentracije:
[NH3]⧸mol dm−3 = 0,1
[OH− ]⧸mol dm−3 = x
[NH4+] mol dm−3 = x
Uvrstimo navedene veličine u izraz za konstantu ravnoteže pa dobivamo:
[OH− ]⧸mol dm−3 = 1,34·10−3
U vodenoj otopini amonijaka koncentracije 0,1 mol dm−3 samo je oko 1,3 % molekula amonijaka reagiralo s vodom, tj. amonijak je ≈ 1,3 % disociran.
Tablica 7.3. Konstante disocijacije i pKb nekih slabih baza
|
Naziv baze |
Jednadžba disocijacije |
Kb |
pKb |
|
Metilamin |
CH3NH2 + H2O ⇄ CH3N |
5.6·10−4 |
3,2 |
|
Amonijak |
NH3 + H2O ⇄ N |
1.8·10−5 |
4,7 |
|
Piridin |
C5H5N + H2O ⇄ C2H5NH+ + OH− |
1.7·10−9 |
8.8 |
|
Acetatni ion |
CH3COO− + H2O ⇄ CH3COOH + OH− |
5.6·10−10 |
9.2 |
|
Fluoridni ion |
F + H2O ⇄ HF + OH− |
1.4·10−11 |
10,8 |
|
Urea |
H2NCONH2 + H2O ⇄ H2NCON |
1.5·10−14 |
13,8 |
Primjer 7.13. Izračunajte koncentraciju iona OH―(aq), pH i pOH u otopini kalcijeva hidroksida, Ca(OH)2(aq), koncentracije 0,0055 mol dm−3.
Rješenje: Kalcijev hidroksid je jaka baza koja u razrijeđenoj otopini potpuno disocira:
Ca(OH)2(aq) ⇄ Ca2+(aq) + 2 OH―(aq)
Odavde proizlazi da je koncentracija iona OH―(aq) jednaka dvostrukoj koncentraciji kalcijeva hidroksida, tj. 0,011 mol dm−3. Kako je pOH otopine jednak ―lg[OH―]/mol dm−3, slijedi:
pOH = ―lg 0,022 = 1,65,
pH = 14 – 1,65 = 12,34.
7.2.4. Indikatori kiselina i baza
Indikatori kiselina i baza po kemijskom sastavu su slabe kiseline ili slabe baze koje mijenjaju boju promjenom pH otopine. Najpoznatiji indikator je lakmus koji je u lužnatoj otopini plave, a u kiseloj crvene boje. Označimo li crveni oblik lakmusa „HIn“, a plavi „In―“, ta se dva oblika indikatora nalaze u ravnoteži:
HIn + H2O ⇄ H3O+ + In―
Radi se o disocijaciji slabe organske kiseline, za koju možemo napisati izraz za koncentracijsku konstantu ravnoteže:
Negativni logaritam konstante disocijacije indikatora zove se pKindikatora. Fizički smisao vrijednosti pKindikatora može se vidjeti ako izraz za konstantu disocijacije prevedemo u oblik:
Kada kvocijent postane jednak jedinici, polovina je prisutne količine indikatora u nedisociranom, a polovina u disociranom obliku. To će se dogoditi kad bude pHotopine = pKindikatora.
Uzmimo kao primjere najpoznatije indikatore, lakmus, fenolftalein i metiloranž. Lakmus je smjesa prirodnih boja dobivenih iz lišajeva. Lakmus u trgovini i laboratoriju najčešće dolazi u obliku crvenih i plavih papirnatih trakica. Njime se kvalitativno dokazuje je li otopina kisela ili lužnata. U kiselome mediju lakmus se oboji crveno, a u lužnatom tamno plavo. Boju mijenja u području pH od 4,5 do 8,3.
Fenolftalein je slaba kiselina. U laboratoriju se rabi kao bezbojna 0,05-postotna alkoholna otopina. U kiselim otopinama fenolftalein je bezbojan a u lužnatim ružičast. Konstanta disocijacije fenolftaleina je Kc = 1,58 ·10−9. Odavde proizlazi: pKfenolftalein = 8,8, što znači da je pri pH = 8.8 polovina molekula fenolftaleina u otopini disocirana na ione. Fenolftalein mijenja boju u području pH od 8,2 do 10. Stoga se rabi pri titraciji slabih kiselina jakim lužinama. Naime, otopine soli slabih kiselina i jakih lužina zbog hidrolize su blago lužnate.
Kako se priprema 0,05-postotna otopina fenolftaleina doznajte OVDJE.
Metiloranž je sintetička azo boja koja je u kiseloj otopini crvena a u lužnatoj žuta. Pri 25 °C pKmetiloranž je 3,47. Mijanja boju iz crvene u žutu u području pH od 3,1 do 4,4. Rabi se za titraciju slabih baza jakim kiselinama. Naime, otopine soli jakih kiselina i slabih lužina zbog hidrolize blago su kisele.
Kako se priprema 0,04-postotna otopina metiloranža doznajte OVDJE.
Danas se pH otopina određuje digitalnim elektroničkim uređajima, pH-metrima, koji omogućuju određivanje pH otopine s točnošću od stotinke jedinice pH. Takvi uređaju rade na temelju mjerenja razlike potencijala galvanskog članka koji se sastoji od dviju elektroda. Jedna elektroda ima poznat standardni elektrodni potencijal, dok potencijal druge elektrode ovisi o koncentraciji iona H3O+(aq). (Vidi poglavlje 8.5.3).

Slika 7.6. Univerzalni indikatorski papir.
7.2.5. Hidroliza soli
Primjer 7.14. Izračunajte pH otopine natrijeva acetata koncentracije 0,1 mol dm−3, ako je konstanta disocijacije octene kiseline, Ka = 1,8 × 10−5 mol dm−3.
Rješenje: Otopina natrijeva acetata u vodenoj otopini pokazuje blago lužnatu reakciju. To se može objasniti reakcijom acetatnih iona s molekulama vode.
CH3COO− + H2O ⇄ CH3COOH + OH−
Reakcije u kojima sudjeluju molekule vode nazivaju se reakcijama hidrolize. Iz jednadžbe reakcije vidimo da hidrolizom acetatnih iona nastaje jednak broj molekula nedisocirane octene kiseline i iona OH−. Stoga u otopini imamo dvije ravnoteže, disocijaciju octene kiseline i ionski produkt vode.
Kako je konstanta disocijacije octene kiseline (vidi primjer 7.10.)
a ionski produkt vode
metodom supstitucije iz ove dvije jednadžbe dobiva se
Već smo kazali da je koncentracija molekula nedisocirane kiseline jednaka koncentraciji iona OH―. Nadalje, koncentracija acetatnih iona zbog reakcije hidrolize zanemarivo malo se snizi. Stoga možemo uzeti da je ravnotežna koncentracija acetatnih iona jednaka njihovoj analitičkoj koncentraciji, tj. 0,1 mol dm−3. Odavde za koncentraciju iona OH― dobivamo:
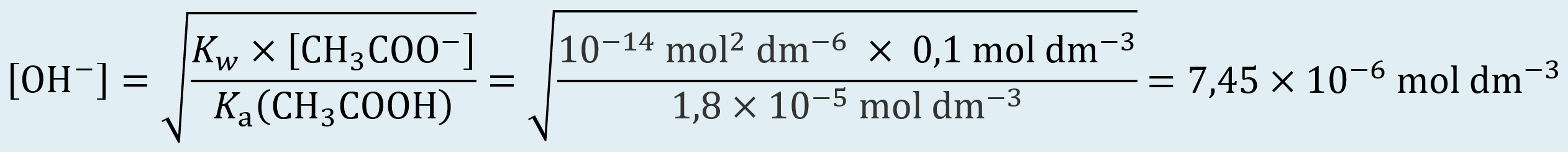
Kako je pOH otopine jednak ―lg([OH―]/mol dm−3), slijedi:
pOH = ― lg(7,45 × 10−6) = 5,12
pH = 14 – pOH = 8,88.
Općenito za [OH− ] otopine soli jake baze i slabe kiseline vrijedi:
Soli jakih kiselina i slabih baza zbog reakcije hidrolize pokazuju slabo kiselu reakciju. Uzmimo kao primjer hidrolizu amonijevih iona:
NH4+ + H2O ⇄ NH3(aq) + H3O+
Iz jednadžbe hidrolize vidimo da hidrolizom amonijevih iona nastaju jednake množine nedisociranih molekula amonijaka i oksonijevih iona. Sličnim postupkom kao u Primjeru 7.14., za koncentraciju iona H+ dobivamo:
Primjer 7.15. Izračunajte pH otopine amonijeva klorida koncentracije 0,1 mol dm−3, ako je konstanta disocijacije amonijaka, Kb(NH3(aq)) = 1,8·10−5 mol dm−3.
Rješenje:
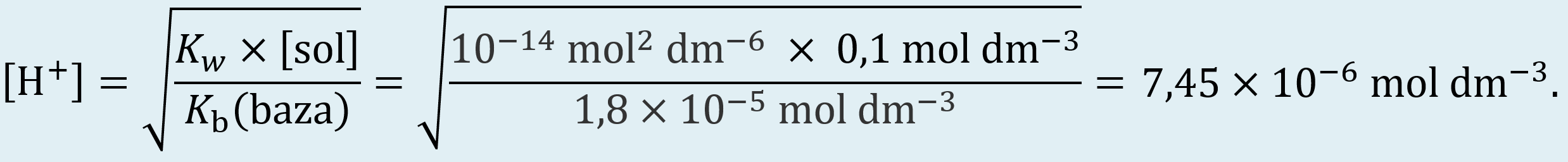
Odavde proizlazi:
pH = ―lg([H+]/mol dm−3 = ―lg(7,45·10−6) = 5,12.
7.2.6. Volumetrijske metode određivanja množina kiselina i baza
Acidimetrija je volumetrijska metoda kvantitativne analize, tj. određivanje množine baza u nekom uzorku titracijom sa standardiziranim otopinama kiselina. Najčeće se u tu svrhu rabe jake kiseline kao što su HCl, HClO4 ili H2SO4.
Alkalimetrija je volumetrijska metoda određivanja množine kiseline titracijom otopinama baza poznate koncentracije. Najčešće se u tu svrhu rabe jake baze kao što su NaOH, KOH ili Ba(OH)2.
Za volumetrijske metode kvantitativne analize potrebne su tzv. standardizirane otopine, tj. otopine točno poznate koncentracije. Za pripremanje standardiziranih otopina može se uzeti svaka tvar topljiva u vodi, točno definiranog kemijskog sastava, koja s ispitivanom tvari reagira prema točno definiranim kemijskim reakcijama. Nadalje, te tvari moraju biti stabilne na zraku i u vodenim otopinama.
Kao standardna tvar za volumetrijske metode neutralizacije rabi se vrlo čist bezvodni natrijev karbonat. Stabilan je na zraku, a nakon sušenja pri 105 °C može se u eksikatoru držati neograničeno dugo. U volumetrijskoj analizi najčešće se rabe otopine koncentracije 0,1 mol dm−3 ili, kako se to obično kaže decimolarne otopine, a kraće se označavaju kao 0,1 M otopine.
Pokus 7.2. Priprema standardizirane otopine natrijeva
karbonata
Vidi na internetu: Free Chemistry Tutorials - Standard Solution of Sodium Carbonate
Pokus 7.3. Priprema standardizirane otopine
klorovodične kiseline
Vidi na internetu: Free Chemistry Tutorials - Titration to Standardise a Hydrochloric Acid Solution
Primjer 7.16. Kolika je koncentracija otopine klorovodične kiseline, ako je za neutralizaciju 0,1208 g bezvodnoga natrijeva karbonata utrošeno 23,15 mL otopine te kiseline uz metiloranž kao indikator.
Rješnje: Napišimo najprije jednadžbu reakcije neutralizacije.
Na2CO3 + 2 HCl → 2 NaCl + H2O + CO2
Preračunajmo masu natrijeva karbonata u množinu:
Iz jednadžbe reakcije proizlazi da jedan mol Na2CO3 reagira s 2 mola HCl, pa vrijedi:
n(HCl) = 2 n(Na2CO3) = 2 × 1,1397 mmol = 2,2794.
Odavde proizlazi da je koncentracija otopine klorovodične kiseline:
Primjer 7.17. Kolika je koncentracija otopine natrijeva hidroksida ako je za neutralizaciju 25,00 mL te otopine, uz metiloranž kao indikator, utrošeno 25,41 mL otopine klorovodične kiseline c(HCl) = 0,0984 mol L−1?
Rješenje: Napišimo jednadžbu reakcije:
HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l)
Iz jednadžbe reakcije proizlazi da 1 mol HCl reagira s jednim molom NaOH. Stoga možemo primijeniti pravilo koje vrijedi za razrjeđivanje otopina:
V1 × c1 = V2 × c2
V(ot. HCl) × c(ot. HCl) = V(ot. NaOH) × c(ot. NaOH).
Odavde proizlazi:
Pri titraciji jake kiseline jakom bazom može se uzeti bilo koji indikator koji mijenja boju u području pH = 3 do pH = 11. Naime, pri titraciji 20 mL 0,1 M otopine jake baze u blizini točke ekvivalencije dodatak samo jedne kapi, tj. 0,02 mL 0,1 M otopine jake kiseline, pH otopine promijenit će se za 3 pH jedinice.
Pri titraciji slabe kiseline jakom bazom kao indikator treba uzeti fenolftalein, koji mijenja boju pri pH = 8,8 jer soli slabih kiselina i jakih baza zbog hidrolize pokazuju lužnatu reakciju. (Vidi primjer 7.14.)
Pri titraciji slabe baze jakom kiselinom kao indikator treba uzeti metiloranž jer soli slabih baza i jakih kiselina zbog hidrolize pokazuju kiselu reakciju. (Vidi primjer 7.15.)
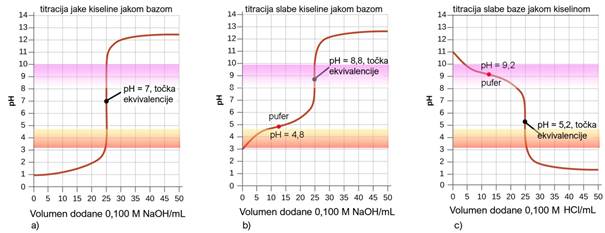
Slika 7.7. a) Krivulje titracije 25 mL 0,1 M otopine jake kiseline 0,1 M otopinom jake baze, b) Krivulje titracije 25 mL 0,1 M otopine slabe kiseline 0,1 M otopinom jake baze c) Krivulje titracije 25 mL 0,1 M otopine slabe baze 0,1 M otopinom jake kiseline.
Pokus 7.4. Redox-titracija
Vidi na internetu:
Omega Open Course - Redox Reaction
7.2.7. Puferske otopine
Smjesa slabe kiseline i njezine konjugirane baze ili smjesa slabe baze i njezine konjugirane kiseline naziva se puferska otopina ili pufer. Puferske otopine malo mijenjaju pH kad im se dodaju male količine jake kiseline ili jake baze.
Otopina u kojoj su octena kiselina, CH3COOH, i natrijeva acetata, CH3COONa, pomiješani u ekvimolarnom omjeru, primjer je pufera koji se sastoji od slabe kiseline i njezine soli. Poznata je pod nazivom acetatni pufer. Kad se u ovu otopinu doda malo otopine neke jake kiselina, kao što je HCl, ona će reagirati s acetatnim ionima pa će se malo povećati koncentracija nedisocirane octene kiseline.
HCl + CH3COONa → NaCl + CH3COOH
Octena kiselina je slaba kiselina, koja disocijacijom daje malo vodikovih iona, stoga se kiselost otopine neće značajno promijeniti. Obratno, doda li se u takvu otopinu neka jaka lužina, kao što je NaOH, ona će reagirati s octenom kiselinom pri čemu će nastati voda i natrijev acetat.
NaOH + CH3COOH → H2O + CH3COONa,
Stoga se lužnatost otopine neće značajno promijeniti. Isto vrijedi i za smjesu slabe baze i njezine soli, kao što je otopina koja sadržava amonijak i amonijev klorid u ekvimolarnom omjeru. U ovom puferu NH3(aq) je slaba baza, a NH4+ sol slabe baze. Ova je smjeşa poznata pod nazivom amonijačni pufer.
Pokus 7.5. Priprema acetatnog pufera
Pribor i kemikalije: 4 čaše od 100 mL, otopina univerzalnog indikatora, otopina octene kiseline, c(CH3COOH) = 0,1 mol L−1, otopina natrijeva acetata, c(CH3COONa) = 0,1 mol L−1, otopina natrijeva hidroksida, c(NaOH) = 0,1 mol L−1, otopina klorovodične kiseline, c(HCl) = 0,1 mol L−1.
Postupak:
- Pripremite niz od 4 jednake čaše od 100 mL. U prvu i četvrtu čašu ulijte 20 mL destilirane vode.
- U drugoj čaši pomiješajte 20 mL otopine octene kiseline c(CH3COOH) = 0,1 mol L−1 i 20 mL otopine natrijeva acetata, c(CH3COONa) = 0,1 mol L−1. Dobro promiješajte a potom čistom injekcijskom štrcaljkom ili pipetom prenesite 20 mL dobivene puferske otopine u treću čašu.
- U sve četiri čaše dodajte kap dvije otopine univerzalnog indikatora ili soka crvenog kupusa koji može poslužiti kao indikator kiselina i baza.
- Na temelju tablice boja univerzalnog indikatora odredite pH otopina u sve četiri čaše.
- U prvu i drugu čašu dodajte po 2 mL otopine klorovodične kiseline, c(HCl) = 0,1 mol L−1.
- U treću i čevrtu čašu dodajte po 2 mL otopine natrijeva hidroksida, c(NaOH) = 0,1 mol L−1.
- Obrazložite uočene promjene.

Slika 7.8. pH vrijednost otopine jako se mijenja kad se u destiliranu vodu doda kap jake kiseline ili lužine, kao u čašama 1 i 4. Kad se ista količina jake kiseline ili lužine doda u otopinu acetatnog pufera, pH otopine malo se mijenja kao u čašama 2 i 3.
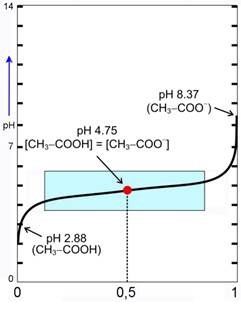
Slika 7.9. Acetatni pufer. Uočite točku u kojoj je polovina octene kiseline neutralizirana jakom bazom.
Pažljivim promatranjem krivulje neutralizacije slabe kiseline jakom bazom, ili slabe baze jakom kiselinom možemo uočiti ravni dio krivulje u području gdje je polovina prisutne količine kiseline ili baze neutralizirana. Vidimo da se u tom dijelu pH otopine malo mijenja dodatkom kiseline ili lužine. (Vidi slike 7.6b i 7.6c.) Zašto se to događa lako ćemo razumjeti ako napišemo izraz za konstantu ravnoteže disocijacije octene kiseline:
Preuredimo jednadžbu tako da iskažimo koncentraciju iona H3O+
Logaritmirajmo ovaj izraz i pomnožimo s ―1, pa za acetatni pufer dobivamo:
ili općenito za neutralizaciju slabe kiseline jakom bazom:
Za neutralizaaciju slabe baze jakom kiselinom (amonijačni pufer) vrijedi:
Odavde proizlazi da pH kisele puferske smjese ovisi o konstanti disocijacije kiseline i omjeru koncentracija soli i kiseline. Slično, pOH bazične puferske smjese ovisi o konstanti disocijacije baze i omjeru koncentracija soli i baze. Ove jednadžbe vrijede za područje pH od 4 do 10.
Primjer 7.18. Izračunajte pH amonijačnog pufera u kojem je koncentracija amonijaka, c(NH3) = 0,2 mol L−1, a koncentracija amonijeva klorida, c(NH4Cl) = 0,3 mol L−1. Konstanta disocijacije amonijaka je Kb(NH3) = 1,85·10−5 mol L−1.
Rješenje
pKb(NH3) = ― lgKb/mol L−1 = ―lg(1,85·10−5) = 4,73
Primijenimo formulu za bazični pufer pa dobivamo:
Primjer 7.19. Izračunajte pH otopine ako se u 20 mL amonijačnog pufera iz prethodnog zadatka doda 8 mL otopine natrijeva hidroksida, c(NaOH) = 0,2 mol L−1. Konstanta disocijacije amonijaka je Kb(NH3) = 1,85·10−5 mol L−1.
Rješenje
pOH amonijačnog pufera ovisi o omjeru koncentracija ili, što je isto, omjeru množina soli i baze u otopini. Množina amonijaka u 20 mL navedenog amonijačnog pufera je:
n(NH3) = V(otop) × c(otop) = 0,020 L × 0,2 mol L−1 = 0,004 mol
Množina amonijeva klorida u 20 mL navedenog amonijačnog pufera je:
n(NH4Cl) = V(otop) × c(otop) = 0,020 L × 0,3 mol L−1 = 0,006 mol
Množina natrijeva hidroksida dodana u 20 mL puferske otopine je:
n(NaOH) = V(otop) × c(otop) = 0,008 L × 0,2 mol L−1 = 0,0016 mol
Amonijev klorid i natrijev hidroksid reagiraju prema jednadžbi:
NH4Cl + NaOH → NaCl + H2O + NH3
Množina amonijaka nastala reakcijom natrijeva hidroksida s amonijevim kloridom jednaka je množini dodanog natrijeva hidroksida, tj. n(NH3) = 0,0016 mol.
Nakon dodatka otopine NaOH puferska otopina sadržava:
n(NH3) = 0,004 mol + 0,0016 mol = 0,0056 mol
n(NH4Cl) = 0,006 mol ― 0,0016 mol = 0,0044 mol
Za pOH puferske otopine nakon dodatka 8 mL otopine c(NaOH) = 0,2 mol L−1 dobivamo:
Ovaj primjer nedvojbeno dokazuje da se puferski sustavi opiru promjeni pH pri dodavanju kiseline ili lužine te održavaju pH otopine na približno istoj vrijednosti.
Puferske otopine rabe se kao sredstva za održavanje pH na gotovo konstantnoj vrijednosti u kemijskim, a pogotovo prehrambenim i prehrambeno-biokemijskim procesima. Svi živi sustavi u prirodi koriste pufere za regulaciju pH. Primjerice, bikarbonatni puferski sustav sadržan je u našoj krvi te regulira njezin pH u području od pH = 7,35 do pH = 7,45. Bikarbonat također ima važnu ulogu u održavanju pH oceana. Nažalost, povećanje koncentracija CO2 u atmosferi dovodi do zakiseljavanja oceana i ugrožavanja njegova ekosustava. Oceani su prirodno lužnati, s prosječnim vrijednostima pH oko 8,2. Od početka industrijske revolucije pH površine oceana pao je za 0,1 pH-jedinicu zbog povećanog otapanja CO2 iz atmosfere. Ova promjena predstavlja povećanje kiselosti oceana od približno 30 %.
Zadaci i teme za vlastite aktivnosti i samoobrazovanje
D. Dabić i D. Petrin, Puferi u nastavi. I. Mjerenje vrijednosti pH i osnove teorije pufera, Kem. Ind. 69 (3-4) (2020) 183-194.
D. Dabić i D. Petrin, Puferi u nastavi. II. Primjene i upotreba, Kem. Ind. 69 (5-6) (2020) 311-319.
Izradite plakat,
PowerPoint prezentaciju, snimite video, održite predavanje u razredu,
organizirajte raspravu ili pišite u školskom listu o puferima.
7.2.8. Produkt topljivosti
Topljivost tvari ovisi o međumolekulskim silama između otapala i otopljene tvari. Voda je polarno otapalo, stoga se u vodi dobro otapa većina ionskih spojeva (soli) i većina spojeva polarne građe. Tvari nepolarne građe netopljive su ili su vrlo slabo topljive u vodi.
Topljivost je najveća količina tvari koja se može otopiti u određenoj količini otapala. Obično se iskazuje kao masa bezvodne tvari koja se pri 20 °C otapa u 100 g otapala. Takav način iskazivanja topljivosti proizašao je iz samog načina njezina određivanja. Naime, odvagali biste masu zasićene otopine, uparili je do suha te izvagali preostalu suhu tvar. Kad od mase otopine odbijete masu suhe tvari, dobijete masu vode u kojoj se otapa navedena masa suhe tvari. Rezultat mjerenja preračuna se na masu tvari koja se otapa u 100 g vode.
No, topljivost teško topljivih soli iskazujemo konstantom produkta topljivosti. Konstanta produkta topljivosti, Ksp, je umnožak ravnotežnih koncentracija (točnije aktiviteta) iona taloga podignutih na potenciju svog stehiometrijskog koeficijenta u jednadžbi. (Subskript „sp“ dolazi od engl. solubility product.)
Tablica 7.4. Topljivost soli u vodi
|
Topljive soli |
Netopljive soli |
|
Sve soli alkalijskih metala i NH4+ |
Svi karbonati (osim karbonata alkalijskih metala i NH4+) |
|
Svi nitrati |
Svi sulfati (osim sulfata alkalijskih metala i NH4+) |
|
Svi acetati |
Svi fosfati (osim fosfata alkalijskih metala i NH4+) |
|
Svi kloridi, bromidi i jodidi (osim Ag+, Pb2+, Cu+ i Hg22+) |
Svi hidroksidi i oksidi (osim alkalijskih metala, NH4+, Ca2+, Sr2+, Ba2+ i Tl+) |
|
Svi sulfati (osim Ag+, Pb2+, Ca2+, Sr2+ i Ba2+) |
Svi sulfidi (osim alkalijskih i zemnoalkalijskih metala te NH4+) |
Uzmimo kao primjer zasićenu otopinu u vodi slabo topljivog minerala fluorita, CaF2. Koncentracija iona Ca2+ i F─ u otopini iznad krutog taloga, CaF2(s), ovisi o temperaturi. Kao što smo za svaku reverzibilnu kemijsku reakciju mogli napisati izraz za konstantu ravnoteže, možemo je napisati i za topljivost teško topljivih soli, kao što je mineral fluorit.
CaF2(s) ⇄ Ca2+(aq) + 2 F─(aq)
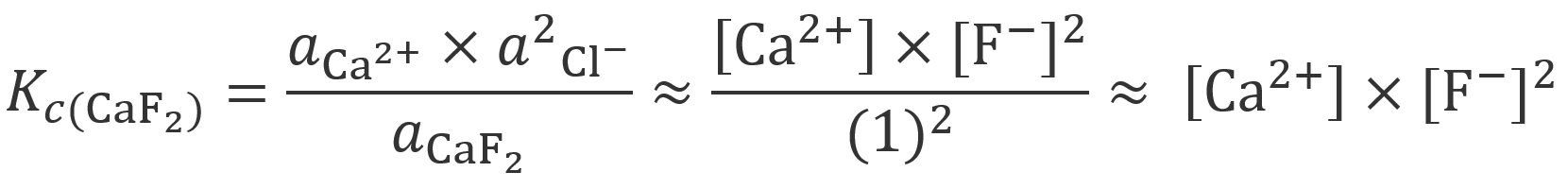
Ovdje je "a" aktivitet nabrojenih vrsta čestica. Kalcijev fluorid je kruta faza pa možemo uzeti da a(CaF2) ima vrijednost 1. Koncentracije iona Ca2+ i F― vrlo su male, stoga možemo pretpostaviti da su i aktiviteti iona Ca2+ i F― jednaki njihovim molarnim koncentracijama . Odavde proizlazi da za konstantu produkta topljivosti, Ksp, vrijedi:
Ksp(CaF2) = [Ca2+] × [F-]2
Za bilo koji spoj opće formule AaBb koji disocira na sljedeći način
AaBb(s) → aA+ + bB―
za konstanta produkta topljivosti vrijedi:
Ksp(AaBb) = [A+]a × [B―]b
Konstanta produkta topljivosti, kao i sve konstante ravnoteže ovisi o temperaturi.
Primjer 7.20. Napišite izraze za konstante produkta topljivosti magnezijeva hidroksida. Što će se dogoditi ako u morsku vodu dodamo gašena vapna. Podatke o konstantama produkta topljivosti potražite OVDJE.
Rješenje
Magnezijev hidroksid slabo je topljiv u vodi. Konstanta produkta topljivosti Mg(OH)2 je:
Ksp(Mg(OH)2) = [Mg2+]×[OH─]2 = 5,61 × 10─12
Konstanta produkta topljivosti Ca(OH)2 je:
Ksp(Ca(OH)2) = [Ca2+]×[OH─]2 = 5,02 × 10─6
Očito je da je topljivost kalcijeva hidroksida puno veća od topljivosti magnezijeva hidroksida. Stoga, kad se u morsku vodu doda gašena vapna istaložit će se magnezijev hidroksid. Na toj se kemijskoj reakciji temelji postupak dobivanja magnezija iz morske vode.
Dobivanje živoga vapna: CaCO3 → CaO + CO2
Dobivanje gašenog vapna: CaO + H2O → Ca(OH)2
Taloženje Mg(OH)2: MgCl2 + Ca(OH)2 → Mg(OH)2 + CaCl2
MgSO4 + Ca(OH)2 + 2 H2O → Mg(OH)2 + CaSO4·2H2O
Dobivanje MgCl2: Mg(OH)2 + 2 HCl → MgCl2 + 2 H2O → elektroliza MgCl2


Zadaci i teme za vlastite aktivnosti i samoobrazovanje
Načinite bar jedan pokus kojim ćete pokazati hidrolizu neke soli.
Obrazložite postupak kiselo-bazne titracije.
Na kakvim se kemijskim reakcijama temelje redox-titracije? Navedite bar jedan primjer.
Istražite povijest promjene pH oceana. Kako povećanje kiselosti oceana utječe na oceanski ekosustav?
Puferski sustavi u tijelu sisavaca (bikarbonatski puferski sustav).
Zašto se topljivost tvari u vodi mijenja promjenom temperature? Kad topljivost tvari raste, a kad se smanjuje porastom temperature? Navedite neke primjere.
U kakvu su odnosu topljivost i produkt topljivosti neke tvari?
Istražite upotrebu kadmija (baterije, solarni paneli, zaštita od korozije ….), otrovnost kadmijevih spojeva, rasprostranjenost kadmija u okolišu, ekotoksikologija kadmija itd.
Izradite plakat, PowerPoint prezentaciju, snimite video, održite predavanje u razredu, organizirajte raspravu ili pišite u školskom listu o čimbenicima koji utječu na topljivost tvari u polarnim i nepolarnim otapalima.
8. ELEKTROKEMIJA
8.1. Vodiči električne struje
Općenito je poznato da metali (kovine) dobro provode električnu struju. Kad se na krajeve metalne žice priključi električni napon, primjerice iz generatora, akumulatora ili baterije, kroz žicu poteče struja elektrona. U doba kad nije bilo jasno postoje li atomi, a nije bilo jasno ni što su atomi, njemački fizičar Paul Drude predložio je 1900. godine model prijenosa elektrona u metalima. Drude zapravo počinje od J.J, Thomsonova otkrića elektrona iz 1897. Prvi moderni model (engl. plum pudding model) strukture atoma datira iz 1904., a Rutherfordov model iz 1909. godine Usprkos nedosljednostima koje su zbunjivale većinu fizičara tog doba, Drudeova teorija prihvaćena je za objašnjenje svojstava metala sve do uvođenja Drude-Sommerfeldovog modela iz 1927. godine.
Metali mogu provoditi električnu struju zato što su njihovi atomi međusobno vezani posebnom vrstom kemijske veze koju zovemo metalna veza. Za razliku od kovalentne i ionske veze, u metalnoj vezi atomi ne čine zajedničke elektronske parove. Umjesto toga valentni elektroni čine nešto što se može nazvati zajedničkim elektronskim oblakom. Prema Drudeovoj teoriji atomi postaju pozitivni ioni uronjeni u "more" delokaliziranih elektrona ili "elektronski plin" u kojem se elektroni manje-više slobodno pomiču kroz kristalnu rešetku. Svaki se ion drži na mjestu privlačenjem negativno nabijenog mora elektrona i odbijanjem drugih pozitivnih iona. Pojedinom atomu potpuno je svejedno je li pripadajuća elektronska gustoća u njegovoj blizini njegova vlastita ili od nekog drugog njemu potpuno istovjetnog metalnog atoma.

Slika 8.1. Shematski prikaz pozitivnih iona u moru delokaliziranih elektrona. Kad se na krajeve metalne žice priključi izvor električnog napona, elektroni se u žici gibaju od ─ pola prema + polu izvora struje. Pritom ne dolazi do kidanja kemijske veze jer je broj elektrona koji ulaze u žicu na ─ polu jednak broju elektrona koji iz žice izlaze na + polu izvora struje. Pojedinom atomu potpuno je svejedno je li pripadajuća elektronska gustoća u njegovoj blizini njegova vlastita ili potječe od nekog drugog atoma ili izvora.
Suvremena teorija metalne veze, teorija elektronskih vrpci, koja ujedno objašnjava svojstva polumetala i izolatora, proizlazi iz teorije molekulskih orbitala. No, ti sadržaju premašuje zadane okvire srednjoškolskog učenje kemije, pa se time nećemo zamarati.
O pojmu „metal“ više doznajte u članku:
N. Raos, Kako razumjeti pojam „metal“, Kem. Ind. 67 (11-12) (2018) 527-531.
Tvari koje ne provode električnu struju su izolatori. Primjerice, suhi kristali natrijeva klorida ne provode električnu struju jer su u kristalu (kristalnoj strukturi) ioni Na+ i Cl― čvrsto uglavljeni na svojim mjestima i ne mogu se gibati. No, kad se natrijev klorid rastali (talište 801 °C), talina dobro provodi električnu struju. Naime, ioni Na+ i Cl― u talini mogu se gibati. Pritom ioni Na+, tj, kationi, putuju prema negativnom polu izvora istosmjerne struje (katodi). Istodobno ioni Cl―, tj. anioni, putuju prema pozitivnom polu izvora istosmjerne struje (anodi).
Tvari ionske građe koje u krutom stanju, talini i vodenoj otopini dobro provode električnu struju nazivamo elektrolitima. Kao primjere elektrolita možemo navesti talinu i vodenu otopinu natrijeva klorida, sumpornu i klorovodičnu kiselinu, otopinu natrijeva hidroksida itd. Te su tvari u vodenoj otopini gotovo potpuno disocirane na ione – katione i anione. Bitna je razlika u načinu provođenja električne struje u metalima i elektrolitima. U metalu električnu struju prenose elektroni. U talini, otopini elektrolita, kao i u krutim elektrolitima, električnu struju prenose ioni.
Pokus 8.1. Ispitivanje električne provodnosti otopina
Vidi na internetu: e-Kemija: Sikirica - Elektroliti
Zanimljivosti
Talijanski liječnik i fizičar Luigi Galvani (1737. -1798.), profesor anatomije na Sveučilištu u Bologni, bavio se istraživanjem djelovanja atmosferskog elektriciteta (munja) na mišiće. Žablji krak vezao bi jednim krajem za dugačku žicu a drugi kraj žabljeg kraka objesio bi mjedenom kukom na željeznu ogradu balkona. Kad bi sijevnula munja žablji krakovi bi se trzali. Ali 20. rujna 1786. bio je lijep sunčan dan i Galvani je promatrao svježe žablje krakove koje je njegova supruga upravo vješala mjedenim kukama na željeznu ogradu balkona. Iako nisu sijevale munje krakovi bi se trzali kad god bi dotakli željeznu ogradu. Galvani je odmah načinio pokus: stavio je svježi žablji krak na željeznu ploči i kad god bi zatvorio krug željezo ― žablji krak ― mjed, krak bi se trgnuo. Nakon mnogih pokusa on je 1791. godine zaključio da tijela životinja sadržavaju "životinjski elektricitet". No, ima mnogo različitih priča o Galvanijevim pokusima sa žabljim kracima, pa nije sigurno da je i ova priča istinita.
Pojavu koju je opazio Galvani, objasnio je 1792. godine njegov sunarodnjak Alessandro Volta (1745. – 1827.), profesor fizike na Sveučilištu u Paviji. On je ponovio Galvanijeve pokuse i došao do zaključka da struja teče žicom (vodičem) koja spaja dva različita metala kad se između njih umjesto žabljeg kraka stavi tkanina navlažena slanom vodom (elektrolitom).

Slika 8.2. Alessandro Volta i replika Voltina stupa načinjena 1999. godine, 200 godina nakon što je Volta načinio prvu bateriju. Svi detalji u ovoj replici precizno su rekonstruirani.
Volta je ustanovio da jakost struje ovisi o paru upotrijebljenih metala. Na osnovi pokusa on je metale svrstao u niz: cink, olovo, željezo, bakar, srebro, zlato. Taj niz njemu u čast i danas zovemo Voltin niz. Godine 1800. Volta je načinio prvu bateriju, poznatu kao Voltin stup. Sastojao se od pločica srebra i cinka između kojih se je nalazila tkanina navlažena slanom vodom. Kasnije je pločice srebra zamijenio bakrom. Parove pločica s navlaženom tkaninom složio bi jedne na druge i tako dobio stup, koji je bio prvi stalan izvor istosmjerne struje napona od oko 80 do 100 volta. (Prije Volte su električnu struju dobivali pražnjenjem kondenzatora.)
Humphry Davy (1778. – 1829.), engleski kemičar i fizičar, iskoristio je Voltin stup kao stalan izvor istosmjerne struje, za dobivanje kemijskih elemenata u elementarnom stanju. Tako je krajem 1806. g. na svom prvom predavanju u Kraljevskom društvu izveo pokus elektrolize vrlo čiste prokuhane vode u zlatnoj posudi i dokazao da se voda strujom razlaže samo na vodik i kisik. Iduće je godine nastavio pokušaje izdvajanja metala iz alkalija. Na platinsku pločicu, spojenu s negativnim polom baterije, stavio je komadić kalijeva hidroksida i dotaknuo platinskom iglom spojenom na pozitivni pol baterije. Navlažen vlagom iz zraka kalijev hidroksid je postao vodljiv i odmah se rastalio, a na platinskoj pločici izlučile su se kapljice rastaljenog metala. Neke su se kapljice odmah zapalile a neke samo pobijelile. Tako je Davy prvi elektrolizom dobio metalni kalij. Na isti je način postupio s natrijevim hidroksidom i dobio natrij. Sir Humphrey Davy smatra se utemeljiteljem elektrokemije. Elektrolizom vlažnih hidroksida zemnoalkalijskih metala, spojenih s pozitivnim polom, u dodiru s kapljicom žive spojenom s negativnim polom baterije proizveo je amalgame Mg, Ca, Sr, Ba. Iz nastalog amalgama živu je uklonio destilacijom i tako dobio male količine zemnoalkalijskih metala. God. 1810. dokazao da klor nije spoj (oksidirani klorovodik) nego kemijski element. God. 1816. pronašao rudarsku sigurnosnu svjetiljku. Da ne bi izazvala eksploziju plinova u rudnicima plamen joj je ograđen žičanom mrežicom tako da je temperatura plinova izvan mrežice bila niža od temperature paljenja.
8.2. Elektroliza
Pokus 8.2. Elektroliza i elektroliti
Vidi na internetu:
e-Kemija: Sikirica - Elektroliti
e-Kemija: Sikirica - Elektroliza otopina soli
e-Kemija: Sikirica - Galvanoplastika1
Tvari koje u rastaljenom stanju ili u otopini provode električnu struju nazivamo elektrolitima. Ugljeni štapići ili pločice od električki vodljivog materijala (redovito metala) uronjene u elektrolit nazivaju se elektrode. Sve zajedno naziva se elektrolizni članak. Elektroda na kojoj se događa redukcija naziva se katoda. Elektroda na kojoj se događa oksidacija naziva se anoda.
Slika 8.3. Elektrolizni članak. a) stanje prije elektrolize, b) tijekom elektrolize, c) nakon elektrolize.
Kad se u otopinu modre galice, tj. bakrova sulfata, urone elektrode od bakrene žice priključene na izvor istosmjerne struje, na elektrodama će doći do kemijskih reakcija. Na katodi, tj. elektrodi priključenoj na – pol izvora struje, ioni Cu2+(aq) reduciraju se u elementarni bakar, Cu(s).
Cu2+(aq) + 2 e− → Cu(s)
Istodobno, na anodi, tj. elektrodi priključenoj na + pol izvora struje, elementarni bakar oksidira se u bakrove ione, Cu2+(aq).
Cu(s) → Cu2+(aq) + 2 e−
Koliko se iona Cu2+(aq) na katodi reducira u elementarni bakar, istodobno se toliko atoma elementarnog bakra na anodi oksidira u ione Cu2+(aq). Stoga se koncentracija otopine elektrolita, modre galice, ne mijenja.
8.2.1. Faradayevi zakoni elektrolize
Davyjev učenik i nasljednik, Michael Faraday (1791. – 1867.), je rezultate pokusa elektrolize sažeo u dva zakona.

Slika 8.4. Michael Faraday (1791. – 1867.)
Slika izvor: Encyclopadia Britannica
Prvi Faradayev zakon
Masa tvari izlučene ili otopljene na elektrodama proporcionalna je električnom
naboju koji je prošao kroz elektrolizni članak.
Drugi Faradayev zakon
Ako
jednak električni naboj prođe kroz različite elektrolite, mase
tvari izlučenih ili otopljenih na elektrodama nalaze se u omjeru njihovih
ekvivalentnih masa.
Električni naboj mjeri se jedinicom kulon, nazvanoj u čast francuskog fizičara Coulomba. Simbol za jedinicu električnog naboja je C. Jedan kulon je električni naboj koji u jednoj sekundi prenese električna struja jakosti 1 A, stoga je 1 C = 1 A s. Prema tome, električni naboj, Q, koji prođe kroz elektrolizni članak jednak je umnošku jakosti struje, I, izražene jedinicom amper i vremena, t, izraženog u sekundama.
Q = I · t
Faradayevi zakone elektrolize proizlaze iz atomističke prirode tvari i elektriciteta. Primjerice, elektrolizom vodene otopine srebrova nitrata ioni Ag+(aq) reduciraju se na katodi prema jednadžbi:
Ag+(aq) + e − → Ag(s)
Za redukciju jednog iona Ag+(aq) potreban je jedan elektron. Razumije se, za redukciju jednog mola iona Ag+(aq) potreban je jedan mol, tj. 6,022 ·1023 elektrona. Taj će električni naboj izlučiti 107,9 g srebra. Dva puta veći električni naboj izlučit će dva puta veću masu srebra, a to je suština I. Faradayeva zakona.
Elektrolizom otopine modre galice ioni Cu2+(aq) reduciraju se na katodi prema jednadžbi:
˝ Cu2+(aq) + e− → ˝ Cu(s)
Iz jednadžbe reakcije proizlazi da će 1 mol elektrona reducirati ˝ mola iona Cu2+(aq), što znači da će se na katodi izlučiti ˝ mola atoma Cu, tj. 31,77 g bakra, a to je smisao II. Faradayeva zakona.

Slika 8.5. Netom izvađene katode iz ćelije za elektrolitičku rafinciju sirovog bakra.
Primjer 8.1. Metalurški dobiveni bakar sadržava niz primjesa (Ag, Au, Ni, Pb, Sb, As, Fe, Co i dr.). Za primjenu u elektrotehnici mora ga se rafinirati do 99,9-postotne čistoće elektrolizom otopine modre galice ugrijane na 60 °C. Anode se izrađuju lijevanjem sirovog 95―postotnog bakra. Kao katode rabe se tanki limovi od rafiniranog bakra. Jedan elektrolizer sadržava 16 paralelno spojenih katoda dimenzije 1m × 0,815 m. Gustoća katodne struje je 20 mA/cm2, a iskorištenje struje 95 %. Kolika je jakost struje koja teče kroz elektrolizer? Koliko dugo treba trajati elektroliza da se na svakoj katodi izluči 100 kg bakra?
Rješenje
Na 16 katoda izlučit će se 1600 kg bakra. Preračunajmo traženu masu bakra u množinu bakra:
n(Cu) = m(Cu) : M(Cu) = 1600 kg : 63,55 kg kmol−1 = 25,18 kmol
Za izlučivanje 1 mola atoma bakra potrebno je 2 mola elektrona. Uz iskorištenje struje od 95 % za izlučivanje 25,18 kmol bakra potreban broj elektrona, n(e−), je:
n(e−) = 2 × 25,18 kmol / 0,95 = 53,01 kmol
Kako je naboj jednog elektrona, e = 1,602·10−19 C, naboj 53,01 kmol elektrona je:
Q = 53,01 × 103 mol × 6,022× 1023 mol−1 × 1,602 × 10−19 C = 5,11 × 109 C
Za površinu, S, svih 16 katoda(obostrano) dobivamo:
S(katode) = 2 × 16 × 100 cm × 81,5 cm = 260 800 cm2
Zadana je gustoća struje, J = 20 mA cm−2 , pa za jakost struje, I, koja prolazi kroz elektrolizer dobivamo:
I = J × S = 20 mA cm−2 × 260 800 cm2 = 5216 A
Kako je 1 C = 1 A s, za vrijeme trajanja elektrolize dobivamo:
t = 5,11 × 109 A s / 5216 A = 979,8 × 103 s = 272 h ≈ 11,3 dana.
Količina elektrike koju nosi 1 mol elektrona naziva se Faradayevom konstantom, F.
F = NA × e
= 6,022 × 1023 mol−1 × 1,602 × 10−19 C
≈ 96 500 C mol−1
Prema tome, ako se tijekom elektrolize, ili neke druge elektrokemijske reakcije oslobodi ili veže količina elektrike od n mola, tad se ta količina elektrike može izraziti nabojem, Q.
Q = n · F
Slika 8.6. Serijski spoj elektrolizera
Primjer 8.2. Serijski su spojena dva elektrolizera. Prvi sadržava otopinu srebrova nitrata, AgNO3, a drugi otopinu niklova sulfata, NiSO4. Kroz elektrolizere je 5 minuta tekla struja nepoznate jakosti. Na katodi prvog elektrolizera izlučilo se 0,100 g srebra. Koliko se nikla izlučilo na katodi drugog elektrolizera? Kolika je bila prosječna jakost struje tijekom elektrolize?
Rješenje
Napišimo jednadžbe reakcija na katodama:
Ag+(aq) + e― → Ag(s)
½ Ni2+(aq) + e― → ½ Ni(s)
Mase različtih tvari izlučenih na katodama serijski spojenih elektrolizere odnose se kao njihove ekvivalentne mase (II Faradayev zakon).
Odavde proizlazi:
Naboj koji je prošao kroz elektrolizere izračunat ćemo iz mase izlučena srebra.
Elektroliza je trajala 5 min, tj. 300 s. Odavde proizlazi da je prosječna jakost struje bila:
8.2.2. Elektroliza vode
Pokus 8.3. Elektroliza vode
Vidi na internetu:
e-Kemija: Sikirica - Elektroliza vode
Elektrolizom vrlo čiste destilirane vode, primjerice u Hofmannovom aparatu s platinskim elektrodama, na katodi se izlučuje vodik a na anodi kisik. Volumen razvijena vodika dva puta je veći od volumena kisika. Na elektrodama se događaju sljedeće reakcije:
Katoda: 4 H2O(l) + 4 e− → 4 OH−(aq) + 2 H2(g) (redukcija)
Anoda: 2 H2O(l) ― 4 e− → 4 H+(aq) + O2(g) (oksidacija)
Nastali ioni H+(aq) i OH−(aq) odmah se spajaju u vodu. Zbog elektrolize neće okolina katode postati lužnata niti će okolina anode postati kisela. To je još 1806. dokazao H. Davy elektrolizom vrlo čiste prokuhane destilirane vode u zlatnoj posudi. (Prvu elektrolizu vode i elektrolizu uopće proveo je engleski kemičar William Nicholson 1800. godine.)

Slika 8.7. Hofmannov aparat
Voda vrlo slabo disocira, pa sadržava vrlo malo iona H+(aq) i OH−(aq). Stoga čista (destilirana) voda vrlo slabo provodi električnu struju, pa se prema specifičnom električnom otporu određuje čistoća voda (veći otpor – čišća voda). Naprotiv, otopina sumporne kiseline dobro provodi električnu struju jer je sumporna kiselina u razrijeđenoj vodenoj otopini praktično potpuno disocirana. Zato se u Hofmannovom aparatu elektrolizira voda zakiseljena sumpornom kiselinom. Sumporne kiseline je jak elektrolit i služi samo za prijenos električnog naboja kroz otopinu. Na elektrodama dolazi samo do redukcije i oksidacije molekula vode.
Pri malim gustoćama struje sulfatni ioni iz razrijeđene sumporne kiseline ne sudjeluju u kemijskim reakcijama na anodi. Naprotiv, elektrolizom hladne 50-postotne sumporne kiseline uz veliku gustoću struje, na anodi nastaje peroksodisumporna kiselina, H2S2O8. Zagrijavanjem peroksodisumporna kiselina se hidrolizira na sumpornu kiselinu i vodikov peroksid, H2O2. Ako se zagrijavanje izvodi pod sniženim tlakom („u vakuumu“), iz te smjese destilira vodikov peroksid.
8.2.3. Putovanje iona
Pokus 8.4. Putovanje iona
Vidi na internetu:
e-Kemija: Sikirica - Putovanje iona 1
e-Kemija: Sikirica - Putovanje iona 2
Tijekom elektrolize kationi uvijek putuju prema katodi, a anioni prema anodi. To znači da električni naboj u otopinama elektrolita istodobno prenose kationi i anioni. Koliko će električnog naboja prenijeti kationi, a koliko anioni ovisi o njihovoj brzini kretanja kroz elektrolit. Brzina kojom ioni putuju kroz elektrolit ovisi o veličini i naboju iona, kao i o broju molekula vode koje ion vuče sa sobom. Primjerice, u otopini natrijeva klorida imamo jednak broj iona Na+(aq) i iona Cl―(aq). No, ioni Cl―(aq) kreću se brže, pa prenesu više od polovine naboja kroz elektrolit.
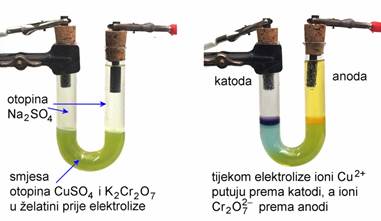
Slika 8.8. Putovanje iona u ovom je pokusu lako je uočljivo jer smo upotrijebili obojene ione Cu2+(aq) i Cr2O72―(aq)
Tijekom elektrolize dušične kiseline, ioni H3O+(aq) prelaze iz anodnog u katodni prostor, a ioni NO3―(aq) iz katodnog u anodni prostor. No, pokretljivost iona H3O+(aq) približno je 5 puta veća od pokretljivosti iona NO3―(aq). Stoga će na svakih približno 5 vodikovih iona koji prijeđu iz anodnog u katodni prostor, samo jedan nitratni ion prijeći iz katodnog u anodni prostor.
8.2.4. Elektroliza taline natrijeva klorida
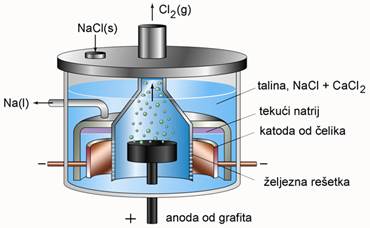
Slika 8.9. Shematski prikaz elektrolize taline natrijeva klorida.
Kristali čistoga suhoga natrijeva klorida ne provode električnu struju, jer su ioni Na+ i Cl― čvrsto uglavljeni na svojim mjestima u kristalnoj strukturi te ne mogu napustiti ili zamijeniti svoja mjesta. Stoga je čist i suh natrijev klorid izolator. No, talina natrijeva klorida (talište 801 °C), dobro provodi električnu struju jer se pod utjecajem električnog polja ioni Na+(l) i Cl−(l) mogu kretati neovisno jedan od drugoga.
Na elektrodama se događaju sljedeće reakcije:
Katoda: 2 Na+(l) + 2 e− → 2 Na(l) (redukcija)
Anoda: 2 Cl−(l) → Cl2(g) + 2 e− (oksidacija)
Redukcija se ne može dogoditi sama za sebe. Dok se jedna tvar reducira na katodi, istodobno se mora neka druga tvar oksidirati na anodi. Oksidacija i redukcija su nerazdvojno povezane, jer elektroni ne mogu ni nastati ni nestati.
Elektroliza taline natrijeva klorida najvažniji je industrijski postupak dobivanja natrija i klora. Obje tvari se naveliko rabe za sinteze u kemijskoj industriji. Natrij je srebrnobijeli metal koji se tali pri 98 °C. Klor je žutozeleni otrovan plin. Natrijevom kloridu se prije taljenja dodaje kalcijev klorid (CaCl2) kako bi se snizilo talište elektrolita (585 – 595 oC).
8.2.5. Elektroliza vodene otopine natrijeva klorida
Pokus 8.5. Elektroliza vodene otopine natrijeva
klorida
Vidi na internetu:
e-Kemija: Sikirica - Elektroliza NaCl
Pri elektrolizi vodene otopine natrijeva klorida ne će se na katodi izlučivati elementarni natrij, već vodik. Za izlučivanje natrija potrebno je utrošiti mnogo više energije nego za izlučivanje vodika iz vode. Stoga se u konkurenciji više mogućih kemijskih reakcija na elektrodama elektroliznog članka događa ona elektrokemijska reakcija koja zahtjeva manji utrošak energije.
Slično se događa na anodi. Za izlučivanje elementarnog klora potrebno je utrošiti nešto malo više energije nego za izlučivanje kisika iz vode. Te dvije kemijske reakcije konkuriraju jedna drugoj pa se pri elektrolizi vodene otopine natrijeva klorida na anodi istodobno izlučuju klor i kisik. Ipak, možemo uzeti da se pri elektrolizi koncentrirane otopine natrijeva klorida u vodi na elektrodama događaju sljedeće reakcije:
Katoda: 2 H2O(l) + 2 e− → 2 OH−(aq) + H2(g) (redukcija)
Anoda: 2 Cl−(aq) → Cl2(g) + 2 e− (oksidacija)
Na ovim se kemijskim reakcijama temelji industrijska proizvodnja natrijeva hidroksida i elementarnog klora. Vodik koji koji pritom nastaje također ima mnogobrojne primjene. Može se odmah spaliti s klorom i dobiti klorovodik, a adicijom klorovodika na etin dobiti vinil-klorid, CH2=CHCl, monomer, koji je pak polazna tvar za dobivanje poli(vinil-klorida) itd.
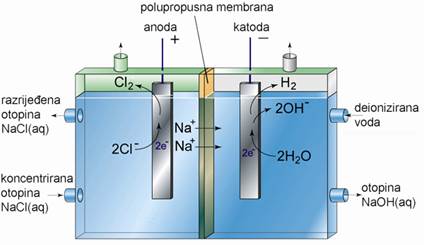
Slika 8.10. Shematski prikaz postupka elektrolize otopine natrijeva klorida s polupropusnom membranom.
Tijekom elektrolize koncentrirane otopine natrijeva klorida natrijevi ioni iz anodnog prostora prolaze kroz polupropusnu membranu u katodni prostor i tamo neutraliziraju negativni električni naboj novonastalih iona OH−(aq). Tako okolina katode postaje otopina natrijeva hidroksida. Istodobno se kloridni ioni na anodi oksidiraju u elementarni klor. On se slabo otapa u koncentriranoj otopini natrijeva klorida, pa se izluči kao žutozeleni plin karakterističnog oštrog mirisa. (Sjetite se mirisa klorirane vode u bazenima za kupanje.)
Natrijev hidroksid ima mnogobrojne primjene te je važan proizvod koji se dobiva upravo elektrolizom koncentrirane otopine natrijeva klorida. Naveliko se rabi u proizvodnji sapuna, sredstava za čišćenje, dezinficijensa (natrijev hipoklorit), papira, stakla, keramike, u proizvodnji umjetnih masa, eksploziva, tekstilnoj, prehrambenoj, farmaceutskoj, kemijskoj industriji i dr.
8.2.6. Anodna oksidacija aluminija
Pokus 8.6. Eloksiranje
Vidi na internetu:
e-Kemija: Sikirica - Eloksiranje
Aluminij se na zraku spontano prevlači zaštitnim slojem aluminijeva oksida koji ga štiti od daljnje oksidacije. Treba paziti da predmeti od aluminija ne dođu u doticaj sa živom ili njezinim spojevima, jer živa s aluminijem čini amalgam te razara zaštitni oksidni sloj. (Vidi na internetu: NileRed - Aluminum and Mercury). Nadalje, aluminij se otapa u lužinama i kiselinama, osim dušične kiseline koja oksidira površinu aluminija i tako podebljava oksidni sloj.
Danas se svi uporabni predmeti od aluminija podvrgavaju eloksiranju, tj. električnoj oksidaciji površine. Tim se postupkom predmeti od aluminija štite od habanja i korozije te ujedno dobivaju ljepši izgled površine. Eloksiranje aluminija provodi se industrijski. U Hrvatskoj postoji desetak poduzeća koja se bave eloksiranjem aluminijskih profila od kojih se izrađuju aluminijski prozori, vrata i dr.
Predmeti od aluminija najprije se čiste vrućom otopinom NaOH i detergenta.
Al2O3(s) + 2 NaOH(aq) + 3 H2O(l) → 2 NaAl(OH)4 (aq)
2 Al(s) + 2 NaOH(aq) + 6 H2O(l) → 2NaAl(OH) 4(aq) + 3 H2(g)
Pritom na površinu izađu čestice bakra kojim se aluminij najčešće legira radi povećanja čvrstoće i tvrdoće. (Vidi: duraluminij.) Odmašćeni predmeti potom se ispiru vodom te potapaju u otopinu razrijeđene dušične kiseline. Bakar i drugi metali otapaju se u razrijeđenoj dušičnoj kiselini.
3 Cu + 8 HNO3 → 3 Cu(NO3)2 + 2 NO + 4 H2O
Ostaci dušične kiseline uklanjaju se ispiranjem u tekućoj vodi. Tako pripremljeni predmeti urone se u elektrolizer s hladnom 15-postotnom otopinom sumporne kiseline te priključe se na + pol izvora struje. Pritom dolazi do sljedećih reakcija:
Katoda: 6 H2O + 6 e― → 3 H2 + 6 OH―
Anoda: 2 Al + 3 H2O → Al2O3 + 6 H+ + 6 e―
―――――――――――――――――――――――――――――――――――――――――――――
Ukupno: 2 Al + 3 H2O → Al2O3 + 3 H2
Osim oksidacije aluminija, istodobno se u manjoj mjeri događa i elektroliza vode. Stoga se na anodi može uočiti i razvijanje kisika. Dobiveni sloj aluminijeva oksida je porozan pa se nakon ispiranja tekućom vodom eloksirani predmeti mogu uroniti u kipuću otopinu organske boje. Boja se apsorbira u poroznom sloju aluminijeva oksida. Pritom reakcijom s kipućom vodom nastaje mineral boehmit, AlO(OH), koji ima veći volumen od aluminijeva oksida, pa se pore zatvore.
Al2O3 + 3 H2O → 2 AlO(OH)
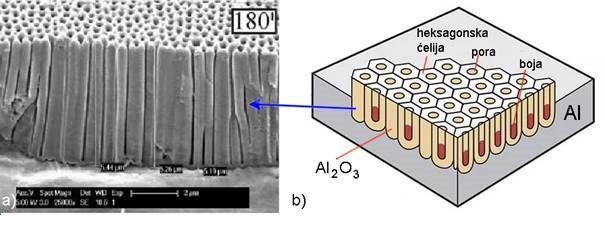
Slika 8.11. a) Poprečni
presjek površine eloksiranog aluminija promatran skenirajućim elektronskim
mikroskopom. b) Idealizirani izgled površine eloksiranog aluminija.
Slika a) izvor: semanticscholar.org
Slika b) izvor: electro-polish.com
Zadaci i teme za vlastite aktivnosti i samoobrazovanje
Dobivanje aluminija elektrolizom otopine glinice u kriolitu.
Emisija fluorovodika pri elektrolizi glinice.
Dobivanje i rafiniranje metala postupkom elektrolize (Al, Mg, Ti, Be, Ca, Na, Li, Ga. In, Zn, Cu …)
Hidrometalurški postupak dobivanja cinka.
Elektroplatiranje cinkom, niklom, kromom, zlatom, srebrom …
e-Kemija: Sikirica - Galvanoplastika 1
e-Kemija: Sikirica - Galvanoplastika 2
Izradite plakat, PowerPoint prezentaciju, snimite video, održite predavanje u razredu, organizirajte raspravu ili pišite u školskom listu o elektrolitičkim postupcima dobivanja metala.
8.3. Primarni galvanski članci ili baterije
Pokus 8.7. Cementacija bakra
Pribor i kemikalije: čaša od 100 mL, komadić željeznog lima ili željezni čavao, epruveta, otopina bakrova(II) sulfata, cink u prahu.
Postupak:
- Ulijte u čašu nekoliko mL otopine modre galice i jako razrijedite destiliranom vodom.
- U razrijeđenu otopinu u čaši uronite komadić sjajnog željeznog lima ili nov željezni čavao.
- Nakon nekoliko minuta izvadite predmet iz otopine modre galice i uočite izlučeni bakar na površini željeznog predmeta. Taj se postupak naziva cementacija. Napišite jednadžbu reakcije.
- Ulijte u epruvetu 5 - 6 mL koncentrirane otopine modre galice. Rukom osjetite ili termometrom izmjerite temperaturu otopine.
- U epruvetu s otopinom modre galice dodajte žličicu cinka u prahu, Snažno promućkajte i uvjerite se je li došlo do promjene temperature reakcijske smjese. Pronađite podatak o reakcijskoj entalpiji i napišite jednadžbu reakcije.
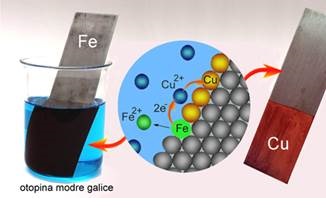
Slika 8.12. Cementacija bakra strugotinama željeza rabi se za pročišćavanje industrijskih otpadnih voda.
Kad se u vro razrijeđenu otopinu bakrova sulfata uroni cinčana ili željezna pločica na njezinoj se površini izlučiti elementarni bakar. Bakrovi ioni, Cu2+(aq), reduciraju se cinkom u elementarni bakar, Cu(s). Istodobno se cink oksidirao i prešao u otopinu u obliku iona Zn2+(aq).
Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s) DH = ―216 kJ mol−1
Toplina oslobođena gornjom reakcijom jedva da se može negdje praktično iskoristiti. No, gotovo sva energija koja se oslobodi ovom reakcijom može se dobiti u obliku električne energije tako da se načini galvanski članak.
8.3.1. Daniellov članak
John Frederic Daniell (1790. –1845.) engleski kemičar i fizičar, elektrokemijski članak konstruirao je 1836. godine.
U posebno impregniranoj cilindričnoj posudi od porozne pečene gline nalazila se otopina sumporne kiseline, koja je kasnije, 1853., zamijenjena otopinom cinkova sulfta, ZnSO4. U tu je otopinu uronjena elektroda, štapić ili pločica od cinka. Keramički lončić s otopinom cinkova sulfata i elektrodom od cinka smješten je u sredinu bakrene posude s otopinom bakrova sulfata, CuSO4.
Polupropusna glinena dijafragma omogućuje prolaz ionima SO42-(aq), H+(aq) i OH−(aq), ali sprječava prolaz ionima Cu2+(aq) i Zn2+(aq).
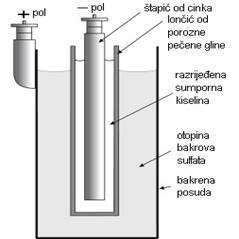
Slika 8.13. Daniellov galvanski članak.
Kad se bakrova i cinkova elektroda međusobno spoje metalnim vodičem, kroz njega poteče struja. Pritom se cink oksidira u ione Zn2+(aq), a bakrovi ioni Cu2+(aq) reduciraju u elementarni bakar. Na elektrodama galvanskog članka događaju se sljedeće reakcije:
anoda Zn(s) → Zn2+(aq) + 2e− (oksidacija)
katoda Cu2+(aq) + 2e− → Cu(s) (redukcija)
Reakcija članka je:
Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s)
Elektroni oslobođeni oksidacijom cinka na anodi putuju metalnim vodičem do katode. Istodobno na elektrodi od bakra dolazi do redukcije iona Cu2+(aq) u metalni bakar. Između elektroda Daniellova članka postoji razlika potencijala od 1,10 V. Struja koja teče vodičem pri ovoj razlici potencijala može vršiti koristan rad, npr. pokretati električni sat, usijati nit "žaruljice za baterije" itd. Daniellovi članci bili su popularni u 19. stoljeću kao izvor električne struje, posebno u telegrafiji.
Prema dogovoru dijagram Daniellova galvanskog članka treba pisati ovako:
Zn(s)│Zn2+(aq) ⃒ ⃒ Cu2+(aq)│Cu(s)
Jedna vertikalna crta označuje granicu između krute elektrode i elektrolita. Dvije vertikalne crte označuju polupropusnu dijafragmu, granicu otopina dviju vrsta iona.
Na lijevu stranu dolazi ona elektroda na kojoj se događa oksidacija, a na desnu stranu ona elektroda na kojoj se događa redukcija, kako bi struja elektrona tekla od lijeve na desnu stranu.
Svaka se redoks reakcija može, teoretski, iskoristiti za dobivanje električne struje u galvanskom članku. Druga je pak stvar prakse, praktičnosti, jer materijali za izradu baterije moraju biti jeftini, baterija mora imati velik kapacitet, a usto treba biti bezopasna i jednostavna za upotrebu. Kao primjer loše baterije navodim Bunsenov članak, koji je imao elektrode od ugljena i cinka, dok je kao elektrolit služila vrlo korozivna kromsumporna kiselina. Baterija je imala uređaj pokretan utegom, sličan satnom mehanizmu, koji je povremeno potresao elektrode kako bi se uklonio talog što se tijekom rada na njima nakupljao. Sušta suprotnost Bunsenovom članku je Lechlanchéov članak, koji je tema sljedećeg odlomka.
8.3.2. Lechlanchéov članak
Lechlanchéov članak sastoji se od čašice od cinka koja služi kao anoda. Unutar čašice nalazi se vrećica od posebne vrste papira koja služi kao separator i sprječava dodir katode i anode. Unutar vrećice smještena je katoda s ugljenim štapićem u sredini. Ugljeni štapić je obložen smjesom grafita, manganova dioksida, MnO2 i elektrolita. Kao elektrolit služi pasta od amonijeva klorida, NH4Cl, cinkova klorida, ZnCl2 i malo vode.
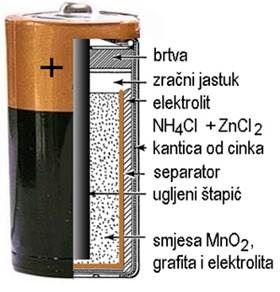
Slika 8.14. Shematski prikaz građe Lechlanché-ova članka
Kad baterija daje struju na elektrodama se događaju sljedeće elektrokemijske reakcije:
Anoda (oksidacija, − pol): Zn(s) → Zn2+(aq) + 2e−
Katoda (redukcija, + pol): 2 MnO2(s) + 2 H2O + 2e− → 2 MnO(OH)(s) + 2 OH−(aq)
Nastali produkti međusobno reagiraju u otopini amonijeva klorida pri čemu najčešće nastaje slabo topljiv kompleksni spoj [Zn(NH3)2Cl2].
Zn2+(aq) + 2 OH−(aq) + 2 NH4+(aq) + 2 Cl− (aq) → [Zn(NH3)2Cl2] + 2 H2O
Kad Lechlanché-ov članak daje struju cinčana čašica se troši, pa se poveća koncentracija cinkova klorida u elektrolitu. Cinkov klorid je jako higroskopan pa upija vlagu iz zraka. Zbog toga iz istrošene baterije curi elektrolit. To može nanijeti velike štete prijenosnim elektroničkim uređajima. Zato istrošene baterije treba odmah izvaditi iz radioaparata ili drugih uređaja, pogotovo kad se prijenosni radioaparat ili drugi elektronički uređaj ne će dulje koristiti.
8.3.3. Alkalne baterije
Napon suhe baterije ili Lechlanché-ova članka je 1,5 V. Zbog velikog unutarnjeg otpora obična suha baterija nije najbolje rješenje za pogon igračaka i sl. Zato je razvijena tzv. alkalna baterija. To je samo jedna od varijanti Lechlanché-ova članka. U čeličnu čašicu uprešana je smjesa grafita i manganova dioksida tako da čini plašt debelih stijenki. U šupljini u središtu nalazi se cink u prahu smješten u rupičastu cjevčicu od cinka. Katoda i anoda odvojene su polupropusnom membranom od posebne vrste papira. Elektrolit je koncentrirana otopina kalijeva hidroksida. Zbog malog unutarnjeg otpora alkalne baterije mogu dati struju veće jakosti, a traju dulje zbog veće količine cinka i manganova dioksida upakiranih u bateriju. Kad članak daje struju na elektrodama se događaju sljedeće reakcije:
Anoda (oksidacija, − pol) Zn(s) → Zn2+(aq) + 2e−
Katoda (redukcija, + pol) 2 MnO2(s) + 2 H2O + 2e− → 2 MnO(OH)(s) + 2 OH−(aq)
Ukupna reakcija članka je:
Zn(s) + 2 MnO2(s) +2 OH−(aq) + 2 H2O → 2 MnO(OH)(s) + [Zn(OH)4]2―(aq)
Proučite konstrukciju suvremene alkalne baterije, dobro zaštićene od curenja elektrolita.
8.3.4. Dugmaste Li – MnO2 baterije
Litij – mangan dioksid dugmaste baterije, napona 3 V, najčešće su baterija za jednokratnu upotrebu. Ekonomične su, sigurne za upotrebu, imaju veliku gustoću energije, dug vijek trajanja, stalan napon pražnjenja te pouzdano brtvljenje tako da ne dolazi do curenja elektrolita.
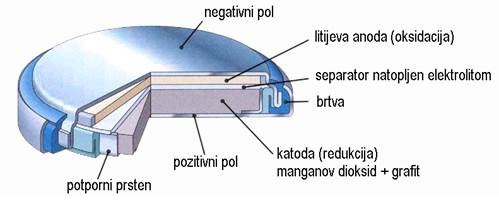
Slika 8.15. Građa tipične Li-MnO2 dugmaste baterije.
Katoda se sastoji od smjesa manganova dioksida, grafita i veziva. Anoda je litij u prahu ili litijeva folija. Kao elektrolit rabi se litijev perklorat, LiClO4, u propilen karbonatu. Na elektrodama se događaju sljedeće reakcije:
Anoda: Li → Li+ + e―
Katoda: MnIVO2 + Li+ + e− → LiMnIIIO2
Zadaci i teme za vlastite aktivnosti i samoobrazovanje
Upoznajte građu i kemijske reakcije koje se događaju na elektrodama drugih vrsta primarnih galvanskih članaka (jednokratnih baterija koje se ne mogu puniti):
N. Raos, Odavna poznati metal našao je svoju primjernu u cink-zrak bateriji, Bug-online, 23-07-2022.
Srebrne ili srebrov oksid baterije.
Živine ili živa(II) oksid baterije
Izradite plakat, PowerPoint prezentaciju, snimite video, održite predavanje u razredu, organizirajte raspravu ili pišite u školskom listu o primarnim galvanskim člancima.
8.4. Sekundarni galvanski članci ili akumulatori
Sekundarni galvanski članci mogu se ponovno puniti pa su stoga mnogo jeftiniji izvor istosmjerne struje stalnog napona. Oni akumuliraju energiju, stoga su dobili naziv akumulatori.
8.4.1. Olovni akumulator
Slika 8.16. Razmještaj elektroda i separatora unutar jedne ćelije olovnog akumulatora.
Anoda olovnog akumulatoru je spužvasto olovo, a katoda olovov dioksid, PbO2. Spužvasto olovo i olovov dioksid nalaze se u rešetki od slitine olova s antimonom i kalcijem. Čisto olovo je jako mekano, a legiranjem s nekoliko postotaka antimona i kalcija poveća mu se tvrdoća i čvrstoća. Elektrolit je sumporna kiselina, g(H2SO4) = 400 g L−1. Ploče su složene u pakete tako da se između "negativnih" i "pozitivnih" ploča nalazi separator od mikroporozne plastike. Kapacitet akumulatora ovisi o broju ploča u svakoj ćeliji. Automobilski olovni akumulator najčešće se sastoji se od šest jednakih ćelija spojenih u seriju. Svaka ćelija daje napon 2 V pa je ukupan napon akumulatora 12 V.
Na elektrodama olovnog akumulatora događaju se sljedeće reakcije:
pražnjenje
− pol Pb(s) + HSO4−(aq) ⇄ PbSO4(s) + H+(aq) + 2e−
punjenje
pražnjenje
+ pol PbO2(s) + 3H+(aq) + HSO4−(aq) + 2e− ⇄ PbSO4(s) + 2 H2O(l)
punjenje
Iz jednadžbi reakcija vidimo da se tijekom rada akumulatora troši sumporna kiselina, a unutar poroznih ploča nastaje voda. U zimskim danima, kad je temperatura akumulatora niska, sumporna kiselina sporije difundira iz okoline u unutrašnjost ploča. Zato pri pokretanju automobilskog motora zimi, ako motor odmah ne upali, prije narednog "paljenja motora" treba pričekati nekoliko minuta dok se ne izjednači koncentracija sumporne kiseline unutar ploča s onom u okolini. Osim toga, hladna i razrijeđena sumporna kiselina slabije provodi električnu struju pa unutarnji otpor akumulatora poraste. Zato se smanji napon na polovima akumulatora pa se elektropokretač (anlasser) okreće sporije a svjećice bacaju slabiju iskru. Uzastopnim bezuspješnim pokušajima "paljenja motora" akumulator će se brzo isprazniti.
Akumulatori se pune tako da se plus pol akumulatora spoji na plus pol, a minus pol akumulatora na minus pol izvora istosmjerne struje. Struja punjenja treba biti prilagođena kapacitetu akumulatora, tako da se akumulator napuni za 10 sati. Primjerice, akumulator kapaciteta 60 A h (amper sati) treba puniti strujom jakosti 6 A.
U suvremenim akumulatorima elektrolit je silika-gel natopljen sumpornom kiselinom. Takav se akumulator može upotrijebiti u svakom položaju bez opasnosti da elektrolit iscuri. Osim toga svaka ćelija ima sigunosni ventil kojim se sprječava porast tlaka tijekom punjenja.
Druga varijanta suvremenih akumulatora umjesto poroznih PVC ili poletenskih separatora sadržava separatore od staklenih mikrovlakna (stakleni mat) natopljenih elektrolitom. Time se smanjuje unutarnji otpor i povećava kapacitet akumulatora.
Ako automobil ostavite dulje vrijeme u garaži, akumulator će se sam od sebe isprazniti, a ploče će se sulfatizirati, tj. prijeći u olovov sulfat. Takav akumulator teško ćete „vratiti u život“. Stoga svaka 3 do 4 mjeseca morate akumulator ponovo napuniti. Do samopražnjenja akumulatora dolazi zbog nečistoća sadržanih u elektrolitu ili pločama akumulatora. Primjerice, ioni Fe2+(aq) oksidiraju se olovovim dioksidom na pozitivnim pločama u ione Fe3+(aq). Oni pak difuzijom dospiju na negativne ploče gdje se olovom reduciraju u ione Fe2+(aq). Proces se ponavlja, a ploče se postupno sulfatiziraju. Akumulator nikad nemojte isprazniti „do kraja“, jer će to također dovesti do sulfatiziranja ploča.
8.4.2. Nikal-metalhidrid (Ni-MH) baterije
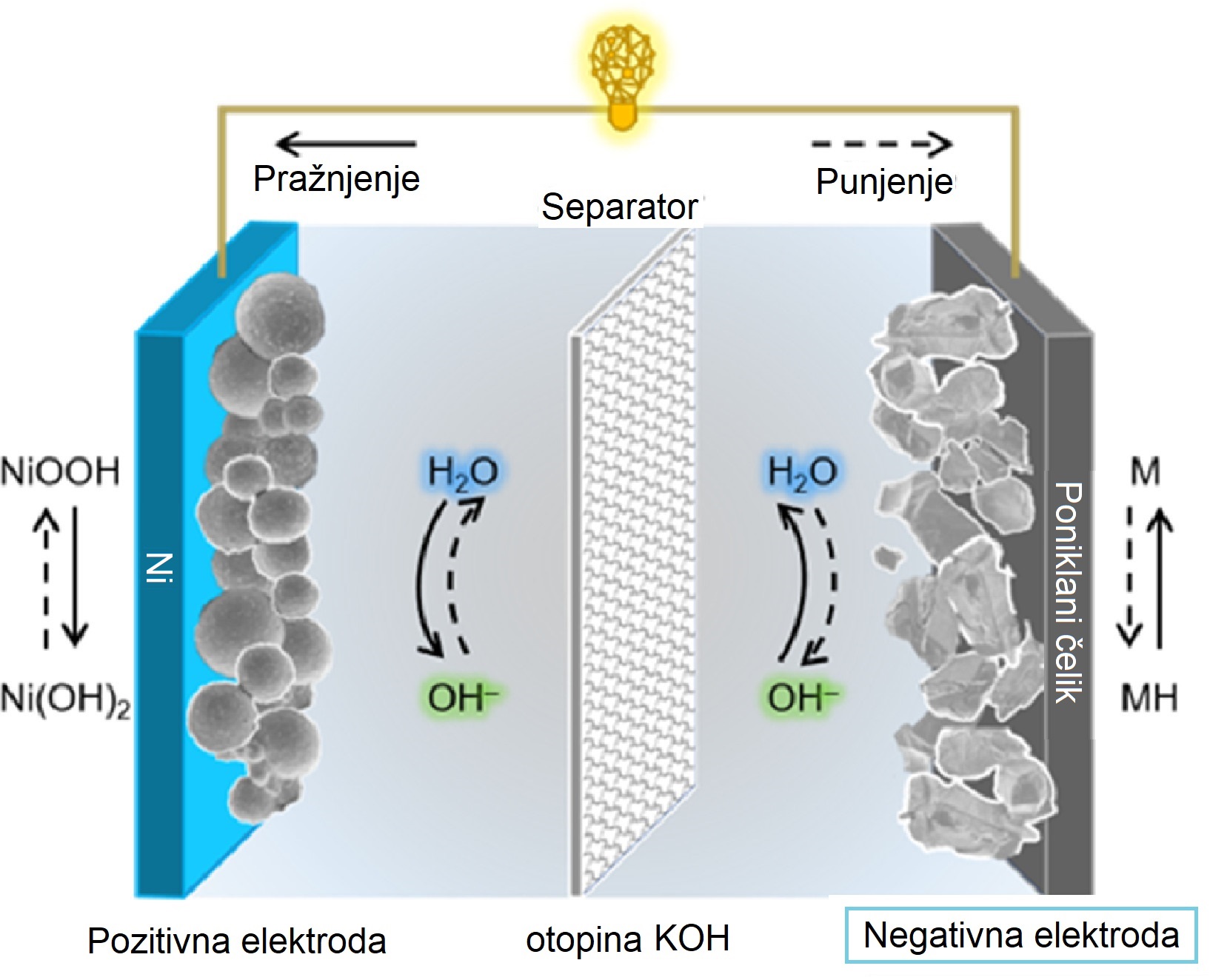
Slika 8.17. Shematski prikaz
nikal-metalhidrid baterije.
Izvor: Journal of Magnesium and Alloys
Prve praktično upotrebljive punjive nikal-metalhidrid baterije (akumulatori) razvijene su 1980-ih godina. U nikal-metalhidrid baterijama negativna elektroda je intermetalni spoj LaNi5. Ovaj intermetalni spoj željno upija vodik. Atomi lantana mnogo su veći od atoma nikla pa se u kristalnoj strukturi ne mogu složiti na najgušći mogući način. Stoga u kristalnoj strukturi LaNi5 nastaju praznine u koje se mogu smjestiti mali atomi vodika. Na jednu formulsku jedinku LaNi5 može doći najviše 6 atoma vodika što odgovara formuli LaNi5H6.
Na elektrodama se događaju sljedeće reakcije:
pražnjenje
Elektroda od nikla: NiO(OH)(s) + H2O + e− ⇄ Ni(OH)2(s) + OH−(aq)
punjenje
pražnjenje
Metal-hidridna elektroda: MH(s) + OH−(aq) ⇄ M(s) + H2O(l) + e−
punjenje
Elektrolit je otopina kalijeva hidroksida. Napon ove baterije je 1,2 V. Umjesto čistoga lantana u praksi se rabi prirodna smjesa lantanoida.
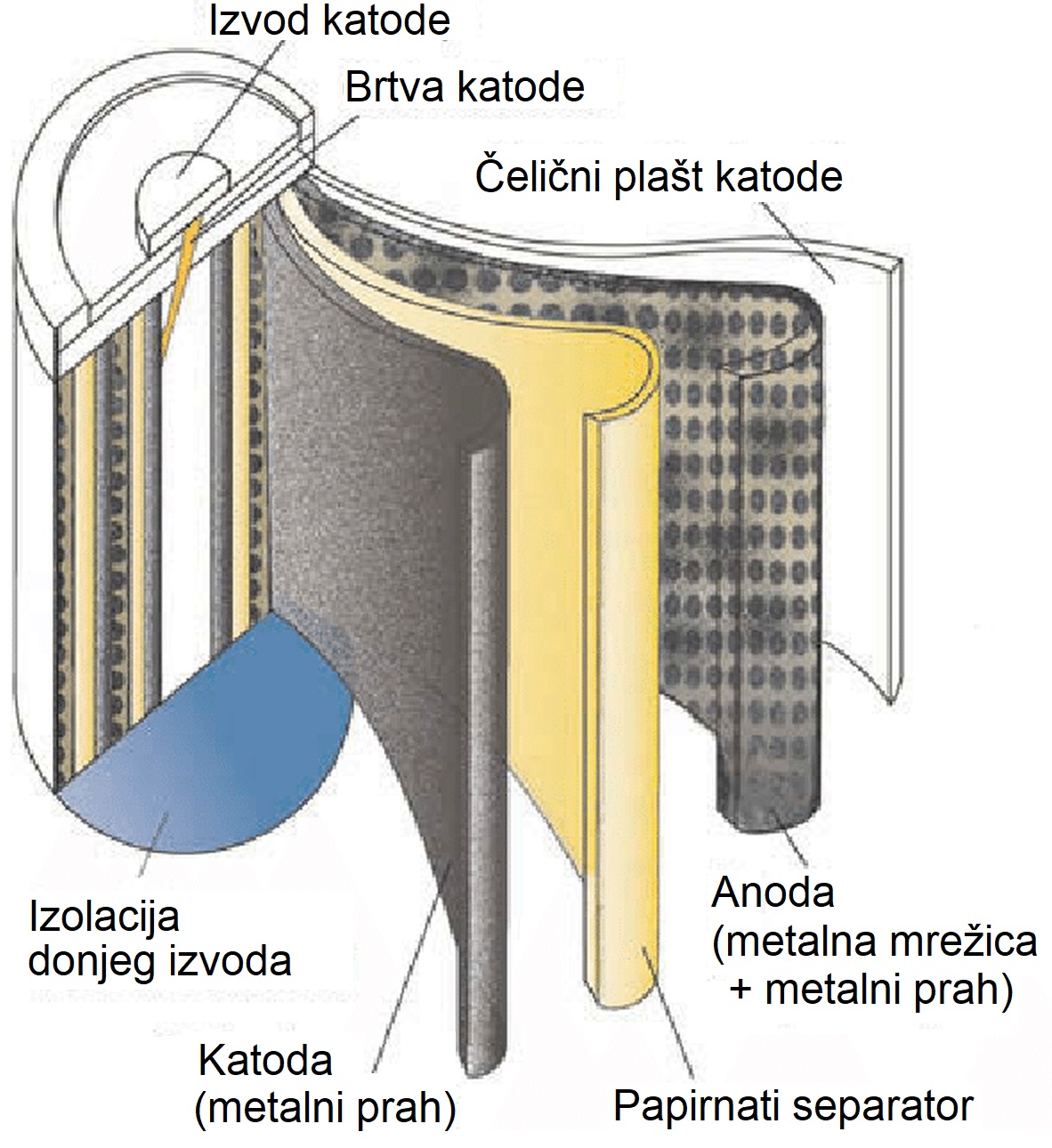
Slika 8.18. Presjek kroz Ni-MH bateriju.
Izvor: ResearchGate
8.4.3. Litij-ionske baterije
Vidi na internetu:
e-lyte - The working principle of thelithium-ion-battery
Suvremeni izvori istosmjerne struje su litij-ionske i litij-polimer baterije. Vrlo su slične. Bitnu razliku čini elektrolit. U Li-ionskim baterijama rabi se tekući elektrolit, LiPF6 ili LiBF4 u organskom otapalu, tj. smjesi etilen karbonata, (CH2O)2CO, i dietil karbonata (DMC/DEC)). Zbog sadržaja organskog otapala Li-ionske baterije su zapaljive.
U Li-polimer baterijama rabe se gel polimerni elektroliti na bazi poli(viniliden fluorid)-a (PVdF), poli(viniliden fluorid-heksafluoro propilen)-a (PVdF-HFP) i dr. Općenito, gel polimerni elektroliti nisu tekuće niti krute membrane, ali su vodljivi za ione Li+ poput tekućih elektrolita. Li-polimer baterije ne sadržavaju organska otapala, stoga su sigurnije.
Negativni pol ovog galvanskog članka je grafit u kojega su interkalirani (lat. intercalare = umetnuti) atomi litija. Grafit ima slojevitu strukturu. Razmak između slojeva ugljikovih atoma u grafitu tako je velik da se između ugljikovih slojeva mogu ugraditi atomi litija. Na 6 atoma ugljika može se ugraditi najviše jedan atom litija. Praktično se može dobiti Li0,9C6.
Pozitivni pol članka je LixMn2O4 koji također ima slojevitu strukturu (spinel). U nekim se Li-polimer baterijama umjesto LiMn2O4, za materijal katode koristi LiCoO2, Li(NiCoMn)O2, Li(NiCoAl)O2 ili LiFePO4. Bez obzira na njezin sastav, na katodi se uvijek događaju iste kemijske reakcije; oksidacija i redukcije kobalta, mangana ili željeza.
Na elektrodama se događaju sljedeće reakcije:
pražnjenje
− pol članka LiyC6 ⇄ C6 + y Li+ + y e−
punjenje
pražnjenje
+ pol članka LixMn2O4 + y Li+ + y e− ⇄ Lix+yMn2O4
punjenje
Tijekom punjenja Lix+yMn2O4 se oksidira u LixMn2O4. Pritom ioni Li+ prelaze u elektrolit, putuju kroz polupropusni separator i na grafitnoj se elektrodi reduciraju u metalni litij koji se ugrađuje u slojevitu strukturu grafita. Polupropusni separator sprječava „kratki spoj“ katode i anode.
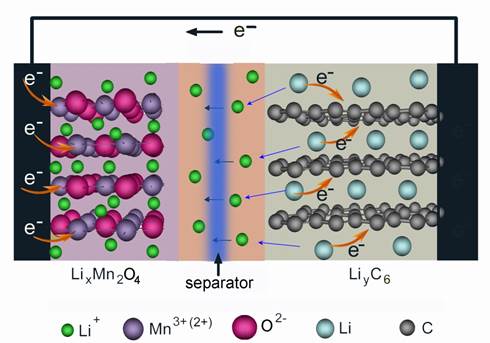
Slika 8.19. Shematski prikaz pražnjenja litij-ionske baterije.
Pri pražnjenju litij se na grafitnoj elektrodi oksidira. Elektroni metalnim vodičem putuju od grafitne elektrode prema elektrodi od LixMn2O4. Istodobno ioni Li+ putuju kroz gel polimerni elektrolit od grafitne prema LixMn2O4 elektrodi. Pritom se LixMn2O4 reducira u Lix+yMn2O4. Oksidacija i redukcija su nerazdvojne i događaju se istodobno.
Dok daje struju napon ovog galvanskog članka je 3,6 V. Baterija ima ugrađen elektronički sklop za sprječavanje kratkog spoja i punjenja prejakom strujom. Pri punjenju vršni napon ne smije biti veći od 4,2 V. Nije dobro već napunjene Li-ion ili Li-polimer baterije stalno „držati pod naponom“. Nikad nemojte Li-ion ili Li-polimer baterije isprazniti ni puniti do kraja.
Zadaci i teme za vlastite aktivnosti i samoobrazovanje
Upoznajte Ni-Cd baterije: struktura, reakcije na elektrodama, elektrolit, ekologija i dr.
Ne mučite se otvaranjem Li-polimer baterije. To su već učinili. Pogledajte OVDJE.
Kako „rade“ Li-ion i Li-polimer baterije doznajte OVDJE , OVDJE i OVDJE.
Upoznajte tehnologiju Li-polimer baterija tako da u tražilicu upišete:
Introduction to Lithium Polymer Battery Technology – Jauch
Upoznajte princip rada i reakcije na elektrodama gorivog članka vodik – kisik.
Izradite plakat, PowerPoint prezentaciju, snimite video, održite predavanje u razredu, organizirajte raspravu ili pišite u školskom listu o sekundarnim galvanskim člancima.
8.5. Elektrodni potencijali
Vidi na internetu: e-Kemija: Sikirica - Elektrodni potencijali
Svi galvanski
članci sadržavaju jednu elektrodu načinjenu od tvari koja je jak
oksidans i drugu elektrodu načinjenu od tvari koja je jak reducens.
Između elektroda se nalazi elektrolit kroz koji električni naboj
prenose ioni.
Kemijske reakcije koje se događaju u galvanskim člancima uvijek su reakcije oksidacije
i redukcije. Svaki galvanski članak možemo rastaviti na dva
polučlanka i zasebno razmatrati reakcije na elektrodama. Pripremimo
Daniellov članak, kao na slici 8.20. Kad se elektrode spoje metalnim
vodičem na elektrodama se istodobno događaju reakcije oksidacije i
redukcije. U lijevo prikazanom polučlanku elementarni cink, Zn(s), se
oksidira u ione Zn2+(aq) prema jednadžbi:
Zn(s) → Zn2+(aq) + 2 e− oksidacija (lijeva elektroda - anoda)
Zbog razlike električnih potencijala lijevo i desno prikazanih polučlanaka, elektroni teku od anode prema katodi, tj. elektrodi od bakra uronjenoj u otopinu bakrova sulfata. Stoga na katodi istodobno dolazi do redukcije iona Cu2+(aq) u elementarni bakar, Cu(s), prema jednadžbi:.
Cu2+(aq) + 2 e− → Cu(s) redukcija (desna elektroda - katoda)
Strujni krug se zatvara putem elektrolita. Naime kroz otopinu električni naboj prenose ioni. Dio naboja prenesu kationi, a dio anioni. Anioni SO42-(aq) kroz slani most putuju prema anodi. Istodobno ioni H+(aq) kroz slani most putuju prema katodi, tj. iz otopine lijevo prikazanog polučlanka u otopinu desno prikazanog polučlanka. No, ioni H+(aq) manji su i pokretljiviji od iona SO42-(aq), stoga će oni kroz otopinu prenijeti veći dio električnog naboja.
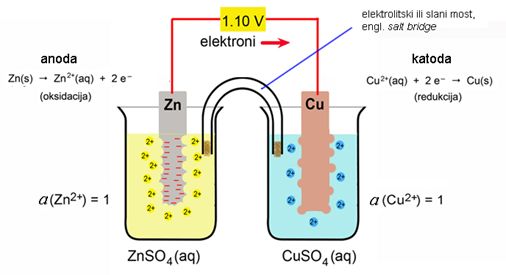
Slika 8.20. Daniellov članak. Kad se otopine elektrolita spoje elektrolitskim ili slanim mostom, a elektrode spoje vodičem, zbog razlike električnih potencijala poteče električna struja. Slani most sprječava miješanje elektrolita, ali omogućuje ionima prijenos električnog naboja. U lijevo prikazanom polučlanku elementarni cink, Zn(s), se oksidira u ione Zn2+(aq). U desno prikazanom polučlanku ioni Cu2+(aq) reduciraju se u elementarni bakar.
Ako su aktiviteti iona Zn2+(aq) i Cu2+(aq) u otopinama elektrolita bili jednaki jedan, tad će razlika potencijala cinkove i bakrene elektrode iznositi 1,10 V. Razlika potencijala između elektroda galvanskog članka naziva se elektromotorna sila članka, EMF (engl. electromotive force). Mjeri se voltmetrom uz uvjet da struja koja teče člankom teži k nuli. Suvremeni digitalni voltmetri omogućuju nam da i u školskim uvjetima mjerimo elektromotornu silu galvanskih članaka. Unutarnji otpor običnog digitalnog voltmetra veći je od 20 MΩ. To znači da pri razlici potencijala 1,10 V, kao u Daniellovu članku, kroz članak teče struja jakosti manje od 5×10―9 A.
Galvanski članak prikazuje se tako da je lijevi polučlanak onaj u kojemu se odvija oksidacija (anoda), a desni onaj u kojem se odvija redukcija (katoda). Daniellov članak prikazujemo ovako:
Zn(s) | Zn2+(aq) ⃒ ⃒ Cu2+(aq) | Cu(s) EMF = 1,10 V
Ovdje jedna vertikalna crta označava granicu faza, krutina ― otopina. Dvije vertikalne crte označuju polupropusnu membranu (ili slani most) kojom se sprječava miješanje otopina različitih elektrolita.
Načinimo sličan galvanski članak u kojemu je lijevi polučlanak olovo uronjeno u otopinu u kojoj je a(Pb2+(aq)) = 1, a desni polučlanak bakar uronjen u otopinu u kojoj je a(Cu2+(aq)) = 1. EMF tog članka bit će 0,463 V.
Pb(s) | Pb2+(aq) ⃒ ⃒ Cu2+(aq) | Cu(s) EMF = 0,463 V
Načinimo još jedan sličan galvanski članak u kojemu je lijevi polučlanak cink uronjen u otopinu u kojoj je a(Zn2+(aq)) = 1, a desni polučlanak olovo uronjeno u otopinu u kojoj je a(Pb2+(aq)) = 1. EMF tog članka bit će 0,637 V.
Zn(s) | Zn2+(aq) ⃒ ⃒ Pb2+(aq) | Pb(s) EMF = 0,637 V
Iz svih do sada navedenih primjera proizlazi da smo uvijek mjerili razliku potencijala dviju elektroda u galvanskom članku. Naime, ne može se izmjeriti "električni potencijal" samo jedne elektrode, već uvijek moramo načiniti galvanski članak da bismo izmjerili razliku potencijala dviju elektroda.
Što je aktivitet iona u vodenoj otopini?
U realnim otopinama elektrolita ioni suprotna naboja djeluju jedni na druge privlačnim elektrostatskim silama. Te su sile to jače što je veći naboj iona i veća koncentracija otopine. Zato je djelotvorna koncentracija iona manja od analitičke. Stoga je Lewis već 1911. god. uveo pojam koeficijent aktiviteta te umjesto koncentracije rabio aktivitete iona u otopini. Koeficijent aktiviteta, gB, jest broj manji od 1. Po dogovoru aktivitet tvari u krutom stanju jednak je 1. Prema Lewisu, aktivitet jedinki B u otopini izračuna se prema jednadžbi:
U ovoj je jednadžbi:
a(B) =
relativni aktivitet jedinki tvari B,
gB =
koeficijent aktiviteta jedinki tvari B (manji od 1),
cB = koncentracija jedinki tvari B,
co = standardna koncentracija otopine = 1 mol
dm―3.
Koeficijent aktiviteta, gB, ovisi o vrsti, naboju i koncentraciji iona u otopini. Primjerice, za vodene otopine koncentracije 0,1 mol dm―3 pri 25 °C koeficijenti aktiviteta, gB, su:
H+ ≈ 0,83, Li+ ≈ 0,80,
(Na+, K+, Cl―, Br―, I―, CN―, NO2―, NO3―) ≈ 0,755,
(Ca2+, Cu2+, Zn2+, Sn2+, Mn2+, Fe+2, Ni2+, Co+2) ≈ 0,405,
(Al3+, Fe3+, Cr3+, Sc3+, Y3+, In3+) ≈ 0,18, itd.
U otopinama koncentracije manje od 0,0001 mol dm―3, za jednovalentne ione može se uzeti da je njihov koeficijent aktiviteta, gB ≈ 1.
Kako načiniti elektrolitski ili slani most?
Za elektrolitski ili slani most kao na slici 8.20. potrebna vam je U-cijev, agar agar ili želatina za kuhanje te neka lako topljiva sol kao što je kalijev klorid ili sulfat. Agar agar se koristi u kulinarstvu kao tvar za zgušnjavanje, slično kao i želatina. Može se nabaviti u trgovinama „zdrave hrane“.
Malo agar agara, koliko stane na vrh noža, uspite u čašu od 100 mL, dodajte 20 mL destilirane vode i malo kalijeva sulfata ili kalijeva klorida. Pričekajte oko pola sata da agar agar nabubri. Ugrijte smjesu, najbolje na vodenoj kupelji, tako da dobijete koloidnu otopinu (sôl). Tom otopinom napunite U-cijev do vrha, i kap više, pustite da se spontano hladi te sôl prijeđe u gel. Isti elektrolitski most možete puno puta upotrijebiti. U međuvremenu ga morate čuvati u čaši s vodom da se gel ne osuši. Ako slani most pripremate sa želatinom, morat ćete uzeti dva do tri puta više želatine nego agar-agara.
Pokus 8.8. Živino srce
Vidi na
internetu: Hrvoje Mesić – živino srce
"Mercury heart" experiment
e-Kemija: Sikirica – Živino srce
Pribor i kemikalije: Satno staklo ⌀ = 5–8 cm, željezni čavao l ≈ 8 cm, kapalica s gumicom, sumporna kiselina, c(H2SO4) = 2 mol L―1, otopina kalijeva bikromata, c(K2Cr2O7) = mol L―1.
Radite u poslužavniku! Kapljice prosute žive teško je skupiti. Živine pare su otrovne!
Postupak
- Na kutiju žigica plastelinom učvrstite glavicu željeznog čavla u takvu položaju da vrh čavla može doseći sredinu satnog stakla.
- Ulijte u satno staklo toliko žive da dobijete krug promjera oko 1,5 cm.
- Dolijte toliko otopine sumporne kiseline da sva živa bude prekrivena.
- Vrh željeznog čavla približite kapljici žive tako da je skoro dotiče. Vrh čavla mora biti pod otopinom sumporne kiseline.
- Dodajte oko 2 mL otopine kalijeva bikromata. Kap žive početi će ritmički oscilirati poput srca koje kuca. Po potrebi malo odmaknite ili primaknite vrh čavla.
- Nakon provedenog pokusa živu isperite vodom, osušite filtrirnim papirom i pomoću malog lijevka ulijte u bočicu debelih stijenki. Bocu začepite. Istim uzorkom žive pokus možete bezbroj puta ponoviti.
Tema o galvanskim člancima ne mora biti živa dosada. Ovim pokusom zabavljali su još 1800. Alesandro Volta i engleski kemičar William Henry.
U otopini sumporne kiseline kalijev bikomat oksidira živu te na njezinoj površini nastaje film od živina(I) sulfata, Hg2SO4. Stoga se napetost površine žive snizi pa se kapljica žive raširi i dotakne vrh željeznog čavla.
6 Hg + 3 SO42- → 3 Hg2SO4 + 6e―
Cr2O72― + 14 H+ + 6 e― → 2 Cr3+ + 7H2O
―――――――――――――――――――――――――
6 Hg + 3 SO42- + Cr2O72― + 14 H+ → 3 Hg2SO4 + 2 Cr3+ + 7H2O
Kad željezni čavao dotakne kap žive, željezo se otapa a elektroni s čavla prelaze na kapljicu žive te reduciraju živin(I) sulfat u elementarnu živu.
Fe → Fe2+ + 2 e― (anoda – oksidacija)
Hg2SO4 + 2 e― → 2 Hg + SO42- (katoda – redukcija)
Stoga poraste napetost površine žive, kapljica žive se skupi pa gubi kontakt s vrhom željeznog čavla. Proces se ponavlja pa kapljica žive oscilira poput srca koje kuca.
8.5.1. Standardna vodikova elektroda
Treba razumjeti da nije moguće izmjeriti potencijal elektrode u apsolutom smislu. Mogu se mjeriti samo razlike potencijala elektroda. Stoga je poželjno imati jednu čvrstu točku, elektrodu, prema kojoj će se određivati potencijali svih drugih elektroda. Ta čvrsta točka je standardna vodikova elektroda (engl. Standard hydrogen electrode ) ili SHE, za koju se dogovorno uzima da ima elektrodni potencijal nula volta pri svim temperaturama. Elektrodni potencijali svih drugih elektroda određuju se kao elektromotorna sila, EMF, (engl. electromotive force) galvanskog članka u kojemu je lijeva elektroda standardna vodikova elektroda.
Elektrodni potencijal neke elektrode jednak električnom potencijalu vodiča spojenog na tu elektrodu minus električni potencijal vodiča spojenog na standardnu vodikovu elektrodu kad električna struja koja teče člankom teži k nuli. Vodikova elektroda uvijek se prikazuje lijevo.
Načinimo li galvanski članak kao na slici 8.21.
Pt, H2(g) │ H+(aq) ⃒ ⃒ Cu2+(aq) │Cu(s)
standardna vodikova elektroda bakar u otopini vlastitih iona, a(Cu2+) =1
izmjerit ćemo razliku potencijala od 0,34 V. Bakrena elektroda pozitivnija je za 0,34 V od SHE, pa je standardni elektrodni potencijal bakra, E°(Cu2+/Cu) = +0,34 V.
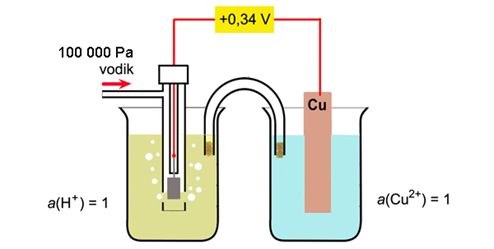
Slika 8.21. Mjerenje standardnog elektrodnog potencijala bakra u odnosu na standardnu vodikovu elektrodu.
Načinimo li galvanski članak kao na slici 8.22.
Pt, H2(g) │ H+(aq) ⃒ ⃒ Zn2+(aq) │Zn(s)
standardna vodikova elektroda cink u otopini vlastitih iona, a(Zn2+) = 1
izmjerit ćemo da je cinkova elektroda za 0,76 V negativnija od SHE, pa je standardni elektrodni potencijal cinka, E°(Zn2+/Zn) = ―0,76 V.
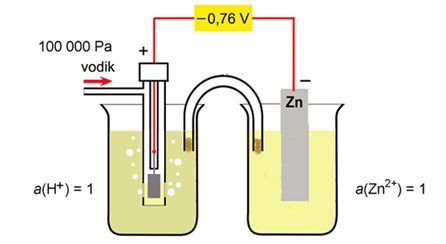
Slika 8.22. Mjerenje standardnog elektrodnog potencijala cinka u odnosu na standardnu vodikovu elektrodu
Standardna vodikova elektroda (engl. Standard hydrogen electrode ) ili SHE, sastoji se od platinske pločice prevučene crnom spužvastom platinom. Elektroda je dopola uronjena u otopinu u kojoj je aktivitet vodikovih iona jednak 1. Oko elektrode neprekidno struje mjehurići čistoga vodika pod tlakom 100 kPa. Potencijal tako načinjene vodikove elektrode u početku varira zbog onečišćenja kisikom, a stabilizira se tek nakon dvadesetak minuta.
Crna spužvasta platina dobije se elektrolizom klorovodičnom kiselinom zakiseljene razrijeđene otopine PtCl4 uz veliku gustoću struje.
U praktičnim mjerenjima rijetko se rabi standardna vodikova elektroda jer ju je teško načiniti i održavati. Stoga se u laboratorijskim mjerenjima najčešće rabi zasićena kalomel elektroda, koju je lakše načiniti i čiji je standardni elektrodni potencijal +0,244 V pri 25 °C. (Kalomel, Hg2Cl2, jest živin(I) klorid, a javlja se i u prirodi kao rijedak mineral. Djelovanjem svjetlosti raspada se na živu i živin(II) klorid.)
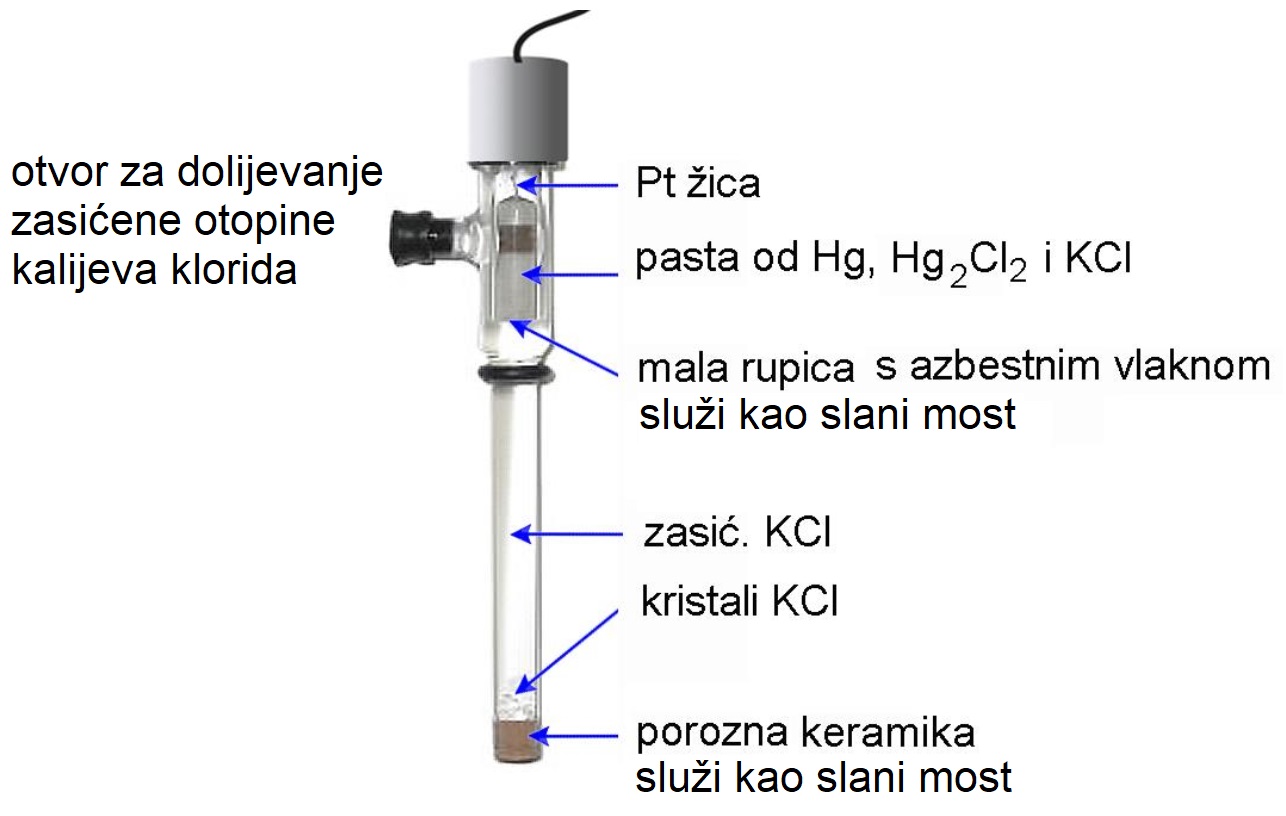
Slika 8.23. Shematski prikaz građe kalomel elektrode.
8.5.2. Elektrokemijski niz
U prethodnom smo poglavlju pokazali da se elektrodni potencijal neke elektrode, tj. njezin redoks potencijal, može odrediti samo tako da se načini galvanski članak. Standardni elektrodni potencijal, E °, ispitivane elektrode jest vrijednost EMF (elektromotorne sile) članka u kojem je lijeva elektroda standardna vodikova elektroda, a desni polučlanak metal uronjen u otopinu u kojoj je aktivitet njegovih iona jednak 1. (Vidi slike 8.21. i 8.22.)
Mjerenjem EMF niza galvanskih članaka, u kojima je uvijek lijevi polučlanak standardna vodikova elektroda, određeni su standardni redoks-potencijali za velik broj redoks-reakcija. Ako se izmjerene vrijednosti redoks-potencijala poredaju prema njihovu porastu dobiva se elektrokemijski niz, prikazan u tablici 8.1.
Tablica 8.1. Odabrani primjeri standardnih elektrodnih potencijala, E °, pri 25°C.
|
Reakcija na elektrodi |
E °/V |
Reakcija na elektrodi |
E °/V |
|
Li+(aq) + e− → Li(s) |
−3,040 |
2H+(aq) + 2e− → H2(g) |
0,000 |
|
K+(aq) + e− → K(s) |
−2,925 |
Cu2+(aq) + 2e− → Cu(s) |
+0,337 |
|
Na+(aq) + e− → Na(s) |
−2,71 |
I2(s) + 2e− → 2I−(aq) |
+0,54 |
|
Mg2+(aq) + 2e− → Mg(s) |
−2,37 |
Fe3+(aq) + e− → Fe2+(aq) |
+0,771 |
|
Al3+(aq) + 3e− → Al(s) |
−1,66 |
Ag+(aq) + e− → Ag(s) |
+0,80 |
|
Zn2+(aq) + 2e− → Zn(s) |
−0,763 |
Hg2+(aq) + 2e− → Hg(l) |
+0,86 |
|
Cr3+(aq) + 3e― → Cr(s) |
―0,74 |
2 Hg2+(aq) + 2e― → Hg22+(s) |
+0,91 |
|
S(s) + 2e− → S2−(aq) |
−0,48 |
Br2(l) + 2e− → 2Br−(aq) |
+1,07 |
|
Fe2+(aq) + 2e− → Fe(s) |
−0,44 |
O2(g) + 4H+ + 4e− → 2H2O(l) |
+1,23 |
|
PbSO4(aq) + 2e−→ Pb(s) + SO42- |
−0,356 |
Cl2(g) + 2e− → 2Cl−(aq) |
+1,36 |
|
Ni2+(aq) + 2e− → Ni(s) |
−0,250 |
PbO2(s)+4H++2e−→Pb2+(aq)+2H2O(l) |
+1,690 |
|
Sn2+(aq) + 2e− → Sn(s) |
−0,136 |
O3(g)+2H+(aq) + 2e− → O2(g) + H2O |
+2,07 |
|
2H+(aq) + 2e− → H2(g) |
0,000 |
F2(g) + 2e− → 2F−(aq) |
+2,85 |
Na temelju tablice elektrokemijskog niza možemo odrediti EMS bilo kojeg galvanskog članka. Primjerice, za olovni akumulator dobivamo:
EMF = Ekatoda - Eanoda = E °(PbO2|Pb) - E °(PbSO4|Pb) = 1,690 V -(- 0,356 V) = 2,046 V.
Pokus 8.9. Elektrodni potencijali 1
Vidi na internetu: e-Kemija: Sikirica – Elektrodni potencijali
Pokus 8.10. Elektrodni potencijali 2
Pribor
i kemikalije: Miliampermetar, U-cijev, vata, 2 ugljena
štapića iz baterije, 2 probušena čepa za ugljene štapiće, 2 žice
s banana utikačima, 2 krokodil-štipaljke, otopina kalijeva jodida, otopina
željezova(III) klorida,
Postupak:
- Složite aparaturu kao na slici 8.24.
- Čep od vate ugurajte u sredinu U-cijevi kako biste spriječili miješanje elektrolita.
- U jednu stranu U-cijevi polagano ulijevajte razrijeđenu otopinu sumporne kiseline, tek toliko da sva vata bude nakvašena.
- Istodobno u jednu granu U-cijevi ulijevajte otopinu kalijeva jodida, a u drugu granu otopinu željezova(III) klorida. Istodobnim punjenjem obje grane U-cijevi spriječit ćete miješanje elektrolita.
- Umetnite ugljene elektrode i priključite ih na polove miliampermetra.
- Na kojoj se elektrodi događa redukcija a na kojoj oksidacija? Kojim smjerom teku elektroni? Napišite jednadžbe reakcija.
- Obrazložite opažanja pomoću elektrokemijskog niza (tablica 8.1.).

Slika 8.24. Galvanski članak. Oksidacija i redukcija su nerazdvojne. Dok se na anodi događa oksidacija, istodobno se na katodi događa redukcija
8.5.3. Nernstova jednadžba
Ovisnost elektrodnog potencijala redoks sustava o aktivitetu oksidiranog i reduciranog oblika u otopini istraživao je Walther Hermann Nernst (1864.-1941.) i našao da se može opisati jednadžbom:
gdje je:
E elektrodni potencijal elektrode,
E o standardni elektrodni potencijal te elektrode,
R univerzalna plinska konstanta, 8,314 J K−1 mol−1,
T termodinamička temperatura,
z stehiometrijski koeficijent elektrona u reakciji članka,
F Faradayeva konstanta, 96485.33 C mol−1,
a(oks) aktivitet oksidansa,
a(red) aktivitet reducensa.
Ako se u jednadžbu uvedu sve konstante, za temperaturu uzme 298 K (25 °C), te sve pomnoži faktorom 2,3026 radi prelaska od prirodnih na dekadske logaritme, Nernstova jednadžba dobiva oblik:
Primjer 8.3. Izračunajte elektromotornu silu koncentracijskog galvanskog članka u kojemu je lijevi polučlanak elektroda od bakra uronjena u otopinu u kojoj je aktivitet bakrovih iona, a(Cu2+) = 0,001, a desni polučlanak elektroda od bakra uronjena u otopinu u kojoj je aktivitet bakrovih iona, a(Cu2+) = 0,1. Elektroliti su međusobno odijeljeni polupropusnom membranom ili slanim mostom. Upotrijebite Nernstovu jednadžu. Obrazložite mehanizam djelovanja koncentracijskog članka.
Rješenje: Kod koncentracijskih članaka elektrode od istoga metala, primjerice bakra, uronjene su u otopine bakrovih iona, ali različitih aktiviteta. Stoga su elektrodni potencijali bakrenih elektroda razlikuju.
Kad se elektrode koncentracijskog članka spoje vodičem električne struje, bakar se na anodi oksidira u bakrove ione, Cu2+(aq)
Cu(s) → Cu2+(aq) + 2e―
Elektroni oslobođeni na anodi metalnim vodičem prelaze na katodu gdje dolazi do redukcije iona Cu2+(aq) u elementarni bakar.
Cu2+(aq) + 2e― → Cu(s)
Strujni krug se zatvara preko elektrolita. Naime, kroz otopine elektrolita električni naboj prenose ioni. Sulfatni ioni putovat će kroz polupropusnu membranu ili slani most iz katodnog u anodni prostor. Istodobno će vodikovi ioni, H+(aq) kroz polupropusnu membranu ili slani most iz anodnog prostora putovati u katodni prostor. No, ioni H+(aq) su manji i pokretljiviji od iona SO42―(aq), stoga će oni kroz otopinu elektrolita prenijeti veći dio električnog naboja.
Elektrodni potencijal bakra u lijevo prikazanom polučlanku bit će:
Elektromotorna sila koncentracijskog članka jednaka je razlici elektrodnih potencijala elektroda.
EMF = Ekatoda – Eanoda = 0,3105 V – 0,2515 V = 0,059 V
Koncentracijski članak „davat će struju“ sve dok se ne izjednače aktiviteti iona Cu2+(aq) u oba polučlanka.
Kao što elektrodni potencijal bilo koje elektrode ovisi o aktivitetu pripadnih iona u otopini, jednako i potencijal neke vodikove elektrode ovisi o aktivitetu iona H+(aq).
Primjer 8.4. Načinjen je galvanski članak u kojemu je lijeva elektroda SHE, a desna elektroda također vodikova elektroda ali uronjena u otopinu u kojoj je a(H+) = 0,0001, tj. pH = 4.
Pt, H2(g) │ H+(aq) ⃒ ⃒ H+(aq) │ H2(g), Pt
SHE, pH = 0 a(H+) = 0,0001, pH = 4
Izračunajte elektrodni potencijal vodikove elektrode uronjene u otopinu u kojoj je aktivitet iona H+(aq) = 0,0001, tj. pH = 4.
Rješenje: Primijenimo Nernstovu jednadžbu uzimajući da je a(oks) = 0,0001 i a(red) = 1. Naime, reducirani oblik iona H+(aq) jest elementarni vodik otopljen u spužvastoj platini. Općenito, za sve tvari u krutom obliku uvijek se uzima da je njihov aktivitet jednak 1.
Slijedi:
Kako je E o = 0,000 V, slijedi:
Odavde proizlazi da se pH može izravno izmjeriti tako da se načini galvanski članak u kojemu je lijevo SHE, a desno vodikova elektroda s istraživanom otopinom kao elektrolitom. No, to bi bilo jako nespretno, stoga su nađene druge elektrode čiji potencijal ovisi o pH otopine. Najčešće se u tu svrhu rabi staklena elektroda. To je cjevčica od običnog stakla koja završava kuglicom vrlo tankih stijenki od silikatnog stakla s oko 25 % Na2O dopiranog litijevim oksidom, Li2O.
Unutrašnjost staklene elektrode sadržava otopinu klorovodične kiseline, c(HCl) = 0,1 mol dm―3 ili neku pufersku otopinu, što ovisi o proizvođaču. U tu je otopinu uronjena srebrna žica prevučena tankim slojem srebrova klorida, AgCl.
Nova, suha staklena elektroda, mora se prije uporabe „kvasiti“ 8 ili više sati o otopini klorovodične kiseline, c(HCl) = 0,1 mol dm―3. Pritom na površini kuglice od posebnog stakla nastaje vrlo tanak gel (~ 10 nm), koji se sastoji od stakla zasićenog vodom. Taj površinski sloj staklene elektrode djeluje kao ionski izmjenjivač. Naime, ioni Na+ i Li+ iz stakla difundiraju u otopinu, a na površinu stakla adsorbiraju se ioni H+. Na unutarnjoj strani membrane količina izmijenjenih iona je stalna, a na vanjskoj strani ovisi o pH otopine. Stoga je potencijal staklene elektrode proporcionalan razlici koncentracija iona H3O+(aq) na ove dvije površine.
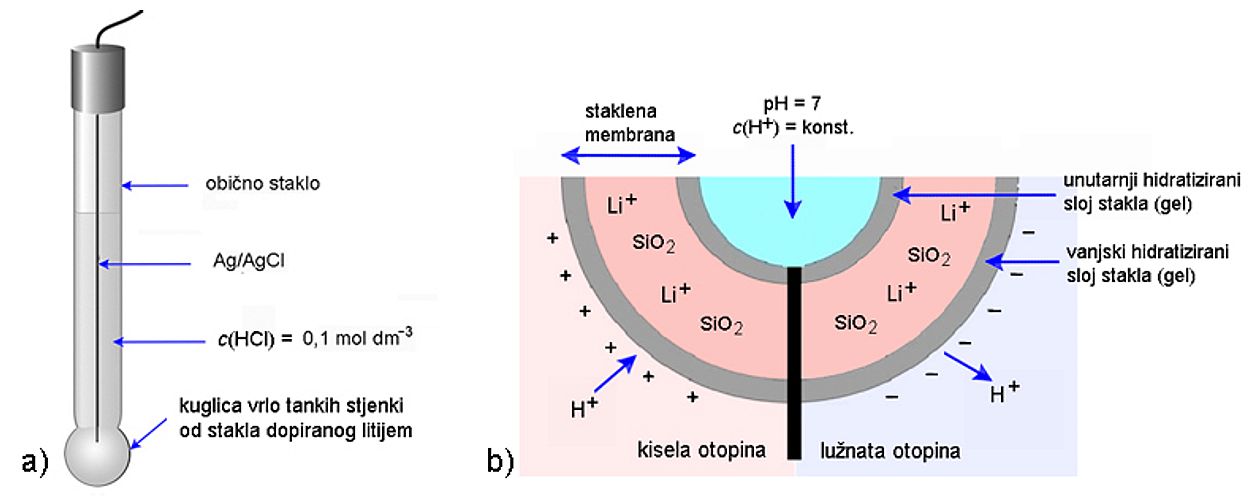
Slika 8.25. a) Građa staklene elektrode. b) Shematski prikaz procesa na površini staklene elektrode.
Mjerenje pH izvodi se tako da se načini galvanski članak: staklena elektroda – kalomel elektroda. Mjerni instrument, tj pH-metar treba najprije baždariti tako da se elektrode urone u otopinu pufera čiji je pH približno jednak pH ispitivane otopine. Na pH-metru se potenciometrom postavi vrijednost pH jednaka pH pufera pri temperaturi mjerenja. Potom se elektrode isperu ispitivanom otopinom te urone u tu otopinu. Na pH-metru se očita vrijednost pH.
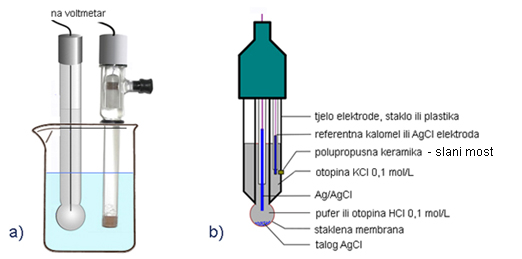
Slika 8.26. a) Shematski prikaz mjerenja pH. b) U suvremenim pH-metrima staklena i referentna elektroda (kalomel elektroda ili Ag/AgCl elektroda) integrirane su u jednu mjernu sondu. Vidi na internetu:
Wikipedia - Glass_electrode
Methrom - pH measurements
Baždarenje pH-metra prije mjerenja potrebno je stoga što staklena elektroda nema odziv 59 mV pri promjeni pH za jedinicu u cijelom području pH od 1 do 14.
Nakon mjerenja elektrode treba isprati i držati u čaši s vodovodnom vodom. Ne smije se dozvoliti da se staklena elektroda osuši.
8.5.4. Korozija i zaštita željeza od korozije
Istraživanja su pokazala da je korozija elektrokemijska pojava po mnogo čemu slična galvanskim člancima. Od svih konstrukcijskih materijala željezo je najviše podložno koroziji. Njegova je površina heterogenog sastava i sadržava niz točkica na kojima se nalaze čestice ugljika, ili čestice drugih metala, primjerice bakra. Dođe li na površinu takva željeza kapljica vode nastat će lokalni galvanski članak u kojem se željezo oksidira i otpušta elektrone. Željezo je anoda galvanskog članka.
Fe(s) → Fe2+(aq) + 2 e−
Istodobno čestica ugljika ili bakra, uklopljena u površinu željeza, djeluje kao katoda na kojoj se reducira kisik otopljen u vodi.
H2O(l) + ½ O2(aq) + 2 e− → 2 OH−(aq)
Nastali ioni Fe2+(aq) s ionima OH−(aq) stvaraju netopljivi Fe(OH)2(s) koji se kisikom iz zraka ili vode dalje oksidira u Fe(OH)3(s).
2 Fe(OH)2(s) + ½ O2(g) + H2O(l) → 2 Fe(OH)3(s)
Fe(OH)3(s) spontano prelazi u hidratizirani željezov(III) oksid, Fe2O3·xH2O(s), kojeg nazivamo hrđa.
Pokus 8.11. Korozija željeza u vodi
Pribor i kemikalije: 3 epruvete, 3 obična nova željezna čavla, komadić bakrene žice, granula cinka.
Postupak:
- U sve tri epruvete ulijte 3 do 4 mL obične vode iz vodovoda.
- U prvu epruvetu stavite običan čavao, u drugu čavao omotan komadićem bakrene žice, a u treću čavao na koji je gumicom pričvršćena granula cinka.
- Pratite i obrazložite promjene tijekom desetak dana.

- Željezo u vodovodnoj vodi polagano hrđa.
- Željezo u vodovodnoj vodi u doticaju s bakrom čini kratko spojeni galvanski članak u kojemu je željezo anoda. Željezo intenzivno hrđa.
- Željezo u vodovodnoj vodi u doticaju s cinkom čini kratko spojeni galvanski članak u kojemu je cink anoda. Cink se otapa, a željezo ostaje zaštićeno.
Talog hrđe ima veći volumen od željeza iz kojeg je nastao. Zato je sloj hrđe porozan i ne može željezo štititi od daljnje korozije. Hrđa se neprekidno stvara, a njezin se sastav mijenja od dubljih slojeva prema površini. U dubljim slojevima, neposredno uz željezo, prevladavaju hidratizirani oksidi dvovalentnog željeza, a na površini trovalentnog željeza.
Dobra zaštita od korozije željeza postiže se zaštitnim prevlakama od cinka. Na očišćenu površinu željeza cink se nanosi elektrolizom ili uranjanjem predmeta u rastaljeni cink. Tako se zaštićuju vodovodne željezne cijevi, stupovi za električnu rasvjetu, limovi od kojih se izrađuju žljebovi (oluci) na krovovima kuća itd. Elektrolitskim se putem cink nanosi na karoserije boljih automobila prije nanošenja boje. Tako se karoserija automobila štiti od hrđanja.
Cink, kao i svi metali, počinje korodirati kad je izložen atmosferi. Pritom svježe pocinčani čelik, izložen mokrim i suhim ciklusima u okolišu, prolazi kroz prirodni proces trošenja pri čemu na površini cinka nastaje patina od tankog sloja cinkova oksida.
Kako su pocinčani predmeti izloženi vlazi (kiša, rosa, vlažan zrak), čestice cinkovog oksida reagiraju s vodom stvarajući porozni, želatinozni cinkov hidroksid, Zn(OH)2.
Nakon toga, tijekom suhih ciklusa, ugljikov dioksid iz zraka reagira s cinkovim hidroksidom pri čemu nastaje tanak, kompaktan i čvrsto prianjajući sloj cinkova karbonata.
Brzina nastajanja patine ovisi o uvjetima okoline, ali obično je potrebno oko 6―12 mjeseci da se potpuno razvije. Kako se cinkova patina razvija, pocinčani predmet će poprimiti mat sivu boju. Potpuno razvijena patina je pasivan, stabilan film koji prianja na površinu cinka i nije topljiv u vodi pa se ne ispire na kiši ili snijegu te sprječava koroziju čelika ispod prevlake od cinka.
No, problem nastaje ako se prevlaka od cinka ošteti pa željezo dođe u neposredan doticaj s vlagom i zrakom. U tom slučaju nastaje korozijski članak u kojem je cink anoda.
Na mjestu ogrebotine istodobno se kisik iz zraka, ili kisik otopljen u kapljici vode reducira u ione OH―.
Nastali ioni OH―(aq) reagiraju s ionima Zn2+(aq) i ugljikovim dioksidom iz zraka pa nastaje u vodi netopljivi cinkov karbonat.
Tako talog cinkova karbonata i drugih produkata korozije zatvara manje ogrebotine i štiti željezo od daljnjeg hrđanja.
Pri vrućem pocinčavanju željezo i cink tvore intermetalne spojeve čiji se sastav može prikazati kemijskom formulom. Pri dnu slike shematski je prikazan sastav slojeva s intermetalnim spojevima koji nastaju pri vrućem pocinčavanju željeza.

Zadaci i teme za vlastite aktivnosti i samoobrazovanje
Na temelju prikazanog kemijskog sastava slojeva, prikazana pri dnu slike 8.28. izračunajte formule intermetalnih spojeva cinka sa željezom. Rezultate zaokružite na najbliže cijele brojeve. U intermetalnim spojevima atomi se mogu zamjenjivati jedni drugima. Stoga intermetalni spojevi imaju djelomično promjenjiv sastav.
O vrućem pocinčavanju doznajte više iz članka: P. Pokorny i sur.: Hot-dip Galvanized Coatings on Steel
Pokus 8.12.
Lokalni galvanski članci i korozija željeza.
Pribor i kemikalije: Petrijeva zdjelica promjera 8 ili 10 cm, 2 nova željezna čavla, želatina, otopina fenolftaleina, otopina kalijeva heksacijanoferata(III), w(K3Fe(CN)6) ≈ 1 %, otopina natrijeva klorida.
Postupak
- Stavite 1,8 g želatine u prahu u 100 mL destilirane vode i pustite da bubri oko jedan sat, a zatim blago zagrijte uz neprekidno miješanje dok se želatina ne otopi.
- Toploj otopini želatine dodajte 1 mL otopine fenolftaleina, 2 mL otopine kalijeva heksacijanoferata(III), K3Fe(CN)6 i malo otopine natrijeva klorida. Dobivenom otopinom napunite Petrijevu zdjelicu do polovine visine i pričekajte da se želatina počne stvrdnjavati.
- Čim se želatina počne stvrdnjavati, stavite u nju odmašćen te vodom i deterdžentom opran novi željezni čavao. Nedaleko njega stavite još jedan čavao savijen na sredini pod oštrim kutom. Upotrijebite čavle duljine oko 6 cm. Poklopite zdjelicu njezinim poklopcem da spriječite isparavanje vode te ostavite nekoliko dana na mirnu mjestu. Uočite promjene na glavici i vrhu čavla.

Mjesta koja su tijekom izrade čavla pretrpjela veće mehaničke promjene postaju anoda lokalnog galvanskog članka. Željezo se na tom mjestu oksidira.
Ostali dijelovi čavla, koji nisu pretrpjeli tako jake mehaničke deformacije djeluju kao katoda na kojoj se kisik otopljen u vodi reducira.
Odavde proizlazi da je okolina katode lužnata što dokazuje i karakteristično crvenoljubičasta boja fenolftaleina. Želatinozna otopina sadržava kalijev heksacijanoferat(III), pa na onim dijelovima čavla koji djeluju kao anoda nastaje plavi talog berlinskog modrila, KFe[Fe(CN)6] u kojemu se željezo nalazi u dva oksidacijska stanja, kao Fe2+ i Fe3+.
8.5.5. Katodna zaštita
Korozija željeza često se sprječava bojenjem bojama na bazi sušivih ulja. Ona na površini stvaraju za vodu nepropustan film koji štiti željezo od hrđanja. No, to nije dovoljno pa se veliki objekti, kao što su brodovi, podzemni željezni spremnici, naftovodi, plinovodi i dr. osim zaštitnim premazima štite i katodnom zaštitom. Kao što sam naziv kaže, katodna zaštita od korozije, najčešće željeza, temelji se na namjerno načinjenom galvanskom članku u kojemu je željezna konstrukcija katoda. Dvije su metode katodne zaštite, pasivna, koja se temelji na žrtvovanim anodama, a aktivna, koja se temelji na vanjskom izvoru istosmjerne struje.
Kao materijal za žrtvovane anode rabe se magnezij, aluminij, cink ili njihove slitine. Cink je u redu napetosti negativniji od željeza. Zaštita žrtvovanom anodom proizlazi iz sljedećih kemijskih reakcija:
Trup broda, ili naftovod je katoda galvanskog članka na kojoj se kisik reducira. Time se željezo, tj. brod ili naftovod štiti od hrđanja.

Slika 8.30. Žrtvovane anode na trupu broda. Izvor: Wikipedia - Galvanic anode
Naftovodi, plinovodi, podzemni rezervoari i sl. općenito su zaštićeni od korozije premazom, primjerice epoksidnim smolama, ali i aktivnom katodnom zaštitom pomoću vanjskog izvora istosmjerne struje. Minus pol izvora struje spoji se na cjevovod (katoda elektroliznog članka), a plus pol na anode, primjerice stare željezničke tračnice i sl.
Vidi na internetu: Educational 3D animation about cathodic Protection
How to: check and replace an anode (zinc)
Cathodic Protection of Steel Pipelines
Zadaci i teme za vlastite aktivnosti i samoobrazovanje
U vlastitom okruženju uočite i navedite primjere kemijske i elektrokemijske korozije.
Uočite primjere elektrokemijske zaštite (cjevovodi, toplovodi, tramvajske i željezničke tračnice).
Izradite plakat, PowerPoint prezentaciju, snimite video, održite predavanje u razredu, organizirajte raspravu ili pišite u školskom listu o metodama zaštite od korozije konstrukcijskih materijala (željezo, aluminij, beton i dr.).
Pogovor
Koliko ste pokusa samostalno izveli? Dvadeset, deset, jedan ili nijedan. Možda ste pregledali sva videa. Videa su zapravo upute kako načiniti pokus, No, samo gledanjem videa nećete postati vješt eksperimentator niti ćete upoznati svojstva tvari. Slično, gledanjem TV emisije o kulinarstvu nećete se najesti niti ćete postati vrstan kuhar.
Autor
Bilješka o autoru

Milan
Sikirica rođen 1934. u selu
Lučincima
pokraj Požege, umirovljeni je profesor Prirodoslovno-matematičkog
fakulteta
Sveučilišta u Zagrebu. Od osme godine živi, školuje se i radi u
Zagrebu. Pod
vodstvom prof. dr. sc. D. Grdenića diplomirao je 1959. godine na
Prirodoslovno-matematičkom
fakultetu Sveučilišta u Zagrebu s temom: Priprema
točkaste i slojne diode iz monokristala germanija. Doktorat znanosti
pod vodstvom prof. dr. sc.
D. Grdenića stekao
je 1963. godine na istom fakultetu s temom: Trokomponentni
sistemi urana, torija, molibdena i silicija. Oba su rada
izrađena u Odjelu
strukturne i anorganske kemije Instituta "Ruđer Bošković".
Od 1960.
do 1963. bio je asistent na Institutu "Ruđer
Bošković", a od 1963. do 1965. asistent u Zavodu za opću i anorgansku
kemiju Prirodoslovno-matematičkog fakulteta. Zvanje docenta stekao je
1965., za
izvanrednog profesora izabran je 1976., a redovnim profesorom postao je
1981. U
mirovini je od 2004. godine. Predavao je kolegije Opća
kemija, Anorganska kemija, Kemija čvrstog stanja i Metodika
nastave kemije.
Obnašao je sljedeće važnije dužnosti: bio je tajnik Hrvatskog kemijskog društva od 1969. do 1970., pročelnik Kemijskog odsjeka PMF-a, prodekan Prirodoslovno-matematičkog fakulteta od 1982. do 1986., član Prosvjetnog savjeta Hrvatske od 1983. do 1990. Dužnost predstojnika Zavoda za opću i anorgansku kemiju PMF-a obnašao je od 1984. do 1999.
Bavio se
istraživanjem kristalnih struktura međumetalnih i
organoživinih spojeva metodom rendgenske strukturne analize pa je iz
tog
područja objavio 50 znanstvenih radova i održao više od 70 predavanja
na
znanstvenim skupovima.
Intenzivno
se bavio problemima metodike nastave kemije pa je održao više
predavanja i seminara za nastavnike osnovnih i srednjih škola. Aktivno
je bio
uključen u proces uvođenja Hrvatskog
nacionalnog obrazovnog standarda (HNOS). Objavio je više
različitih
udžbenika i priručnika u izdanju Školske knjige od kojih se ističu: Digitalni udžbenici
- Stehiometrija (20 izdanja),
- Metodika nastave kemije,
- Praktikum iz opće kemije (zajedno s B. Korpar-Čolig),
- Zbirka kemijskih pokusa za osnovnu i srednju
školu, te popularna zbirka
- 77 kuhinjskih pokusa za djecu i mlade od 7
do 77 godina.
Krajem 2015. godine objavio je besplatan cjeloviti digitalni udžbenik kemije za učenike 7. i 8. razreda osnovne škole grupe autora Milan Sikirica,
Mihaela Vrbnjak Grđan, Karmen Holenda
e-Kemija udžbenik za učenike osnovne škole
dostupan na adresi: Prirodopolis - e-kemija_OŠ.
Svi digitalni udžbenici sadrže niz poveznica prema drugim izvorima
informacija i
80
video uradaka u ukupnom trajanju od oko 8 sati. Video uradci dostupni
su na adresi:
e-Kemija: Sikirica - YouTube
Narednih godina objavio je besplatne digitalne udžbenike za srednje škole
Digitalni
udžbenik e-Kemija 1 za učenike 1. razreda srednjih škola dostupan je na adresi:
Prirodopolis.hr - e-kemija1
Digitalni
udžbenik e-Kemija 2 za učenike 2. razreda srednjih škola dostupan je na adresi:
Prirodopolis.hr - e-kemija2
Digitalni
udžbenik e-Kemija 3 za učenike 3. razreda srednjih škola dostupan je na adresi:
Prirodopolis.hr - e-kemija3
Digitalni
udžbenik e-Kemija 4 za učenike 4. razreda srednjih škola dostupan je na adresi:
Prirodopolis.hr - e-kemija4
Digitalni
udžbenik Mala škola kristalografije dostupan je na adresi:
Prirodopolis.hr - Mala škola kristalografije
