Kompleksni spojevi nikla
Sinteza niklovog (II) - dibenzoilmetanata
Struktura ovog spoja prikazana je na slici 9. Uočava se sličnost
sa strukturom Co(DBM)2 × 2H2O. Kod niklovog
kompleksa vjerojatno nema koordinativno vezanih molekula vode, već
se javlja veza između dva niklova iona pa se nameće zaključak da
se radi o polimernoj molekuli.
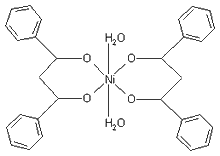
Slika
9. Struktura molekule Ni(DBM)2 (monomer?) |
Na sljedećoj slici prikazan je trodimenzionalni model molekule
načinjen u programu WebLab ViewerLite po predlošku molekule
iz programa ISIS Draw.
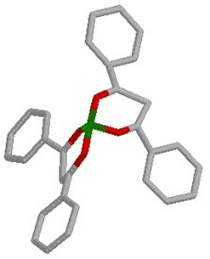
Slika
10. 3D prikaz molekule Ni(DBM)2 |
Prilikom sinteze niklovog kompleksa kao izvor niklovih iona poslužio
je niklov (II) - klorid heksahidrat, NiCl2 × 6H2O.
Niklov klorid i DBM reagiraju u molarnom odnosu 1 : 2. Na temelju
jednadžbe proizlaze količine reaktanata za sintezu 1 mmol kompleksa.
Mehanizam reakcije kompleksiranja prikazan je na slici 11. Kod
ove sinteze zbog upotrebe vode kao otapala za niklov klorid potrebno
je prevesti 1,3-difenilpropan-1,3-dion u anionski oblik jer je to
spoj netopljiv u vodi (slika a).
| |
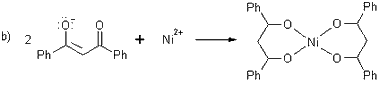
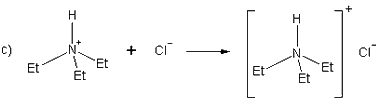
Slika
11. Mehanizam kompleksiranja Ni2+ iona
|
To se postiže pomoću spoja koji djeluje poput
Bronstedove baze, dakle proton akceptora tj. Lewisove baze - elektron
donora. Znači da takav spoj mora imati nepodijeljeni par elektrona
koji onda vežu vodikov ion odnosno proton iz molekule DBM - a. Na
taj način navedena molekula prelazi u negativno nabijeni ion i stupa
u reakciju s niklovim ionom u vodenoj otopini. Kao baza je korišten
trietilamin, a u istu svrhu služi i npr. neki hidroksid
(npr. NaOH ili KOH).
Na slici b anion molekule DBM - a reagira
s niklovim ionom pri čemu nastaje niklov kompleks, niklov (II) dibenzoilmetanat
dok protonirani trietilamin stvara svoju sol, klorid (slika c) reagirajući
s kloridnim ionom koji nastaje disocijacijom niklovog klorida u
vodi:
NiCl2 × 6H2O 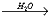 Ni2+ + 2Cl-
+ 6H2O Ni2+ + 2Cl-
+ 6H2O
ispravnije je pisati [Ni(H2O)6]2+,
tj. heksaakvaniklov(II) ion umjesto Ni2+ + 6H2O
jer je niklov ion hidratiziran sa 6 molekula vode koje su oko središnje
čestice raspoređene oktaedarski.
Prema tome, ukupna jednadžba koja prikazuje
proces kompleksiranja niklovog (II) iona izgleda ovako :
Za dobivanje 1 mmol Ni(DBM)2
potrebno je uzeti 2 mol DBM - a i 1 mol niklovog klorida, tj, masa
1,3-difenilpropan-1,3-diona je 448 mg, a NiCl2 × 6H2O
237 mg. Niklov klorid se otopi u čaši u 3 mL destilirane vode, a
DBM u 20 mL metanola (CH3OH) u tikvici u kojoj se odvija
reakcija. Otopini DBM - a se automatskom kapaljkom doda 0,5 mL trietilamina
(reakcije na slici 11.) Zatim se u tikvicu ulije vodena otopina
niklovog klorida i složi aparatura za refluksiranje (slika 6.).
Kad se postigne temperatura vrelišta metanola refluksira se oko
15 - ak minuta.
Dobiveni talog se iz vrućeg metanola otfiltrira
preko nabranog filter papira i osuši na zraku. Spoj je svijetlozelene
boje, netopljiv u vodi, a dobro topljiv u dimetilsulfoksidu (DMSO)[1]
i kloroformu.
|