Interakcija EMZ i tvari
Ukupna energija neke čestice (molekule, atoma, iona ...), Euk,
zbroj je velikog broja različitih doprinosa. Ti su energetski doprinosi
interakcije: (a) između atoma u molekuli (translacije, rotacije,
vibracije, raspodjela vanjskih elektrona) ili (b) unutar pojedinog
atoma (raspodjela unutarnjih elektrona, interakcije unutar jezgre,
promjene spina jezgre ili elektrona). Translacija je pomak težišta
čestice u prostoru, a promjena orjentacije višeatomne čestice u
prostoru zove se rotacija (vrtnja). Pojam vibracija označava (malu)
promjenu duljine kemijskih veza ili kuteva između kemijskih veza
(valentnih kuteva) u takvoj čestici. Četvrti doprinos je promjena
raspodjele elektrona čestice, vanjskih (valentnih) ili unutarnjih.
Odgovarajući energetski doprinosi su Et,
Er, Ev i Ee,
jednadžba (1.7). Od interakcija unutar pojedinog atoma izdvojiti
ćemo interakcije unutar jezgre, En, koje
rezultiraju najvećim enegetskim promjenama, te promjenu nuklearnog
spina, Es, koja rezultira vrlo malom energetskom
promjenom. U jednadžbi (1.7) energetski doprinos raste s lijeva
na desno, najveći doprinos daju interakcije unutar jezgre, a doprinos
translacije toliko je mali da nema primjene u spektrometriji.
|
Euk = Et
+ Es + Er + Ev
+ Ee + En
|
(1.7)
|
Svi energetski doprinosi neke čestice su kvantizirani (diskretni),
što znači da ne mogu poprimiti bilo koje vrijednosti energije, nego
samo neke točno određene. Te vrijednosti zovemo energetske razine
(nivoi), a čestice imaju veliki broj kvantiziranih energetskih razina,
koje se mogu podijeliti na translacijske, rotacijske, vibracijske,
elektronske i nuklearne energetske razine.
Interakcija EMZ i tvari može se podijeliti u dva oblika: interakciju
koja dovodi do promjene energije tvari (apsorpcija ili emisija),
te interakciju koja dovodi do promjene smjera ili svojstva zračenja.
Prilikom interakcije EMZ i tvari može doći do izmjene energije samo
ako je energija fotona EMZ jednaka razlici između dvije energetske
razine čestice, DE. Ako je taj
uvjet zadovoljen, čestica može primjerice apsorbirati foton zračenja
i tako prijeći s niže energetske razine E1 na
višu energetsku razinu E2. Razlika energije
može se prikazati realcijom:
Ukoliko se promatrani uzorak tvari izloži EMZ nekog izvora, te na
pogodnom detektoru mjeri ovisnost intenziteta zračenja o frekvenciji
(valnoj duljini ili valnom broju, a zapravo energiji) nastaje spektar.
Na dobivenom spektru mogu se uočiti spektralne linije nastale smanjenjem
intenziteta EMZ kod onih frekvencija koje ispunjavaju uvjet iz jednadžbe
(1.8). Budući da su vrijednosti DE
različite za različite čestice (molekule, atome, ione ...), na osnovi
dobivenog spektra može se izvršiti karakterizacija promatranog uzorka.
Intenzitet spektralnih linija
Tri glavna faktora o kojima ovisi intenzitet spektralnih linija
su:
(a) vjerojatnost prijelaza između energetskih razina,
(b) popunjenost (populacja) energetskih razina česticama i
(c) ukupan broj čestica u kontaktu s EMZ.
(a) Računanje vjerojatnosti prijelaza
između dvije energetske razine prelazi razinu ovog teksta, a dovoljno
je znati da iz takvih računa proizlaze izborna pravila, koja kažu
da li je prijelaz dozvoljen ili ne. Tako se zabranjeni prijelazi
ili ne događaju ili imaju znatno manji intenzitet od dozvoljenih
prijelaza, a vjerojatniji prijelazi daju intenzivnije spektralne
linije.
(b) Ukoliko je vjerojatnost prijelaza
iz dvije različite energetske razine u neku treću jednaka, intenzivniju
spektralnu liniju dati će prijelaz s razine koja je popunjenija
česticama. Raspodjela čestica po energetskim razinama zasniva se
na jednostavnom statističkom zakonu koji je otkrio Boltzmann:
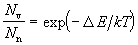 |
(1.9)
|
gdje su Nv i Nn
broj čestica u višoj odnosno nižoj enegetskoj razini, T je termodinamička
temperatura, DE je razlika između
više i niže energetske razine, a k je Boltzmannova konstanta koja
iznosi 1,38 ´ 10-23 J K-1.
(c) Utjecaj količine uzorka u kontaktu
s EMZ na intenzitet spektralnih linija može se najlakše objasniti
na primjeru apsorpcije zračenja. Ako čestice uzorka tvari apsorbiraju
EMZ, logično je da će se povećanjem broja čestica uzorka koje stupaju
u kotakt s EMZ apsorpcija povećati. Povećanje broja čestica u kontaktu
s EMZ može se postići produljenjem puta zrake kroz uzorak ili povećanjem
koncentracije uzorka. Moglo bi se očekivati da udvostručenje duljine
puta ili koncetracije uzorka uzrokuje pad intenziteta EMZ za pola.
To bi značilo da bi polazno EMZ bilo potpuno apsorbirano prolazom
kroz dva uzorka od kojih svaki ima sposobnot apsorpcije 50% inteziteta
polaznog EMZ, no jednostavno je dokazati da nije tako. Ako uzmemo
uzorak, U1, sa sposobnošću apsorpcije
50% inteziteta polaznog EMZ, I0, jasno
je da će intenzitet EMZ na izlazu iz uzorka U1
iznosi I1 = 1/2 I0.
Postavimo li na put EMZ I1 uzorak U2,
identičan uzorku U1, intenzitet EMZ na
izlazu će iznositi: I2 = 1/2 xI1,
odnosno I2 = 1/2 x1/2 xI0
= 1/4 xI0. Znači, nakon prolaza kroz uzorke
U1 i U2 intenzitet
polaznog EMZ se smanjio za 75%, no zraka nije bila u potpunosti
apsorbirana. Zakon koji daje odnos između intenziteta polaznog EMZ
(I0) i intenziteta nakon prolaska zrake
kroz uzorak (I1) naziva se Beer-Lambertov
zakon:
|
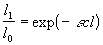
|
(1.10)
|
gdje je e apsorpcijeki koeficijent
koji ovisi o tipu uzorka, c je koncentracija uzorka, a
l duljina puta zrake kroz uzorak.
Spektralna područja EMZ
S obzirom na valnu duljinu, odnosno pripadajuću energiju (frekvenciju
ili valni broj) EMZ je podjeljeno na nekoliko područja,Tablica 1.1.
Treba naglasiti da nema nikakve suštinske razlike u prirodi EMZ
unutar pojedinog područja. Razgraničenja su napravljena umjetno
na osnovi razlike u instrumentaciji potrebnoj za proizvodnju ili
detekciju EMZ, ali i prema energiji potrebnoj za pojedine interakije
unutar čestica tvari.
Tablica 1.1: Područja EMZ i pripadajuće spektrometrijske tehnike
| Spektralna
područja |
Valna
duljina |
Vrsta
interakcija |
Eksperimentalne
tehnike |
| područje
g-zraka |
0,005
- 1,4 A |
nuklearni
prijelazi |
Mössbauerova
spektrometrija |
| područje
rentgenskih zraka |
0,1
- 100 A |
prijelazi
unutarnjih elektrona |
spektrometrija
apsorcije rentgenskih zraka |
| ultraljubičasto
područje |
10
- 400 nm |
prijelazi
vanjskih elektrona |
UV-VIS;
AAS |
| vidljivo
područje |
400
- 700 nm |
prijelazi
vanjskih elektrona |
UV-VIS;
AAS |
| infracrveno
područje |
700
nm - 1 mm |
vibracije |
IR;
Raman |
| mikrovalno
područje |
1
mm - 1 dm |
rotacije |
spektrometrija
mikrovalne apsorpcije |
| radijovalno
područje |
>
1 dm |
promjena
spina jezgre i elektrona |
EPR;
NMR |
|