Precipitacija
CaCO3
Sastav precipitata
Sadržaj
drugih tvari u precipitiranom kalcijevu karbonatu rijetko prelazi
10 %. Strane tvari ili pripadaju mineralnom ili organskom detritusu
ili se izlučuju iz vodene otopine.
Oksidi
željeza oksidi, ako ih ima u precipitatu, potječu iz minerala koje
voda mehanički troši i, mada prisutni u maloj količini, mogu obojiti
sediment crvenosmeđim tonovima.
Silicijeva
dioksida ima u većim količinama (do 5 %). Kremen je mineralno-‑detritusnog
porijekla, dok amorfni SiO2 dolazi iz biljaka. Također
se talože čestice gline i drugih silikata.
Glavna
primjesa u precipitatu je magnezijev karbonat koji se izlučuje istodobno
sa kalcijevim, iako voda ne mora biti njime zasićena. Njegov udio
može doseći 20-ak posto. Zbog specifične strukture njegove kristalne
rešetke, magnezijev karbonat ne koprecipitira sa aragonitom. Jedan
dio magnezija može dospjeti iz rastrošenog, ali ne i otopljenog,
materijala.
Organske
spojevi mogu u sediment dospjeti iz vode u kojoj su otopljeni, organskog
detritusa ili supstarata organskog supstrata. Njihova količina smanjuje
se vremenom jer se razgrađuju, a prvi nestaju lako razgradivi spojevi
poput šećera i bjelančevina.
Elementarna
analiza pokazuje da se, uz elemente iz prije nabrojenih spojeva,
u sedimentu u značajnijim količinama javljaju stroncij, mangan i
fosfor.
|
Tablica 2.
Prosječni sadržaj pojedinih tvari u britanskim slatkovodnim
CaCO3 precipitatima. Netopljivo u kiselini: uglavnom
kremen, glina, Fe-oksidi i organska materija.
(Pentecost, 1993)
|
| |
|
Aktivni
travertin
|
Fosilni
travertin
|
|
| |
CaCO3
|
94,2
|
%
|
91,6
|
%
|
|
| |
Mg
|
1140
|
ppm
|
1180
|
ppm
|
|
| |
Sr
|
465
|
ppm
|
115
|
ppm
|
|
| |
Fe
|
1140
|
ppm
|
610
|
ppm
|
|
| |
Mn
|
190
|
ppm
|
137
|
ppm
|
|
| |
P
|
210
|
ppm
|
210
|
ppm
|
|
| |
Organski spojevi
|
1,66
|
%
|
1,33
|
%
|
|
| |
Netopljivo
u kiselini
|
3,44
|
%
|
6,60
|
%
|
|
|
|
|
|
|
|
|
Kontrola
sastava, kristalne morfologije i mineralogije
Već
je prije spomenuto da kalcijev karbonat uglavnom precipitira kao
kalcit i, tek ponegdje, u obliku aragonita. Dugi niz godina sastav
precipitata i njegova mineralogija povezivali su se sa količinom
magnezija u otopini, zapravo s omjerom količina magnezija i kalcija.
U
slatkoj vodi uz mali omjer magnezij/kalcij, do 2, kristalizira niskomagnezijski
kalcit u kojemu magnezija ima manje od 6 %. Gotovo sav kalcijev
karbonat istaložen u kopnenim vodama pripada kalcitu s niskom koncentracijom
magnezija. Veći Mg/Ca, kakav je rijedak u slatkoj vodi, uzrokuje
stvaranje visokomagnezijskog kalcita sa do 25 % magnezija.
I
precipitacija aragonita je povezivana sa omjerom Mg/Ca (DeGroot
i Duyvis, 1966; Muller et al., 1972; Folk, 1974;
Berner, 1975
) pa tako uz koncentraciju magnezija deset i
više puta veću od kalcijeve kristalizira CaCO3 kao aragonit
iako je ta modifikacija pri tim uvjetima termodinamički nestabilnija
od kalcita. Izlučivanje aragonita potiču i visoki pH, temperatura,
a čini se da utjecaja imaju i neki ioni u vodi. Sprečavaju taloženje
kalcita Mg2+, Cu2+, Zn2+, Ni2+,
Mn2+, a potpomažu stvaranje aragonita Mg2+,
Sr2+, Ba2+, Pb2+.
Proučavanjem
precipitata kalcijeva karbonata u prirodi i eksperimentima u laboratoriju
došlo se do saznanja da su morfologija, sastav i mineralogija kontrolirani
u prvom redu kinetički, barem što se tiče abiogene precipitacije.
Neki nalazi kalcijeva karbonata iskristalizirana iz morske vode
sadrže vrlo malo magnezija dok postoje spiljski aragonitni depoziti,
dakle iz vode s malom količinom magnezija.
Koeficijent
distribucije je mjera za raspodjelu magnezija između otopine i krute
faze kalcita. Mucci i Morse (1983) eksperimentom su utvrdili
da je koeficijent neovisan o brzini rasta kristala. Drugi hidrogeokemičari
dobili su drugačije rezultate. Berner (1975, 1978), Thorenston
i Plummer (1977, 1978) i drugi ustanovili su da ta ovisnost
ipak postoji. Prije diskusije o povezanosti udjela magnezija u kalcitu
i kinetike precipitacije potrebno je nešto reći o kristalnoj morfologiji
kalcita na mikroskopskoj i molekulskoj razini.
Kalcit
kristalizira u trigonskom sustavu, a najčešće se pojavljuje u obliku
više‑manje pravilnih romboedara iako su vrlo česte i forme
skalenoedar, heksagonska prizma i pinakoid. U prirodi kalcit iz
vodene otopine ponekad kristalizira kao ekvidimenzionalni romboedri,
ali nisu rijetki ni nalazi kristala izduženih u pravcu osi c
sa mnogo bridova koji se protežu okomito na izduženje. U pravilu
romboedri i izduženi kristali ne mogu se naći na istom lokalitetu,
a obično prvi pripadaju niskomagnezijskom, a ovi posljednji visokomagnezijskom
kalcitu.
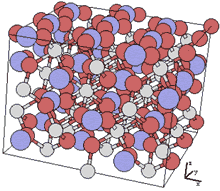
U kristalnoj rešetci
kalcita okomito na kristalografsku os c ioni su složeni u
ravninama koje sačinjavaju naizmjenično karbonatni i kalcijevi ioni
(slika 3). Uklapanje iona u rešetku na ovim ravninama ne odvija
se jednako ugradnji iona u ostale mrežne ravnine. Pri pH otopine
većem od 8 ili manjem od 8 uz suvišak kalcijevih iona prema karbonatnima
plohe na kristalu okomite na c uvijek imaju pozitivan naboj
(Somasundaran i Agar, 1967; Lahann, 1978) što
znači da su adsorbirani Ca2+ ioni. Energija dehidratacije
karbonatnih aniona, zbog njihove veličine, mnogo je manja od energije
dehidratacije iona kalcija.
|
Slika 3.
Prikaz kristalne rešetke kalcita.
|
 |
Stoga je za očekivati da brzina kristalizacije bude limitirana
dehidratacijom i koncentracijom kalcija. Upravo iz tih razloga je
degradiran rast kristala okomito na os c. U smjeru te osi,
međutim, brzina nije ograničena dehidratacijom Ca2+ jer
karbonatni ion ugrađen u kristalnu rešetku odmah za sobom povlači
kalcijev. U uvjetima kada je mala koncentracija CO32‾
u odnosu na Ca2+ (puno CO2) ili mnogo Ca2+
uz slabo zasićenjekalcitom (duboka hladna morska voda) rast uzduž
osi c je smanjen pa nastaju kristali koji su podjednako razvijeni
u sve tri dimenzije. No, uz mnogo karbonatnih iona, u prirodi najčešće
na mjestima gdje se rapidno smanjuje količina ugljikova dioksida
u vodi, produkt kristalizacije su izduženi bridasti kristali. Zapravo,
mehanizam rasta u smjeru osi c nešto je kompliciraniji jer
se ne odvija ponavljanjem bazne ravnine, već, vjerovatno, ravnine
(101ˉ1).
Vratimo se magnezijskoj komponenti precipitata. U svome eksperimentu
Mucci i Morse varirali su koncentraciju Ca2+ dok
su pH i p(CO2) održavali konstantnim. Za koeficijent
distribucije dobili su vrijednost 0,0123 prema kojoj bi morski precipitat
sadržavao 6 % magnezija. Ipak, na mjestima u moru sa istom
koncentracijom kalcijevih iona i omjerom Mg/Ca kristalizira kalcit
sa različitim udjelom magnezija. U tropima on može dostići 17 %,
ali u vodi sa više ugljikova dioksida ponekad ga ima manje od 4 %.
Lahann i Siebert (1982)
potvrdili su da se koeficijent distribucije otopina/krutina za magnezij
ipak mijenja s brzinom precipitacije. Ugrađivanje magnezija u kalcit
na ravninama paralelnim sa kristalografskom osi c proporcionalno
je o vrijednosti Mg/Ca, ali to nije jedini faktor koji regulira
ugradnju na njima okomitim ravninama. Magnezijevi iona su mnogo
jače hidratizirani od kalcijevih i ako je količina magnezija samo
funkcija odnosa energija hidratacije kalcija i magnezija kristalizira
gotovo čist kalcit. Premda je termodinamički stabilan samo kalcit
sa manje od 1 magnezija, može on koprecipitirati u mnogo
većoj količini.
Isti
mehanizam koji regulira izgradnju mrežnih ravnina okomitih na c
vrijedi i za kalcijeve i magnezijeve ione. To znači da se smanjuje
važnost dehidratacije pa, uz dovoljno karbonatnih iona, može se
ugraditi mnogo više magnezija. U sporijoj precipitaciji više je
vremena za sređivanje kristalne strukture te se i više otpušta magnezij
sa površine rastućeg kristala (Schoonmaker et al., 1982).
Koeficijent distribucije za ove ravnine povećava se sa brzinom rasta
kristala uzduž c. Dakle, iz vode sa niskim Mg/Ca može iskristalizirati
samo niskomagnezijski kalcit. Kod visokog Mg/Ca može nastati visoko
ili niskomagnezijski što ovisi o brzini precipitacije, točnije,
o koncentraciji karbonatnih iona.
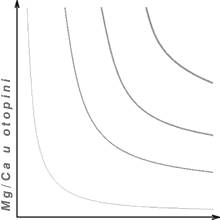
|
Slika 4.
Udio magnezija u percipitiranom kalcitu
kao funkcija Mg/Ca otopine i brzine rasta izražene preko koeficijenta
distribucije, tj. dostupnosti CO3. Debljina linija predstavlja
relativan sadržaj magnezija.
(prema Given i Wilkinson, 1985)
|
 |
Za koeficijent distribucije Lahann i Siebert utvrdili su
da se povećava ubrzanjem kristalizacije do 0,04. U moru, gdje je
Mg/Ca 5,1, sastav bi precipitata s takvom raspodjelom odgovarao
udjelu magnezija od 17 %. Marinski aragonit često se može naći
sa kalcitom upravo takva sastava. I kalcit i aragonit kristaliziraju
pri istom Mg/Ca, stoga ne može razlog nastanka druge modifikacije
biti veća količina magnezija prema kalciju. Visoka koncentracija
karbonatnih iona potiče izlučivanje kalcita sa mnogo magnezija,
no njenim daljnim povećanjem kristalizacija kalcita se zaustavlja
jer sada lakše nastaje aragonit.
Ima
mnogo primjera u prirodi koji potvrđuju kinetika kontrolira mineralogiju.
Aragonit kristalizira u uvjetima koji pogoduju izlaženju CO2
i zasićenju vode kalcijevim karbonatom visoka temperatura, nemirna,
plitka voda, isparavanje vode i slično. Upravo zato u spiljama mnogi
sedimenti su aragonitni iako magnezij može biti zastupljen samo
u tragovima.
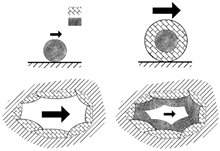
Neki bimineralni depoziti mogu zorno pokazati kako kristalizacijsko
mikrookruženje može imati važnu ulogu. Mineralni ooidi su granule
anorganski izlučenog karbonata. U Zaljevu Baffin u Texasu pronađeni
su ooidi sastavljeni od visokomagnezijskog kalcita i aragonita (Land
et al., 1979). Jezgra je kalcitna, a oko nje je sloj aragonita.
Protok vode, ujedno i doprema otopljenog karbonata, veći su preko
ooida većeg promjera pa se aragonit ne izlučuje dok nije postignuta
određena veličina. Istodobno, na mjestima sa većim i manjim valovima
postoje ooidi istog promjera, ali oni na izloženijem mjestu imaju
deblju aragonitnu koru. Morski cementi evoluiraju suprotnim putem.
Šupljine u stijenama popunjava isprva aragonitni precipitat. Kada
se pore smanje počinje taloženje kalcita.
|
Slika 5.
Shematski prikaz formiranja bimineralnih
depozita (gornji crtež - ooid, donji crtež merinski cement).
Veličina strelice predočava intenzitet vodene struje.
(prema Given i Wilkinson, 1985)
|
 |
|
Slika 6.
Ovisnost karakteristika abiogenih CaCO3
precipitata o uvjetima kristalizacije.
1. nisko Mg-kalcit, pravilni kristali
2. visoko Mg-kalcit, pravilni kristali
3. nisko Mg-kalcit, bradasti kristali
nisko Mg-kalcit, bridasti kristali
4. visoko Mg-kalcit, bridasti kristali
5. aragonit
(prema Given i Wilkinson, 1985)
|
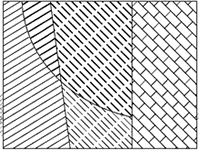 |
Povezanost morfologije, sastava i mineralogije abiogenih
precipitata kalcijeva karbonata, kinetike kristalizacije i količine
otopljenog magnezija prema kalciju prikazana je dijagramom na slici
4.
Ikait
je hidratizirani oblik kalcijeva karbonata, CaCO3 ˇ 6H2O,
koji se u prirodi susreće veoma rijetko. Laboratorijski je dobiven
1916. (Johnston et al., 1916), ali u prirodi je opažen tek
1962. u grenlandskom fjordu Ika (Pauly, 1963). Za stvaranje
i održavanje ikaita potrebna je anaerobna sredina i niska temperatura
(niža od 3 °C). Iako je pri uobičajenim temperaturama ikait topljiviji
u vodi od anhidridnih formi njegova topljivost se snizuje hlađenjem
(anhidridima se povećava), a ortofosfati kao inhibitori precipitacije
anhidrida ne sprečavaju taloženje ikaita (Bischoff et al,
1993).
Kristalizacija
kalcita
Najrašireniji
oblik kalcijeva karbonata u prirodi je kalcit, a ujedno i jedan
od najzastupljenijih minerala u Zemljinoj kori. Nije stoga čudno
što je vrlo dobro proučen, a mnogo su se istraživali i mehanizmi
kristalizacije i ostali fenomeni vezani uz precipitaciju kalcita.
Inicijacija kristalizacije
U
mnogim prirodnim vodama koncentracija kalcita je veća od zasićenja
pa ipak ne dolazi do precipitacije. Kristalizaciju ometa postojanje
energijske barijere, visoke čak i bez prisustva inhibitora.
Jedan
od načina odvijanja precipitacije je homogena kristalizacija. Započinje
oblikovanjem klustera molekula i iona u vodenoj otopini. Međusobnim
udruživanjem klustera u mikrokristal (kristalit) stvara se jezgra
budućeg kristala. Formiranje nukleusa energijski je vrlo zahtjevan
proces. Neophodna je tridesetak puta veća koncentracija otopine
kalcita od ravnotežne da dođe do homogene kristalizacije. U slatkim
vodama homogena kristalizacija je vrlo rijetka, ali ponekad se zbiva
u morskim lagunama.
Mnogo lakše
odvija se kristalizacija na čvrstu površinu. Kao centri heterogene
kristalizacije mogu poslužiti bilo kakve čvrste čestice u vodi,
najčešće mineralni i organski detritus, skeleti ili dijelovi skeleta
mikroorganizama, a, po nekim izvještajima, i mikrokolonije bakterija
(Chafetz i Folk, 1984). Najbolja podloga su postojeći kristalići
kalcita zbog istovjetnosti kristalne rešetke. Za heterogenu kristalizaciju
potreban je indeks zasićenja veći od 2 iako su ponekad nužna prezasićenja
5 do 10 puta (Reddy, 1983; Jacobson i Usdowski, 1975;
Dandurand et al., 1982).
Kinetika precipitacije kalcita
Izraz
za brzinu precipitacije koji se najčešće koristi u hidrogeokemiji
razvijen je prvotno za opisivanje otapanja kalcita (Plummer et
al., 1978), ali dobro opisuje i precipitaciju (Plummer et
al., 1979) PWP-model (Plummer, Wighley, Parkhurst):
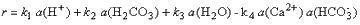
k1
k4 su
temperaturno ovisne kinetičke konstante, dok k4
ovisi i o aktivitetu H2CO3. Kasnijim eksperimentima
(Reddy et al., 1981; House, 1981; Suarez, 1983;
Inskeep i Bloom, 1981) utvrđeno je dobro slaganje kinetike
precipitacije s tim izrazom uz odstupanja uglavnom ne veća od 2
do 3 puta.
No
postoji velika razlika u brzini precipitacije iz nepokretne i turbulentne
vode. Otapanje i precipitacija uključuju difuziju između površine
kristala i otopine, tj. mjerenja u većem volumenu ne slažu se sa
stvarnom situacijom na površini kristala. Granični sloj debljine
je mikrometra do desetinke milimetra što ovisi o hrapavosti površine,
viskoznosti tekućine i brzini protjecanja. Postoji još jedan mnogo
tanji sloj (debljine nekoliko molekula) odmah uz površinu kristala
u kojemu se nalaze molekule i ioni slabo vezani na kristal (Plummer
et al., 1979).
PWP-model
ne uključuje postojanje difuznog sloja. Buhmann i Dreybrodt
(1985, 1985, 1987) te Dreybrodt i Buchmann (1991) dopunili
su model uzevši u obzir transport difuzijom, ali i sporu reakciju
hidratizirana ugljikova dioksida:
CO2(aq)  HCO3‾ + H+
HCO3‾ + H+
U
jednom terenskom istraživanju u klancu Huanglong u Kini (Zaihua
et al., 1995) rezultati dopunjenog PWP‑modela slagali
su se sa izmjerenima. Brzina precipitacije izračunata standardnim
PWP-modelom bila je u brzoj vodi 5 10, a u nepokretnoj 10 50
puta veća od izmjerene. Izračunata precipitacija prema PWP-modelu
je u većini toka potoka Falling Spring (Virginia, SAD) 1,1 19
puta veća, a na vodopadu 1,6 46 puta manja nego izmjerena prema
promjeni koncentracije iona (Herman i Lorah, 1988).
Taloženje
CaCO3 nekoliko puta veće iz turbulentne vode objašnjava
nastanak barijera i ostalih sedrenih tvorevina u tekućicama. Na
ovim mjestima dodatno ubrzavaju precipitaciju jače isplinjavanje
CO2 i više suspendiranih čestica kao jezgri kristalizacije
(Nielsen, 1964; Berner, 1980).
Inhibitori precipitacije kalcita
Kako
je prije spomenuto, kristalizaciju kalcita otežavaju ioni teških
metala bakar, cink, nikal, mangan i drugi. Oni se ugrađuju u kristalnu
rešetku, remete je i tako sprečavaju odlaganje kalcija. Zbog svoje
specifične strukture, kristalna rešetka kalcita ima sposobnost adsorpcije
mnogih drugih iona, pa čak i tako velikh kao što je uranil. Adsorpcija
tvari ima za posljedicu dvije pojave inhibiciju precipitacije
i uklanjanje te tvari iz vodene otopine, a ponekad uzrokuje i promjene
u kristalnoj morfologiji.
Od anorganskih
inhibitora u prirodi najvažniji su magnezij i fosfati. Magnezijevi
ioni nisu osobito efikasni u ometanju kristalizacije kalcita, ali
se u mnogim vodama nalaze u velikoj koncentraciji, često većoj od
kalcijeve. Reddy i Nancollas (1976) zabilježili su veći učinak
magnezija tek s koncentracijom 10‾3 mol dm‾3.
Mnogo jači inhibitor su fosfatni anion i slični spojevi fosfora
(Berner, 1975; Morse, 1983). Već 60 mg/L ortofosfata
sprečava precipitaciju (Mason, 1967). Osim otapanjem minerala,
fosfati mogu dospjeti u vodu kao proizvod ljudskog djelovanja.
Organski
spojevi onemogućavaju precipitaciju na dva načina. Sa kalcijevim
ionima u otopini stvaraju kelate i time smanjuju aktivitet kalcija.
Istodobno imaju sposobnost adsorpcije na površinu kristala te djeluju
slično ionima metala i fosfatima. K tome, u većim količinama, spojevi
sa kiselim skupinama snizuju pH. Glavni organski spojevi sa kompleksirajućim
i adsorpcijskim svojstvima u prirodi su kiseline velike molekulske
mase koje nastaju raspadanjem organske tvari, a najviše humična
i fulvična, poliaromatske organske kiseline sa mnogo hidroksidnih
i karboksilnih skupina kojima se mogu povezati sa ionima u komplekse
ili na površinu kristalne klice. Već u vrlo niskim koncentracijama
organski spojevi reduciraju kristalizaciju kalcita (Hoch et al.,
1998: 0,2 mg/L usporava rast kristala, 5 mg/L potpuno
inhibira).
Biološki faktori u precipitaciji kalcijeva karbonata
Velik
broj živih vrsta, posebno morskih, povezan je na različite načine
sa precipitatima kalcijeva karbonata. Predstavnici spužvi, člankonošaca,
koralja mekušaca, crvenih algi, parožina, bundeva i vrste iz mnogih
drugih skupina imaju izlučen kalcit ili aragonit u pojedinim tkivima,
najčešće za povećanje mehaničke čvrstoće tkiva. CaCO3
kristaliziran unutar organizma nije tema ovog rada.
Postoje eksterni precipitati za koje je sigurno da su biogeni.
Na primjer neke morske zelene alge (Dasiycladaceae, Codiaceae)
stvaraju na sebi omotač od igličastih kristala aragonita. I za kalcit
na vodenom bilju i cijanobakterijama u slatkoj stajaćoj vodi smatra
se da je, barem dijelom, izlučivanje potaknuto fotosintetskim djelovanjem
organizama, a potpomognuto i asimilacijom nekih inhibitora npr.
fosfata (Stoffers, 1975; Denffer, Ehrendorfer i Mägdefrau,
1978). Bakterijske kolonije, osim što mjenjaju okolnu vodu transpiracijom
i produktima metabolizma, kao kristalizacijski centri sudjeluju
u precipitaciji CaCO3, čak do 90 % kalcita u nekim
hidrotermalnim travertinima bogatim sulfidom (Chafetz i Folk,
1984).
 |
|
Slika 7.
Precipitati kalcijeva karbonata iz depozita
travertina, jugozapad Colorada. 1) aragonitne hemisfere na
površini vode. 2) bimineralni mjehurići. Razbijen je pa se
vidi glatka unutrašnja stijenka. 3) anorganski istaložen kalcijev
karbonat na bakru. Pravilni kristali kalcita, aragonita vrlo
malo. 4) shema bimineralnog mjehurića: a - mjehurić fotosintetiziranog
kisika i CO2 iz okolne vode; b - plosnati zvjezdasti klusteri
nježnih aragonitnih kristala, debljina sloja 10 - 20 žm -
najveći Izas; c - sloj hemisfere radijalno raspoređenih aragonitnih
iglica, 10 - 20 žm - srednji Izas; d - kristali kalcita (20
- 40 žm), radijalno raspoređeni, ponekad lagano izduženi.
(prema Chafetz et al., 1991)
|
O ulozi živih organizama u taloženju CaCO3
iz tekuće vode postoji nekoliko mišljenja. Zastupnici abiogene precipitacije
ne smatraju biljke osobito važnima ili potpuno zanemaruju njihov
utjecaj. Vodeni organizmi predstavljaju tek podlogu na kojoj se
odvija kristalizacija karbonata ili hvataju iskristalizirane čestice.
U nekim slučajevima dokazano je da se precipitacija može odvijati
bez organizama. Bakrovi ioni otrovni su za niže organizme u vrlo
niskoj koncentraciji (oligodinamsko djelovanje). Stoga bakar u vodi
ne može obrasti algama i cijanobakterijama. Postavljanjem bakrenih
objekata na pojedina mjesta u toku može se utvrditi da li su fotosintetski
organizmi neophodni za procese kristalizacije karbonata. U nekim
slučajevima stvara se doista prevlaka od kalcijeva karbonata (Chafetz
et al., 1991), no ima izuzetaka (Srdoč et al., 1985).
 |
|
Slika 8.
SEM snimke bioaktivno deponiranog kalcit
sa uklonjenom organskom tvari (JZ Colorado). Kristali su dobro
razvijeni romboedri ili pločaste forme. Mnogi imaju rupu u
sredini koja vjerovatno potječe od vlakanaca mikroorganizama.
Mnoge ljušturice dijatomeja još se vide na precipitatu.
(Chafetz et al., 1991)
|
Da fotosintetski
organizmi mogu doprinijeti formiranju uvjeta precipitacije i u tekućoj
vodi dokazao je Chafetz sa suradnicima (Chafetz et al.,
1991) na jednom potoku u američkoj saveznoj državi Colorado. Na
listovima u vodi izlučeni kisik zaostaje u obliku mjehurića. CO2
ulazi u mjehuriće i okolna voda postaje vrlo prezasićena s obzirom
na CaCO3. Oko mjehurića kristalizacija je vrlo brza pa
nastaju dva različita sloja aragonita. Zasićenje postaje manje i
potom kristalizira kalcit. Na površini vode također se rapidno smanjuje
koncentracija CO2 i tu nastaju aragonitne hemisfere (sl.
7.1, 7.2). Na istome mjestu na bakru kristalizira CaCO3 kao kalcit
s vrlo malo aragonita (sl. 7.3). Dotični potok formira se iz dvaju
izvora vrlo bogatih otopljenim karbonatom i ugljikovim dioksidom
(Izas: 2,1 63; p(CO2): 1,2ˇ105
Pa 8,2ˇ102 Pa) pa ostaje upitno koliku ulogu imaju
produkti fotosinteze u prosječnoj prirodnoj vodi, ali primjer pokazuje
da može postojati ogromna razlika u svojstvima tankog sloja vode
koji okružuje organizam i ostatka otopine na koji se djelovanje
prenosi difuzjom i cirkulacijom vode.
Obično
se ranije biogeneza povezivala sa fotosintetskom aktivnošću organizama.
Nepostojanje promjena u ukupnom toku vode koja bi upućivala na biološki
poticanu precipitaciju tumačena su kao izostanak utjecaja organizama
(Usdowski et al., 1979; Dandurand et al., 1982; Lorah
i Herman, 1988). Istraživanja skenirajućom elektronskom mikroskopijom
donijela su nov pomak u istraživanjima. Zapaženo je da su kristali
precipitata iz tekuće vode često probušeni (Love, 1085; Emeis
et al., 1987; Winsborough i Golubić, 1987; Utech,
1988; Chafetz et al., 1991). Šupljina potječe od vlakna biljke
ili cijanobakterije, a prolazi centralno kroz kristal (slika 8).
Položaj šupljine znači kontrolu rasta od strane organizma. Da je
on samo pasivni supstrat, rast bi bio radijalan. Također je ustanovljeno
da se precipitacija ne odvija na ljušturi dijatomeja već na stapki
na nekoj udaljenosti od ljušture (Winsborough i Golubić,
1987). Kristali koji precipitiraju abiogenetski nemaju šupljine.
Ovime
je naglasak stavljen na epiftske vodene mikroorganizme, odnosno
preifiton, na višem vodenom bilju, stijenju i drugim objektima u
vodi. Ostaje nepoznato na koji način upravljaju cijanobakterije
i alge kristalizacijom oko vlakana. Posredno preifiton može pomoći
stvaranju većih naslaga CaCO3 zadržavanjem kristalića,
koji mogu iskristalizirati na drugom mjestu ili biti dio mineralmog
detritusa, na ljepljivom mukoznom omotaču (Emeis et al.,
1987).
Koliko je kalcijeva karbonata precipitirano u slatkoj vodi anorganskim
putem, a koliku zaslugu imaju živi organizmi? Na nekim nalazima
ne može se primjetiti djelovanje mikroorganizama (npr. Zaihua
et al., 1995), ponegdje se precipitacija odvija i anorganski
i biogenezom (Chafetz et al., 1991). S druge strane, katkada
postojanje perifitona je nužno za precipitaciju, kao što je dokazano
za barijere Plitvičkih jezera (Srdoč et al., 1985).
|