Strukture molekula interhalogenih spojeva
Svi neutralni molekulski interhalogeni spojevi su dijamagnetični
i sastoje se od centralnog atoma težeg halogena okruženog s atomima
lakšeg halogena. Građu molekula interhalogenih spojeva određuje
broj atoma lakšeg halogena vezanih na centralni atom, ali i prisutnost
nepodijeljenih elektronskih parova centralnog atoma. Spojevi tipa
AB su, naravno, linearne građe, a njihovom reakcijom s halidnim
anionima nastaju kompleksni anioni tipa AB2-
(ICl2-, IBr2-)
ili ABC- (IBrF-,
IBrCl-). I ti anioni su linearno građeni,
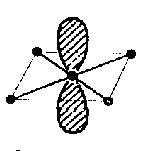
baš kao i anioni I3-
i Cl3-,
što se objašnjava dsp3 hibridizacijom
centralnog atoma joda, tako da njega okružuju tri nepodijeljena
elektronska para u ekvatorijalnoj ravnini trigonske bipiramide,
a ostali atomi nalaze se na apikalnim vrhovima (vidi sliku).
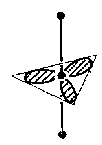
Struktura iona I3-
Reakcijom ICl3 s Lewisovim kiselinama
poput SbF5 i AsF5
nastaju soli kationa ICl2+.
Taj kation je, sukladno predviđanjima VSEPR modela, savinuta
molekula s kutom Cl-I-Cl od 97°.
Dok se BrF3 i ICl3
u krutom stanju sastoje od dimernih molekula, klorov trifluorid
sastoji se od planarnih molekula ClF3.
I ova struktura objašnjava se sp3d
hibridizacijom centralnog klorovog atoma tako što fluorovi atomi
zauzimaju dva apikalna i jedan ekvatorijalni položaj, dok preostala
dva ekvatorijalna vrha trigonske bipiramide zauzimaju elektronski
parovi.
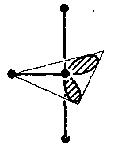
Građa molekule ClF3
Odstupanja od idealne geometrije trigonske bipiramide se kod ClF3
objašnjavaju različitim odbijanjima između nepodijeljenih elektronskih
parova te fluorovih atoma.
Ion ICl3F-
koji nastaje reakcijom ICl3 s fluoridima
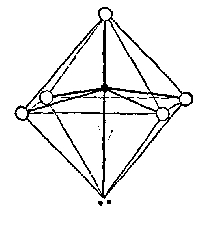
metala građen je jednako kao i anioni ICl4-
i BrF4- koji
nastaju reakcijom odgovarajućih metalnih halida i interhalogena.
Ioni su planarni, a atomi lakšeg halogena okružuju centralni atom
u vrhovima kvadrata. Ovakva struktura objašnjava se sp3d2
hibridizacijom centralnog atoma joda ili broma, s time da atomi
lakšeg halogena zauzimaju ekvatorijalne vrhove oktaedra, a elektronski
se parovi nalaze u apikalnim vrhovima (vidi sliku).
Građa iona ICl4-
i BrF4-
Pentafluoridi BrF5 i IF5
imaju strukturu tetragonske piramide kojoj se u uglovima nalaze
atomi fluora, a atom broma ili joda nalazi se malo iznad centra
baze piramide:
Građa molekula BrF5 i IF5
I ova struktura objašnjava se sp3d2
hibridizacijom centralnog atoma u kojoj je samo jedan apikalni vrh
zauzet sa slobodnim elektronskim parom.
Reakcijom BrF5 s jakim oksidacijskim
sredstvima poput [KrF+][AsF6-]
nastaju soli kationa BrF6+
koji ima oktaedarsku strukturu.
Molekule jedinog poznatog heptafluorida i jedinog poznatog spoja
sa sedam kovalentnih veza na jednom atomu, IF7,
imaju oblik pentagonske bipiramide na čijim se uglovima nalaze atomi
fluora, s atomom joda u centru.
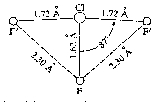
Reakcijom joda sa SbCl5 na 78 °C u tekućem
kloru nastaje kation I3Cl2+.
Taj kation je građen slično kao i kation I5+:
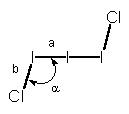
a = 2,90
b = 2,34
a = 93 o
Građa iona I3Cl2+
|