 |
1. U V O D
1.1. BOJA TVARI
Boja neke tvari uzrokovana je apsorpcijom svjetlosti. Ako tvar apsorbira dio vidljivog dijela spektra, tj. odgovarajuću boju, propušta ili odbija svjetlost ostalog dijela spektra i boja tvari je komplementarna apsorbiranoj boji. Ako tvar propušta fotone svih valnih duljina vidljivog spektra (oko 400 – 700 nm) ona je bezbojna; ako ih apsorbira crna je. Tvar je crvene boje ako apsorbira valne duljine od 400 do 600 nm jer propušta crveni dio spektra od 600 do 700 nm. Tvar je ljubičasta ako propušta valne duljine oko 400 nm, ali i ako propušta fotone iz ljubičastog, plavog i crvenog spektralnog područja. Znači da se samo na temelju boje ne može zaključiti koji dio spektra tvar apsorbira. Zato je potrebno snimiti apsorpcijski spektar, a metoda se zove apsorpcijska spektrometrija. Na slici 1. je apsorpcijski spektar crvenoljubičaste vodene otopine titanovog perklorata,
Ti(ClO4)3. Ta otopina sadrži kompleksni ion [Ti(H2O)6]3+ i vidi se da najjače apsorbira valne duljine iz zelenog dijela (max=492,6 nm), a najjače propušta crveni i ljubičasti dio spektra.
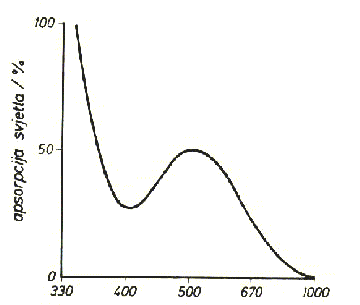
Slika 1. Apsorpcijski spektar [Ti(H2O)6]3+
1.2. ORGANSKI SPOJEVI S KONJUGIRANIM SUSTAVIMA I NJIHOVI APSORPCIJSKI SPEKTRI
Za apsorpciju su odgovorni atomi i molekule. Energija, tj. valna duljina i frekvencija apsorbirane svjetlosti jednaka je razlici energija višeg i nižeg (ili osnovnog) energetskog nivoa:
h = E2 – E1
Kada je E mala tvar apsorbira u vidljivom i vrlo bliskom infracrvenom području jer je energija obrnuto proporcionalna valnoj duljini. Vrijedi i obratno pa za veći E se apsorpcija pomiče prema ultraljubičastom.
Apsorpcijom energije elektroni mogu skočiti u viši energetski nivo istog atoma u molekuli ili se premjestiti u praznu orbitalu drugog atoma u molekuli. Pri tome nastaju tzv. elektronski spektri. Energiju potrebnu za te skokove i prijelaze imaju fotoni UV i vidljivog dijela spektra. To je tzv. UV-VIS spektroskopija.
Fotoni infracrvenog dijela spektra (blisko IR područje) imaju energiju dovoljnu da izazovu promjene energije vibracija (titranja) atoma u molekuli. Apsorpcijski spektri nastaju tako da pojedine skupine atoma npr. OH ili COOH u molekuli apsorbiraju IR svjetlost one frekvencije koja je jednaka frekvenciji titranja te skupine atoma. Energija IR svjetlosti se troši na simetrično istezanje (engl. symmetrical stretching), asimetrično istezanje (engl. asymmetrical stretching) i savijanje ili deformaciju (engl. bending).
Vlastita frekvencija svakog dijela molekule ovisi o masama međusobno povezanih atoma i jakosti veze među njima. Te su veličine različite za različite skupine atoma pa svaka skupina apsorbira karakterističnu valnu duljinu IR zračenja.
Valna duljina se često zamjenjuje valnim brojem koji je recipročna vrijednost valne duljine. Valnim brojem se označava položaj apsorpcijskih maksimuma. Energija dalekog IR područja mijenja energiju rotacije molekule. Spektri u IR području se nazivaju molekulskim spektrima, a metode su infracrvena, mikrovalna ili radiofrekventna spektroskopija.
Kod UV-VIS spektroskopije apsorpcija se izražava kao ekstinkcija E (ili optička gustoća ili apsorbancija). To je logaritam omjera inteziteta upadnog svjetla I0 prema intezitetu prolaznog svjetla I.
Kod normalne temperature kinetička energija molekula nije dovoljna da premjesti elektrone iz osnovnog stanja u pobuđeno. EM zračenje valnih duljina UV i VIS područja ima dovoljnu energiju za to. Pri tome se elektron premješta u višu orbitalu, a zračenje se apsorbira. Molekule imaju više od jedne pozitivne jezgre i kod prijelaza elektrona dolazi do promjene internuklearnih udaljenosti i promjene rotacijskih i vibracijskih energija. Zato apsorpcija nije vezana za jednu valnu duljinu nego se proteže preko širokog spektralnog područja i daje tzv. sistem-vrpce.
Jednostruke veze u organskim molekulama se sastoje od para elektrona u orbitalama tipa i apsorpcija u dubokom UV-području ista je kao i za molekulu vodika (pri prijelazu iz osnovnog stanja tj. g orbitale u višu u). Ako je prisutna dvostruka veza jedan je par elektrona u u orbitali, a viša g orbitala je prazna i ima jednu čvornu ravninu okomitu na C – C vezu. Energetska razlika između u i g orbitala je manja nego razlika između g i u što znači da su elektroni povezani slabije i da svjetlo niže energije (tj. veće ) može izazvati prijelaz. Ako su u molekuli prisutne dvije izolirane dvostruke veze ukupna apsorpcija je suma pojedinih apsorpcija. Ako su dvostruke veze konjugirane, valne funkcije svih četiri p-orbitala se udruže i daju novi niz molekulskih orbitala (slika 2.).
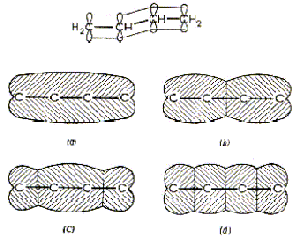
Slika 2. Konjugacija u 1,3-butadienu
Najstabilnija je u orbitala s jednom čvornom ravninom (a). Ali prema Paulijevom principu isključenja svaka, pa i u orbitala može imati najviše dva elektrona pa se zato drugi par elektrona nalazi u višoj g orbitali s dvije čvorne ravnine (b). Slijedeće više orbitale imaju dvije i tri čvorne ravnine okomite na prvi (c i d). Prijelaz koji zahtijeva najmanje energije i apsorpciju najveće valne duljine je b c pri 220 m.
Kako raste broj konjugiranih dvostrukih veza raste i broj -orbitala potrebnih za smještaj elektrona nezasićenosti. S povećanjem konjugiranih dvostrukih veza smanjuje se razlika između -orbitale u osnovnom stanju i orbitale u prvom pobuđenom stanju. Zato se apsorpcijski maksimumi pomiču prema crvenom (tablica 1.).
Tablica 1. Apsorpcijski maksimumi za konjugirane aldehide
Kada se u konjugaciji nađe osam ili devet dvostrukih veza, apsorpcija je u plavom području spektra, a spoj je žut. Povećanjem konjugacije boja se mijenja u narančastu, crvenu i purpurnu. Visoki intezitet apsorpcije u vidljivom području karakteristika je organskih bojila. Sva imaju (1) mnogo konjugiranih dvostrukih veza što je uzrok velikom broju -orbitala koje se malo razlikuju u energiji i (2) dvije ili više polarnih grupa koje su međusobno znatno razmaknute i uzrokuju velik prijelazni dipol.
1.3. PIGMENTI U PAPRICI I STRUKTURA ß-KAROTENA
U prirodi se javlja mnogo obojenih tvari čija se boja temelji na apsorpciji dijela vidljivog spektra sustavom konjugiranih dvostrukih veza. Narančasti i crveni pigmenti u voću i povrću, npr. rajčici, paprici, mrkvi, jagodi jesu ugljikovodici poznati pod nazivom karotenoidi. Karotenoidi se sastoje od više izoprenskih jedinica CH2=CHC(CH3)=CH2 koje su karakteristične za prirodne spojeve pod nazivom terpeni. Karotenoidi spadaju u tzv. tetraterpene. Tvore žuto do crveno obojene u mastima topljive pigmente biljaka. Nekoliko pigmenata obično dolazi zajedno i to u malim količinama. Po strukturi su vrlo slični i njihovo čišćenje pomoću uobičajenih metoda kristalizacije je bilo vrlo teško. Nagli razvoj na području kemije karotenoida započeo je primjenom kromatografske apsorpcije na aluminijevom oksidu, magnezijevom oksidu ili kalcijevom karbonatu. Upravo pri odvajanju karotenoida ova se tehnika ubrzano razvijala.
Crveni pigment iz zrele rajčice (Lycopersicum esculentum) je likopen, C40H56, aciklički tetraterpen. Njegova struktura je na slici 3.
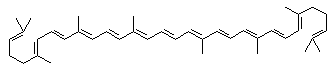
Slika 3. Struktura likopena
Najvažniji tetraterpeni su karoteni jer oni u životinjskom organizmu prelaze u vitamin A. Ime karoten potječe od žutog pigmenta mrkve (Daucus carota) iz koje je prvi put bio izoliran 1831. Primjenom metoda kromatografske apsorpcije identificirano je šest karotena koji su nazvani -, ß-, -, -, - i -karoten. Posljednja tri su dokazana pomoću apsorpcijskih spektara, a poznate su strukture samo prva tri izomera (slika 4.). U tablici 2. se nalaze podaci o sastavu ploda crvene paprike. Iz toga se vidi da postoji nekoliko spojeva koji određuju crvenu boju ploda.
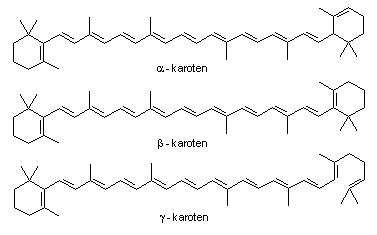
Slika 4. Izomeri karotena
Cijepanjem ß-karotena sisavci sintetiziraju vitamin A pa je ß-karoten provitamin. -karoten ima samo jedan -jononski prsten, dok je drugi prsten -jononskog tipa (slika 4. i 5.). Kod -karotena polovina molekule slična je ß-karotenu dok je druga polovina slična polovini likopenske strukture.
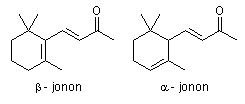
Slika 5. Strukture ß - jonona i - jonona
Životinjski organizam ne može izomerizirati -jononsku strukturu u ß-jononsku, a ne može ni ciklizirati krajeve likopenskog lanca u ß-jononski prsten. Zato je aktivnost - ili -karotena manja od aktivnosti ß-karotena, dok je likopen potpuno neaktivan.
Ukupne i relativne količine -, ß- i -karotena koje se nalaze u biljkama ovise o izvoru. Lišće sadrži približno 0,01% smjese karotena s obzirom na suhu težinu. Glavni sastojak ove smjese je -karoten. Količina -karotena varira od 0 – 35% ukupnih karotena, a količina -karotena je mnogo manja. Industrijska sinteza ß-karotena omogućila je njegovu upotrebu u bojenju hrane pa se tako mogu zamijeniti karcinogena azo-bojila.
Uz karotene biljke sadrže i žute pigmente poznate kao ksantofili ili ksantini koji sadrže kisik. Zajedno s karotenima ovi su spojevi uzrok jesenskoj boji lišća jer se zadržavaju nakon razgradnje zelenog klorofila. Žuto – crveni tetraterpeni koji sadrže kisik izolirani su i iz drugih izvora. Kisik može biti prisutan u obliku jedne ili više hidroksilnih grupa, jedne ili više karbonilnih grupa ili kao hidroksilna i karbonilna grupa.
Lutein, C40H56O2, dolazi u zelenom i žutom lišću te u žutom cvijeću. Zajedno sa zeaksantinom čini pigment žumanjka. Lutein je hidroksi – derivat ß-karotena (slika 6.).
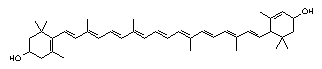
Slika 6. Struktura luteina
Zeaksantin, C40H56O2, je dihidroksi – derivat ß-karotena. Glavni je pigment žutog kukuruza, a u različitoj količini dolazi i u žumanjku jajeta (slika 7.).
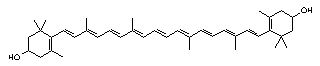
Slika 7. Struktura zeaksantina
Kriptoksantin, C40H56O, je monohidroksi – derivat ß-karotena. Nađen je slobodan i esterificiran u kukuruzu, mahunama i paprici, a glavni je pigment mandarine. Kriptoksantin ima polovicu aktivnosti vitamina A (slika 8.).
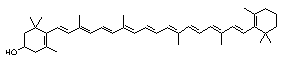
Slika 8. Struktura kriptoksantina
Rodoksantin, C40H50O2, primjer je ketonskih karotenoida. Budući da su u njega sve dvostruke veze konjugirane uključujući i veze karbonilnih grupa, njegove apsorpcijske vrpce leže dalje prema crvenom nego vrpce bilo kojeg drugog karotenoida (slika 9.).
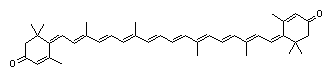
Slika 9. Struktura rodoksantina
Tablica 2. Sastav ploda crvene paprike
1.4. METODE PRIMJENJENE U POSTUPKU IZOLACIJE I DOKAZIVANJA PIGMENATA
1.4.1. EKSTRAKCIJA
Ekstrakcija je izdvajanje neke tvari iz otopine, suspenzije ili čvrste tvari pomoću otapala, tj. radi se o prijenosu tvari iz krute ili tekuće faze u otapalo. Tvar koja se ekstrahira mora u otapalu biti topljivija nego u polaznoj fazi. Već iz same definicije se vidi da postoje dvije vrste ekstrakcija: to su ekstrakcija tekuće – tekuće i ekstrakcija čvrsto – tekuće.
Kod ekstrakcije tekuće – tekuće dolazi do raspodjele tvari između dvije tekuće faze koje se ne miješaju. Takvo stanje predstavlja ravnotežu jer je nakon razdvajanja otapala na dva sloja omjer koncentracija u otapalima stalan bez obzira na volumene otapala i količinu otopljene tvari. Tu je pojavu formulom izrazio Nernst što je poznato kao Nernstov zakon razdjeljenja:
K=c1 / c2
pri čemu su c1 i c2 ravnotežne koncentracije (množinske ili masene), a konstanta K je koeficijent razdjeljenja. Vrijednost K je pri određenoj temp. stalna. Ako se uzme da je c1 koncentracija tvari u otapalu manje gustoće (to je gornji sloj) onda se iz koeficijenta razdjeljenja može vidjeti kako će se tvar ponašati kod raspodjele u otapala. Ako je K>1 onda je c1>c2 pa je tvar topljivija u otapalu manje gustoće i nakon ekstrakcije će koncentracija tvari u tom otapalu biti K puta veća nego u otapalu veće gustoće. Na isti se način analizira slučaj da je K<1. Topljivost tvari je funkcija njezine strukture pa različite tvari imaju i različit koeficijent razdjeljenja u istom sustavu dvaju otapala.
Prijelaz tvari se odvija na dodirnoj površini dvaju otapala pa je radi što veće uspješnosti i brzine ekstrakcije potrebno tu površinu povećati. To se postiže mućkanjem pa se ekstrakcija tekuće – tekuće često naziva izmućkivanje. Iz izraza za koeficijent razdjeljenja se vidi da se jednom ekstrakcijom ne može potpuno ekstrahirati tvar iz jednog otapala u drugo. Zato se ekstrakcija ponavlja više puta s manjim obrocima otapala, najčešće tri puta.
Kod izmućkivanja su tekuće faze najčešće voda i neko organsko otapalo koje se s njom ne miješa. Ovaj se postupak izvodi u lijevku za odjeljivanje (slika 10.).
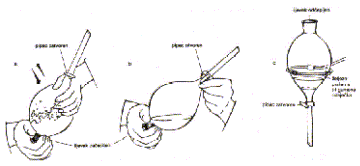
Slika 10. Postupak ekstrakcije u lijevku za odjeljivanje
U lijevak se ulije tekućina u kojoj je tvar otopljena i otapalo u koje se tvar ekstrahira. To otapalo treba biti kemijski indiferentno prema prisutnim tvarima, željena tvar treba biti što topljivija u njemu za razliku od primjesa u polaznom otapalu, razlika gustoća otapala treba biti što veća i vrelište ne previsoko (60 - 90 C) da se otapalo može lako otpariti. Lijevak se intenzivno protrese i ostavi da se slojevi razdijele. Kod izmućkivanja treba uvijek voditi računa o tome da u lijevku nastaje pretlak koji se mora izjednačiti s vanjskim tlakom otvaranjem donjeg pipca. Pri izmućkivanju može nastati emulzija, a taj se problem lako riješava dodatkom amil – alkohola ili zasićenjem vodene faze natrijevim kloridom. Nakon što se slojevi odijele potrebno ih je osušiti. Naime, određena količina vode se otopi u organskoj fazi, a dodatkom sredstva za sušenje se uklanja. Ta sredstva ne smiju reagirati ni s otapalom ni s otopljenom tvari. Najčešće se koriste bezvodni magnezijev i natrijev sulfat koji kristaliziraju kao heptahidrati, zatim bezvodni kalcijev klorid, kalijev hidroksid i dr. Bistra suha otopina se filtrira i zatim slijedi uparavanje otapala destilacijom ili otparavanjem pri normalnom ili sniženom tlaku. Najbolje je otparavati pri sniženom tlaku u rotacijskom otparivaču ili rotovaporu (slika 11.).
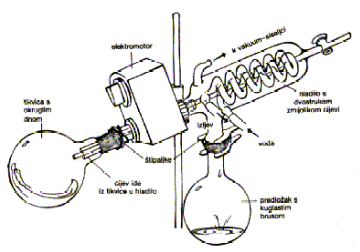
Slika 11. Rotacijski otparivač (rotovapor)
Kod ekstrakcije čvrsto – tekuće tvar se iz krutine (čvrste faze) izdvaja u tekuću fazu tj. otapalo. Organske molekule mogu biti uklopljene unutar čvrste faze ili mogu uz nju biti vezane međumolekulskim silama. Oslobađanje tih molekula iz čvrste faze se postiže prodiranjem otapala u blizinu molekula. To se ubrzava usitnjavanjem čvrstog supstrata. Ekstrakcija krutina se može izvesti kuhanjem s otapalom u tikvici s povratnim vodenim hladilom. To se naziva refluksiranje. Pare otapala izlaze iz tikvice, kondenziraju se u hladilu i vraćaju u tikvicu (slika 12.).
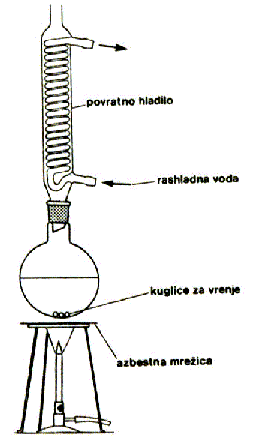
Slika 12. Aparatura za refluksiranje
Najbolje je postupak izvoditi u otapalu s vrelištem otprilike jednakim optimalnoj temperaturi reakcije. Nakon toga se vruća otopina dekantira ili filtrira. Najčešće slijedi ekstrakcija tekuće – tekuće radi što boljeg izdvajanja tvari.
Sve opisane postupke sam koristio radi pripreme uzoraka za kromatografska ispitivanja. Refluksiranjem sam ekstrahirao pigmente iz svježe paprike (slika 14.), ekstrakcijom tekuće – tekuće sam izdvojio pigmente iz mljevene paprike te isprao ekstrakt nakon refluksiranja (slika 15.).
1.4.2. TANKOSLOJNA KROMATOGRAFIJA (TLC)
Kromatografija je metoda odjeljivanja koja se zasniva na različitoj razdiobi (distribuciji) tvari između mobilne (MF ili eluens) i stacionarne faze (SF). Dvije faze sustava između kojih dolazi do raspodjele mogu biti: kruto – kapljevito (kromatografija na stupcu, tankoslojna kromatografija, kromatografija na papiru), kapljevito – kapljevito i kapljevito – plinovito (plinska kromatografija).
Tvar se raspodjeljuje između eluensa i adsorbensa, pri čemu se uspostavlja ravnoteža između dviju faza, što znači da dio tvari ostane adsorbiran na pločici, a dio se otopi u otapalu. Kako se otapalo kreće i odnosi otopljenu tvar, ravnoteža se poremeti i da bi se ponovno uspostavila, otapa se nova količina tvari u svježem pristiglom otapalu. S druge strane, otapalo odnosi sa sobom tvar u dio pločice na kojem još nema adsorbirane tvari, pa se ravnoteža uspostavlja tako da se dio tvari ponovno adsorbira na stacionarnu fazu. Pri tome dolazi do kontinuiranog niza adsorpcija i otapanja.
U adsorpcijskoj kromatografiji kao MF se upotrebljavaju otapala koja se razlikuju sposobnošću desorbiranja (eluiranja) pojedinih tvari sa SF. SF je kruta, najčešće silikagel ili aloks. Prema toj sposobnosti otapala se mogu svrstati u eluotropni niz:
voda > metanol > etanol > aceton > etil-acetat > dietil-eter > kloroform > metilen-klorid > toluen > tetraklorugljik > cikloheksan > heksan.
Što je tvar jače adsorbirana na SF koristi se otapalo (ili smjesa) s većom moći eluiranja (bliže početku niza).
Tankoslojna kromatografija ili TLC (engl. thin layer chromatography) se zasniva na razdiobi tvari između krutog adsorbensa i tekuće mobilne faze. Otapalo ili eluens se po krutom adsorbensu uspinje zbog kapilarnih sila. TLC se izvodi na metalnoj ili plastičnoj pločici presvučenoj tankim slojem krutog adsorbensa. Vrlo mala količina se kapilarom nanese na adsorbens. Pošto otapalo ishlapi, pločica se uroni u eluens tako da uzorak ostane iznad razine otapala (slika 13.). Zbog kapilarnih sila se eluens uspinje i različitim brzinama nosi tvar iz nanesene smjese. Mjesto na koje se nanosi uzorak se zove start, a fronta je zona najveće udaljenosti eluensa od starta. Kad se fronta otapala približi gornjem rubu pločica se izvadi i detektiraju se zone koje određuju mjesto pojedinih komponenata. Brzina prolaska tvari po pločici je proporcionalna udaljenosti do fronte pa na brzinu ukazuje Rf vrijednost (engl. related to front) koja je omjer prijeđenog puta tvari od starta (x) i udaljenosti fronte od starta (y) tj. x / y . Nisu li komponente već obojene, da bi se izmjerile Rf vrijednosti potrebno ih je učiniti vidljivima. To se postiže pomoću UV-lampe, kristalića joda ili prskanjem sumpornom kiselinom. Pločica s definiranim mjestima adsorbirane tvari se zove kromatogram.
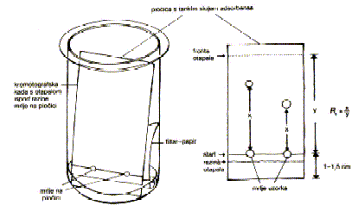
Slika 13. Tankoslojna kromatografija
TLC ima široku primjenu. Koristi se za utvrđivanje identičnosti tvari na osnovi istih Rf vrijednosti, za određivanje broja komponenata neke smjese i praćenje reakcije. Prije svake kolonske kromatografije se pomoću TLC pronalazi najpogodnije otapalo ili smjesa otapala za eluiranje. Koristi se i u preparativne svrhe. Za to služe tzv. preparativne ploče koje su presvučene debljim slojem krutog adsorbensa. Smjesa se nanosi na startnu liniju širinom cijele ploče, kromatogram se razvije, a nakon vađenja ploče iz otapala i detekcije zona slojevi na kojima se nalaze pojedine komponente se sastružu s ploče i ekstrahiraju otapalom.
2. C I LJ R A D A
Cilj rada je dokazati da crvena boja paprike nije jedan spoj baš crvene boje već da ona potječe od smjese pigmenata koji su i žuti i narančasti. To se dokazuje metodom tankoslojne kromatografije. Također, cilj je pokazati da mljevena paprika koja se koristi u domaćinstvu kao začin sadrži iste pigmente kao i svježa paprika. Pokušat će se pokazati da i u kobasicama postoje pojedini pigmenti koji se nalaze u paprici.
3. M A T E R I J A L I M E T O D E
3.1. MATERIJAL
U postupku izolacije i dokazivanja pigmenata u crvenoj paprici korišten je sljedeći pribor:
okrugla tikvica od 250 mL, 10 Erlenmeyerovih tikvica, 3 okrugle tikvice od 100 mL, 3 menzure od 50 mL, lijevak za odjeljivanje od 500 mL, 2 čaše od 150 mL, čaša od 2000 mL, Liebigovo hladilo, termometar, kristalizirka za vodenu kupelj, stativ, kleme, mufe i 2 prstena, 2 lijevka, tronog, azbestna mrežica, stakleni štapić, filter papir, pločice za kromatografiju sa slojem silikagela, kapilare, satna stakalca, kapaljke, spatula, rotovapor.
Od kemikalija korištene su sljedeće:
kloroform, toluen, jod, bezvodni natrijev sulfat, uzorak svježe paprike, mljevena paprika, uzorak kobasice, dest. voda.
3.2. METODE
Ekstrakcija pigmenata iz svježe paprike
Oko 10 g svježe crvene paprike se nasjecka na sitne komadiće (ne miksati). Takav se uzorak stavi u okruglu tikvicu koja je dio aparature za refluksiranje i tome se doda 50 mL kloroforma. Reakcijska se smjesa zagrijava preko azbestne mrežice do vrelišta kloroforma (61C) i refluksira se 10 – 15 minuta (slika 14.).
Nakon toga, smjesa se ohladi i otfiltrira. Filtrat koji je narančasto crvene boje se ulije u lijevak za odjeljivanje i izmućkava tri puta destiliranom vodom u obrocima od 50 mL (slika 15.).
Isprani filtrat se prelije u Erlenmeyerovu tikvicu u koju se doda 1 – 2 g bezvodnog natrijevog sulfata, Na2SO4, tikvica se začepi i ostavi 10 – ak minuta da sulfat veže preostalu vodu.
Slika 14. Ekstrakcija pigmenata refluksiranjem
Sadržaj tikvice se otfiltrira i dobiveni ekstrakt pigmenata iz svježe paprike se prelije u suhu Erlenmeyerovu tikvicu i začepi. Time je ekstrakt spreman za drugu fazu, a to je koncentriranje uparavanjem na rotacijskom otparivaču.
Slika 15. Slojevi vode i kloroforma (narančasto)
u lijevku za odjeljivanje
Ekstrakt se prelije u malu okruglu tikvicu od 100 mL koja se pričvrsti na rotovapor (dijelovi su od šlifanog posuđa pa je grlo tikvice dobro namazati silikonskom masti). U hladilo se pusti voda i uključi vodena sisaljka čime se smanji tlak u aparaturi. Voda u posudi se zagrijava i ekstrakt se upari na približno 1 mL (slika 16.). Zamjećuje se promjena boje u žarko crvenu jer su pigmenti sada koncentrirani u maloj količini otapala.

Slika 16. Uparavanje ekstrakta na rotovaporu
Ekstrakcija pigmenata iz mljevene paprike
Budući da mljevena paprika sadrži veću koncentraciju pigmenata ekstrakcija ne obuhvaća proces refluksiranja već je dovoljno pigmente jednostavno otopiti u kloroformu. U tu svrhu se u Erlenmeyerovu tikvicu stavi 2 – 3 žličice mljevene paprike i ulije 50 mL kloroforma. Sadržaj tikvice se intenzivno miješa 1 – 2 minute, a zatim se smjesa otfiltrira. Filtrat je tamnocrvene boje. Ispere ga se destiliranom vodom tri puta u obrocima od 50 mL. Preostala voda se ukloni pomoću 1 – 2 g bezvodnog natrijevog sulfata. Ekstrakt se filtrira i na rotovaporu upari na približno 1 mL.
Ekstrakcija pigmenata paprike iz kobasice
Kobasica se nareže na sitne komadiće i napravi suspenzija u destiliranoj vodi. Takva se suspenzija zagrijava u čaši preko azbestne mrežice tako dugo dok se ne izdvoji sloj narančaste boje koji pliva na vodi (sadrži masti). Zatim se taj sloj odvoji u posebnu tikvicu i doda 50 mL kloroforma te promućka kako bi se pigmenti ekstrahirali u kloroform. Taj se sloj narančaste boje ispire destiliranom vodom i dalje izmućkava i upari već opisanim postupcima.
Nakon priređivanja ekstrakata koji su upareni na približno 1 mL može se pristupiti tankoslojnoj kromatografiji. Na pločice presvučene slojem silikagela se kapilarom nanese uzorak svakog od ekstrakta na startnu liniju. Komora za kromatografiju se priredi tako da se u staklenu čašu ulije smjesa otapala kloroforma i toluena u omjeru CHCl3 : C6H5CH3 = 1 : 1. Razina otapala ne smije biti u visini startne linije. U čašu se stavi komad filter papira da se posuda zasiti parama otapala i sve se pokrije satnim stakalcem. Pločice s uzorcima se stave u čaše, a postupak se prekine prije nego otapalo stigne do gornjeg ruba pločice (slika 17.). Pločice se izvade, olovkom označi fronta otapala i pojedine mrlje pigmenata te se osuše.
Pločica sa uzorkom iz kobasice nije sadržavala dovoljno kvalitetne mrlje koje se mogu raspoznati pa ju je bilo potrebno izložiti parama joda. U posebnu čašu se stavi nekoliko kristalića joda, a kako jod ima visok tlak para čaša se vrlo brzo ispunila parama. Pločica se stavi u tu čašu i nekoliko minuta ostavi kako bi jod formirao s pojedinim mrljama komplekse žuto – smeđe boje. Zatim se pločica izvadi i olovkom označi položaj mrlja koje su vidljive.

Slika 17. Razvijanje kromatograma
4. R E Z U L T A T I
Dobiveni rezultati su u skladu s očekivanjima. Naime, bilo je za očekivati da će se u mljevenoj paprici nalaziti isti pigmenti kao i u svježoj, a također, ali s mnogo manje uspjeha, dokazana je prisutnost skupine pigmenta i u kobasici. To potvrđuju izmjerene i izračunate Rf vrijednosti u tablici 3. za svaki od tri slučaja.
Tablica 3. Rf vrijednosti za pigmente
Ovi se rezultati vrlo lijepo mogu vidjeti na kromatogramima na slici 18. Lijeva slika je kromatogram pigmenata iz svježe paprike dok je desna slika kromatogram pigmenata iz mljevene paprike. Na slikama se vide mrlje, njih devet, koje su zaokružene olovkom. Jasno se vidi da su rezultati gotovo identični.

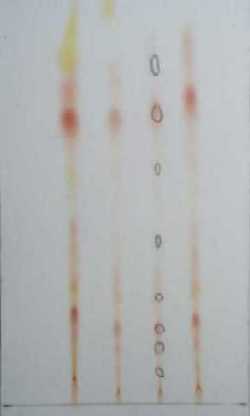
Slika 18. Usporedba kromatograma svježe i mljevene paprike
5. R A S P R A V A
Opisane i predložene metode za izolaciju tj. ekstrakciju pigmenata iz svježe crvene paprike kao i iz mljevene paprike pokazale su se učinkovitima. Kloroform, kao nepolarno otapalo koje se zato ne miješa s vodom prikladno je za postupak izolacije. Količina pigmenata crvene paprike u ekstraktu kobasice nije zadovoljavajuća zbog drugih prisutnih tvari koje utječu na uspješnost ekstrakcije kao što su masnoće i proteini, što upućuje na dodatne postupke u procesu izolacije.
Ovo je istraživanje jasno pokazalo da crvena boja paprike nije jedan spoj već da se radi o smjesi spojeva, pigmenata iz skupine karotenoida. Dokazivanje tih pigmenata je uspješno izvedeno uporabom tankoslojne kromatografije (TLC), a na pločicama se razlikuje devet skupina pigmenata. Također je dokazano da svi pigmenti nisu samo crvene boje, već ima prisutnih žutih pigmenata iz skupine ksantina (ksantofila), prije svega luteina i zeaksantina što je u skladu s navedenim literaturnim podacima u tablici 2.
Podaci iz tablice 3. pokazuju da se u svježoj paprici nalaze isti pigmenti kao i u mljevenoj paprici. Dobivene Rf vrijednosti, kao i kromatogrami sa slike 18. to potvrđuju. Takvi su se rezultati i očekivali jer se kod priređivanja mljevene paprike ne gube pigmenti. U kobasici je pronađen samo jedan pigment kojemu odgovara Rf vrijednost 0,73. Ako se to usporedi s kromatogramima svježe i mljevene paprike, može se zaključiti da je to pigment najjačeg inteziteta što upućuje na zaključak da je upravo taj pigment u čitavoj smjesi najviše zastupljen.
Ovim radom je također ustanovljeno da je pri odjeljivanju pigmenata tankoslojnom kromatografijom najbolje koristiti smjesu organskih otapala kloroforma i toluena koji se nalaze u omjeru 1 : 1. Razvijanje kromatograma je izvedeno i u čistom toluenu kao i u čistom kloroformu, no rezultati nisu bili zadovoljavajući budući da nije došlo do odjeljivanja pojedinih pigmenata tj. mrlja već su one bile razvučene. Navedenu smjesu se ne može koristiti dugo jer nakon određenog vremena kloroform ispari pri čemu se naruši optimalni omjer otapala.
6. Z A K LJ U Č A K
Metodama koje su upotrebljene pri izolaciji i dokazivanju pigmenata u crvenoj paprici može se vrlo lako pokazati da kod boje neke tvari često nije u pitanju samo jedan spoj već da ona proizlazi iz međusobne interakcije nekoliko različitih spojeva. Ovisno o koncentracijama pojedinih komponenata takve smjese, paprika ili neki drugi prirodni materijal kao npr. list je zelene, crvene ili žute boje. Ove boje posljedica su apsorpcije dijela vidljivog spektra sustavom konjugiranih dvostrukih veza koje su u velikoj mjeri zastupljene u organskih pigmenata.
7. L I T E R A T U R A
1. I. Filipović, S. Lipanović: Opća i anorganska kemija (I. dio); Školska knjiga, Zagreb, 1991. (353 – 356)
2. C. R. Noller: Kemija organskih spojeva; Tehnička knjiga, Zagreb, 1967. (657 – 667, 852, 863 – 866)
3. M. Sikirica, B. Korpar – Čolig: Organska kemija; Školska knjiga, Zagreb, 1998. (16 – 20, 40 – 41)
4. V. Rapić: Postupci priprave i izolacije organskih spojeva; Školska knjiga, Zagreb, 1994. (48, 52 – 56, 61 – 63, 92, 96)
5. S. Borčić, O. Kronja: Praktikum preparativne organske kemije; Školska knjiga, Zagreb, 1991. (10, 16 – 22, 38 – 41)
|
|

