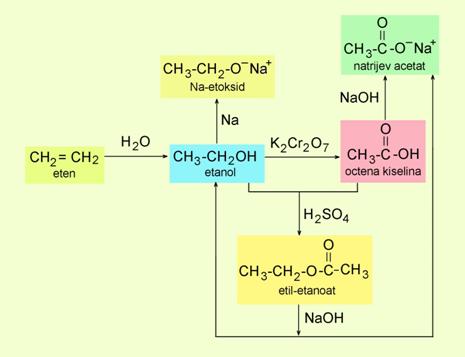
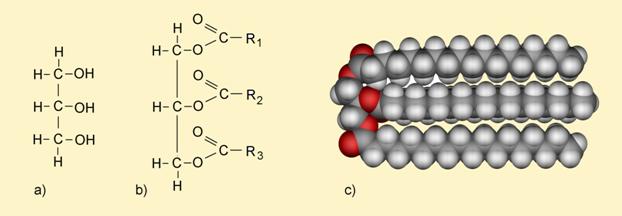
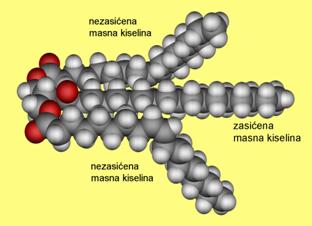
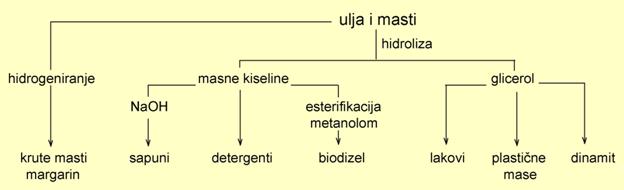
Milan Sikirica, Mihaela Vrbnjak Grđan, Karmen Holenda
e-Kemija
udžbenik za učenike osnovne škole
Drage učenice i učenici!
Pred vama je e-udžbenik prilagođen informacijsko- komunikacijskoj tehnologiji. Udžbenik se sastoji od 3 dijela;
POJMOVNIK sadržava šire objašnjenje pojmova koji su u udžbeniku podcrtani i otisnuti masno plavom bojom. Ako vam je pojam razumljiv, čitajte dalje, ako pak ne razumijete, kliknite na taj pojam i dobit ćete šire objašnjenje sadržano u POJMOVNIKU.
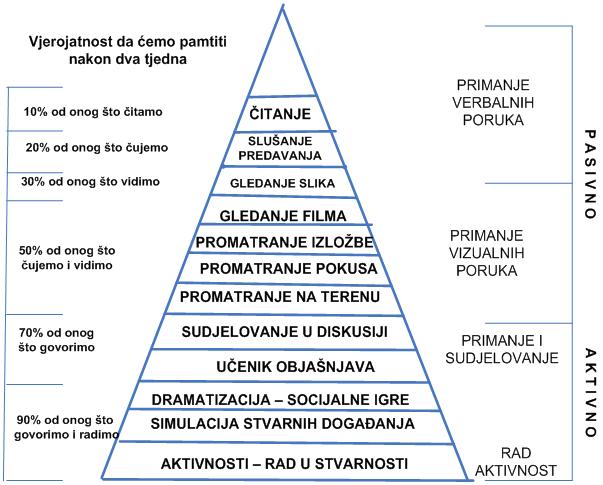
Sve
što
naučite napamet, to ćete i zaboraviti. No, sve što sami učinite,
vidite,
zaključite i izgovorite vlastitim riječima ostaje vam kao trajna
vještina,
sposobnost i uporabivo znanje.
Stožac iskustva (Prilagodio Bruce Hyland prema predlošku Edgara Dalea)
Izvor: https://bib.irb.hr/datoteka/284657.Edgar_Dale.doc
Kemija – znanost za sva vremena
Suvremena je kemija nastala kao ishod iskustva prikupljanog od samih početaka čovjekova postojanja. Kao znanje o tvarima i pojavama iskustvo se tijekom vremena nakupljalo i povećalo toliko da je promijenilo način života čovjeka pojedinca i njegove zajednice. To se dogodilo u doba neolitika, oko 8 000 godina prije Krista. U halkolitiku, oko 5 000 godina prije Krista, samorodni bakar zamijenio je kremen, a oko 3 000 godina prije Krista otkrivena je bronca. S brončanim dobom podudaraju se počeci drevnih civilizacija. Oko 1 500 godina prije Krista počelo se rabiti željezo istaljeno iz rude.
Prvotna se kemija razvila u Aleksandriji u prvim stoljećima nove ere. Aleksandrijski „kemičari” nastojali su pretvorbom bakra i drugih metala napraviti pravo zlato. No, teorija koju su slijedili nije bila kemijski dobra. Ipak su izumili pribor, naprave i peći za kemijske pokuse, otkrili destilaciju te dobili nove kemijske spojeve.
Aleksandrijsku „kemiju” u 9. stoljeću preuzeli su Arapi, načinili od nje alkemiju, koju je zatim, u 13. stoljeću preuzeo Zapad. Za alkemiju je karakteristično miješanje znanosti i magije, čuda i čaranja. Tražio se kamen mudraca kojim će se neplemenite kovine pretvoriti u zlato i životni eliksir kao opći lijek kojim bi se liječile sve bolesti i produljio život. Tijekom 16. i 17. stoljeća alkemija je procvala. Njome su se bavili čak i školovani ljudi. Plemići, knezovi i vladari nadali su se alkemijom doći do novca koji bi im osigurao bogatstvo i prestiž. Rudolf II., rimsko-njemački car, od 1572. godine kralj hrvatsko-ugarski, i sam se bavio alkemijom i na svom dvoru u Pragu zapošljavao alkemičare. Čak je i genijalni Newton, svestrani znanstvenik i istraživač, uporno izvodio alkemijske pokuse. Bio je uvjeren da sličnost kovina dokazuje mogućnost njihove pretvorbe. Ipak, alkemičari su u 16. i 17. stoljeću unaprijedili tehnologiju i metalurgiju, proizveli porculan, a u potrazi za ljekovitim kemikalijama otkrili mnoge kemijske spojeve.
U 18. stoljeću
razvila se tzv. pneumatska
kemija ili kemija plinova. Kemičari su
istraživali gorenje, disanje, svojstva zraka i drugih tada dostupnih
plinova.
Na kraju 18. stoljeća francuski znanstvenik Lavoisier
dokazao je da je gorenje spajanje s kisikom iz zraka, što je u to doba
bilo
epohalno otkriće. On je svojom knjigom Osnove kemije iz 1789. godine
postavio
temelje suvremene kemije jer je jasno pokazao što su elementarne tvari.
Elementarne tvari su primjerice zlato,
srebro, bakar, željezo, živa, olovo, aluminij, kisik i dr. Sva priroda
Zemlje i
svemira izgrađena je od samo 98 elementarnih tvari. Kemija je tek
Lavoisierovim
djelom postala prava znanost.
1. ŠTO RADE SUVREMENI KEMIČARI
Slika 1.2. Tipično radno mjesto jednog kemičara
1.1. Kemija u svakidašnjem životu
Mnogo prije nego je kemija postala znanost obrtnici su znali iskoristiti tvari (kemikalije) koje su našli u prirodi. Za štavljenje kože rabili su hrastovu koru, za pranje prirodnu sodu i lukšiju dobivenu iz pepela drveta itd. Znalo se da su ekstrakti dijelova nekih biljaka ljekoviti ili pak otrovni. Do tog se znanja došlo iskustvom. Istaljivanje metala, izrada glinenih predmeta, dobivanje i obrada stakla ili proizvodnja piva nije znanost nego obrt ili umijeće. Majstori lončari, talioničari i ljevači, staklari i pivari znali su odgovoriti na pitanje kako, a znanost počinje s odgovorima na pitanje zašto.
1.2. Kemijski laboratorij (radionica)
Bilo koja obrtnička radionica ili tvornica ne može se zamisliti bez odgovarajućih strojeva, uređaja, alata ili pribora potrebnih u radu. Kemičari se u svojim laboratorijima (lat. labor - rad, posao) također služe različitim uređajima, alatima i priborom. Zato, prije nego počnete izvoditi pokuse, morate upoznati najosnovniji laboratorijski pribor. Način rada s pojedinim priborom upoznat ćete postupno samostalnim izvođenjem pokusa.
Slika 1.4. a) Kemijski laboratorij ne može se zamisliti bez mnoštva bočica u kojima se čuvaju različite kemikalije. b) Za spremanje kemikalija nikada se ne smiju rabiti bočice od osvježavajućih napitaka, sokova ili bilo kojeg prehrambenog proizvoda. Možete se zabuniti i umjesto osvježavajućeg napitka popiti otrov.
Pokus 1. Upoznajmo osnovni kemijski pribor
U školskom ili bilo kojem drugom kemijskom laboratoriju nalazi se mnoštvo različitog pribora izrađenog od stakla, metala, drva ili plastike. Stakleni pribor je lako lomljiv pa je potrebno razviti neke vještine u radu s tako osjetljivim priborom. Kao što se plivanje uči plivanjem, tako se i vještina rada s laboratorijskim priborom stječe radom s tim priborom. Vještine su potrebne u svakom zanimanju, a stječu se samo radom.
Pokus 2. Mjerenje volumena tekućine – eksperimentalna pogreška
Ponovimo
Pri radu u kemijskom laboratoriju obvezno se nose zaštitne naočale.Sve su kemikalije opasne i otrovne i zato se ne smiju kušati.
Mnoge kemikalije nagrizaju kožu i zato ih se ne smije dirati prstima.
Pare različitih kiselina i drugih kemikalija jako nadražuju organe za disanje i zato ih se ne smije udisati.
U kemijskom laboratoriju ne smije se jesti ili hranu ostavljati na radnom stolu. Sve su kemikalije otrovne.
U kemijskom laboratoriju ne smije se pušiti jer su mnoge kemikalije zapaljive, a pušenjem se u organizam mogu nehotice unijeti štetne i otrovne tvari. Osim toga pušenje je samo po sebi štetno i nepovratno narušava zdravlje pušača.
Kemikalije se ne smiju prolijevati mimo posuda ili po radnom stolu. Svaku prosutu kemikaliju morate pažljivo skupiti, a stol više puta obrisati čistom vlažnom krpom. Višak neke kemikalije nikad ne vraćajte natrag u bocu u kojoj se inače čuva. Zato uvijek trebate uzeti ili odliti samo onoliko neke kemikalije (reagensa) koliko ćete i utrošiti.

Izradite plakat o jdnoj od tema:
a) laboratorijski pribor,
b) mjere opreza pri radu s kemikalijama.
Ne treba posebno dokazivati da se različite tvari međusobno razlikuju po fizikalnim svojstvima. Neke su tvari krutine, ali se međusobno razlikuju bojom, tvrdoćom, gustoćom, električnom i toplinskom vodljivošću, magnetičnošću, talištem i mnogim drugim svojstvima. Druge su tvari pri sobnoj temperaturi tekućine, opet različito obojene, različita vrelišta, gustoće ili viskoznosti. Plinovi se ne mogu opipati, ali se neki od njih mogu prepoznati po mirisu. Različite tvari razlikujemo na osnovi nabrojenih i mnogih drugih fizikalnih i kemijskih svojstava.
2.1. Gustoća
Napunite li posudu vodom i u vodu potopite neki predmet, on će istisnuti onoliko vode koliki je njegov volumen. To je jedno od bitnih fizikalnih svojstava tvari, a iskazano je zakonom o neproničnosti: dvije tvari (ili stvari) ne mogu u isto vrijeme biti na istome mjestu.
Pokus 3. Mjerenje gustoće Arhimedovom metodom
Gustoća je temeljno svojstvo tvari, jer tvar je sve ono što ima gustoću, odnosno ima masu i zauzima prostor. Gustoća tvari iskazuje se omjerom mase i volumena uzorka ispitivane tvari. SI jedinica mase je kg, a volumena m3. Prema tome SI jedinica gustoće jest kg/m3, ali se češće iskazuje kao g/cm3.
2.2. Električna i toplinska vodljivost
Kovine (metali) općenito su dobri vodiči topline i elektriciteta. Ipak, različite kovine različito provode toplinu i elektricitet. Srebro i bakar su najbolji vodiči električne struje. Oni su pet puta bolji vodiči električne struje od željeza. Zato se vodovi za električnu struju i namotaji u električnim strojevima izrađuju od bakra.
Općenito vrijedi pravilo da su tvari koje dobro provode električnu struju ujedno i dobri vodiči topline. Tako je bakar oko pet puta bolji vodič topline od željeza, a dva puta bolji od srebra. Nemetali su slabi vodiči topline i električne struje. Staklo je oko 400 puta, drvo oko 2 000 puta, a pluto čak 10 000 puta slabiji vodič topline od bakra. Tvari koje ne provode toplinu i elektricitet zovu se izolatori.
Pokus 4. Toplinska provodnost
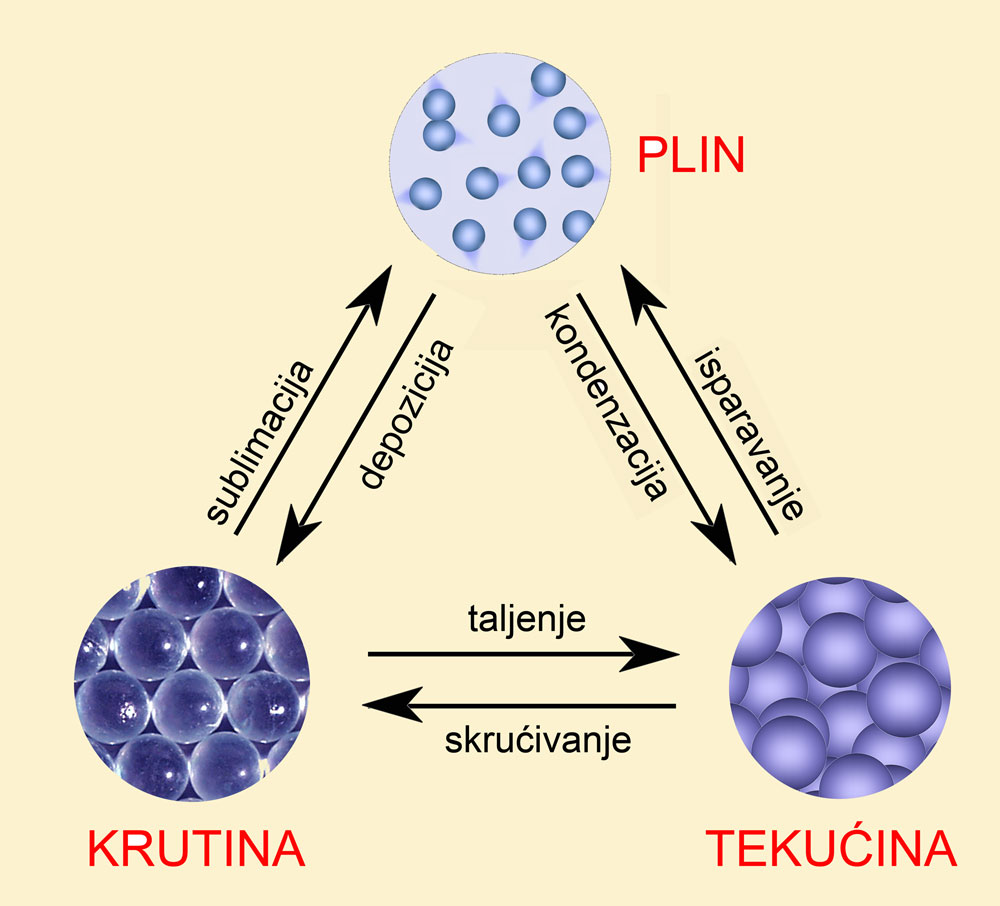
2.3. Agregacijska stanja tvari
Iz iskustva vam je poznato da su pri sobnoj temperaturi neke tvari krutine, kao npr. kuhinjska sol, šećer i bakar. Druge su tvari tekućine, npr. voda, ulje i alkohol. Zrak koji udišete je smjesa plinova, dušika, kisika, ugljikova dioksida, vodene pare i plemenitih plinova.

Slika 2.2. Čestice u krutinama slažu se na najgušći mogući način, najčešće s geometrijski pravilno uređenim razmještajem. Čestice se u krutinama ne mogu slobodno gibati, mogu samo titrati oko ravnotežnog položaja.
Krutine imaju stalan oblik, a mnoge kristaliziraju u obliku pravilnih geometrijskih tijela. Udarcem čekića neke će se krutine razmrviti, a većina metala promijenit će oblik. No, i pod najvećim tlakom volumen krutina ostaje gotovo nepromijenjen.
Krutine ne moraju nužno biti kristalizirane. Primjerice, staklo i mnoge plastične mase jesu krutine, ali imaju strukturu tekućina, odnosno kaotičan razmještaj čestica.
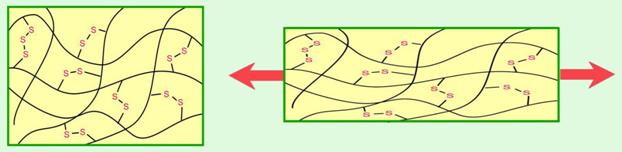
Slika 2.3. Čestice u tekućinama također su gusto složene jedna do druge, ali bez ikakva reda. Čestice u tekućinama mogu se gibati neovisno jedna o drugoj.
Tekućine poprimaju oblik posude, ali im je površina uvijek vodoravna. Tekućine i pod najvećim tlakom samo neznatno smanje volumen, pa se rabe u hidrauličnim sustavima automobila za kočenje i u hidrauličnim dizalicama.

Slika 2.4. Čestice plina daleko su jedna od druge. Kreću se velikom brzinom, nekoliko stotina metara u sekundi. Povišenjem temperature brzina čestica plina raste. Čestice plina manje mase pri istoj temperaturi kreću se brže od čestica veće mase. Tlak plina potječe od udaraca mnoštva čestica na stijenke posude.
Plinovi nemaju stalan oblik niti volumen. Čestice plina zauzeti će sav raspoloživi prostor. Gustoća plinova je mnogo manja od gustoće krutina i tekućina. Plinovi se mogu lako stlačiti. Sjetite se pumpanja lopte ili zračnica na biciklu.
Agregacijsko stanje neke tvari ovisi o jakosti privlačnih sila među česticama te tvari te o temperaturi i tlaku. Prijelaz tvari iz jednoga u drugo agregacijsko stanje neposredno je povezan s prijenosom topline između promatranog uzorka i okoline. Primjerice, dovođenjem topline led se postupno tali pa se dobije smjesa vode i leda. Sve dok se sav led ne rastali, smjesa vode i leda ima temperaturu 0 °C. Pri toj su temperaturi led i voda u ravnoteži. Obratno, hlađenjem voda se zaledi. Temperatura 0 °C zove se talište leda ili ledište vode. Talište ili temperatura taljenja leda i ledište vode jedna su te ista temperatura.

Slika 2.5. Na ohlađen komadić crnog papira uhvatite samo jednu snježnu pahuljicu i pogledajte jakim povećalom. Snježne pahuljice su voda u kristalnom stanju, odnosno kristali leda. Javljaju se u mnogo oblika, ali uvijek imaju šest krakova.
Pri normalnom atmosferskom tlaku svaka tvar ima vlastito, samo njoj svojstveno talište. Neke tvari, staklo i većina plastičnih masa, pri skrućivanju ne kristaliziraju već zadržavaju strukturu tekućine. Te tvari nemaju definirano talište već postupno omekšavaju.
Pokus 5. Taljenje stearinske kiseline - krivulja hlađenja
Zagrijavanjem vode njezina temperatura raste sve dok ne dosegne 100 °C. Pri toj temperaturi, pri normalnom atmosferskom tlaku, voda prelazi u plinovito stanje. Ta se temperatura naziva vrelište vode. Bez obzira na to koliko jako zagrijavali, temperatura kipuće vode se ne mijenja. Prijelaz tekućine u plin naziva se isparavanje.

Slika 2.6. Vrelište tvari ovisi o tlaku. U mnogim se kućanstvima za brzo kuhanje hrane rabe tzv. ekspres-lonci. U njima se hrana kuha pri povišenom tlaku. Pri tlaku višem od normalnog atmosferskog tlaka voda vrije pri temperaturi višoj od 100 °C, pa se hrana brže skuha. Pri tlaku nižem od normalnog atmosferskog tlaka, primjerice na visokim planinama, vrelište vode je pri temperaturi nižoj od 100 °C, pa hranu treba dulje kuhati.
Neke tekućine, primjerice različita eterična ulja, pa i voda, isparavaju već pri sobnoj temperaturi, odnosno ispod temperature njihova vrelišta. To je lako objasniti. Čestice se u tekućinama gibaju kaotično, različitom brzinom i smjerom. Događa se da se na površini tekućine međusobno sudare dvije ili tri čestice pa jedna od čestica poprimi tako veliku kinetičku energiju da može svladati privlačne sile okolnih čestica i izletjeti s površine. Zato iz otvorene posude eterično ulje nakon nekog vremena ispari, a njegov se miris osjeća u cijeloj prostoriji. Čestice se u plinovima gibaju velikim brzinama i zato se miris eteričnog ulja začas osjeti na suprotnom kraju prostorije.
Ako se iznad lonca s kipućom vodom postavi posude s hladnom vodom njezino se dno orosi jer se vodena para kondenzira u tekućinu. Neposredni prijelaz tvari iz plinovitog u tekuće agregacijsko stanje općenito se naziva kondenzacija. Tekućine i krutine su kondenzirane ili zgusnute za razliku od plinova. Pri kondenzaciji vodena para predaje toplinu posudi s hladnom vodom.
Plinovi i pare najčešće su nevidljivi. Vidljive su samo ljubičaste pare joda, crvenosmeđe pare broma i još nekih obojenih plinova. Slično je i s vodom. Kad voda proključa u čajniku, iz njega izlazi "para". Ne, to nije vodena para, već sitne kapljice vode nastale kondenzacijom vodene pare zbog naglog hlađenja. Već malo dalje od čajnika "para" nestaje zato što kapljice vode ispare, odnosno voda prijeđe u plinovito stanje i izmiješa se s okolnim zrakom.
Pokus 6. Sublimacija NH4Cl
Neke tvari pri zagrijavanju ispare prije nego se rastale. Prijelaz tvari iz krutog u plinovito stanje bez prethodnog taljenja zove se sublimacija. Sublimiraju primjerice kristali joda, kamfora, naftalena (naftalin), nekad popularnog sredstva protiv moljaca, i drugih tvari.

Slika 2.7. Ljubičaste pare iznad kristala joda. Jod sublimira već pri sobnoj temperaturi, pritom mali kristali nestaju, a veliki se još povećaju.
Pri opisivanju agregacijskih stanja tvari znanstvenici se služe kraticama. Krutine se označuju znakom (s), što potječe od latinskog solidus = krut. Tekućine se označuju znakom (l), što također potječe od latinskog liquidus = tekuć. Plinovi se označuju znakom (g) što potječe od gas = plin. Riječ gas izmislio je nizozemski liječnik van Helmonth na temelju grčkog chaos = nered.
Ponovimo
Zagrijavanjem led se tali pa nastane voda. Zagrijavanjem vode do ključanja nastane vodena para, a njezinom kondenzacijom ponovno se dobije voda. Led, voda, vodena para, to je jedna te ista tvar, samo u različitim agregacijskim stanjima. Takvu vrstu promjene pri kojoj se tvari ne mijenjaju zovemo fizikalnom promjenom. Kad kipar dlijetom i čekićem kleše komad mramora, iz njega će nastati skulptura. Mramor je samo promijenio oblik, ali i skulptura i otklesani komadići mramora ista su tvar. Udarci čekića i dlijeta po mramoru izazvali su samo fizikalnu promjenu.
Pokus 7. Kemijska promjena
Kad se komadići mramora stave u čašu s octom ili klorovodičnom kiselinom, kakva se u kućanstvu rabi za čišćenje sanitarnih uređaja, nastaje plin. Komadići mramora postupno se smanjuju i nakon nekog vremena potpuno otope.

Slika 3.1. Ljuska jajeta i mramor sastoje se od iste tvari, kalcijeva karbonata. Otapaju se u octu i pritom nastaje plinoviti ugljikov dioksid. To je onaj plin koji se oslobađa kad otvorite bocu s kiselom vodom ili nekim gaziranim napitkom.
Međusobnim djelovanjem mramora i octa, ili klorovodične kiseline, nastale su nove tvari drukčijih svojstava. Kaže se da su mramor i ocat, ili mramor i klorovodična kiselina, međusobno kemijski reagirali. Takvu vrstu promjene pri kojoj iz jednih tvari nastaju druge tvari drukčijih fizikalnih i kemijskih svojstava zovemo kemijskom promjenom.
Pokus 8. Je li gorenje svijeće fizikalna ili kemijska promjena
Uzmite svijeću i opišite njezina svojstva, oblik, boju, tvrdoću, opip, topljivost u vodi itd. Istražite je li gustoća materijala od kojeg je načinjena svijeća veća ili manja od gustoće vode. Upalite svijeću i pokušajte uočiti što više različitih svojstava njezina plamena. Obrazložite promjene koje se događaju pri gorenju svijeće. Koje su od opaženih promjena fizikalne, a koje kemijske?

Slika 3.2. Kad se drveni štapić nakratko unese u plamen svijeće, on pougljeni na rubnim dijelovima plamena gdje je najveći dotok svježega zraka i najviša temperatura. Srednji dio plamena svijeće je relativno hladan jer tu svijeća gori uz nedostatan dostup zraka.
3.1. Fiziološko djelovanje tvari
Pokus 9. Podržava li ugljikov dioksid gorenje i disanje
Kad se u visokoj čaši na sodu bikarbonu dolije ocat, smjesa se zapjeni jer se razvija ugljikov dioksid. Gustoća ugljikova dioksida veća je od gustoće zraka pa ga se skuplja u posudama s otvorom okrenutim prema gore. Upaljena se svijeća ugasi u čaši s ugljikovim dioksidom.
Ugljikov dioksid nastaje kao jedan od produkata gorenja drveta, ugljena, benzina, zemnog plina i drugih zapaljivih tvari. Na nekim mjestima ugljikov dioksid izlazi iz zemlje. Kako mu je gustoća veća od gustoće zraka nakuplja se u dubokim bunarima. Nastaje i pri alkoholnom vrenju grožđa i drugog voća pa se nakuplja u donjem dijelu podruma. Ugljikov dioksid ne podržava gorenje i disanje. Zato podrum ili duboki bunar treba prisilno provjetriti i ispitati upaljenom svijećom prije nego u njih uđe čovjek.

Slika 3.3. U podrum u kojemu vrije mošt ulazi se s upaljenom svijećom. Ako se svijeća ugasi to je siguran znak da se u podrumu nakupio ugljikov dioksid.
Ose, pčele, zmije i neke vrste riba proizvode otrove koji im služe za obranu. Južnoamerički Indijanci, a i neka afrička plemena, znaju iz određenih vrsta biljaka proizvesti otrove kojima mažu vrhove svojih strelica pa se njima služe u lovu. Otrov sa strelice paralizira životinju tako da blokira djelovanje acetilkolina koji sudjeluje u prijenosu živčanih impulsa. Ti se otrovi u vrlo malim količinama danas rabe u bolnicama pri kirurškim zahvatima jer izazivaju opuštanje mišića. Mogli bismo tako u beskraj nabrajati tvari prirodnog podrijetla koje imaju različite fiziološke učinke (fiziologija, grč. fysis – priroda + logos – riječ, znanost koja proučava životne pojave i procese).
Kemičari su u laboratorijima proizveli mnoge tvari kojih nema u prirodi, a koje imaju određene fiziološke učinke. Neugodne komarce koji nas ljeti grizu, ali ujedno i prenose neke bolesti, prskamo tvarima koje paraliziraju njihov živčani sustav pa ugibaju. Kemijska industrija proizvodi velike količine pesticida različite namjene, kao što su herbicidi (lat. herba – biljka + occidere – ubiti) koji služe za uništavanje nepoželjnih korova u usjevima, fungicidi (lat. fungus – gljiva) koji se rabe za suzbijanje štetnih gljivica na usjevima, voću i povrću, insekticidi koji služe za borbu protiv insekata itd. Sve se to radi s ciljem povećanja proizvodnje hrane. Ipak, ta su kemijska sredstva otrovna za ljude, ribe, pčele i druge korisne životinje. Zato se moraju rabiti u umjerenim količinama, točno prema uputi, kako ne bi došlo do zagađenja hrane, vode i tla. Danas se protiv najezde insekata čovjek sve češće bori prirodnim sredstvima koja ne zagađuju okoliš.
Konačno, kemičari su proizveli i mnoštvo ljekovitih tvari bez kojih se suvremena medicina ne može ni zamisliti. Aspirin je jedna takva tvar i ujedno najprodavaniji lijek u svijetu. Tu su još mnoga sredstva za snižavanje temperature, tvari koje spriječavaju razvoj nekih vrsta bakterija te antibiotici širokog spektra kao što su npr. različiti derivati penicilina. Protiv raka, danas jedne od najopakijih bolesti, suvremena se medicina bori različitim kemijskim spojevima (kemoterapija) koji ometaju razvoj stanica raka. Sve ljekovite tvari nastale su kao rezultat zajedničkih znanstvenih istraživanja kemičara, biologa, biokemičara, farmaceuta i liječnika.
3.2. Zlouporaba kemijskog znanja
Nažalost, kemiju i kemičare optužuju za zagađenje zraka, vode i tla. Ali kemija i kemičari nisu za to krivi jer oni znaju kako se štetne tvari mogu učiniti bezopasnima. Kriva je čovjekova gramzivost i nastojanje da se uz što manji trošak, ostvari što veći profit. To dovodi do nezgoda u industrijskim postrojenjima. Pri takvim nezgodama u okoliš iscure otrovne kemikalije, pa i one koje uzrokuju rak. I opet kemičari priskaču u pomoć, analiziraju zrak, vodu, zemlju te predlažu postupke uklanjanja štetnih tvari.
Mnoge tvari prirodnog podrijetla unesene u naš organizam izazivaju različite učinke. Primjerice, crna kava i indijski čaj sadržavaju tvari koje ubrzavaju rad srca i povisuju krvni tlak. To može biti korisno nekim ljudima sa sniženim krvnim tlakom. Obrnut učinak ima alkohol iz vina ili žestokih alkoholnih pića jer širi kapilare i snižava krvni tlak. No, alkohol usporava prijenos živčanih impulsa pa vozači sporije reagiraju na promjene u prometu. To je jedan od najčešćih uzroka prometnih nezgoda. Veće količine alkohola izazivaju stanje pijanstva, pa čak i gubitak svijesti.
Neke tvari biljnog podrijetla imaju opojno djelovanje, izazivaju san, umanjuju bol ili mijenjaju stanje svijesti. Takve se tvari zajedničkim imenom nazivaju drogama što dolazi od francuskog drogue, a znači osušene dijelove biljaka od kojih se pripravljaju lijekovi.

Slika 3.4 Ovakve i slične tabletice prvi su korak na putu u pakao. Ne vjeruj lijepim pričama „prijateljâ” koji će ti prvu tabletu ecstasyja ili bilo koje druge opojne droge dati besplatno. Oni računaju s tvojom radoznalošću i željom za novim „iskustvima”. Njihov je jedini cilj načiniti od tebe roba iz kojega će izvlačiti novac za kupnju droge bez koje više ne bi mogao biti. (Snimljeno u Centru za kriminalistička vještačenja „Ivan Vučetić” – Ministarstvo unutarnjih poslova RH.)
Alkohol i opojne droge djeluju neposredno na centralni živčani sustav i trajno ga oštećuju. Ovisnici o opojnim drogama najlakše postaju psihopatske, neotporne, nezrele i neizgrađene osobe. Oni koji se odaju alkoholu i drogama samo su teret svojim bližnjima jer su potpuno nesposobni za učenje ili bilo kakav rad. Dokazano je da droge oštećuju i kromosome pa se tako rađaju djeca s tjelesnim deformacijama i živčanim poremećajima.
UpamtiteNema prirodnih ni sintetskih droga koje nisu štetne i koje ne izazivaju naviku. Pod utjecajem droga nastaju kemijske promjene u centralnom živčanom sustavu. Kad prestane utjecaj droge, čovjek se osjeća loše pa ponovno poseže za drogom da bi se osjećao "bolje". Tako to ide unedogled i svaki put nakon prestanka djelovanja droge, osjećaj je sve gori pa je potrebna sve veća i veća doza droge. To dovodi do uništavanja vlastita organizma. Da bi osigurali potrebnu količinu droge, svi se narkomani vrlo brzo upuštaju u kriminalne radnje.
Koliko ljudi poznaješ koji su se odviknuli pušenja? Cigareta, odnosno nikotin, sasvim je bezazlena i jeftina droga u usporedbi s drogama koje se nude na ilegalnom tržištu. Ipak, i tako slaba droga stvara tako veliku ovisnost da se samo neki ljudi uspiju odreći cigarete, i to tek kad shvate da im je život ugrožen zbog raka pluća ili srčanog infarkta koje izazivaju sastojci duhana.
U posljednje vrijeme na ilegalnom tržištu pojavile su se opasne droge kućne izrade. Najpoznatiji je „krokodil“ koji se počeo širiti iz Rusije. Izaziva raspadanje tkiva iznutra prema van, “jede ljudsko meso” kako to kažu ovisnici. Droga je prozvana „krokodil“ jer je jedan od prvih simptoma koje stvara ljuskanje kože pa ovisnici počinju podsjećati na reptile. Tko god se navuče na krokodil može računati da će za 2 do 3 godine sigurno umrijeti u strašnim mukama.
Ponovimo
Izradite plakat o jednoj od tema:
a) fizikalna i kemijska promjena,
b) droge i ovisnost,
c) bolesti uzrokovane pušenjem.
4. VRSTE TVARI
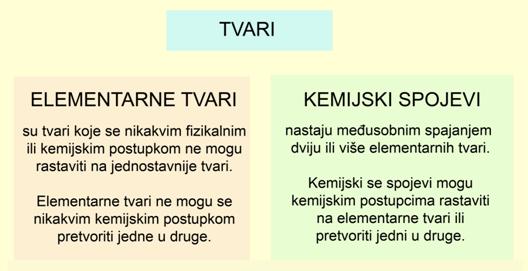
Sve tvari koje poznajemo možemo podijeliti u dvije velike skupine: elementarne tvari i kemijske spojeve.
4.1. Elementarne tvari
Svatko od nas s lakoćom može prepoznati neke metale kao što su zlato, srebro, bakar, olovo, željezo i dr. Većina zna da se cink rabi za zaštitu željeznih limova od kojih su načinjeni žljebovi na kućnim strehama. Aluminij u obliku tankih listova (folija) svakodnevno rabimo za zamatanje hrane. Živa je tekući metal kojim je punjena većina termometara. Od volframa su načinjene niti električnih žarulja. Krom se rabi kao ukrasna prevlaka slavina i drugih metalnih dijelova sanitarnih uređaja. O uranu se svakodnevno može nešto pročitati u novinama ili čuti u TV vijestima. Sve nabrojene i masnim slovima istaknute tvari su metali ili kovine. Mogu se kovati pa ih nazivamo kovine. Riječ metal proizašla je iz latinske riječi metallum, koja pak potječe od grčke riječi metallon - kovina.
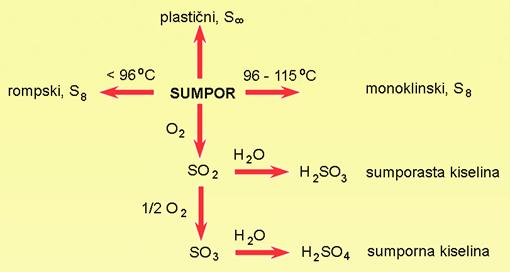
Teško bismo pronašli nekoga tko nije čuo za sumpor jer se o njemu svakodnevno govori u vijestima o zagađenju okoliša, sadržaju sumpora u nafti i zemnom plinu itd. Sigurno vam je poznato da crvenosmeđi premaz na kutiji šibica sadržava fosfor. Kisik i dušik glavni su sastojci zraka, klor se rabi za dezinfekciju vode u bazenima za kupanje itd. Sve nabrojene masnim slovima otisnute tvari u ovom odjeljku nekovine su ili nemetali. Ne mogu se kovati.
Sve masnim slovima istaknute tvari u prethodnim odjeljcima su elementarne tvari. Znameniti francuski kemičar Lavoisier u svom udžbeniku iz 1789. godine prvi je naveo tablicu metalnih i nemetalnih tvari koje se ni na koji način ne mogu razložiti na jednostavnije, pa ih smatra elementarnim tvarima.
Upamtite
Tvari koje se nikakvim fizikalnim ili kemijskim postupkom ne mogu razložiti na jednostavnije tvari nazivaju se elementarne tvari.
Elementarne se tvari nikakvim kemijskim postupkom ne mogu pretvoriti jedne u druge.
Metali ili kovine čine više od dvije trećine svih elementarnih tvari koje nalazimo u prirodi. Svi su metali pri sobnoj temperaturi krutine osim žive koja je jedina tekuća. Uglađene površine svih metala reflektiraju svjetlost. To se svojstvo naziva metalni sjaj.
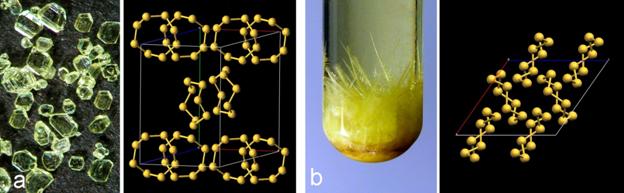
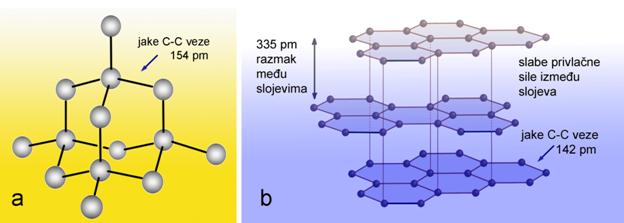
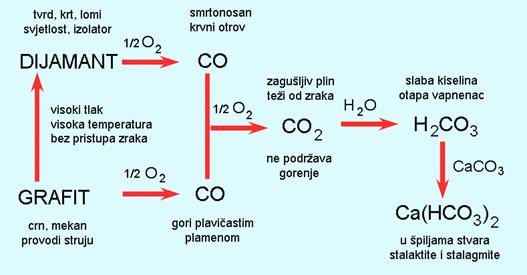
Od svih nemetala pri sobnoj temperaturi krutine su ugljik, sumpor, fosfor i jod. Ugljik se u prirodi javlja u dva oblika, kao dijamant i grafit. Dijamant je tvrd, proziran, a njegova uglađena površina reflektira svjetlost poput ogledala. Grafit je mekan i crn, a uglađena površina grafita slabo reflektira svjetlost. Kristali sumpora su žuti, a kristali crvenog fosfora i joda pokazuju ljubičastu boju. Iako njihove uglađene površine slabo reflektiraju svjetlost, nemetali ne pokazuju metalni sjaj. Od svih nemetala pri sobnoj temperaturi samo je brom crvenosmeđa tekućina. Svi ostali nemetali su bezbojni plinovi, osim klora koji je žutozelen.

Slika 4.1. Bakar, aluminij, zlato i željezo samo su neki primjeri elementarnih tvari od kojih se izrađuju uporabni predmeti i nakit.

Slika 4.2. Izgled nekih elementarnih tvari koje svrstavamo u nemetale: brom, jod fosfor i sumpor. Bijeli fosfor se sam od sebe zapali na zraku. Čuva ga se pod vodom u tamnoj boci ili u mraku.
|
|
Metali |
Nemetali |
|
Agregacijsko stanje pri sobnoj temperaturi |
Svi su krutine osim žive. |
Jedanaest plinova, brom je tekućina, a ugljik, fosfor, sumpor, selen i jod su krutine |
|
Talište |
Najčešće visoko. |
Ugljik ima vrlo visoko talište, a svi ostali nemetali imaju niska tališta. |
|
Izgled površine u krutom stanju |
Mogu se polirati do visokog sjaja, pokazuju metalni sjaj. |
Uglavnom bez sjaja osim dijamanta koji je proziran, sumpora koji je žut i joda čiji su kristali tamnoljubičasti i sjajni. |
|
Električna vodljivost |
Dobri vodiči električne struje |
Svi su izolatori, osim ugljika kad je u obliku grafita koji vodi struju. |
|
Toplinska vodljivost |
Svi su dobri vodiči topline. |
Svi su slabi vodiči topline. |
|
Gustoća |
Uglavnom velika i nekoliko puta veća od gustoće vode. |
Uglavnom mala, jer je većina nemetala pri sobnoj temperaturi u plinovitu stanju. Od svih nemetala samo jod ima gustoću koja je veća od gustoće aluminija i drugih lakih metala. |
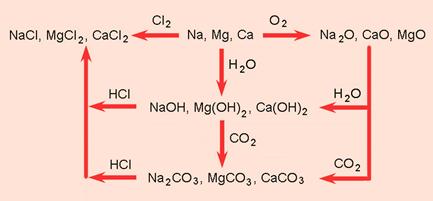
4.2. Kemijski spojevi
Već smo kazali da su bakar i sumpor elementarne tvari, odnosno tvari koje se nikakvim postupkom ne mogu razložiti na jednostavnije tvari. No, što će se dogoditi ako pomiješamo bakar i sumpor i smjesu zagrijemo? Najbolji odgovor dobit ćemo ako načinimo pokus.
Pokus 10. Što nastaje zagrijavanjem smjese bakra i sumpora

Slika 4.3. Kad se smjesa bakra i sumpora zagrije nastane kemijski spoj bakra sa sumporom. To je nova tvar, bakrov sulfid.
Zagrijani sumpor i bakar međusobno reagiraju uz oslobađanje topline i pojavu crvenog žara. Pritom nastaje nova tvar, kemijski spoj bakra sa sumporom. Spojevi sa sumporom nazivaju se sulfidi (lat. sulphur – sumpor), pa se kaže da je međusobnom reakcijom bakra sa sumporom nastao bakrov sulfid. Bakar i sumpor su reaktanti, a bakrov sulfid produkt kemijske reakcije.
Svojstva bakrova sulfida bitno se razlikuju od svojstava reaktanata, bakra i sumpora. Bakrov sulfid je tamnoplav i krt, te se može slomiti prstima. Takva svojstva nema ni bakar ni sumpor. Kad se smotuljak prelomi i prelomljeno mjesto pogleda povećalom može se uočiti prvotna struktura bakrenih niti. Ali, to više nije ni bakar ni sumpor, već nova tvar, bakrov sulfid. Nastali bakrov sulfid zadržao je samo oblik početnog smotuljka bakra.
Samorodnih elementarnih tvari, tj. onih koje nisu vezane u kemijske spojeve, na Zemlji ima vrlo malo. U Zemljinoj kori to su zlato, platina, živa i sumpor, a ponegdje se mogu naći još srebro i bakar. Svi drugi metali, primjerice željezo, cink ili olovo u prirodi dolaze u spojevima. Velike prirodne naslage spojeva nekog metala nazivamo rudama.
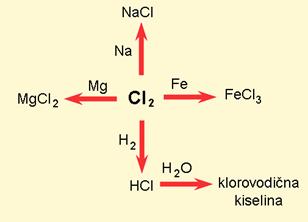
Bakar se dobiva iz ruda koje sadržavaju bakrov sulfid, kemijski spoj bakra sa sumporom. Olovo se u prirodi javlja kao olovov sulfid, cink kao cinkov sulfid.
Željezo u prirodi dolazi u spojevima s kisikom. Spojevi s kisikom općenito se nazivaju oksidi. Ukratko, Zemljina kora izgrađena je od kemijskih spojeva.

Slika 4.4. Minerali – sastojci ruda iz kojih se dobivaju pojedini metali: a) Rutil ili titanijev dioksid najvažniji je sastojak titanijevih ruda. b) Sfalerit ili cinkov sulfid najvažniji je sastojak cinkovih ruda. c) Cinabarit ili rumenica, odnosno živin sulfid, najvažniji je sastojak živinih ruda. Svijetle točkice koje se vide na slici su kapljice žive. d) Galenit ili olovov sulfid najvažniji je sastojak olovovih ruda.
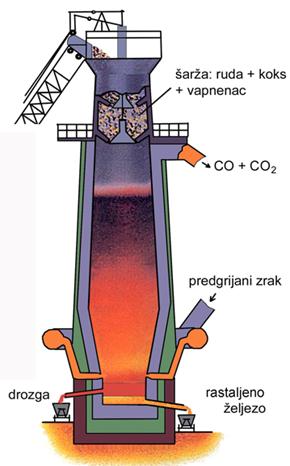
Sulfidne rude najčešće se prže na zraku da bi se dobili oksidi iz kojih se pri visokoj temperaturi redukcijom ugljenom, točnije koksom, dobiju metali. Pritom se ugljik iz koksa oksidira u ugljikov monoksid. Procesi oksidacije i redukcije su nerazdvojni i uvijek se događaju istodobno. Dok se jedna tvar reducira druga se oksidira.
Pokus 11. Redukcija bakrova(II) oksida s drvenim ugljenom
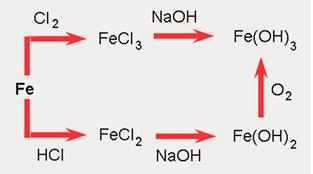
Neki su metali postojani na zraku i u vodi, kao primjerice zlato i platina, pa se rabe za izradu nakita. No, većina metala već pri sobnoj temperaturi spontano reagira sa zrakom i vodom. Primjerice, površina novih i sjajnih željeznih čavala u doticaju s vodom i zrakom prevuče se ružnim crvenosmeđim naslagama koje nazivamo hrđa. Hrđa je smjesa više različitih kemijskih spojeva nastalih međusobnim spajanjem željeza, vode i kisika iz zraka. Nema stalan kemijski sastav.

Slika 4.5. a) Sidreni lanci hrđaju jer su
nezaštićeni i stalno
izloženi kisiku iz zraka i slanoj morskoj vodi.
b) Izgled novih željeznih čavala nakon 7 dana stajanja u običnoj
(lijevo) i
slanoj vodi (desno).
Kiseline su vrsta kemijskih spojeva. Octenom kiselinom (octom) svakodnevno zakiseljujemo salatu. Okus čaja popravit ćete tako da ga zakiselite limunovim sokom koji sadržava limunsku kiselinu. Kisele jabuke sadržavaju jabučnu kiselinu. Oksalna kiselina nalazi se u mnogim vrstama povrća, primjerice kupusu, špinatu, blitvi, rajčici itd. Za sve nabrojene kiseline kažemo da su slabe kiseline. Svakodnevno ih uzimamo hranom, odnosno različitim vrstama voća i povrća. U trgovinama kućanskih potrepština može se nabaviti limunska kiselina kojom se može zakiseliti čaj umjesto limunovim sokom. Ipak, bolje je upotrijebiti limun jer on osim limunske kiseline sadržava i askorbinsku kiselinu, poznatiju kao vitamin C.
Pokus 12. Indikatori kiselina i lužina
U svakoj trgovini kućanskih potrepština može se nabaviti 19-postotna solna ili klorovodična kiselina. To je jaka kiselina, a rabi se za čišćenje keramičkih sanitarnih uređaja jer otapa vodeni kamenac, odnosno kalcijev karbonat. Otrovna je i nagriza kožu pa se pri radu solnom kiselinom moraju rabiti zaštitne naočale i gumene rukavice. Solnom se kiselinom ne smiju čistiti sudoperi od nehrđajućeg čelika, slavine i drugi kromirani dijelovi sanitarnih uređaja jer solna kiselina otapa metale.
Lužine su vodene otopine hidroksida alkalijskih i zemnoalkalijskih metala. Primjerice, na svakom gradilištu gdje se nešto zida, rabi se gašeno vapno ili kalcijev hidroksid, kako bi kazali kemičari. Smjesa kalcijeva hidroksida i pijeska s vodom rabi se za zidanje i žbukanje. Otopina kalcijeva hidroksida u vodi je jaka lužina. Nagriza kožu pa zidari pri radu rabe zaštitne rukavice. Ako vapno ili žbuka dospije u oko, posljedice također mogu biti katastrofalne. Neka sredstva za čišćenje pećnica su 5 do 10-postotne otopine natrijeva hidroksida. To su vrlo jake lužine koje razaraju masti i druge organske tvari. Najčešće se nanose pomoću raspršivača, pa obvezno treba upotrijebiti zaštitne rukavice i naočale kako bismo sačuvali ruke i oči.
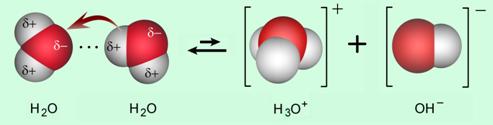
Kiseline i lužine mogu se prepoznati indikatorima kiselina i lužina. Najpoznatiji indikator kiselina i lužina je prirodna boja poznata pod imenom lakmus. U kiselim otopinama lakmus pokazuje crvenu, a u lužnatim plavu boju.

Slika 4.6. Karakteristične boje lakmusa, fenolftaleina i metiloranža u kiselim (a) i lužnatim otopinama (b).
Još su dva najpoznatija indikatora, a to su fenolftalein i metiloranž. Fenolftalein je bezbojan u kiselim, a ružičastoljubičast u lužnatim otopinama. Metiloranž u kiselim otopinama pokazuje crvenu, a u lužnatim žutu boju.
Sok crvenog kupusa također je dobar indikator kiselina i lužina. U kiselim otopinama pokazuje crvenu, u neutralnim ljubičastu, u lužnatim zelenu, a u jako lužnatim otopinama žutu boju.
Upamtite
Pri radu s jakim kiselinama i lužinama, kojih ima u svakom domaćinstvu, uvijek treba upotrijebiti zaštitne naočale i gumene rukavice.
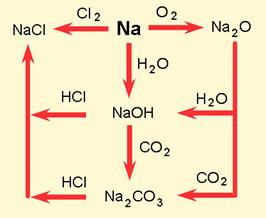
Soli su također kemijski spojevi, a najčešće se dobiju međusobnom neutralizacijom kiselina i lužina. Primjerice, kad se u određenom omjeru pomiješaju otopine natrijeva hidroksida i klorovodične kiseline one se međusobno neutraliziraju pa se dobije otopina natrijeva klorida ili kuhinjske soli. Uparavanjem te otopine na dnu posude ostaju kristali natrijeva klorida. Imaju oblik kocke što se lako može uočiti povećalom. Natrijev klorid sastojak je svakodnevne prehrane. Vodena otopina natrijeva klorida ne mijenja boju indikatora kiselina i lužina pa se kaže da je neutralna.
Pokus 13. Ispitivanje svojstava modre galice

Slika 4.7. Zagrijavanjem kristala modre galice, bakrova(II) sulfata pentahidrata, dobije se bijeli bezvodni bakrov(II) sulfat i voda koja se skupi u koljenasto savijenom dijelu epruvete.
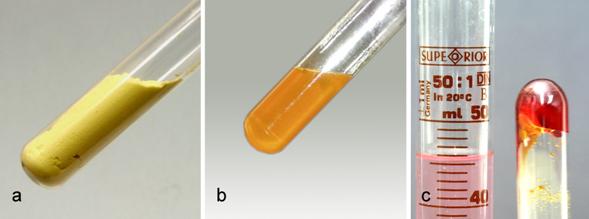
Modra galica je također sol, a dobije se otapanjem bakrova hidroksida ili bakrova oksida u razrijeđenoj sumpornoj kiselini. Uparavanjem te otopine na dnu posude zaostaju modri kristali. Kristali modre galice u svojoj strukturi sadržavaju tzv. kristalizacijsku vodu. Ako ih se ostavi na zraku, tijekom vremena izgube vodu pa pobijele. Ta se pojava naziva eflorescencija (lat. efflorescere – procvasti). Bijeli kristali su bezvodni bakrov(II) sulfat. Ako se bezvodnom bakrovu(II) sulfatu doda vode, on će poplaviti jer nastaju kristali modre galice. Kemijski naziv (ime) za modru galicu jest bakrov(II) sulfat pentahidrat. Modru galicu u smjesi s gašenim vapnom rabe vinogradari za zaštitu vinove loze od peronospore.
Ponovimo
Izradite plakat o temi „vrste tvari“.
5. SMJESE I POSTUPCI RAZDVAJANJA SMJESA
Pogledajte malo po policama kuhinje u svom domu. Tamo ćete naći šećer, limunsku kiselinu, sodu bikarbonu, vrećicu s vitaminom C, kuhinjsku sol, prašak za pecivo, vegetu i još mnogo drugih kutijica i vrećica.
Proučite naljepnice na vrećicama ili kutijama. Na vrećici praška za pecivo nabrojani su sljedeći sastojci: pšenični škrob, regulator kiselosti: dinatrijev fosfat i tvar za rahljenje; natrijev hidrogenkarbonat. Očito, prašak za pecivo je smjesa svih tih nabrojenih tvari. Pogledajmo dalje. Sadržava li kuhinjska sol samo jedan kemijski spoj ili je smjesa više različitih kemijskih spojeva? Ni jako povećalo ni mikroskop ne bi bili od velike koristi. Svi kristalići soli izgledaju podjednako. Ipak, na kutiji kuhinjske morske soli može se pročitati kemijski sastav.

Slika 5.1. Sastav kuhinjske morske soli. Aditiv E536 jest kalijev heksacijanoferat(II), K4[Fe(CN)6], a rabi se kao sredstvo protiv zgrudavanja u mnogim industrijskim prehrambenim praškastim proizvodima.
Kuhinjska sol je smjesa natrijeva klorida, NaCl, i nekih nečistoća. U trgovinama kućanskih potrepština može se pronaći i „sol sa smanjenim udjelom natrija“. To je također smjesa koja sadržava 49 % natrijeva klorida, 49 % kalijeva klorida, 25,5 do 38,5 mg/kg kalijeva jodata i aditiv E551 koji spriječava zgrudavanje soli. Aditiv E551 je bezopasan amorfni silicijev dioksid.
No, paketić limunske kiseline sadržava samo limunsku kiselinu, kutijica sode bikarbone sadržava samo sodu bikarbonu (natrijev hidrogenkarbonat), a na vrećici vitamina C piše askorbinska kiselina. Lako je zaključiti da se u tim vrećicama i kutijama nalaze čiste tvari ili kemijski spojevi točno određenog kemijskog sastava.
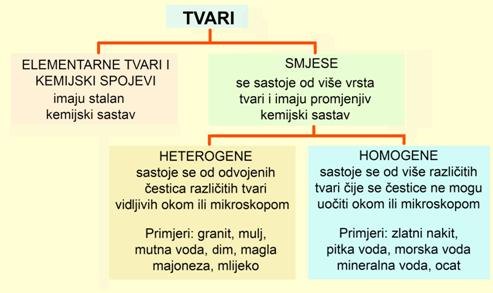
Promatrajući vegetu, običnim okom ili povećalom, lako ćete uočiti različite sastojke. Vegeta je heterogena smjesa (grč. heteros – drugi + genos – rod) jer se u njoj mogu uočiti različito obojena zrnca. Različito su obojena zrnca različite tvari, različita kemijskog sastava i različitih fizikalnih svojstava.
Promatranjem kristalića kuhinjske soli nije bilo moguće uočiti odijeljena zrnca pojedinih sastojaka navedenih na kutiji. Za uzorak kuhinjske soli može se kazati da je homogena smjesa (grč. homoios – jednak, isti + genos – rod). Homogenim smjesama svojstveno je da svaki dio smjese, svako njezino zrnce, ima isti kemijski sastav i ista fizikalna svojstva. To znači da su nečistoće i dodaci u kuhinjskoj soli jednolično raspodijeljeni po svim zrncima.
Elementarna tvar, zlato, po definiciji je čista tvar i ne sadržava nikakve druge sastojke osim zlata. Takvog čistog zlata u prirodi nema. I najčišće zlato, kakvo se može naći samo u kemijskom laboratoriju, također je homogena smjesa jer sadržava vrlo male količine drugih metala. Kad se zlato različitim kemijskim postupcima toliko pročisti da se u njemu ne može dokazati prisutnost drugih metala, onda se za njega kaže da je kemijski čisto zlato. Isto pravilo vrijedi i za sve druge elementarne tvari i njihove spojeve.
Zlatni se nakit nikad ne izrađuje od čistoga zlata, jer je ono mekano, već iz homogene smjese zlata sa srebrom, bakrom, platinom i još nekim metalima. Čistoća zlata od kojeg se izrađuje nakit iskazuje se jedinicom karat. Čisto zlato označuje se kao 24 karatno. Nakit izrađen od smjese koja sadržava 50 % zlata i 50 % srebra, bakra ili drugih metala, ima 12 karata. Nakit izrađen od smjese koja sadržava 75 % zlata i 25 % drugih metala ima 18 karata itd.
Dijamanti, za koje najčešće mislimo da su čist ugljik, dakle elementarna tvar, također su homogene smjese jer sadržavaju male količine različitih primjesa koje im daju specifičnu boju. Primjerice žuti dijamanti, koji su inače i najčešća boja dijamanata, sadržavaju dušik. Masa dijamanata mjeri se posebnom jedinicom mase, karat (grč. keration – sjemenka rogača, 1 karat = 0,2 g).
Upamtite
5.1. Razdvajanje heterogenih smjesa
Ne postoji neki univerzalni postupak razdvajanja smjesa. Svaka vrsta smjese razdvaja se različitim postupkom. Primjerice, sastojci heterogene smjese imaju različita fizikalna svojstva kao što su gustoća, agregacijsko stanje, topljivost u različitim otapalima i dr. Postupci razdvajanja takvih smjesa temelje se na razlici fizikalnih svojstava pojedinih sastojaka.
Svatko je imao priliku vidjeti kako se voda potoka ili rijeka zamuti nakon obilnih kiša. Zamućenje vode potječe od vrlo sitnih čestica gline i pijeska koje lebde u vodi. Mutna voda je tipična suspenzija (lat. suspendere = objesiti, staviti nešto da lebdi) krutih čestica u vodi i zato neprikladna za piće.
Mnogi se gradovi opskrbljuju vodom iz rijeka i zato prije puštanja u vodovodnu mrežu, vodu moraju pročistiti. U tu se svrhu voda iz rijeke pumpa u velike rezervoare na čijem se dnu sedimentiraju krupne čestice gline i pijeska. Sedimentacija označava taloženje, a potječe od latinske riječi sedere što znači sjesti ili sjedati. Sediment općenito označava talog, naslagu ili mulj. Taj se izraz često rabi u geologiji pri opisivanju nastanka stijena u Zemljinoj kori.
Pokus 14. Dekantiranje
Nakon sedimentacije krupnih čestica relativno bistar gornji sloj vode potom se dekantira (franc. décanter = otakati), odnosno pretoči u drugi rezervoar. Tako pročišćenoj vodi dodaju se neke kemikalije pa nastaje voluminozni talog koji podsjeća na raspršene pahuljice. U taj se talog tijekom njegova stvaranja uklope zaostale suspendirane (lebdeće) čestice gline i različiti mikroorganizmi kao što su bakterije. Voda se potom filtrira kroz filtre načinjene od više slojeva pijeska. Prije puštanja u vodovodnu mrežu vodi se još po potrebi dodaje klor da bi se uništile zaostale štetne bakterije. Klor dodaju i vodi u bazenima za kupanje. U suvremenim se uređajima za pročišćavanje vode rabi ozon.
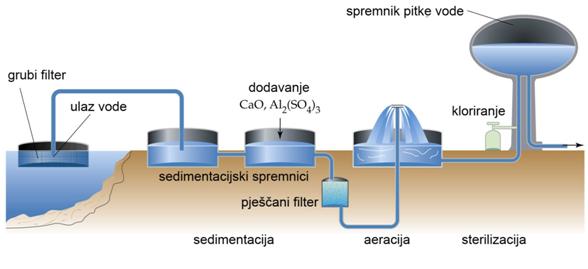
Slika 5.2. Shematski prikaz pročišćavanja riječne vode za uporabu u industriji i kućanstvu
Heterogena smjesa koja se sastoji od krutine pomiješane s tekućinom može se rastaviti i centrifugiranjem. (Sjetite se centrifuge u stroju za pranje rublja.) Centrifugalna sila djeluje na tekućinu i na krute čestice koje imaju veću gustoću od tekućine te se zbog povećane „sile teže” brže talože na dnu epruvete.

Slika 5.3. Uzorci heterogene smjese prije i nakon centrifugiranja
Pokus 15. Filtriranje
Suspendirane krute čestice mogu se od tekućine razdvojiti filtriranjem. U laboratoriju u tu se svrhu rabe lijevak i filtrirni papir. Čestice koje su veće su od pora filtrirnog papira ne mogu kroz njih proći, već kao talog zaostaju na filtrirnom papiru. Bistra tekućina dobivena filtriranjem naziva se filtrat. Bitno je da pore filtrirnog papira budu manje od čestica taloga koji želimo odvojiti od vode. Zato se izrađuju filtrirni papiri s različitom veličinom pora. Za sitnozrnate taloge treba upotrijebiti papir s malim porama. Kroz njih voda teško prolazi pa je filtriranje sporo. Za krupnije taloge rabe se filtrirni papiri većih pora pa kroz njih voda prolazi brže.
Krute heterogene smjese
mnogo je
teže rastaviti. Treba poznavati fizikalna i kemijska svojstva
sastojaka smjese, pa tada odabrati pravu metodu. Primjerice, željezo se
magnetom odvaja iz smjese s drugim metalima. Neke krute smjese mogu se
razdvojiti
Slika 5.4. Zagrijavanjem smjese natrijeva klorida i amonijeva klorida amonijev klorid će sublimirati i kondenzirati se na hladnijem dijelu epruvete, dok će natrijev klorid zaostati na njezinu dnu
Slika 5.5. Tekućine koje se međusobno ne miješaju, npr. ulje i voda, rastavljaju se tako da se smjesa ulije u lijevak za odjeljivanje i pusti na mirnu mjestu. Zbog razlike u gustoći tekućine se razdijele u slojeve. Donji „teži” sloj, odnosno sloj veće gustoće, ispusti se u jednu tikvicu, a gornji „lakši” sloj izlije se kroz grlo lijevka u drugu tikvicu.
5.2. Razdvajanje homogenih smjesa
Kojom će se metodom razdvojiti homogena smjesa ovisi o njezinom sastavu. Primjerice, voda je bistra pa ne možemo znati je li to čista tvar - voda, ili pak homogena smjesa vode i još nečega nevidljivog našem oku. Ako čašu napunimo pitkom vodom i ostavimo je na toplom mjestu, nakon nekoliko dana voda će ispariti, a na dnu čaše zaostat će talog. To nam dokazuje da pitka voda nije čista tvar već otopina. Morska voda je otopina natrijeva klorida (kuhinjske soli) i manjih količina nekih drugih soli. Prirodnim isparavanjem morske vode u plitkim bazenima u solanama na Pagu te u Stonu i Ninu dobiva se „morska sol“ koja se sastoji pretežito od natrijeva klorida. Voda je otapalo, a natrijev klorid i druge soli otopljene tvari. Voda se od otopljenih soli može odvojiti destilacijom jer isparava, a otopljene soli ne isparavaju.
Pokus 16. Destilacija
Laboratorijska aparatura za destilaciju sastoji se od tikvice za destilaciju i Liebigovog hladila. U tikvicu se ulije morska voda ili otopina natrijeva klorida i kap tinte. Zagrijavanjem do ključanja (vrenja) voda prelazi u vodenu paru koja se u Liebigovu hladilu kondenzira natrag u vodu i kao destilat hvata u predlošku. Destilat je bezbojan što dokazuje da tinta ne isparava. Stavimo li na stakalce za mikroskopiranje kap destilata nakon njegova isparavanja, ne zaostaju nikakvi tragovi. To dokazuje da i kuhinjska sol, odnosno natrijev klorid ne isparava. Tako smo destilacijom morske vode dobili destiliranu vodu koja ne sadržava otopljenih soli ili drugih tvari.

Slika 5.6. Aparatura za destilaciju
Pri sintezi većine spojeva koje nalazimo u laboratoriju, ili pri sintezi lijekova, dobiveni kruti produkt uvijek sadržava više ili manje nepoželjnih tvari. Kemikalije za laboratorijske svrhe, a pogotovo lijekovi, ne smiju sadržavati nečistoće. Zato se najčešće pročišćavaju prekristalizacijom iz različitih otapala.
Prekristalizacija se izvodi tako da se najprije načini zasićena otopina otapanjem nečiste krute tvari u vrućoj vodi ili odgovarajućem otapalu. Otopina je zasićena kad pri danoj temperaturi i nakon upornog miješanja na dnu posude ostane neotopljenih kristala. Vruća se zasićena otopina odlije u drugu čistu posudu i pusti da se spontano hladi. Hlađenjem takve zasićene otopine otopljena se tvar kristalizira jer joj se topljivost smanjuje sniženjem temperature. Dobiveni kristali filtriranjem se odvoje od matičnice, odnosno preostale hladne zasićene otopine. Hladna matičnica je zasićena u odnosu na dobivene kristale, ali je nezasićena u odnosu na nečistoće kojih ima malo i zato ostaju otopljene u matičnici.
Topljivost tvari u nekom otapalu obično se prikazuje krivuljom topljivosti, odnosno masom bezvodne tvari koja se otapa u 100 g vode.
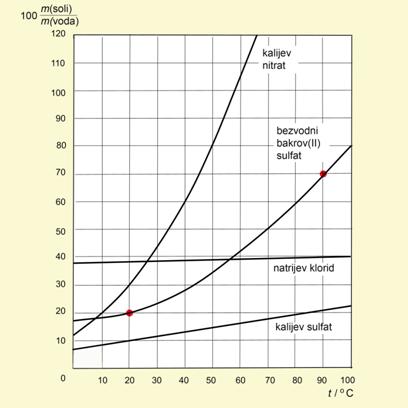
Slika 5.7. Dijagram topljivosti nekih krutina u vodi. Iz dijagrama topljivosti lako se može očitati topljivost pojedine tvari pri zadanoj temperaturi. Primjerice, na krivulji topljivosti bezvodnog bakrova(II) sulfata dvije su točke označena crvenim kružićem. Spustite iz gornje točke okomicu na apscisu i pročitajte temperaturu, 90 °C. Iz iste točke povucite okomicu na ordinatu i pročitajte topljivost, 70 g bezvodnog bakrova(II) sulfata u 100 g vode. Istim postupkom dobiva se da se pri 20 °C u 100 g vode otapa 20 g bezvodnog bakrova(II) sulfata, 10 g kalijeva sulfata, 30 g kalijeva nitrata itd.
Topljivost modre galice u vodi jako se povećava porastom temperature. U 100 g vode pri 0 ºC otapa se 31,6 g modre galice, odnosno bakrova(II) sulfata pentahidrata. Za takvu otopinu kažemo da je zasićena pri 0 ºC, jer pri toj temperaturi ne može otopiti daljnju količinu modre galice. No, pri 100 ºC u 100 g vode otapa se 203,0 g modre galice. Pazite! Modra galica sadržava kristalizacijsku vodu pa se dio modre galice otapa u vlastitoj kristalizacijskoj vodi.
Otopine modre galice zasićene pri nekoj višoj temperaturi hlađenjem postaje prezasićena pa se višak otopljene modre galice kristalizira. Ohlađena otopina zasićena je u odnosu na modru galicu, ali je nezasićena u odnosu na nečistoće kojih ima malo. Zato nečistoće neće kristalizirati, već će ostati u matičnici.
Osim hlađenjem otopine zasićene pri nekoj višoj temperaturi prekristalizacija se može izvesti i isparavanjem otapala iz zasićene otopine. Primjerice, topljivost kuhinjske soli slabo se mijenja promjenom temperature. Isparavanjem vode iz zasićene otopine kristalizira čist natrijev klorid, a nečistoće ostaju u otopini. Kad dvije trećine otopine ispari izlučene kristale treba filtriranjem odvojiti od matičnice.
Isparavanjem zasićene vodene otopine mogu se dobiti lijepi kristali natrijeva nitrata, aluminijeva alauna (stipse) i modre galice. Mali lijep kristalić zavežite na konac i objesite u sredinu zasićene otopine. Što otopina polaganije isparava to je veća vjerojatnost da će početni mali kristalić, jezgra, izrasti u velik kristal.

Slika 5.8. a) Kristal kromove stipse (alauna) ima oblik oktaedra. b) Središnji dio kristala sadržava kromovu stipsu, koja je ljubičasta, a vanjski dio aluminijevu stipsu koja je bezbojna. Nakon što je u zasićenoj otopini kromove stipse izrastao dovoljno velik kristal, isti je premješten u zasićenu otopinu aluminijeve stipse u kojoj se nastavio rast. Kristali kromove i aluminijeve stipse imaju jednaku kristalnu strukturu pa se kaže da su izomorfni (grč. isos – isti + morfe – oblik).
Pokus 17. Prezasićena otopina
Topljivost limunske kiseline jako se povećava porastom temperature. No hlađenjem vruće zasićene otopine limunska kiselina najčešće ne kristalizira već nastaje prezasićena otopina gusta poput meda. Ona sadržava više otopljene tvari nego zasićena otopina. Kristalizaciju prezasićene otopine treba nečim potaknuti, primjerice ubacivanjem nekoliko kristalića limunske kiseline koji služe kao centri kristalizacije.
Zanimljivo je da se pri otapanju limunske kiseline u vodi otopina hladi, što se može osjetiti rukom. Obratno, kristalizacijom limunske kiseline toplina se oslobađa, što se također može osjetiti rukom.
Ponovimo
Tablica 5.1. Metode razdvajanja smjesa
Metoda
Iskorišteno fizikalno svojstvo
Postupak
Dekantiranje i centrifugiranje
Gustoća
Dekantiranje je odlijevanje bistre otopine iznad taloga. Rotacijom u centrifugi s velikim brojem okretaja tvari veće gustoće brže se talože i skupljaju na dnu kivete.
Filtriranje
Topljivost i veličina čestica
Smjesa tekućine i krute tvari propušta se kroz filtrirni papir. Netopljive krute čestice ostaju na filtrirnom papiru jer su veće od pora filtrirnog papira.
Destilacija
Vrelište
Zagrijavanjem do ključanja najprije destilira tvar nižeg vrelišta.
Prekristalizacija
Topljivost
Polaganim hlađenjem iz zasićene otopine kristalizira se slabije topljiva tvar, dok dobro topljive tvari ostaju u otopini.
Izradite
plakat o
temi „smjese i
postupci razdvajanja smjesa“.
Sastav smjesa može se iskazati na više načina. Mi ćemo sastav smjesa iskazivati masenim i volumnim udjelima sastojaka u smjesi.
6.1. Maseni udio
Maseni udio nekog sastojka u smjesi jest omjer mase tog sastojka smjese prema masi svih sastojaka u smjesi.
m(sastojak)w(sastojak, smjesa) = ——————
m(smjesa)
Maseni udio nekog sastojka smjese označuje se slovom w (duplo ve) iza kojega se u zagradi navodi naziv ili simbol tog sastojka. Kako je masa smjese veća od mase pojedinog sastojka, maseni udio pojedinog sastojka u smjesi uvijek je manji od 1. Zbroj masenih udjela svih sastojaka u smjesi uvijek mora biti 1. Maseni udio sastojaka smjese često se iskazuje postocima. Izračunati maseni udio pomnoži se sa 100 i iza dobivenog broja stavi znak %.
Načinjena je smjesa od 32,1 g sumpora i 55,8 g željeza u prahu. Izračunajte maseni udio sumpora u smjesi.
Rješenje
Kazali smo da je maseni udio pojedinog sastojka u smjesi jednak omjeru mase tog sastojka prema masi svih sastojaka smjese. Izračunajmo najprije masu smjese.
m(sumpor) = 32,1 g+ m(željezo) = 55,8 g
—————————---------—
m(smjesa) = 87,9 g
Za maseni udio sumpora u smjesi dobivamo:
m(sumpor) 32,1 gw(sumpor, smjesa) = —————— = ———— = 0,365
m(smjesa) 87,9 g
Jednakim postupkom dobivamo da je maseni udio željeza u smjesi:
m(željezo) 55,8 gw(željezo, smjesa) = —————— = ———— = 0,635
m(smjesa) 87,9 g
Zbroj masenih udjela mora biti 1, pa to provjerimo tako da zbrojimo masene udjele sumpora i željeza,
w(sumpor) + w(željezo) = 0,365 + 0,635 = 1
ili iskazano u postocima
w(sumpor) + w(željezo) = 36,5 % + 63,5 % = 100 %.
Primjer 6.2.
U 100 g vode pri 50 °C otapa se 80 g kalijeva nitrata, a pri 20 °C samo 30 g. Koliki je maseni udio kalijeva nitrata u zasićenoj otopini pri 50 °C, a koliki pri 20 °C?
Rješenje
m(kalijev nitrat)w(kalijev nitrat, voda, 50 °C) = ———————————-----—
m(voda) + m(kalijev nitrat)
80 g 80= —————---- = —— = 0,444 = 44,4 %
100 g + 80 g 180
m(kalijev nitrat)w(kalijev nitrat, voda, 20 °C) = ———————————-----—
m(voda) + m(kalijev nitrat)
30 g 30= ————-----— = —— = 0,230 = 23,0 %
100 g + 30 g 130
Pri 50 °C maseni udio kalijeva nitrata u
zasićenoj otopini iznosi 44,4 %, a pri 20 °C maseni udio kalijeva
nitrata u
zasićenoj otopini manji je i iznosi 23,0 %.
Primjer 6.3.
Magnezij zapaljen na zraku izgori uz pojavu bliješteće svjetlosti. Pritom se magnezij spaja s kisikom iz zraka pa nastaje bijeli prah magnezijeva oksida. Koliki je maseni udio magnezija u magnezijevu oksidu ako spaljivanjem 0,500 g magnezija nastane 0,829 g magnezijeva oksida.
Rješenje
m(magnezij) 0,500 gw(magnezij, magnezijev oksid) = —————————----- = ———— = 0,603 = 60,3 %.
m(magnezijev oksid) 0,829 g
Primjer 6.4.
Koliko treba uzeti natrijeva klorida i vode za pripremanje 5 dm3 otopine u kojoj je maseni udio natrijeva klorida, w(NaCl, otopina) = 0,18, odnosno 18 %. U ovom i narednim izrazima "NaCl" označuje natrijev klorid. Gustoća 18-postotne otopine natrijeva klorida je 1132 g/dm3.
Rješenje
Izračunajmo najprije masu 5 dm3 18-postotne otopine natrijeva klorida.
m(otopina NaCl) = V(otop. NaCl) × ρ(otop. NaCl) = 5 dm3 ×1132 g/dm3 = 5660 g.
Maseni udio natrijeva klorida u 18-postotnoj otopini jest 0,18. Masa natrijeva klorida u 5660 g 18-postotne otopine izračuna se tako da se masa otopine pomnoži masenim udjelom natrijeva klorida u otopini.
m(NaCl) = m(otopina NaCl) × w(NaCl, otopina) = 5660 g × 0,18 = 1019 g
Masa vode u 5 660 g otopine natrijeva klorida dobijemo tako da od mase otopine odbijemo masu otopljena natrijeva klorida.
m(H2O) = m(otopina NaCl) – m(NaCl) = 5660 g – 1019 g = 4641 g.
Za pripremanje 5 dm3 18-postotne otopine natrijeva klorida treba odvagati 1019 g natrijeva klorida i otopiti u 4 641 g vode.
6.2. Volumni udio
Sastav smjesa plinova i tekućina koje se međusobno miješaju iskazuje se volumnim udjelima. Volumni udio nekog sastojka u smjesi jednak je omjeru volumena tog sastojka prema zbroju volumena svih sastojaka smjese prije miješanja. Volumni se udio označava malim grčkim slovom φ (čitaj fi).
V(sastojak1)φ(sastojak1, smjesa) = ——————————————------
V(sastojak1) + V(sastojak2) + ...
Primjer 6.5.
Smjesa za hlađenje automobilskih motora zimi priprema se iz "koncentrata" i vode. Koliki je volumni udio "koncentrata" u smjesi koja je dobivena miješanjem 5 L vode i 2 L koncentrata?
Rješenje
V(koncentrat) 2 L 2 Lφ(koncentrat, smjesa) = ——————————---— = ————— = —— = 0,286 = 28,6 %.
V(koncentrat) + V(voda) 2 L + 5 L 7 L
Primjer 6.6.
Prosječan automobil u gradskoj vožnji s 1 L benzina prevali put od 10 km. Za spaljivanje 1 L benzina u automobilskom motoru potrebno je 2 500 L kisika. Koliko litara zraka mora usisati automobilski motor za spaljivanje 1 L benzina, ako je volumni udio kisika u zraku 0,21 ili 21 %?
Rješenje
volumen kisika V(kisik) 2 500 LV(zrak) = ——————————---——— = ————---—— = ———— = 11 905 L
volumni udio kisika u zraku φ(kisik, zrak) 0,21
Prosječan automobil u gradskoj vožnji na putu od 10 km utroši oko 12 m3 zraka.
Primjer 6.7.
Elektrolizom vode
dobije se smjesa dvaju
plinova, vodika i kisika. Ta se smjesa naziva plin praskavac jer
zapaljena
žestoko eksplodira. Volumni omjer vodika prema kisiku u toj je
smjesi
2 : 1. Izračunajte
volumni udio vodika i
kisika u toj smjesi.
Izračunajte koliko je vodika i koliko kisika potrebno da se pripremi 18 mL praskavca.
Rješenje
a) Smjesa sadržava 2 volumna dijela vodika i 1 volumni dio kisika. Odavde proizlazi:
V(vodik) 2 2φ(vodik, smjesa) = ─────── = ──── = ── = 0,667
V(smjesa) 2 + 1 3
V(kisik) 1 1φ(kisik, smjesa) = ─────── = ──── = ── = 0,333
V(smjesa) 2 + 1 3
b) Za pripremu 18 mL praskavca potrebno je:
V(vodik) = φ(vodik) × V(smjesa) = 0,667 × 18 mL = 12 mL,
V(kisik) = φ(kisik) × V(smjesa) = 0,333 × 18 mL = 6 mL.
Primjer 6.8.
Neka smjesa plinova sadržava 50 volumnih dijelova dušika, 20 volumnih dijelova kisika i 30 volumnih dijelova ugljikova dioksida. Smjesa plinova je propuštena kroz tornjić s granulama natrijeva hidroksida. Pritom su ugljikov dioksid i natrijev hidroksid međusobno reagirali tako da je nastao natrijev karbonat (soda). Koliki je volumni udio dušika i kisika u preostaloj smjesi plinova?
Rješenje
Preostala smjesa plinova sastoji se od 50 volumnih dijelova dušika i 20 volumnih dijelova kisika. Volumni udio pojedinog plina u smjesi jednak je omjeru njegova volumnog dijela prema zbroju volumnih dijelova svih sastojaka smjese plinova.
V(dušik) 50φ(dušik, smjesa) = ────────────---- = ─────-- = 0,714 ili 71,4 %
V(dušik) + V(kisik) 50 + 20
V(kisik) 20
φ(kisik, smjesa) = ────────────--- = ─────-- = 0,286 ili 28,6 %
V(dušik) + V(kisik) 50 + 20
7. ZRAK I GLAVNI SASTOJCI ZRAKA
Zrak je svuda oko nas. U njemu živimo i dišemo ga. Čovjek koji miruje, svakodnevno udahne i izdahne oko 15 000 litara zraka. Pri napornu radu udahne se 30 do 40 litara zraka svake minute.
Zrak je smjesa većeg broja plinova. Glavni sastojak zraka je dušik. U 100 L suhoga zraka ima 78,1 L dušika. Sljedeći po zastupljenosti je kisik. U 100 L suhoga zraka ima 20,9 L kisika. Kaže se da je volumni udio dušika u zraku 78,1 % a kisika 20,9 %. Osim kisika i dušika značajan sastojak zraka je argon. Volumni udio argona je 0,936 %. Osim argona u zraku ima i vrlo malo helija, neona, kriptona i ksenona. Helij, neon, argon, kripton i ksenon nazivaju se plemenitim plinovima jer osim ksenona, ne čine spojeve s drugim elementarnim tvarima. Suhi zrak sadržava i ugljikov dioksid. Njegov je volumni udio u zraku jako malen, svega 0,040 %. Kad se kroz vapnenu vodu dulje vrijeme propušta zrak, ona se zamuti. Pritom nastaje u vodi netopljiv kalcijev karbonat, odnosno vapnenac. To dokazuje da zrak sadržava ugljikov dioksid.

Slika 7.1. Argonom i kriptonom pune se žarulje s metalnom niti. Argon i kripton su plemeniti plinovi i ne spajaju se s užarenim metalima
7.1. Zemljina atmosfera
Atmosfera ili zrak, kako ljudi običavaju reći, jest sloj plinova koji okružuje Zemlju. Pri morskoj razini tlak zraka je najveći i iznosi oko 1000 hPa (hektopaskala). Iz meteoroloških izvještaja može se doznati da je primjerice tlak zraka u Rijeci 1000 hPa, a na Bjelolasici 800 hPa. Na visini Mount Everesta tlak zraka iznosi samo jednu trećinu tlaka pri morskoj razini. Zato penjači na Mount Everest moraju nositi boce s kisikom kako bi mogli disati. Na visini od 50 km tlak zraka je 1000 puta manji, a na visini od 80 km manji je 100 000 puta nego pri morskoj razini. Sloj zraka do 12 km visine, iznad kojega prestaje svaki život, zove se troposfera. Više od tri četvrtine mase cijele atmosfere sadržano je u sloju do 10 km visine.
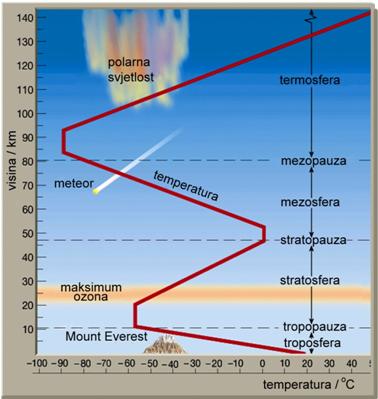
Slika 7.2. Svojstva Zemljine atmosfere
Sastav zraka nije svuda jednak. Ovisi o nadmorskoj visini i mjestu uzimanja uzorka. Osim dušika, kisika, ugljikova dioksida i plemenitih plinova u zraku ima i metana, koji nastaje truljenjem organskih tvari, a u zrak dospijeva i iz prirodnih izvora, npr. pri eksploataciji ugljena. U vrlo malim količinama u zraku ima ozona, i dušikovih oksida koji nastaju zbog ultraljubičastog Sunčeva zračenja i električnog pražnjenja tijekom oluja.
Sastav atmosfere, kakav je danas, nije oduvijek bio takav. Trebalo je nekoliko milijardi godina da Zemljina atmosfera postane povoljna za životinje koje udišu kisik. To su omogućili autotrofni organizmi (zelene biljke, alge, biljni plankton u površinskim slojevima oceana) koji kao nusprodukt svoje fotosintetske aktivnosti izlučuju kisik.
7.2. Kružni tok sastojaka atmosfere
Svi sastojci zraka osim helija, neona, argona i kriptona, u neprekidnom su kruženju, tj, oni ulaze u atmosferu i iz nje izlaze. Za život na Zemlji od presudne je važnosti kružni tok ugljikova dioksida i kisika. Odvija se pomoću zelenih dijelova biljaka procesom fotosinteze. Kisik nastao fotosintezom, osim za disanje živih bića, troši se pri gorenju i mnogobrojnim kemijskim reakcijama koje se događaju u Zemljinoj kori i atmosferi.
Zbog spaljivanja fosilnih goriva, ugljena, nafte i zemnog plina, volumni udio ugljikova dioksida u zraku neprestano se povećava. Početkom 20. stoljeća volumni udio ugljikova dioksida u zraku iznosio je 0,030 % a danas je veći od 0,040 %. Smatra se da je povećanje udjela ugljikova dioksida u atmosferi jedan od uzroka klimatskih promjena.
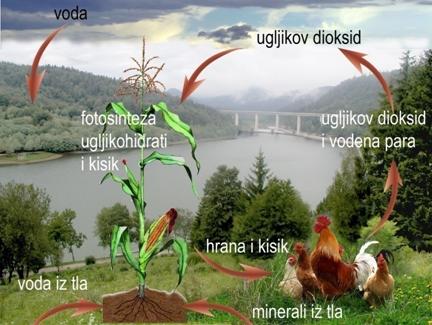
Slika 7.3. Kružni tok ugljikova dioksida i kisika u prirodi. Biljke su prave čudotvorne tvornice koje pomoću energije Sunčeve svjetlosti iz ugljikova dioksida i vode proizvode hranu za sve ostale organizme, životinje i čovjeka te proizvode kisik nužan za disanje svih živih bića.
Dušik također neprekidno kruži između atmosfere, vode i tla. Biljkama i životinjama dušik je potreban za rast. Biljke ne mogu potreban dušik uzimati neposredno iz atmosfere već samo iz tla i to u obliku spojeva. Samo biljke u čijim se čvorićima korijenja (grah, grašak, djetelina) nalazi određena vrsta bakterija mogu atmosferski dušik prevesti u amonijak koji potom ugrađuju u aminokiseline i proteine. Potrebnu energiju za te procese bakterije dobivaju od biljke u obliku ugljikohidrata. Životinje i ljudi dušik primaju putem proteina. Kad životinja ili biljka ugine, opet se dio dušika vrati u tlo. No, neke bakterije u tlu razgrađuju dušikove spojeve tako da elementarni dušik ponovno dospijeva u atmosferu. U poljoprivrednoj proizvodnji osim prirodnih danas se naveliko rabe umjetna gnojiva koja sadržavaju dušikove spojeve, kao i kemijske spojeve drugih elementarnih tvari potrebnih za rast bilja.
7.3. Fizikalna svojstva zraka
Za nas zrak nema okusa ni mirisa. Nikad ne razmišljamo o tome ima li zrak masu jer je njegova gustoća mnogo manja od gustoće krutina i tekućina koje svakodnevno rabimo. Pri normalnom uvjetima (n.u. = tlak 101 325 Pa, temperatura 0 °C) gustoća zraka jest oko 1,2 kg/m3.
Gustoća zraka, kao i svih drugih plinova, ovisi o temperaturi i tlaku. U to se možemo uvjeriti tako da djelomično napuhan dječji balon nataknemo na grlo manje boce. Ako bocu s balonom uronimo u visoku posudu s vrućom vodom, balon će se jače napuhati. Obratno, uronimo li bocu u posudu sa smjesom vode i leda, balon će splasnuti. Masa zraka u boci i balonu nije se promijenila, ali se promijenio njegov volumen. Omjer mase i volumena jest gustoća pa proizlazi da je gustoća toploga zraka manja od gustoće hladnoga zraka.

Slika 7.4. Balon ispunjen toplim zrakom diže se u visinu jer je gustoća toploga zraka manja od gustoće hladnog zraka. Topli zrak se dobiva spaljivanjem propana, jednog od sastojaka „ukapljenog plina” kakav se rabi za zagrijavanje u kućanstvu.
Baloni za meteorološka istraživanja pune se helijem čija je gustoća oko 7 puta manja od gustoće zraka. Zato baloni s helijem mogu doseći visine 30 do 40 km. Tlak zraka na toj je visini oko 100 puta manji nego pri morskoj razini, pa će se volumen balona povećati oko 100 puta. Zato su meteorološki baloni, kad ih se pušta u atmosferu, slabo napuhani. Balon koji je kapsulu s Austrijancem Felixom Baumgartnerom 14. listopada 2012. podigao na visinu od 39 068 m, također je bio punjen helijem.
7.4. Industrijska primjena zraka
Zrak i njegovi sastojci dragocjene su industrijske sirovine. Najveće količine zraka troše se pri dobivanju željeza. U visoku peć u kojoj se nalazi smjesa željezove rude i koksa, upuhuju se goleme količine vrućeg zraka da bi se postigla potrebna temperatura od oko 1600 °C.
U svakomu malo većem industrijskom mjestu nalaze se postrojenja za dobivanje čistog kisika, dušika i argona. Postupak se temelji na stlačivanju (komprimiranju) zraka na vrlo visoki tlak, stotinu ili više puta veći od atmosferskoga. Pri tom se zrak jako ugrije pa ga se ohladi vodom. Kad se tako ohlađenu i stlačenu zraku naglo snizi tlak i poveća volumen (ekspandiranje), njegova se temperatura toliko snizi da se dio zraka ukaplji (prijeđe u tekućinu).
Frakcijskom destilacijom ukapljenog zraka dobiju se dušik, argon i kisik. Frakcijska destilacija slična je običnoj, ali se provodi u posebnoj aparaturi tako da iz smjese najprije destilira tvar najnižeg vrelišta, a zatim postupno tvari sve višeg vrelišta. Iz ukapljenog zraka najprije destilira dušik, a potom kisik. Stlačeni u čeličnim bocama pod tlakom do 200 bara, kisik, dušik i argon prevoze se do mjesta uporabe.
Dušik i argon rabe se u kemijskoj industriji i laboratorijima pri sintezi tvari osjetljivih na kisik. Argon se najviše rabi pri zavarivanju aluminija i nehrđajućeg čelika. Argonom se pune i žarulje, jer usijani metali ne reagiraju s argonom. Helijem se pune istraživački, ali i dječji baloni. Neonom su punjene cijevi tzv. neonskih reklama. Kripton i ksenon rabe se u posebnim vrstama izvora svjetlosti velikog intenziteta, kao što su bljeskalice na fotografskim aparatima itd.
7.5. Kisik
Kisik je plin bez boje okusa i mirisa. Gustoća kisika veća je od gustoće zraka. Podržava gorenje i disanje. Rabi se pri autogenom zavarivanju željeza. U posebnom plameniku uz obilan dotok kisika izgara etin (acetilen), pri čemu se postiže temperatura plamena oko 3000 °C. Pri toj se temperaturi željezo rastali, a dijelovi spoje. To se može vidjeti, npr., pri postavljanju plinovodnih instalacija u kućama.
Kisik se u laboratoriju najčešće dobiva raspadom vodikova peroksida uz pomoć manganova dioksida koji djeluje kao katalizator. Vodikov peroksid je bezbojna tekućina. Može se naći gotovo u svakom kućanstvu jer se rabi prilikom bojenja kose.
Pokus 18. Ispitivanje kemijskih svojstava kisika
7.6. Ozon
Ako se kroz kisik propuštaju električne iskre, osjeti se miris svojstven ozonu. Ozon je alotropska modifikacija kisika (grč. allos – drugi + tropos – način). Alotropija je svojstvo nekih elementarnih tvari da se javljaju u više oblika različitih fizikalnih i kemijskih svojstava. Pri sobnoj temperaturi gustoća kisika je 1,43 kg m─3, dok je gustoća ozona 2,14 kg m─3. Običan kisik za nas nema mirisa, dok se miris ozona osjeća već pri volumnom udjelu od samo 0,0001 %. Ozon u prirodi nastaje električnim pražnjenjem tijekom oluja, a u visokim slojevima atmosfere djelovanjem kratkovalnih ultraljubičastih zraka. Ozon je u visokim slojevima atmosfere koristan jer štiti živi svijet od štetnih ultraljubičastih Sunčevih zraka. U nižim slojevima atmosfere ozon je štetan jer smanjuje prinose usjeva, izaziva peckanje u očima, razara gumu i druge materijale.
Upamtite
Ultraljubičaste zrake mogu izazvati rak kože pa zato treba izbjegavati pretjerano sunčanje, osobito tijekom podnevnih sati. (Pazite! Pretjerano izlaganje kože ultraljubičastim zrakama u solariju također može uzrokovati rak kože.)
Ozona u zraku ima vrlo malo, ali i ta mala količina spriječava prodiranje štetnih ultraljubičastih zraka na površinu Zemlje. Kad bismo sav ozon iz atmosfere skupili u jedan sloj, pri normalnom atmosferskom tlaku taj sloj ozona ne bi bio deblji od 3 mm.
Ozon lako stupa u kemijske reakcije s mnogim tvarima. U reakciji s tvarima koje sadržavaju klor u visokim slojevima atmosfere ozon prelazi u običan kisik pa tako nastaju područja sa smanjenom koncentracijom ozona, odnosno „ozonske rupe“.
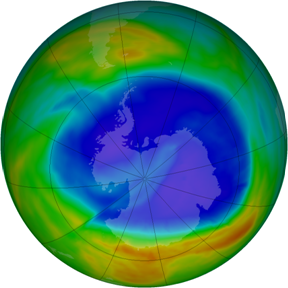
Slika 7.5. Na satelitskom snimku zemljinog Južnog pola različitim su bojama označena područja s različitom koncentracijom ozona. Najmanja koncentracija ozona (ljubičasto i plavo područje) ili ozonska rupa, nalazi se na polovima gdje, srećom, nema naselja. Žuto i crveno označeno je područje s većom koncentracijom ozona. Provedbom Montreolskog protokola, iz 1987. godine, o smanjenju emisije štetnih plinova, postupno se ozonski sloj obnavlja, a ozonska rupa na polovima smanjuje. NASA, 10. rujan 2014.
7.7. Gorenje
Za gorenje su potrebne tri stvari: tvar koja može gorjeti, tvar koja podržava gorenje, a to je kisik, i dovoljno visoka temperatura za početak kemijske reakcije. Općenito, gorenje je spajanje s kisikom. Kao što smo već kazali, spojevi s kisikom nazivaju se oksidi. Primjerice, gorenjem magnezija u kisiku nastaje bijeli prah magnezijeva oksida. Gorenjem bakra u kisiku nastaje crni prah bakrova oksida. Gorenjem željeza u kisiku nastaju crne kuglice željezovih oksida.
Svijeća uvijek gori čađavim plamenom zbog nedostatnog dotoka zraka. Kad se u plamen svijeće stavi hladna metalna žličica ili bijela porculanska pločica na njima se uhvati crni sloj čađe, odnosno ugljika. Ako se iznad plamena svijeće postavi hladna okrenuta čaša, njezine stijenke se zamagle. Lako je zaključiti da gorenjem svijeće nastaju čađa i vodena para. Kad bismo produkte gorenja svijeće, alkohola ili zemnog plina propustili kroz vapnenu vodu, ona bi se zamutila. To znači da gorenjem, osim vodene pare i ugljika, nastaje i ugljikov dioksid. Koliko će nastati ugljikova dioksida, a koliko čađe, odnosno ugljika, ovisi o dotoku zraka. To se može pokazati bojom plamena plinskog plamenika kod kojega se dotok zraka može regulirati. Uz dostatan dotok zraka plamen je plavičast, a uz nedostatan svjetleći ili čađav.
7.8. Gašenje požara
Požari se u načelu gase vodom što možemo svakodnevno vidjeti na televizijskim vijestima. Šumski požari najčešće nastaju ljudskim nemarom pri spaljivanju korova, roštiljanju u prirodi ili zbog odbačene i neugašene šibice. Žeravicu zaostalu nakon paljenja vatre na otvorenom treba ugasiti polijevanjem vodom i zatrpavanjem zemljom ili pijeskom. I najmanji vjetar može raspiriti vatru iz zaostale žeravice, što može uzrokovati šumski požar. Šumski požar u početku zahvaća lišće i može se ugasiti udaranjem otrgnute grane po zapaljenom lišću. Gašenju požara treba pristupiti odmah dok još nije zahvaćena veća površina.
Zapaljeno ulje u tavi ne smije se gasiti vodom ili puhanjem u plamen. Izvor plamena treba pokriti metalnim poklopcem ili mokrom dekom kako bi se spriječio dovod svježega zraka. Temperatura zapaljenog ulja viša je od temperature vrelišta vode. Ako se u zapaljeno ulje ulije voda, ona naglo ispari, pa se ulje rasprši u sitne kapljice, a plamen pojača.
Upamtite
Zapaljene električne instalacije ne smiju se gasiti vodom. Voda provodi električnu struju pa bi mlaz uperen na električne instalacije usmrtio gasitelja. Zato se električne instalacije gase aparatima s ugljikovim dioksidom.

Slika 7.6. Električne instalacije smiju se gasiti samo ugljikovim dioksidom, kao što se to vidi na ovom upozorenju.
Pokus 19. Kako načiniti model uređaja za gašenje požara
7.9. Disanje
Za disanje je potreban kisik. Svaki prekid disanja opasan je po život. Bez kisika čovjek može izdržati samo tri do četiri minute. Poslije toga nastupaju ozbiljna oštećenja mozga i smrt.
Kad se zrak iz pluća izdiše kroz vapnenu vodu, ona se vrlo brzo zamuti jer zrak iz pluća sadržava puno više ugljikova dioksida od svježega zraka. Izdahnuti zrak sadržava i vodenu paru. To se može uočiti kad se za vrlo hladnih zimskih dana zrak izdahne kroz usta. Tada se vidi "oblak pare". To nije vodena para, jer je ona nevidljiva, već sitne kapljice vode ili kristalići leda. Hladan zrak može sadržavati manje vodene pare od toplog zraka, zato se hlađenjem vodena para kondenzira u sitne kapljice vode ili kristaliće leda.
Izradite plakat o jednoj od tema:
a) Zemljina atmosfera,
b) zrak,
c) disanje,
d) gorenje,
e) gašenje požara.
Voda je najvažnija tvar i najrasprostranjeniji spoj na Zemlji. Oko 71 % Zemljine površine prekriveno je vodom. U vodi je nastao sav život. Bez vode ne bi bilo ni nas niti svih nama poznatih oblika života.
Voda je tvar neobičnih svojstava. Pri normalnom atmosferskom tlaku, 101,3 kPa, ledi se pri 0 °C, a vrije pri 100 °C. Ledište i vrelište vode neobično je visoko u usporedbi s tvarima slične građe. I gustoća vode je veća u odnosu na gustoću drugih sličnih tekućina. Za veliku većinu tvari vrijedi pravilo da im je gustoća u krutom stanju veća nego u tekućem. Kod vode je obratno. Gustoća leda manja je od gustoće vode. Nadalje, zagrijavanjem tekućina njihova se gustoća smanjuje porastom temperature. Naprotiv, zagrijavanjem vode od 0 do 4 °C njezina se gustoća povećava. Tek daljnjim zagrijavanjem, iznad 4 °C, gustoća vode se smanjuje kao kod ostalih tekućina. Kad neka pojava odstupa od pravila, onda se kaže da je to anomalija (grč. anomalos – nejednak).

Slika 8.1. Gustoća leda manja je od gustoće vode i zato led pliva na vodi. Zbog male razlike gustoće leda i vode sante leda izviruju samo 1/11 volumena iznad vode, dok se 10/11 nalazi pod vodom.
Anomalija vode je neobično važna za održanje života u zaleđenim rijekama i jezerima. Led koji se stvori na površini rijeke ili jezera usporava zaleđivanje dubljih slojeva. Nadalje, voda ima najveću gustoću pri 4 °C pa se pri dnu zaleđenih rijeka i jezera nalazi toplija, a u gornjim slojevima hladnija voda.
Voda ima velik toplinski kapacitet, a to znači da se kilogramu vode treba dovesti više topline nego kilogramu nekog metala da bi im se temperatura povisila za 1 °C. Zbog velikoga toplinskog kapaciteta vode, oceani se vrlo polagano zagrijavaju i hlade. Naprotiv, kopno se brzo zagrijava i brzo hladi. Klimu na Zemlji zapravo regulira voda oceana tako što upija Sunčevu toplinu. Oceanski povjetarac zimi zagrijava kopno, a ljeti ga hladi.

Slika 8.2. Voda je slab vodič topline. Dok u gornjem dijelu epruvete voda ključa, pri dnu epruvete temperatura vode je samo 18 °C.
Slika 8.3. Voda ima veliku površinsku napetost. Britvica za brijanje pliva na vodi iako je gustoća željeza skoro 8 puta veća od gustoće vode. Zbog velike površinske napetosti vode neke vrste kukaca mogu hodati po vodi.
8.1. Uporaba vode
Osim što je voda bitna
za održanje života, ona
se u industriji rabi na mnogo načina. Velike se količine vode troše za
hlađenje
u termoelektranama, nuklearnim elektranama i čeličanama. Zato se takva
industrijska postrojenja redovito grade pored rijeka kako bi uvijek
bilo
dovoljno vode za hlađenje. To povisuje temperaturu vode u rijekama čak
i za
nekoliko °C, što uzrokuje promjene u riječnoj fauni i flori. Za
proizvodnju
tone čelika utroši se oko 250 000,
a za tonu papira oko
170 000
L vode. Porast
industrijske proizvodnje i rast stanovništva iziskuju sve više svježe
vode.
Upamtite
U naš organizam, koji sadržava oko 65 % vode, treba svakodnevno unijeti najmanje 1,5 L svježe pitke vode. Hrvatska je još jedna od rijetkih zemalja koje za sada imaju dovoljno pitke vode. Pitanje je samo koliko još dugo. Ako odrasli pravovremeno ne spriječe daljnje zagađivanje i prodaju prirodnih izvora vode, njihova će djeca ostati bez pitke vode.
8.2. Voda u prirodi
Oko 71 % Zemljine površine prekriveno je vodom. Nažalost, 97 % su slane oceanske vode neupotrebive za piće i poljoprivredu. Ledenjaci sadržavaju oko 2 % ukupne vode, a samo je 1 % vode u podzemlju, rijekama i jezerima. U atmosferi je tek 0,001 %, a u stanicama svih biljaka i životinja tek 0,0005 % ukupne vode na Zemlji. Voda zarobljena kao led na Zemljinim polovima je slatka voda. Led nastao zamrzavanjem mora ne sadržava soli.
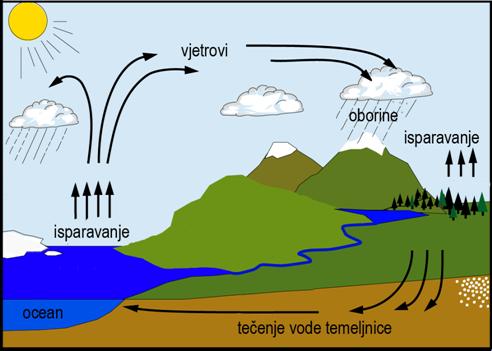
Slika 8.4. Shematski prikaz kružnog toka vode u prirodi.
Voda je u prirodi u stalnom kruženju. Voda
koja ispari s vodenih površina, tla i vegetacije odlazi u atmosferu.
Gustoća
vlažnoga zraka manja je od gustoće suhoga zraka. Zato se vlažan i topao
zrak
uzdiže. Na velikim visinama tlak je manji pa se zrak širi i pritom
hladi. (Obrnut
proces od onoga koji se opaža pri pumpanju zračnice od bicikla kad se
stlačeni
zrak ugrije.) Hladan zrak ne može više sadržavati toliko vodene pare pa
se para
kondenzira u vrlo sitne kapljice ili kristaliće leda koje vidimo kao
oblake.
Ovisno o uvjetima koji se stvore u atmosferi, te se sitne kapljice i
kristalići
spajaju u veće pa tako pada kiša, snijeg ili led (tuča).
Prolaskom kroz atmosferu kišne kapi otapaju plinove, prvenstveno kisik i ugljikov dioksid. Kišnica koja sadržava otopljen ugljikov dioksid na putu u podzemlje otapa vapnenac. Zato voda koja se crpi iz podzemnih ležišta i rabi kao voda za piće nije čista tvar. Ona sadrži otopljene plinove i soli. Proučite naljepnice na bocama različitih izvorskih ili kiselih voda. Lako ćete uočiti da voda iz različitih izvora sadrži različite količine otopljenih soli i plinova.

Slika 8.5. Voda koja sadrži puno otopljenih kalcijevih spojeva naziva se tvrdom vodom. Zagrijavanjem tvrde vode kalcijevi spojevi raspadaju se na plinoviti ugljikov dioksid i u vodi netopljiv kalcijev karbonat. Zato se kuhanjem voda zamuti, a na električnim grijačima kućanskih i laboratorijskih aparata izluči „kamenac”, odnosno kalcijev karbonat.
Vodu s malo otopljenih tvari nazivamo mekanom vodom. Kišnica je tipična mekana voda. Talog koji ostaje nakon isparavanja kišnice najčešće potječe od čestica prašine koje kišne kapi pokupe prolaskom kroz onečišćenu atmosferu gradova i industrijskih središta.
U industrijskim središtima, u kojima se potrebna energija dobiva spaljivanjem ugljena, u atmosferu odlaze velike količine sumporova dioksida. Kišne kapi na svom putu kroz tako zagađenu atmosferu otapaju sumporov dioksid. Otopina sumporova dioksida u vodi je slaba kiselina pa zato padaju kisele kiše. One nanose veliku štetu okolišu, šumama, usjevima, građevinama, spomenicima od mramora i dr. Da bi se spriječilo nastajanje kiselih kiša suvremene elektrane na ugljen iz dimnih plinova posebnim postupkom uklanjaju sumporov dioksid. Zemni plin i nafta također sadržavaju sumpor, pa i njihovim spaljivanjem nastaje sumporov dioksid. Zato se iz zemnog plina sumporovi spojevi uklanjaju već na izvoru. U rafinerijama nafte također uklanjaju sumpor pa gorivo koje se prodaje na benzinskim crpkama nosi oznaku BS, što znači bez sumpora.

Slika 8.6. Zbog djelovanja kiselih kiša mnogi su povijesni spomenici u posljednjih 100 godina oštećeniji nego od vremena njihova nastanka pa do početka 20. stoljeća
8.3. Od kojih se elementarnih tvari voda sastoji
Voda je kemijski spoj vodika s kisikom. To je još 1781. godine dokazao engleski fizičar i kemičar H. Cavendisch. Izvodeći eksplozije smjesa vodika i kisika, ustanovio je da u njegovom uređaju (eudiometru) ne ostaje ništa plina ako se vodik i kisik uzeti u volumnom omjeru 2 : 1 i da pritom nastaje samo voda. Bio je to prvi dokaz da je voda kemijski spoj vodika s kisikom. Djelovanjem istosmjerne električne struje voda se može razložiti na vodik i kisik. Razlaganje tvari djelovanjem električne struje naziva se elektroliza.
Pokus 20. Elektroliza vode
Slika 8.7. Djelovanjem istosmjerne električne struje voda se razlaže na vodik i kisik. Na elektrodi priključenoj na minus pol izvora struje izluči se dva puta veći volumen plina nego na elektrodi priključenoj na plus pol izvora struje. Plin kojeg ima manje podržava gorenje pa se može zaključiti da je to kisik. Plin kojeg ima više zapaljen gori. Taj se plin naziva vodik. Njegovo je latinizirano ime hidrogenium, tj onaj koji tvori vodu (grč. hydor – voda + genesis – postanak). Čista voda slabo provodi električnu struju. Zato je u vodu dodano malo otopine natrijeva hidroksida, NaOH. Vodena otopina natrijeva hidroksida sadržava električki nabijene čestice, ione, koji prenose električni naboj kroz otopinu. Otopina je obojena dodatkom par kapi alkoholne otopine fenolftaleina. Fenolftalein je indikator kiselina i lužina. U kiselim otopinama je bezbojan, a u lužnatim pokazuje boju kao na slici.
8.4. Otpadne vode
Porast broja stanovnika i industrijska proizvodnja doveli su do zagađenja riječnih voda pa i oceana. U rijeke se ispuštaju komunalne vode s bakterijama, virusima, ali i hranjivim tvarima iz klaonica, šećerana, mljekara i dr. S poljoprivrednog zemljišta u rijeke dospijevaju umjetna gnojiva i sredstva za zaštitu bilja. Sve to završava u moru.
Zagađenje rijeka ne mora biti nužna posljedica porasta broja stanovnika i razvoja industrije. Iskorištenu vodu treba pročistiti i vratiti u riječne tokove. Najprije se uklanjaju krupna onečišćenja, kao što su komadi drva, plastične vrećice i drugi kruti otpaci. Zatim se voda pušta kroz široke kanale u kojima se taloži pijesak i drugi grubi otpaci, a potom u velike spremnike u kojima se taloži mulj. Tvari organskog podrijetla, koje mogu potjecati iz gradske kanalizacije ili industrije, uklanjaju se pomoću bakterija. Onečišćena se voda rasprši u sitne kapljice kako bi se u njoj otopilo što više kisika. Kisik pomaže rast bakterija koje organske tvari troše za hranu. Ako je potrebno, voda se još dodatno klorira prije ispuštanja u rijeke. Nažalost, ta dva stupnja pročišćavanja otpadnih voda ne mogu ukloniti otopljene nitrate i fosfate. Oni u otpadne vode dospijevaju iz fekalija i s poljoprivrednih površina koje se gnoje velikim količinama fosfornih i dušičnih gnojiva. Nitrati i fosfati u vodama pomažu razvoj algi. One se brzo razmnožavaju, ali i brzo ugibaju i padaju na dno rijeka i jezera. Tamo trunu i troše kisik što uzrokuje ugibanje svih onih organizama kojima je za život potreban kisik. Zato iz rijeka i jezera nestaju ribe.
Prije oko sedamdeset godina upotrebljavao se insekticid poznat pod nazivom DDT. To je vrlo stabilan spoj koji se ubrzo pojavio u gotovo svim prehrambenim proizvodima. U svrhu istraživanja, u Americi su u jedno čisto jezero namjerno ubacili određenu količinu DDT-a i mjerili njegovu koncentraciju u vodi, planktonu, malim i velikim ribama te pticama koje su se hranile ribama iz tog jezera. Ustanovili su da se koncentracija DDT-a u planktonu povećala oko 250 puta, u malim ribama, kojima je plankton osnovna hrana, oko 10 000 puta, u velikim ribama oko 100 000 puta, dok su ptice ugibale. Isto se događa sa svim teško razgradivim spojevima koje nesmotren ili gramziv čovjek odbacuje u prirodu. Koncentracija štetnih tvari neprekidno se povećava unutar hranidbenog lanca, a upravo je čovjek kao svežder na njegovu vrhu.
Dobro razmislite prije nego upotrijebite neki pesticid, ili u prirodu odbacite neki otrov, jer ćete ga na kraju sami pojesti ili popiti.
Upamtite
Razlaganje tvari djelovanjem električne struje zove se elektroliza (grč. elektron – jantar + lysis - razlaganje).
Razlaganje tvari djelovanjem topline naziva se piroliza (grč. pyr – vatra).
Razlaganje tvari djelovanjem svjetlosti zove se fotoliza (grč. fos – svjetlo).
Dobivanje novih tvari međusobnom reakcijom elementarnih tvari ili kemijskih spojeva naziva se sinteza (grč. synthesis – sastavljanje).
Rastavljanje neke tvari kemijskim postupcima na jednostavnije tvari naziva se analiza (grč. analyo – rasčlanjujem).
Izradite plakat o temi „voda“.
YouTube Video: Wastewater Treatment Plant Tour - "Flush To Finish"
9. VODIK
Vodik zauzima posebno mjesto i pažnju među svim nemetalima jer tri četvrtine mase Sunca čini upravo vodik. Smatra se da 90 % svih atoma u svemiru čine atomi vodika i da vodik čini čak 75 % mase svemira. Na Zemlji je većina vodika vezana s kisikom u vodu.
Vodik je plin bez boje i mirisa. Rabi se u industriji, primjerice u proizvodnji margarina, za oplemenjivanje motornih ulja, dobivanje volframa od kojega se izrađuju niti električnih žarulja, itd. Ukapljeni (tekući) vodik (vrelište pri −253 °C) zajedno s ukapljenim kisikom (vrelište pri −183 °C) rabi se kao raketno gorivo.

Slika 9.1. Kippov aparat. Vodik se u laboratoriju najčešće dobiva djelovanjem razrijeđene sumporne kiseline na cink u Kippovu aparatu. Da bi se ubrzalo razvijanje vodika sumpornoj kiselini doda se nekoliko kristalića ili malo otopine modre galice. Otvaranjem pipca na tubusu Kippova aparata sumporna kiselina dođe u doticaj s metalnim cinkom, pa se razvija vodik. Kad se pipac zatvori vodik se i dalje razvija pa potisne kiselinu iz srednje kugle s cinkom. Zbog toga prestane daljnje razvijanje vodika. Vodik se skuplja u posudama s otvorom okrenutim prema dolje jer mu je gustoća manja od gustoće zraka.
H2O - kemijska
formula vode
Zn - kemijski simbol (znak) za cink
H2SO4 - kemijska formula sumporne kiseline
Od svih plinova vodik ima najmanju gustoću. Zato su ga nekad rabili za punjenje balona i upravljivih „zračnih brodova” pokretanih benzinskim motorima. Glavni pobornik gradnje čvrstih zračnih brodova bio je njemački konstruktor Ferdinand von Zeppelin. Najpoznatiji je njegov zračni brod Hindenburg kojim se odvijao putnički promet između Europe i Amerike. Dugačak 245 m i promjera 41 m imao je zapreminu 199 998 m3, a putovao je brzinom od 126 km/h. Bio je punjen vodikom. Prilikom pristajanja u Lakehurstu, N. J., SAD, zapalio se 6. svibnja 1937. godine. Pretpostavlja se da su katastrofu uzrokovale nepovoljne vremenske prilike i električno pražnjenje.
Pokus
21.
Eksplozija smjese
vodika i zraka (demonstracijski pokus)
Pri gorenju vodika ili
eksploziji smjese
vodika i zraka jedini produkt je voda. Najžešće eksplodiraju smjese
vodika i
kisika kad se ti plinovi pomiješaju u volumnom omjeru 2 : 1. Takva
smjesa se
naziva plin praskavac.
Prisjetite se
pokusa elektrolize vode. Elektrolizom vode dobiju se vodik i kisik u
volumnom
omjeru 2 : 1.
Upamtite
Sve su smjese zapaljivih plinova i zraka eksplozivne. U rudnicima ugljena dolazi do eksplozije smjese metana (zemnog plina) i zraka. Uzrok tim eksplozijama je slabo provjetravanje rudnika. Iz novinskih vijesti doznajemo da se eksplozije u stanovima događaju zbog nekontroliranog istjecanja plina iz plinovodne mreže ili boca s ukapljenim plinom (smjesa propana i butana).
Izradite plakat o jednoj od tema:
a) dobivanje vodika,
b) upotreba vodika.
Još prije 2 500 godina grčki filozofi materijalisti pitali su se do koje se mjere tvari mogu usitnjavati na sve manje i manje čestice? Ima li tome kraja? Demokrit (470. do 380. godine prije Krista) prihvatio je Leukipovo učenje o atomima razvio ga i zaključio da sve tvari moraju biti izgrađene od najmanjih, dalje nedjeljivih čestica, atoma (grčki atomos znači nedjeljiv). Demokritove ideje prihvaćene su tek početkom 19. stoljeća kad su znanstvenici uspjeli rezultate svojih pokusa objasniti teorijom o atomima i molekulama kao najmanjim česticama tvari.
Prvu prihvatljivu atomsku teoriju dao je 1808. godine engleski kemičar John Dalton (1766. – 1844.). On je na osnovi mnogobrojnih kemijskih pokusa došao do zaključka da su elementarne tvari izgrađene od vrlo malih materijalnih čestica – atoma, koji se tijekom kemijske reakcije ne cijepaju i ne nestaju. Prvi zapis o tome nalazi se u njegovu dnevniku s nadnevkom 6. rujna 1803. Ta ideja nije nova, ali sugerira da se svaka pojedina elementarna tvar, odnosno kemijski element, sastoji od samo njemu svojstvenih i jednakih atoma.
10.1. Koliko su veliki atomi
Atom je najmanja čestica bilo koje elementarne tvari, odnosno kemijskog elementa. Atome zamišljamo kao vrlo male kuglice. Ipak, atomi su toliko maleni da se to ne može jednostavno zamisliti. Radijus atoma vodika je 0,12 nanometara, kisika 0,14 a dušika 0,15 nanometara. Ni atom kalcija nije mnogo veći, iako je on jedan od najvećih atoma. Njegov je radijus 0,20 nanometara.
Što je nanometar?
To je dio metra koji se dobije tako da se dužina od 1 m podijeli na milijardu dijelova. Kako je radijus atoma kalcija 0,20 nm (nm je kratica za nanometar), njegov je dijametar 0,40 nm. Zamislimo atome kalcija, odnosno kuglice dijametra 0,40 nm, složene u niz jedne do drugih. Broj atoma kalcija koji stane na dužinu od 1 m može se izračunati tako da se dužinu od 1 m podijeli dijametrom jednog atoma kalcija. Odavde proizlazi da bi na dužinu od 1 m stalo dvije i pol milijarde atoma kalcija ili čak tri i pol milijarde atoma zlata, jer su oni manji od atoma kalcija.
Koliko je velik broj dvije i pol milijarde?
To bismo mogli jednostavno doznati – brojenjem. Brojimo tako da svake sekunde uzmemo jednu kuglicu – atom. Minuta ima 60 s, sat 3600 s, dan 86 400 s, a godina 31 536 000 s. Ako broj atoma kalcija, 2 500 000 000, podijelimo s 31 536 000 proizlazi da bismo za oko 79 godina uspjeli prebrojiti atome kalcija koji čine lanac duljine samo 1 m. Dakle, prosječan ljudski život. Kad bi taj lanac bio od atoma zlata, za taj bi posao jednom čovjeku trebalo čak 111 godina. (Teško je biti milijarder. Za razliku od običnih ljudi, milijarderi ne mogu ni prebrojiti svoj novac.)
10.2. Građa atoma
Građu atoma nije bilo tako jednostavno otkriti. Kraj 19. i početak 20. stoljeća jedno je od najuzbudljivijih razdoblja znanosti. Otkrića su se događala jedno za drugim, a novine su gotovo svakodnevno o tome izvještavale.
Krajem 19. stoljeća znanstvenici su otkrili da su atomi, za koje se smatralo da su nedjeljivi, ipak sastavljeni od više manjih dijelova ili čestica. Najprije su otkrili česticu negativna električnog naboja koju su nazvali elektron (grč. elektron – jantar). Naboj elektrona najmanji je mogući ili elementarni električni naboj. Elektrone označujemo znakom e−.
Atomi su električki neutralni pa su znanstvenici zaključili da atom sadržava i pozitivno nabijene čestice koje neutraliziraju negativni naboj elektrona. Kada su otkrili tu česticu, ustanovili su da je njezina masa gotovo dvije tisuće puta veća od mase elektrona. Tu su česticu pozitivnog naboja nazvali proton (grč. protos – prvi). Naboj protona jednak je naboju elektrona, ali suprotna predznaka. Protone označujemo znakom p+.
Daljnja su istraživanja pokazala da atom sadržava još i čestice približno jednake mase kao i protoni, ali bez električnog naboja. Te su čestice nazvali neutronima. Neutrone označujemo znakom no.
Građa atoma ili međusobni razmještaj protona, neutrona i elektrona u atomu dugo je bio zagonetka. Na temelju pokusa koje su proveli H. Geiger i E. Marsden, engleski znanstvenik Ernest Rutherford došao je 1911. godine do zaključaka:
U središtu atoma je nukleus ili pozitivno nabijena atomska jezgra koja se sastoji od protona i neutrona.
Oko pozitivno nabijene jezgre nalaze se negativno nabijeni elektroni koji čine elektronski omotač.
U neutralnom atomu broj protona u jezgri jednak je broju elektrona u elektronskom omotaču.
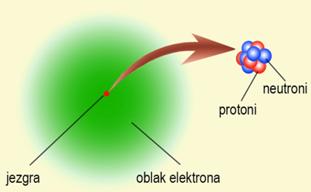
Slika 10.1. Shematski prikaz građe atoma. Atom zamišljamo kao kuglu. Jezgra atoma sastoji se od protona i neutrona. Oko jezgre nalaze se elektroni koji čine elektronski omotač. Promjer atomske jezgre je oko 10 000 puta manji od promjera atoma. Crtež je uvećan 100 000 000 puta.Ne može se reći gdje se elektroni nalaze u nekom trenutku. Zato se u shematskim prikazima i modelima građe atoma elektroni prikazuju oblakom različite gustoće. Gdje je gustoća oblaka veća, veća je vjerojatnost da se na tome mjestu nađu elektroni.
10.3. Kemijski elementi
Atomi različitih kemijskih elemenata različite su građe. Primjerice, jezgra atoma vodika sadržava samo jedan proton. Svi atomi čija jezgra sadržava samo jedan proton jesu atomi vodika. Svaki atom koji u jezgri sadržava dva protona jest atom helija. Atomi ugljika sadržavaju šest, atomi dušika sedam, a kisika osam protona u jezgri. Svi atomi koji u jezgri sadržavaju 92 protona jesu atomi urana.
Upamtite
Kemijski element je vrsta tvari koja se sastoji samo od atoma s istim brojem protona u jezgri.
Broj protona u jezgri atoma određuje kojemu kemijskom elementu taj atom pripada.
Broj protona u jezgri atoma naziva se protonski ili redni broj, a označuje se znakom Z.
Protoni i neutroni nazivaju se nukleoni jer izgrađuju atomsku jezgru (lat. nucleus – jezgra).
Tablica 10.1. Građa atoma nekih kemijskih elemenata
|
Element |
Redni broj, Z |
Broj elektrona |
Broj protona |
Broj neutrona |
|
vodik |
1 |
1 |
1 |
0 |
|
helij |
2 |
2 |
2 |
2 |
|
litij |
3 |
3 |
3 |
4 |
|
berilij |
4 |
4 |
4 |
5 |
|
bor |
5 |
5 |
5 |
6 |
|
ugljik |
6 |
6 |
6 |
6 |
|
dušik |
7 |
7 |
7 |
7 |
|
kisik |
8 |
8 |
8 |
8 |
|
fluor |
9 |
9 |
9 |
10 |
|
neon |
10 |
10 |
10 |
10 |
|
natrij |
11 |
11 |
11 |
12 |
|
aluminij |
13 |
13 |
13 |
14 |
|
fosfor |
15 |
15 |
15 |
16 |
|
zlato |
79 |
79 |
79 |
118 |
|
uranij |
92 |
92 |
92 |
146 |
Na temelju podataka iz tablice 10.1. zaključite:
- U kakvu su međusobnom odnosu protonski ili redni broj elementa, broj elektrona u elektronskom omotaču i broj protona u atomskoj jezgri?
- Neutroni su „ljepilo“ koje održava pozitivno nabijene protone u jezgri atoma. Kako se mijenja broj neutrona u jezgri s porastom rednog ili protonskog broja elementa?
10.4. Imena i simboli kemijskih elemenata
Imena kemijskim elementima obično su davali oni znanstvenici koji su element i otkrili. To su najčešće latinizirana imena. Neki su kemijski elementi poznati od davnine pa im se ne zna podrijetlo imena. U opisima svojih pokusa kemičari se rijetko služe punim imenima kemijskih elemenata, već rabe simbole. Engleski znanstvenik John Dalton uzimao je slikovne simbole za kemijske elemente. Suvremene simbole kemijskih elemenata uveo je švedski kemičar J. Berzelius (1779.– 1848.).

Simbol kemijskog elementa označuje vrstu atoma. Sastoji se najčešće od dva početna slova njegova latiniziranog imena. Pritom je prvo slovo uvijek veliko. Samo za mali broj elemenata rabi se simbol od jednog slova. U tablici 10.2. navedena su latinizirana imena, simboli i hrvatska imena samo nekih kemijskih elemenata.
YouTube Video: The History of Atomic Theory
Tablica 10.2. Suvremena imena i simboli nekih kemijskih elemenata|
Latinizirano ime |
Simbol |
Čitaj |
Hrvatsko ime |
|
Hydrogenium |
H |
ha |
vodik |
|
Carboneum |
C |
ce |
ugljik |
|
Nitrogenium |
N |
en |
dušik |
|
Oxygenium |
O |
o |
kisik |
|
Phosphorus |
P |
pe |
fosfor |
|
Sulphur |
S |
es |
sumpor |
|
Ferrum |
Fe |
ef-e |
željezo |
|
Zincum |
Zn |
ze-en |
cink |
|
Cuprum |
Cu |
ce-u |
bakar |
|
Plumbum |
Pb |
pe-be |
olovo |
|
Argentum |
Ag |
a-ge |
srebro |
|
Aurum |
Au |
a-u |
zlato |
|
Platinum |
Pt |
pe-te |
platina |
|
Hydrargyrum |
Hg |
ha-ge |
živa |
Simbol svakog elementa ima dvojako značenje. Primjerice, simbol Fe kvalitativno označuje kemijski element željezo i ujedno kvantitativno označuje jedan atom željeza. Ako želimo označiti 2 atoma željeza, onda ćemo ispred simbola elementa dodati koeficijent 2 i napisati 2 Fe, tri atoma željeza označuju se koeficijentom 3 ispred simbola elementa, odnosno 3 Fe itd.

10.5. Protonski i maseni broj
Već smo kazali da svi atomi nekoga kemijskog elementa imaju isti broj protona u jezgri, tj. isti protonski broj. Protonski broj označuje se slovom Z, a ponekad se naziva i redni broj, jer se po njemu kemijski elementi mogu poredati u niz. Protonski ili redni broj elementa označuje se kao donji indeks ispred simbola elementa. Za prvih šest elemenata to bismo napisali ovako: 1H, 2He, 3Li, 4Be, 5B, 6C.
Jezgre atoma, osim protona, sadržavaju i neutrone. Ukupan broj protona i neutrona u jezgri atoma naziva se maseni broj ili nukleonski broj i označuje znakom A.
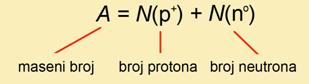
Svi atomi istoga kemijskog elementa ne moraju biti jednaki. Neki mogu imati više, a neki manje neutrona. Tako se u prirodi nalaze tri vrste atoma ugljika koje nazivamo izotopima. Svi oni u jezgri sadržavaju 6 protona i imaju protonski ili redni broj 6. Glavnina, 98,9 %, atoma ugljika koji se nalaze u prirodi sadržava u jezgri 6 neutrona, pa je njihov maseni broj 12. No, 1,1% ugljikovih atoma sadržava 7 neutrona i njihov je maseni broj 13. U prirodi se nalaze još i atomi ugljika s 8 neutrona u jezgri pa je njihov maseni broj 14. Ugljikovih atoma s masenim brojem 14 ima vrlo malo, samo 1 atom prema tisuću milijarda atoma ugljika s masenim brojem 12.
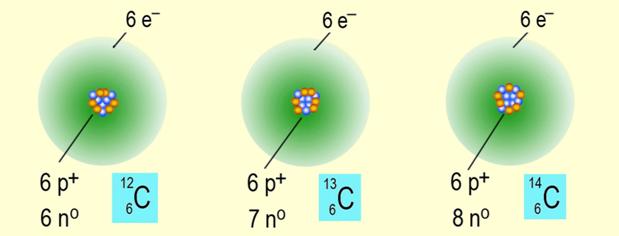
Slika 10.3. Shematski prikaz građe atoma izotopa ugljika. Svi atomi ugljika sadržavaju 6 protona u jezgri i 6 elektrona u elektronskom omotaču. Zato je 6 protonski ili redni broj svih atoma ugljika. Maseni broj nekog atoma jednak je zbroju broja protona i neutrona u jezgri. Zato atomi izotopa ugljika imaju različite masene brojeve: 12, 13 i 14.
Upamtite
Izotopi su atomi istoga kemijskog elementa s različitim brojem neutrona u jezgri.
Protonski ili redni broj elementa piše se kao donji indeks ispred simbola elementa
Maseni broj piše se kao gornji indeks ispred simbola elementa. Za atome izotopa ugljika to bismo napisali ovako: 126C, 136C, 146C.
10.6. Relativna atomska masa, Ar
Mase atoma nije lako neposredno izmjeriti. Zato se čak od Daltonova vremena pa do danas, mase atoma iskazuju relativnom atomskom masom, odnosno brojem koji pokazuje relativni odnos mase pojedinog atoma prema nekoj odabranoj jedinici mase. Nekad se za atomsku jedinicu mase uzimala masa atoma vodika. Danas rabimo drugu jedinicu mase, koju u čast J. Daltonu nazivamo dalton, a koja se ne razlikuje puno od mase atoma vodika.
Relativne atomske mase kemijskih elemenata nisu cijeli brojevi. To je zato što su kemijski elementi u prirodi smjesa izotopa s različitim masenim brojevima. Kod određivanja relativnih atomskih masa treba uzeti prosječnu masu svih atomâ nekog elementa u prirodi. Npr. prirodni kositar je smjesa čak 10 izotopa. U prirodi su jednaki samo svi atomi helija, berilija, fluora, natrija, aluminija, fosfora, zlata i još nekih elemenata. Oni nemaju prirodnih izotopa. Njihovi se izotopi mogu dobiti umjetnim putem tako da ih se izloži zračenju u nuklearnom reaktoru.
Upamtite
Relativna atomska masa nekoga atoma jest broj koji kaže koliko je puta masa toga atoma veća od atomske jedinice mase dalton.
Relativna atomska masa je neimenovan broj. Znak za relativnu atomsku masu je Ar.
Svi atomi nekoga kemijskog elementa nisu jednaki, tj. u prirodi dolaze kao smjesa izotopa.
Relativna atomska masa kemijskog elementa, Ar(E), jest broj koji kaže koliko je puta prosječna masa atomâ nekoga kemijskog elementa veća od atomske jedinice mase dalton.
Smisao prosječne mase atomâ nekog kemijskog elementa objasnit ćemo jednostavnim primjerom s kuglicama. Učenici su određivali relativne mase 17 crnih kuglica prema masi manje narančaste kuglice koju su odabrali za jedinicu mase. Vagom su ustanovili da 10 crnih kuglica ima relativnu masu 20, pet kuglica ima relativnu masu 21, a samo dvije kuglice imaju relativnu masu 22. Odavde proizlazi:
Ukupan broj kuglica: N = 10+5+2 = 17
Zbroj relativnih masa svih kuglica je:
mukupno = 10×20 + 5×21 + 2×22 = 349.
Prosječna relativna masa kuglica, mr, dobije se tako da se zbroj relativnih masa svih kuglica podijeli njihovim brojem, N.
mukupno 349mr = ———--- = ——— = 20,53
N 17
Isto se načelo primjenjuje pri izračunavanju relativnih atomskih masa kemijskih elemenata. Relativne atomske mase kemijskih elemenata možemo pročitati iz tablica. Te se tablice stalno nadopunjuju sve točnijim vrijednostima kako napreduju mogućnosti mjerenja.
10.7. Periodni sustav kemijskih elemenata
Tijekom XVIII. stoljeća i prvih desetljeća XIX. stoljeća mnogi su istraživači uspjeli prikupiti brojne podatke o svojstvima tada poznatih kemijskih elemenata i njihovih spojeva. Već se tada znalo da neki kemijski elementi pokazuju slična kemijska svojstva.
Oslanjajući se na sličnosti kemijskih svojstava i na poznavanje relativnih atomskih masa, mnogi su istraživači pokušavali načiniti racionalnu klasifikaciju elemenata. Najviše je uspjeha pritom imao ruski kemičar profesor Sveučilišta u Petrogradu, Dmitrij Ivanovič Mendeljejev (1834. - 1907.). On je 1869. godine poredao kemijske elemente u niz po rastućim relativnim atomskim masama. Kad bi u nizu elemenata došao do elementa sličnih kemijskih svojstava s nekim prethodnim elementom, započeo je novi redak stavljajući kemijski slične elemente jedne ispod drugih. Tako je dobio tablicu koja je sadržavala horizontalne redove ili periode i vertikalne stupce ili skupine. Tim su se načinom u istoj skupini našli elementi sličnih kemijskih svojstava.
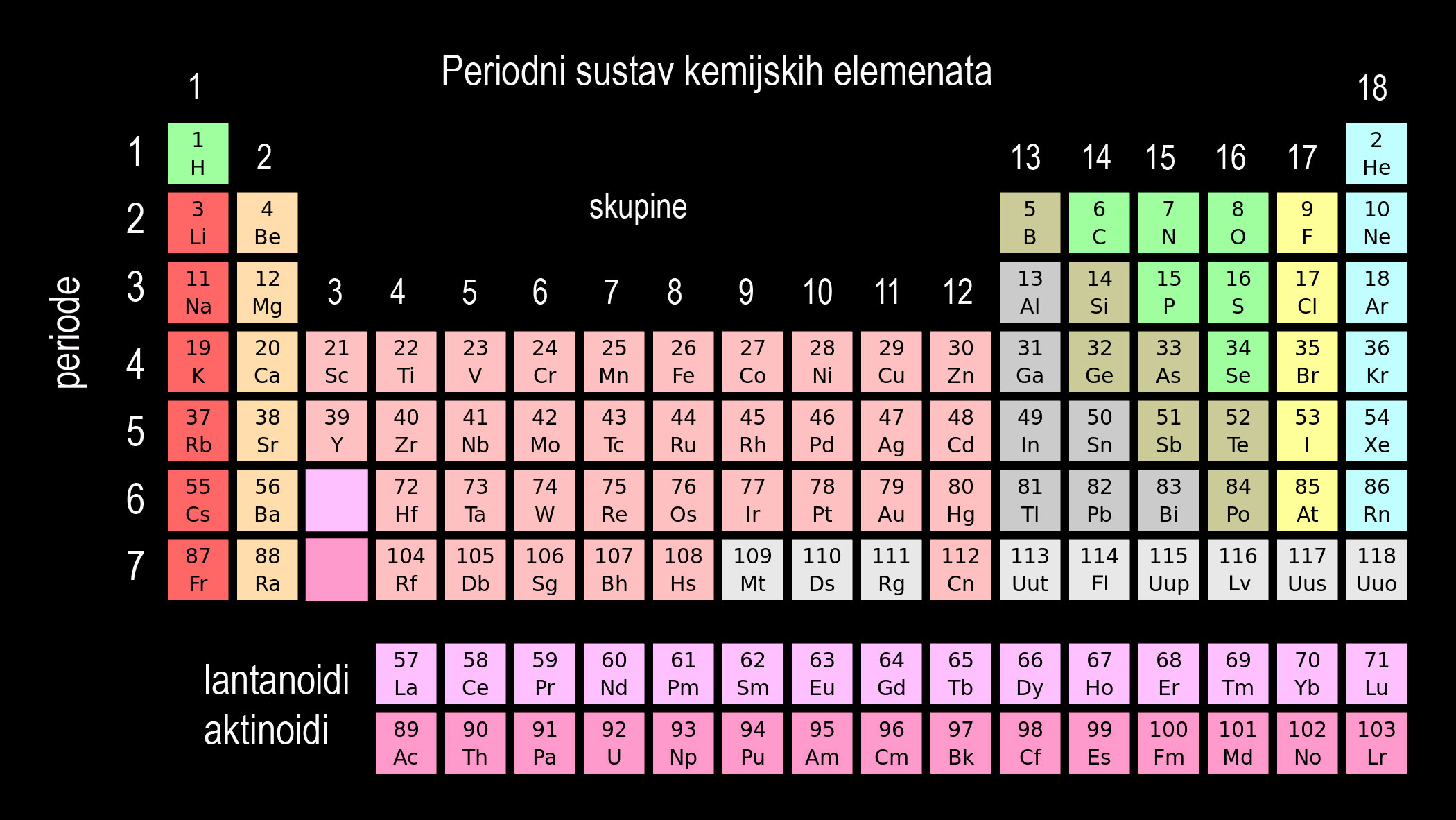
Slika 10.4. Suvremena tablica periodnog sustava kemijskih elemenata. Redni ili protonski broj elementa piše se iznad njegova simbola.
Mendeljejev je bio toliko siguran u otkrivenu zakonitost, po kojoj se svojstva elemenata periodički mijenjaju (periodni zakon), da je mnogim elementima ispravio tada krivo određene relativne atomske mase. Važno je naglasiti da je periodni sustav elemenata Mendeljejev otkrio prije spoznaja o građi atoma. Otkrića o građi atoma početkom 20. stoljeća samo su potvrdila ispravnost Mendeljejevog periodnog zakona.
Upamtite
Kemijski elementi čine niz u kojemu svaki sljedeći element u nizu ima jedan proton više u jezgri i jedan elektron više u elektronskom omotaču.
Broj protona u jezgri atoma naziva se protonski ili redni broj, a označuje se znakom Z.
Redni broj elementa u Mendeljejevom periodnom sustavu elemenata jednak je protonskom ili rednom broju atoma dotičnog elementa.
Skupine u Mendeljejevom periodnom sustavu elemenata sadržavaju elemente sličnih kemijskih svojstava.
10.8. Rasprostranjenost kemijskih elemenata u prirodi
U prirodi se nalazi 98 kemijskih elemenata, od kojih 84 postoje od iskona. Ostalih 14 elemenata nastalo je kao posljedica radioaktivnog raspada nekih od prvotnih elemenata. Svi elementi, počem od Einsteinija (redni broj 99) do ununoctium-a, Uuo (redni broj 118), ne nastaju prirodnim putem u svemiru, već su sintetizirani u laboratoriju. Ti umjetno stvoreni kemijski elementi vrlo brzo se raspadaju te se ne mogu dobiti u makroskopskim količinama. Svi elementi s rednim brojem većim od 92 nazivaju se transuranijskim elementima.
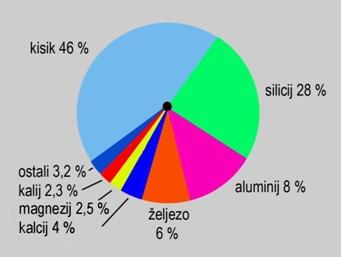
Slika 10.5. Rasprostranjenost kemijskih elemenata u Zemljinoj kori.
Zanimljivo je da je od svih poznatih kemijskih elemenata u svemiru najzastupljeniji vodik, a astronomi tvrde da on čini čak 75 % mase svemira i 90 % svih atoma u svemiru. Daljnjih 34 % mase svemira čini helij, a samo 1 % svi ostali kemijski elementi. Na zvjezdanom nebu vide se milijuni zvijezda i samo nekoliko planeta. Zvijezde se sastoje uglavnom od vodika. Primjerice, Sunce se sastoji od oko 73,5 % vodika, 24,5 % helija dok oko 2 % mase Sunca čine svi ostali elementi zajedno. Planeti imaju drukčiji kemijski sastav. Primjerice, samo 8 kemijskih elemenata čini 98,2 % mase Zemljine kore do dubine od 35 km, a od toga 46 % otpada na kisik, 28 % na silicij i 8 % na aluminij. (Napomena: Podaci iz različitih literaturnih izvora mogu se razlikovati.)
Živi organizmi sastoje se uglavnom od kisika, ugljika, vodika, dušika, sumpora, kalcija i fosfora. U sastav živih organizama ulaze još natrij, kalij, klor, željezo, a u vrlo malim količinama kobalt, cink, bakar i još neki kemijski elementi.
Ponovimo
Atomska jezgra ili nukleus ima pozitivan električni naboj, a sastoji se od protona i neutrona.
Pozitivno nabijenu jezgru okružuje negativno nabijeni oblak elektrona (elektronski omotač).
Protoni, p+, imaju jedinični pozitivan električni naboj.Neutroni, no, nemaju električnog naboja.
Elektroni, e–, imaju jedinični negativni električni naboj.
U neutralnom atomu broj protona u jezgri jednak je broju elektrona u elektronskom omotaču.
Broj protona u jezgri atoma određuje kojemu kemijskom elementu taj atom pripada.
Protonski ili redni broj, Z, atoma nekog elementa jednak je broju protona u jezgri, a piše se kao donji indeks ispred simbola elementa.
Maseni ili nukleonski broj, A = N(p+) + N(no), piše se kao gornji indeks ispred simbola elementa.
Izotopi su atomi istoga kemijskog elementa s različitim brojem neutrona u jezgri.
Redni broj elementa u Mendeljejevom periodnom sustavu elemenata jednak je protonskom ili rednom broju atoma dotičnog elementa.
Skupine u Mendeljejevom periodnom sustavu elemenata sadržavaju elemente sličnih kemijskih svojstava.
Izradite plakat o jednoj od tema:
a) atomi,
b) kemijski elementi,
c) simboli kemijskih elemenata.
YouTube Video: Elements and the Structure of the Atom
YouTube Video: The History of Atomic Theory
11. KEMIJSKE FORMULE I JEDNADŽBE
Spojevi nastaju međusobnim spajanjem atoma dvaju ili više različitih kemijskih elemenata. No, svi se atomi međusobno ne spajaju na jednak način. Ima više načina međusobnoga spajanja atoma elemenata. Atomi nemetala međusobno se spajaju tako da tvore molekule. Atomi metala s atomima nemetala spajaju se tako da tvore ione i spojeve ionske građe ili ionske strukture.
11.1. Zakoni kemijskog spajanja
Pokus 22. Sinteza željezova sulfida
Na temelju rezultata kemijske analize velikog broja kemijskih spojeva francuski kemičar Louis Joseph Proust (1754.-1826) još je 1797. godine najavio zakon stalnih omjera masa elemenata u kemijskom spoju.
Dva ili više kemijskih elemenata u određenom kemijskom spoju uvijek se međusobno spajaju u stalnom omjeru njihovih masa.
Kad se užarenom žicom dotakne smjesa željeza i sumpora u prahu, oni se međusobno spajaju u željezov sulfid uz pojavu svjetlosti i oslobađanje topline. Istraživanja su pokazala da se željezo i sumpor međusobno spajaju uvijek u istom uteznom omjeru. Primjerice, uvijek će se 55,85 g željeza spojiti s 32,06 g sumpora pri čemu će nastati 87,91 g željezova sulfida.
Stalan utezni omjer u kojem se međusobno spajaju kemijski elementi posljedica je atomske građe tvari. U željezovu sulfidu željezo i sumpor uvijek se spajaju tako da na jedan atom željeza dolazi jedan atom sumpora. Atomi željeza i sumpora imaju različite relativne atomske mase. Relativna atomska masa željeza je 55,85 a sumpora 32,06. Ako odvažemo 55,85 g željeza ili 32,06 g sumpora onda smo u oba slučaja odvagali jednak broj atoma. Kako se atomi željeza i sumpora spajaju u omjeru 1 : 1, logično je da se željezo i sumpor međusobno spajaju u stalnom uteznom omjeru, 55,85 : 32,06, odnosno u omjeru njihovih relativnih atomskih masa.
Zagrijemo li u zataljenoj kvarcnoj cijevi smjesu od 55,85 g željeza i 50 g sumpora, opet će nastati 87,91 g željezova sulfida pa ćemo dobiti smjesu od 87,91 g željezova sulfida i 17,94 g neizreagiranog sumpora. Na temelju sličnih pokusa francuski kemičar A. L. Lavoisier zaključio je 1789. godine da je ukupna masa tvari koje ulaze u kemijsku reakciju jednaka ukupnoj masi tvari koje nastaju tom reakcijom. Ta je činjenica poznata kao zakon o očuvanju mase kod kemijskih reakcija, jer tvari ne mogu nestati niti mogu nastati ni iz čega.
11.2. Formula spoja
Omjer broja atoma pojedinih elemenata međusobno vezanih u kemijskom spoju prikazuje se formulom. Kemijska formula opisuje sastav kemijskih spojeva pomoću simbola kemijskih elemenata. Kako se u željezovu sulfidu atomi željeza i sumpora spajaju u omjeru 1 : 1, formula željezova sulfida jest FeS.
U prirodi se može naći mineral poznat pod nazivom pirit u kojemu su atomi željeza i sumpora međusobno vezani u omjeru 1 : 2. Prema tome formula pirita jest FeS2. Lijepo razvijeni kristali pirita imaju oblik kocke. Zbog zlatnožute boje lako se prevariti i pirit zamijeniti za zlato.
Atomi sumpora s atomima drugih elemenata spajaju se i u drukčijim omjerima. Primjerice, u srebrovom sulfidu atomi srebra i sumpora međusobno su spojeni u omjeru 2 : 1, pa je formula srebrova sulfida Ag2S.

Atomi željeza spajaju se s atomima kisika u omjerima 1:1, 2:3 i 3:4, pa su pripadne formule željezovih oksida FeO, Fe2O3 i Fe3O4.
Kad se dva elementa spajaju u više nego jedan spoj, onda se njihovi udjeli u spoju nalaze u omjeru malih cijelih brojeva. Zakon o višekratnim uteznim omjerima elemenata u kemijskom spoju otkrio je Dalton, ali ga nije postavio. Nije to smatrao potrebnim jer taj zakon proizlazi iz njegove atomske teorije spajanja kemijskih elemenata.
11.3. Jednadžba kemijske reakcije
Željezov sulfid, FeS, u laboratoriju se dobije sintezom (grč. synthesis – sastavljanje) iz kemijskih elemenata željeza i sumpora. Kaže se da je došlo do kemijske reakcije između željeza i sumpora. Kako se u željezovu sulfidu atomi željeza i sumpora spajaju u omjeru 1 : 1, nastajanje željezova sulfida iz željeza i sumpora prikazuje se jednadžbom kemijske reakcije:
Fe + S → FeSreaktanti produkt
Željezo i sumpor su reaktanti, a željezov sulfid je produkt ove kemijske reakcije. Reaktanti se uvijek pišu na lijevoj, a produkti na desnoj strani jednadžbe kemijske reakcije. Već smo kazali da tvari ne mogu nestati niti nastati ni iz čega. Zato broj atoma na lijevoj strani mora biti jednak broju atoma na desnoj strani jednadžbe.
Iz gornje jednadžbe reakcije željeza sa sumporom možemo pročitati da jedan atom željeza reagira s jednim atomom sumpora pri čemu nastaje jedna formulska jedinka željezova sulfida, FeS. Formulska jedinka pokazuje omjer broja atoma različitih kemijskih elemenata u spoju izražen najmanjim mogućim brojevima. Pomnožimo li obje strane gornje jednadžbe nekim koeficijentom, primjerice 2, dobivamo:
2 Fe + 2 S → 2 FeS
Ovu bismo jednadžbu pročitali kao da 2 atoma željeza reagiraju s 2 atoma sumpora pri čemu nastaju dvije formulske jedinke željezova sulfida. No, takav način pisanja jednadžbi nije uobičajen. U jednadžbi reakcije koeficijente ispred simbola atoma ili formulskih jedinki spoja uvijek treba svesti na najmanje moguće cijele brojeve.
Jednadžbu kemijske reakcije možemo ispravno napisati samo ako znamo formule reaktanata i produkata. Primjerice, gorenjem željeza u kisiku nastaje željezov(III) oksid, Fe2O3, u kojemu su atomi željeza i kisika spojeni u omjeru 2 : 3.
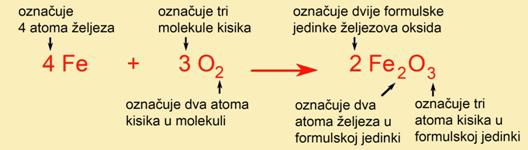
Da bismo napisali ispravnu jednadžbu reakcije u prvom koraku treba napisati formule reaktanata na lijevu stranu i formule produkata na desnu stranu jednadžbe. U drugom koraku treba izjednačiti broj atoma kisika na desnoj i lijevoj strani. Formulska jedinka Fe2O3 sadržava 3 atoma kisika, no kisik dolazi u obliku dvoatomnih molekula, O2. Zajednički višekratnik brojeva 2 i 3 jest šest. Zato treba uzeti 3 molekule kisika O2, a ispred formulske jedinke Fe2O3 staviti koeficijent 2. Kako se sada na desnoj strani jednadžbe nalaze 4 atoma željeza i na lijevoj strani moraju biti 4 atoma željeza pa ispred simbola atoma željeza treba staviti koeficijent 4.
Ponovimo
Zakon o očuvanju mase: ukupna masa svih tvari koje sudjeluju u kemijskoj reakciji ne mijenja se tijekom kemijske reakcije.
Zakon stalnih omjera masa: neki određeni kemijski spoj uvijek sadržava iste kemijske elemente spojene u istom stalnom omjeru masa.
Formula spoja pokazuje vrstu i broj atoma međusobno vezanih u spoju.
Formulska jedinka spoja jest omjer broja atoma različitih kemijskih elemenata u spoju izražen najmanjim mogućim brojevima.
Jednadžba kemijske reakcije jest kvalitativan i kvantitativan sažet prikaz kemijske reakcije.
Reaktanti su tvari koje se troše tijekom kemijske reakcije.
Produkti su tvari koje nastaju tijekom kemijske reakcije.
Reaktanti se uvijek pišu na lijevoj strani, a produkti na desnoj strani jednadžbe reakcije.
Broj atoma i električkih naboja na lijevoj strani mora biti jednak broju atoma i električkih naboja na desnoj strani jednadžbe reakcije.
Koeficijent jest broj (brojčani množitelj) ispred simbola kemijskog elementa ili formule kemijskog spoja. U jednadžbi kemijske reakcije označuje broj atoma, molekula ili formulskih jedinki spoja koje sudjeluju u kemijskoj pretvorbi.
12. IONI I IONSKE STRUKTURE
Kad se rastaljeni natrij u metalnoj žličici unese u tikvicu ispunjenu klorom, natrij se zapali. Pritom na stijenkama tikvice i u žličici nastane bijela naslaga koja se sastoji od natrijeva klorida, odnosno kuhinjske soli.
12.1. Što su i kako nastaju ioni
Tijekom gorenja natrija u kloru oslobađa se energija u obliku topline i svjetlosti. Pritom dolazi do promjene građe atoma natrija i klora jer jedan elektron preskači s atoma natrija na atom klora. Tako natrijevi atomi postaju pozitivno nabijeni natrijevi ioni, Na+ (čitaj: en-a-plus) jediničnog pozitivnog naboja, jer jezgra sadržava jedan proton više od broja elektrona u omotaču. Elektrone koje su otpustili atomi natrija istodobno primaju atomi klora i postaju negativno nabijeni klorovi ioni, Cl– (čitaj: ce-el-minus) jediničnog negativnog naboja, jer se u elektronskom omotaču nalazi jedan elektron više nego što ima protona u jezgri.
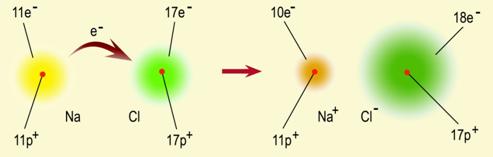
Slika 12.1. Shematski prikaz nastajanja iona Na+ i Cl– u reakciji natrija s klorom
Kemijsku reakcija između natrija i klora opisuje se sljedećom jednadžbom:
Na + ½ Cl2 → NaCl ili 2 Na + Cl2 → 2 NaCl ili 2 Na + Cl2 → 2 Na+ + 2 Cl─
(Uočite da klor čini molekule Cl2 u kojima su međusobno vezana dva atoma klora. Zato smo u jednadžbi reakcije ispred simbola natrija stavili koeficijent 2, kako bismo postigli jednak broj atoma na lijevoj i desnoj strani jednadžbe.)
Električki nabijeni atomi nazivaju se ioni. Pozitivno nabijeni ioni nazivaju se kationi. Negativno nabijeni ioni nazivaju se anioni. Spojevi izgrađeni od kationa i aniona zajedničkim se imenom nazivaju soli.
12.2. Ionska veza
Kationi i anioni u kemijskim spojevima međusobno su vezani ionskom vezom. Ta se vrsta kemijske veze temelji na elektrostatskoj privlačnosti iona suprotna naboja. Zbog jakih elektrostatskih privlačnih sila između kationa i aniona, spojevi s ionskom vezom su kristalizirane krutine visokog tališta. Primjerice, natrijev klorid, NaCl, ili kuhinjska sol tali se pri 801 ºC.
Ioni Na+
i Cl– imaju
jedinične naboje i zato se u kristalima
natrijeva klorida nalaze u omjeru
1 : 1. Iz modela kristalne strukture natrijeva klorida (slika 12.2.)
vidi se da
tu nema izoliranih molekula NaCl. Zato se nikad ne govori o molekulama
natrijeva klorida jer njih nema, već se kaže formulska
jedinka natrijeva klorida.


Slika 12.2. Model kristalne strukture natrijeva klorida. Manje žute kuglice označuju ione natrija, a veće zelene ione klora. Formula natrijeva klorida je NaCl jer na svaki ion Na+ dolazi jedan ion Cl–. Kristal je u cjelini električki neutralan. U kristalima natrijeva klorida svaki ion Na+ okružen je sa šest iona Cl–, i obratno, svaki ion Cl– okružen je sa šest iona Na+.
Slika 12.3. Pravilno razvijeni kristali natrijeva klorida imaju oblik kocke. Zato se plohe kristala natrijeva klorida sijeku pod pravim kutom. U kristalima bilo koje tvari razmještaj čestica, atoma, molekula ili kationa i aniona periodički se ponavlja u tri smjera u prostoru. To se lijepo vidi na modelu kristalne strukture natrijeva klorida prikazanom na slici 12.2.
Upamtite
U formulskoj jedinki spoja zbroj pozitivnih naboja kationa mora biti jednak zbroju negativnih naboja aniona. Formulska jedinka spoja električki je neutralna.
Sve su tvari ionske građe pri sobnoj temperaturi krutine. Talište im je visoko. Njihove vodene otopine i taline dobro provode električnu struju.
U spojevima nastalim međusobnim spajanjem elemenata druge skupine s elementima 17. skupine uvijek atomi elemenata druge skupine otpuštaju dva elektrona. Ta dva elektrona primaju dva atoma 17. skupine. Primjerice, gorenjem kalcija u kloru nastaje kalcijev klorid koji sadržava ione Ca2+ i Cl− u omjeru 1 : 2, što se opisuje jednadžbom kemijske reakcije:
Ca + Cl2 → Ca2+ + 2 Cl− ili u molekulskom obliku Ca + Cl2 → CaCl2
Aluminij također gori u kloru pri čemu nastaje aluminijev klorid, AlCl3. Atom aluminija pritom otpušta tri elektrona i zato se atomi aluminija i klora međusobno spajaju u omjeru 1 : 3.
Al + 3/2 Cl2 → Al3+ + 3 Cl− ili u molekulskom obliku 2 Al + 3 Cl2 → 2 AlCl3
Užareni metali gore i u kisiku. Primjerice, gorenjem kalcija u kisiku nastaje kalcijev oksid, CaO, u kojemu se kalcij nalazi u obliku iona Ca2+ a kisik u obliku iona O2─.
Ca + ½ O2 → Ca2+ + O2− ili u molekulskom obliku 2 Ca + O2 → 2 CaO
Kad se spajaju elementi druge skupine s elementima 16. skupine, uvijek atomi elemenata druge skupine otpuštaju dva elektrona pa postaju ioni dvostrukog pozitivnog naboja. Istodobno atomi 16. skupine te elektrone primaju pa postaju ioni dvostrukog negativnog električnog naboja.
Gorenjem aluminija u kisiku nastaje aluminijev oksid. Atomi aluminija otpuštaju tri elektrona pa postaju ioni Al3+, dok atomi kisika te elektrone primaju pa postaju ioni O2─. Broj elektrona koje otpuštaju atomi aluminija mora biti jednak broju elektrona koje primaju atomi kisika. Da bismo ispravno napisali formulu aluminijeva oksida, moramo naći zajednički višekratnik broja otpuštenih i primljenih elektrona. Zajednički višekratnik brojeva 3 i 2 jest 6.
2 Al + 3/2 O2 → 2 Al3+ + 3 O2− ili u molekulskom obliku 4 Al + 3 O2 → 2 Al2O3
Broj atoma aluminija dobijemo tako da zajednički višekratnik podijelimo nabojnim brojem iona aluminija, odnosno 6 : 3 = 2. Broj atoma kisika dobijemo tako da zajednički višekratnik podijelimo nabojnim brojem iona kisika, odnosno 6 : 2 = 3. Odavde proizlazi da je formula aluminijeva oksida Al2O3.
12.3. Maseni omjeri elemenata u kemijskom spoju
Ako se jedan atom nekog elementa spaja s jednim atomom drugog elementa, tad je omjer masa tih elemenata u spoju jednak omjeru njihovih relativnih atomskih masa. Primjerice:
Na + ½ Cl2 → Na+ + Cl─ m(Na) : m(Cl) = Ar(Na) : Ar(Cl) = 23 : 35,5
Ako se jedan atom nekog elementa spaja s dva atoma drugog elementa, tad je omjer masa tih elemenata u spoju jednak omjeru 1 : 2 njihovih relativnih atomskih masa.
Ca + Cl2 → Ca2+ + 2 Cl─ m(Ca) : m(Cl) = Ar(Ca) : 2 Ar(Cl) = 40 : 71
Ako se jedan atom nekog elementa spaja s tri atoma drugog elementa, tad je omjer masa tih elemenata u spoju jednak omjeru 1 : 3 njihovih relativnih atomskih masa.
Fe + 3/2 Cl2 → Fe3+ + 3 Cl─ m(Fe) : m(Cl) = Ar(Fe) : 3 Ar(Cl) = 55,85 : 106,35
Ako se dva atoma nekog elementa spajaju s jednim atomom drugog elementa, tad je omjer masa tih elemenata u spoju jednak omjeru 2 : 1 njihovih relativnih atomskih masa.
2 Na + S → 2 Na+ + S2─ m(Na) : m(S) = 2 Ar(Na) : Ar(S) = 46 : 32
Gorenjem aluminija u kisiku nastaje aluminijev oksid, Al2O3. Odavde proizlazi da je maseni omjer aluminija i kisika u aluminijevu oksidu:
2 Al + 3/2 O2 → 2 Al3+ + 3 O2─ m(Al) : m(O) = 2 Ar(Al) : 3 Ar(O) = 54 : 48
Po istom načelu dobivamo maseni omjer elemenata u svim spojevima, bez obzira na to kakve su građe. Uzmimo kao primjer dušičnu kiselinu, HNO3
HNO3 m(H) : m(N) : m(O) = Ar(H) : Ar(N) : 3 Ar(O) = 1 : 14 : 48.
12.4. Svojstva tvari ionske građe
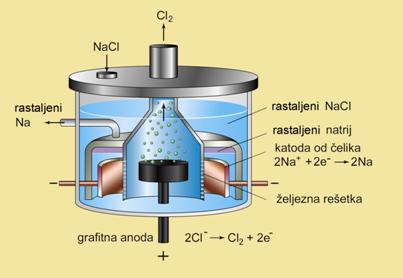
Slika 12.4. Shematski prikaz ćelije za elektrolizu rastaljena natrijeva klorida. Elektrolizom taline natrijeva klorida dobivaju se elementarni natrij i klor. Kad pozitivno nabijeni ion Na+ dotakne katodu, on primi jedan elektron i postaje atom natrija. Kad negativno nabijeni ion Cl¯ dotakne anodu, on preda jedan elektron i postaje atom klora. Atomi klora spajaju se u molekule Cl2.
Kad se tvar ionske građe rastali, talina provodi električnu struju jer se u talini ioni mogu kretati pod utjecajem električnog polja. Vodene otopine tvari ionske građe također provode električnu struju jer se i u vodenim otopinama ioni mogu kretati pod utjecajem električnog polja.
Upamtite
Tvari koje u rastaljenom stanju i vodenoj otopini provode električnu struju nazivaju se elektroliti.
U talinama i vodenim otopinama elektrolita električni naboj prenose ioni. To je bitna razlika u odnosu na metalne vodiče kroz koje električni naboj prenose elektroni.
U talinama i vodenim otopinama pod utjecajem električnog polja pozitivno nabijeni ioni (kationi) kreću se prema negativno nabijenoj elektrodi koja se naziva katoda. Istodobno, negativno nabijeni ioni (anioni) kreću se prema pozitivnoj elektrodi koja se naziva anoda.
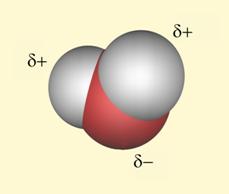
Slika
12.5. Model molekule vode. Molekule vode, H2O,
imaju oblik slova V. Elektroni u molekuli vode okružuju tri pozitivno
nabijene
jezgre. Jezgra atoma kisika ima pozitivni naboj +8, pa jače privlači
elektrone nego jezgre atoma vodika koje
imaju jedinični
pozitivni naboj. Zbog toga se na atomu kisika javlja vrlo mali
negativni, a na
atomima vodika vrlo mali pozitivni naboj. Kaže se da su molekule vode
polarne
građe jer imaju pozitivni električni pol na atomima vodika i negativni
na atomu
kisika.
Kristali natrijeva klorida, kao i drugih soli alkalijskih metala, otapaju se u vodi zato što ioni na površini kristala elektrostatskim silama privlače polarne molekule vode. Pritom se molekule vode okrenu tako da svoj pozitivno nabijeni kraj naslone na anione (negativno nabijene ione), a negativno nabijeni kraj na katione (pozitivno nabijene ione). Sada na ione na površini, a posebno na bridovima i uglovima kristala, s jedne strane djeluju jake privlačne sile polarnih molekula vode, a s druge strane oslabljene privlačne sile prema ionima iz kristala. (Vidi sliku 12.6.) Zbog toga ioni s površine kristala lako prelaze u otopinu. Otapanje se događa tako dugo dok ne nastane zasićena otopina. U zasićenoj otopini je broj iona koji iz kristala prelaze u otopinu jednak broju iona koji se iz otopine vraćaju na površinu kristala.
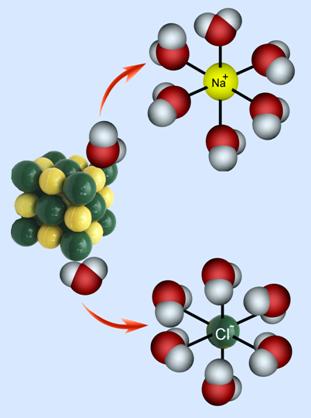
Slika 12.6. Shematski prikaz otapanja natrijeva klorida u vodi. Molekule vode izvlače ione s površine kristala. U vodenoj otopini kationi i anioni okruženi su molekulama vode i kaotično se gibaju kroz cijelu otopinu.
Tablica 12.2. Svojstva nekih spojeva ionske građe
|
Spoj |
Agregacijsko stanje |
Topljivost u vodi |
Formula |
Ioni u otopini |
|
natrijev klorid |
krutina |
dobra |
NaCl |
Na+, Cl– |
|
magnezijev klorid |
krutina |
dobra |
MgCl2 |
Mg2+, 2 Cl– |
|
kalcijev klorid |
krutina |
dobra |
CaCl2 |
Ca2+, 2 Cl– |
|
bakrov(II) klorid |
krutina |
dobra |
CuCl2 |
Cu2+, 2 Cl– |
|
kalcijev fluorid |
krutina |
netopljiv |
CaF2 |
_ |
|
kalcijev karbonat |
krutina |
netopljiv |
CaCO3 |
_ |
|
aluminijev oksid |
krutina |
netopljiv |
Al2O3 |
_ |
Neke tvari ionske građe netopljive su u vodi. Primjerice, u vodi su netopljivi aluminijev oksid, Al2O3, kalcijev fluorid, CaF2, cinkov sulfid, ZnS, olovov sulfid, PbS, kalcijev karbonat, CaCO3, i mnogi drugi spojevi.
Topljivost ovisi o jakosti privlačnih sila između iona suprotna naboja. Primjerice, ioni Na+ i Cl– imaju jedinični električni naboj i privlačna sila između njih slabija je od privlačne sile između iona s dvostruko većim električnim nabojem, kao što su ioni Ca2+ i CO32−. Oni se u kristalima kalcijeva karbonata tako jako privlače da ih molekule vode ne mogu razdvojiti. Zato je mramor, odnosno kalcijev karbonat, CaCO3, netopljiv u čistoj vodi. U protivnom, svi bi se mramorni spomenici odavno otopili.
Ponovimo
Formulska jedinka spoja jest omjer broja atoma ili iona različitih kemijskih elemenata u spoju izražen najmanjim mogućim brojevima.
Kationi su pozitivno nabijeni ioni.
Anioni su negativno nabijeni ioni.
Elektrolit je otopina ili talina kemijskog spoja u kojoj električni naboj prenose kationi i anioni.
Elektroliza je rastavljanje tvari djelovanjem električne struje.
Izradite plakat o jednoj od tema:
a) zakoni kemijskog spajanja,
b) što su i kako nastaju ioni,
c) zašto i kako otopine soli provode električnu struju,
d) elektroliza.
13. MOLEKULE
Čestice koje se sastoje od dva, tri do više stotina tisuća međusobno čvrsto povezanih atoma nazivaju se molekule. Razlikujemo dvije skupine molekula, one koje su izgrađene od istovrsnih atoma i one sastavljene od atoma različitih kemijskih elemenata.
13.1. Molekule kemijskih elemenata
Od svih kemijskih elemenata molekule čine samo nemetali. Uzmimo kao primjer klor - zagušljiv i otrovan plin. Ime je dobio prema grčkoj riječi chloros, što znači žutozelen. Molekule klora sastoje se od dva međusobno vezana atoma klora. Broj atoma klora u molekuli označit ćemo tako da iza simbola klora stavimo indeks 2, pa je formula molekule klora Cl2 (čitaj: ce-el-dva).
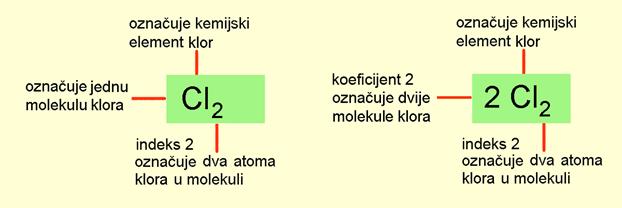
Kemijske formule imaju dvojako značenje. Primjerice, formula Cl2 (čitaj: ce-el-dva) označuje molekulu klora, ali i klor kao čistu tvar.
Fosfor je dobio ime po tome što svjetluca na zraku (grč. fotos – svjetlo + foros – nosač). Simbol P za fosfor prvo je slovo njegova latiniziranog imena – Phosphorus. Molekula bijeloga fosfora sastoji se od četiri međusobno vezana atoma fosfora. Zato je formula molekule bijelog fosfora P4 (čitaj: pe-četiri).
Molekula sumpora sastoji se osam međusobno vezanih atoma sumpora. Zato je formula molekule sumpora S8 (čitaj: es-osam).
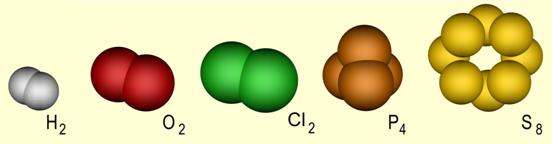
Slika 13.1. Modeli molekula nekih kemijskih elemenata
13.2. Molekule kemijskih spojeva
Kad se pomiješaju klor i vodik njihova smjesa može neograničeno dugo stajati u mraku. Ako se smjesa osvijetli Sunčevom svjetlošću, dolazi do snažne eksplozije pri čemu nastaje klorovodik.
H2 + Cl2 → 2 HCl
Molekule klorovodika sastoje od jednog atoma klora i jednog atoma vodika. Prema tome, pripadna molekulska formula klorovodika jest HCl (čitaj: ha-ce-el).
Vodik i kisik se međusobno se spajaju u volumnom omjeru 2 : 1 pri čemu nastaje samo voda.
2 H2 + O2 → 2 H2O
Molekule vode sastoje se od dva atoma vodika i jednog atoma kisika. Pripadna molekulska formula vode jest H2O (čitaj: ha-dva-o).
U molekuli amonijaka tri su atoma vodika vezana na jedan atom dušika. Zato je pripadna molekulska formula amonijaka NH3 (čitaj: en-ha-tri).
U molekuli metana četiri su atoma vodika vezana na jedan atom ugljika pa je molekulska formula metana CH4 (čitaj: ce-ha-četiri).
Spomenimo još ugljikov dioksid u kojemu su na jedan atom ugljika vezana dva atoma kisika. Zato je molekulska formula ugljikova dioksida CO2. Predmetak di- kaže da su dva atoma kisika vezana na atom ugljika, Slično, iz imena ugljikov monoksid (grč. monos – sam, jedan) vidi se da je samo jedan atom kisika vezan na atom ugljika, pa je formula ugljikova monoksida CO.

Već smo kazali da broj ispred simbola elementa označuje broj atoma tog elementa i da se naziva koeficijent. Na primjer, koeficijent 2 ispred simbola H, odnosno 2 H, označuje dva atoma vodika, 3 H označuje tri atoma vodika, itd. Na jednak način označavamo brojnost molekula kemijskih spojeva. Na primjer, formula CO2 označuje jednu molekulu ugljikova dioksida, 2 CO2 dvije molekule ugljikova dioksida, 3 CO2 tri molekule ugljikova dioksida itd.
Slika 13.2. Modeli molekula nekih kemijskih spojeva
13.3. Formule i nazivi molekula
Tablica 13.1. Tvorba naziva nekih oksida nemetala
|
Formula oksida |
Čitaj |
Broj atoma nemetala |
Broj atoma kisika |
Naziv spoja |
|
CO |
ce-o |
1 |
1 |
ugljikov monoksid |
|
CO2 |
ce-o-dva |
1 |
2 |
ugljikov dioksid |
|
SO2 |
es-o-dva |
1 |
2 |
sumporov dioksid |
|
SO3 |
es-o-tri |
1 |
3 |
sumporov trioksid |
|
N2O |
en-dva-o |
2 |
1 |
didušikov monoksid |
|
N2O3 |
en-dva-o-tri |
2 |
3 |
didušikov trioksid |
|
N2O5 |
en-dva-o-pet |
2 |
5 |
didušikov pentoksid |
Unatoč tomu što se kemijskim spojevima sistematska imena pridjeljuju na temelju njihova kemijskog sastava, mnogi su spojevi zadržali uobičajene ili trivijalne nazive koji su i danas u uporabi. Neke od njih već smo upoznali, primjerice voda, octena kiselina, solna kiselina, limunska kiselina, amonijak, metan, kuhinjska sol, soda bikarbona, šećer itd.
Ponovimo
Molekulska formula kazuje broj i vrstu atoma koji grade jednu molekulu.
Broj istovrsnih atoma u nazivu molekule označuje se brojčanim prefiksima: mono-, di-, tri-, tetra-, penta-, heksa-, hepta-, okta- itd., a pišu se ispred imena elementa. Prefiksi su uzeti iz grčkog, a znače jedan, dva, tri, četiri itd.
Izradite plakat o jednoj od tema:
a) zakoni kemijskog spajanja,
b) molekule.
14. VALENCIJA
Valencija (lat. valere – vrijediti) jest sposobnost atoma pojedinog elementa da se spaja s određenim brojem atoma vodika ili atoma nekog drugog jednovalentnog elementa.
14.1 Valencija atoma u molekulama
Tablica 14.1. Valencija atoma u molekulama
|
Klor se veže samo s jednim atomom vodika. Vodik je jednovalentan pa je i klor u klorovodiku jednovalentan. |
HCl |
|
|
U vodi su dva atoma vodika vezana na atom kisika. Kako je vodik jednovalentan, kisik je dvovalentan jer se veže s dva atoma vodika. |
H2O |
|
|
U amonijaku dušik se veže s tri atoma vodika. Kako je vodik jednovalentan proizlazi da je dušik trovalentan. |
NH3 |
|
|
U metanu ugljik je četverovalentan jer je povezan s četiri atoma vodika. |
CH4 |
|
|
U sumporovu trioksidu sumpor je šesterovalentan jer je povezan s tri atoma kisika koji su dvovalentni. Valencija sumpora jednaka je zbroju valencija kisika. |
SO3 |
|
I I I II III I IV I I II IV II VI II III II V II II II IV II
H Cl, H2 O, N H3, C H4, H2 S, S O2, S O3, N2 O3, N2 O5, C O, C O2
Za prikazivanje građe molekula nastalih međusobnim spajanjem atoma nemetala često se rabe formule s valentnim crticama.
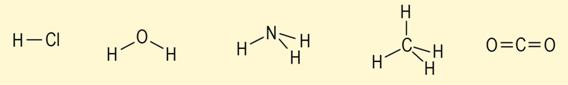
Upamtite
Valencija nekog atoma jednaka je broju atoma vodika s kojima je vezan u spoju.
14.2. Empirijska i molekulska formula
Valencije klora, kisika, sumpora, dušika i ugljika, dobivene su na temelju broja atoma vodika s kojima se vežu ti atomi. Tako određene valencije mogu se upotrijebiti za određivanje valencije atoma drugih elemenata. Primjerice, za kisik smo kazali da je dvovalentan. Prema tome, valencije drugih atoma u molekuli mogu se odrediti na osnovi broja vezanih atoma kisika.
U spojevima s kisikom fosfor može biti trovalentan i peterovalentan. Da bismo ispravno odredili formulu fosforova oksida, u kojemu je fosfor trovalentan, treba naći zajednički višekratnik valencija fosfora i kisika, odnosno brojeva 3 i 2, a to je 6. Ako zajednički višekratnik, 6, podijelimo valencijom fosfora, 3, dobivamo da je broj fosforovih atoma u tom oksidu jednak dva jer je 6 : 3 = 2. Na isti način dobivamo da je broj atoma kisika u spoju 3 jer je 6 : 2 = 3. Prema tome, formula prvog fosforovog oksida je P2O3.
U drugom fosforovom oksidu, koji nastaje gorenjem fosfora uz dovoljan dostup zraka, fosfor je peterovalentan. Znamo da je kisik dvovalentan. Zajednički višekratnik brojeva 5 i 2 jest 10. Ako zajednički višekratnik podijelimo valencijom fosfora dobivamo da je broj fosforovih atoma u spoju 2 jer je 10 : 5 = 2. Ako zajednički višekratnik podijelimo valencijom kisika, dobivamo da je broj atoma kisika u spoju 5 jer je 10 : 5 = 2. pa je formula drugog fosforova oksida P2O5.
Formule P2O3 i P2O5 jesu empirijske formule koje pokazuju najmanji mogući omjer broja atoma fosfora i kisika u ovim oksidima.
Istraživanja su pokazala da su prave molekulske formule fosforovih oksida P4O6 i P4O10. Do tog zaključka nismo mogli doći na temelju valencija elemenata u spoju. Prave ili molekulske formule spojeva određuju se različitim instrumentalnim metodama, ali to nije predmet razmatranja u ovom udžbeniku.
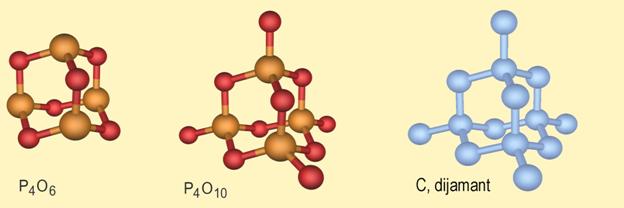
Slika 14.2. Modeli molekula fosforovih oksida i prikaz međusobnog povezivanja atoma ugljika u dijamantu
Upamtite
Empirijska formula pokazuju najmanji mogući omjer broja atoma elemenata u spoju.
Molekulska formula pokazuje broj i vrstu atoma koji grade jednu molekulu.
Neke su tvari izgrađene od „gigantskih molekula“, poput grafita, dijamanta, kvarca, rubina, safira i dr. Takve tvari uvijek opisujemo empirijskim formulama ili formulskom jedinkom koja pokazuju najmanji mogući omjer broja atoma kemijskih elemenata u spoju. Tako znak C označuje kemijski element ugljik, ali i dijamant i grafit. Formula SiO2 označuje silicijev dioksid ili kvarc te kazuje da u silicijevu dioksidu na svaki atom silicija dolaze dva atoma kisika. Iz formule aluminijeva oksida, Al2O3, možemo zaključiti da su u tom spoju aluminij i kisik međusobno vezani u omjeru 2 : 3 itd. Aluminijev oksid u prirodi se javlja kao mineral korund. Ako je crven, naziva se rubin, a safiri su bezbojni, plavi, ružičasti, žuti ili zeleni u različitim nijansama boje.
14.3. Valencije atoma u ionskim spojevima
Valencija atoma elementa u ionskom spoju jednaka je broju elektrona koje je dotični atom otpustio ili primio.
Kad se spajaju elementi prve skupine s elementima 17. skupine, atomi prve skupine otpuštaju jedan elektron i postaju ioni jediničnog pozitivnog naboja, a atomi 17. skupine primaju taj elektron i postaju ioni jediničnog negativnog naboja. Prema tome, u ionskim spojevima atomi elemenata prve i 17. skupine su jednovalentni. Atomi elemenata druge skupine, i cink, otpuštaju dva elektrona pa su dvovalentni. Atomi elemenata treće skupine, i aluminij, otpuštaju tri elektrona pa su trovalentni. Atomi elemenata 17. skupine u ionskim spojevima primaju jedan elektron pa su jednovalentni. Atomi elemenata 16. skupine u ionskim spojevima primaju dva elektrona pa su dvovalentni. (Za lakše razumijevanje upotrijebite periodni sustav elemenata.)
14.4. Valencija i nazivi spojeva
Nazivi spojeva izvode se na temelju njihova kemijskog sastava. Primjerice, sve spojeve metala i nemetala s kisikom zovemo oksidima. Spojeve metala i nemetala sa sumporom zovemo sulfidima. Spojeve metala i nemetala s fluorom zovemo fluoridima, s klorom kloridima, s bromom bromidima itd.
Pri imenovanju spojeva u kojima atom nekog elemenata može imati različite valencije obvezno treba naznačiti valenciju tog elementa. Na primjer, bakar čini dva oksida i dva sulfida čiji se sastav može opisati formulama Cu2O, Cu2S, CuO i CuS. U prva dva spoja bakar je jednovalentan pa će njihovi nazivi biti bakrov(I) oksid i bakrov(I) sulfid. U druga dva spoja bakar je dvovalentan pa ćemo ih nazvati bakrov(II) oksid i bakrov(II) sulfid. Kao što ovi primjeri pokazuju, valencija se piše rimskim brojem u zagradi odmah iza posvojnog pridjeva elementa.
Tablica 14.1. Nazivi nekih oksida i sulfida
|
Formula spoja |
Valencija metala |
Valencija nemetala |
Naziv spoja |
Čitanje naziva spoja |
|
Cu2O |
I |
II |
bakrov(I) oksid |
bakrov-jedan-oksid |
|
CuO |
II |
II |
bakrov(II) oksid |
bakrov-dva-oksid |
|
Cu2S |
I |
II |
bakrov(I) sulfid |
bakrov-jedan-sulfid |
|
CuS |
II |
II |
bakrov(II) sulfid |
bakrov-dva-sulfid |
|
PbO |
II |
II |
olovov(II) oksid |
olovov-dva-oksid |
|
PbO2 |
IV |
II |
olovov(IV) oksid |
olovov-četiri-oksid |
|
FeO |
II |
II |
željezov(II) oksid |
željezov-dva-oksid |
|
Fe2O3 |
III |
II |
željezov(III) oksid |
željezov-tri-oksid |
Ponovimo
Valencija atoma elementa u ionskom spoju jednaka je broju elektrona koje je dotični atom otpustio ili primio.
U ionskim spojevima elementi prve skupine uvijek su jednovalentni jer otpuštaju jedan elektron.
U ionskim spojevima elementi druge skupine uvijek su dvovalentni jer otpuštaju dva elektrona. Osim elemenata druge skupine uvijek su dvovalentni još cink i kadmij. Bakar i živa u spojevima mogu biti jednovalentni i dvovalentni, a željezo dvovalentno i trovalentno.
U ionskim spojevima aluminij je uvijek trovalentan jer otpušta tri elektrona.
U ionskim spojevima elementi 17. skupine primaju jedan elektron pa su jednovalentni.
U ionskim spojevima kisik je uvijek dvovalentan jer prima dva elektrona.
Pri imenovanju spojeva elemenata koji imaju samo jednu valenciju, nikad se ne navodi valencija tog elementa. Primjerice natrijev oksid, Na2O, magnezijev oksid, MgO, aluminijev oksid, Al2O3, natrijev fluorid, NaF, kalcijev fluorid, CaF2, cinkov oksid, ZnO, cinkov klorid, ZnCl2 itd.
15. RELATIVNA MOLEKULSKA MASA
Molekule, kao i atomi, vrlo su male čestice. No neke molekule, nastale povezivanjem nekoliko stotina tisuća atoma, mogu biti tako velike da se vide pod elektronskim mikroskopom. Mase molekula iskazuju se relativnim molekulskim masama, jednako kao i mase atoma.
Relativna molekulska masa, Mr, jest broj koji kaže koliko je puta prosječna masa molekulâ ili formulskih jedinki nekoga kemijskog spoja veća od atomske jedinice mase dalton.
Relativne molekulske mase lako je izračunati. Treba samo zbrojiti relativne atomske mase atoma koji čine jednu molekulu ili formulsku jedinku spoja. Primjerice, molekula vodika sastoji se od dva atoma vodika pa je njezina relativna molekulska masa dva puta veća od relativne atomske mase vodika. To se piše ovako:
Mr(H2) = 2 × Ar(H) = 2 × 1,008 = 2,016
Po istom načelu za relativnu molekulsku masu vode, H2O, dobije se:
Mr(H2O)
= 2 Ar(H)
+ Ar(O)
= 2 × 1,008 + 16,00
= 18,02
Na jednak način izračuna se relativna molekulska masa amonijaka, NH3:
Mr(NH3)
= Ar(N)
+ 3 Ar(H)
= 14,01 + 3 × 1,008
= 17,03
Po istom načelu za relativnu molekulsku masu naftalena, C10H8, dobije se:
Mr(C10H8)
= 10 Ar(C) + 8 Ar(H)
= 10 × 12,01 + 8 × 1,008
= 128,2
Kod ionskih spojeva kao što su natrijev klorid, silicijev dioksid, aluminijev oksid, željezov(II) oksid, željezov(III) oksid i dr. nema izoliranih molekula. Njihova se relativna molekulska masa računa se na temelju najjednostavnije formulske jedinke spoja. Formulska jedinka pokazuje omjer broja atoma u spoju izražen najmanjim mogućim brojevima.
Primjerice, relativna molekulska masa natrijeva klorida dobije se tako da se zbroje relativne atomske mase natrija i klora.
Mr(NaCl) = Ar(Na) + Ar(Cl)= 22,99 + 35,45
= 58,44
Za relativnu molekulsku masu bakrova(II) sulfata, CuSO4, dobivamo:
Mr(CuSO4) = Ar(Cu) + Ar(S) + 4 Ar(O)= 63,55 + 32,06 + 4 × 16,00
= 159,6
Za relativnu molekulsku masu bakrova(II) sulfata pentahidrata, CuSO4∙5H2O, dobivamo:
Mr(CuSO4∙5H2O)
= Mr(CuSO4)
+ 5 Mr(H2O)
=
159,6 + 5 × 18,02
=
249,7
Formulsku jedinku može se definirati po volji i onda izračunati njezinu relativnu molekulsku masu. Pritom treba jasno naznačiti o kojoj se formulskoj jedinki radi. Za formulsku jedinku može se uzeti, na primjer 3 H2O, pa će pripadna relativna molekulska masa tako definirane formulske jedinke 3 H2O biti:
Mr(3
H2O) = 3 [2 Ar(H)
+ Ar(O)]
= 3 [2 × 1,008 + 16,00]
= 54,05
Po istom načelu za relativna molekulska masa formulske jedinke ⅓ Al(OH)3 dobivamo:
Mr(⅓
Al(OH)3)
= ⅓ [Ar(Al) + 3 Ar(O)
+ 3 Ar(H)]
= ⅓ [27,00 + 3×16,00 + 3×1,008]
= 26,08
Ponovimo
Relativna molekulska masa spoja jednaka je zbroju relativnih atomskih masa svih atoma koji čine molekulu ili formulsku jedinku spoja.
Formulska jedinka pokazuje omjer broja atoma u spoju izražen najmanjim mogućim brojevima.
Formulsku jedinku može se definirati po volji i onda izračunati njezinu relativnu molekulsku masu. Pritom treba jasno naznačiti o kojoj se formulskoj jedinki radi.
16. KEMIJSKE REAKCIJE I ENERGIJA
Za bacanje diska, koplja ili kamena s ramena potrebno je utrošiti energiju. Potrebnu energiju čovjek proizvodi kemijskim reakcijama u svom organizmu pri čemu „izgara“ šećer i druge hranjive tvari. Pritom se kemijska energija, pohranjena u energijom bogatim spojevima, pretvara u druge oblike energije, rad mišića, kinetičku i potencijalnu energiju kamena i konačno u toplinu.
Pri svakoj kemijskoj i fizikalnoj promjeni uvijek dolazi do razmjene energije između promatranog sustava i okoline. Pod sustavom kemičar uvijek razumije reakcijsku posudu, epruvetu, čašu ili tikvicu s reaktantima. Okolina može biti zrak ili čaša s vodom u koju je uronjena epruveta s reaktantima. Razmjena energije najčešće se očituje oslobađanjem ili vezanjem topline.
16.1. Egzotermne promjene
Kemijska ili fizikalna promjena pri kojoj se toplina oslobađa zove se egzotermna promjena (grč. egzo - van + thermos - topao). Najpoznatije su egzotermne promjene gorenje drveta, ugljena, zemnog plina i dr. Pri egzotermnim promjenama, osim topline, energija se može oslobađati u obliku svijetlosti, električne energije ili rada.

Slika 16.1. Gorenjem magnezija na zraku oslobađa se toplina i obilje svjetlosti. 2 Mg + O2 → 2 MgO Da bismo zaštitili oči od prejake svjetlosti, moramo upotrijebiti tamne zaštitne naočale ili goruću magnzijevu vrpcu brzo umetnuti u smeđu bocu. Sve do 1980. g. proizvodile su se žaruljice s finim magnezijevim strugotinama u kisiku koje su služile kao bljeskalice za fotografiju.
Većina kemijskih reakcija, koje smo već upoznali tijekom izvođenja pokusa, događa se uz oslobađnje topline. Primjerice, pri zagrijavanju bakra sa sumporom smotuljak bakrene žice se užari jer bakar i sumpor međusobno reagiraju uz oslobađanje topline. Gorenjem magnezija na zraku oslobađa se obilje topline i vrlo intenzivna svjetlost itd.
Toplina koja se tijekom kemijske reakcije razmjenjuje između promatranog sustava i okoline može se izmjeriti kalorimetrom. Jednostavan kalorimetar sastoji se od termometra i plastične čaše u koju je smještena i druga manja plastična čaša. Unutarnja čaša sadržava poznatu masu vode, dok vanjska čaša spriječava prijenos topline iz okoline u reakcijsku smjesu i obratno.
Pokus 23. Toplina neutralizacije
Kad se pomiješaju razrijeđene otopine natrijeva ili bilo kojeg hidroksida i bilo koje jake kiseline, kiselina i lužina međusobno se neutraliziraju. Pritom uvijek nastaju soli pripadne kiseline i voda. U reakciji neutralizacije sudjeluju samo ioni OH– i H+, dok kation i kiselinski ostatak tvore sol.
Na+ + OH− + H+ + Cl− → H2O + Na+ + Cl−
Pritom se oslobađa toplina pa se reakcijska smjesa ugrije. Na osnovi specifičnoga toplinskoga kapaciteta vode, izmjerene promjene temperature i poznate mase vode u kalorimetru lako je izračunati količinu oslobođene topline.
Pokus 24. Redukcija bakrovih iona cinkom
Kad se u otopinu modre galice doda cink u prahu i smjesa protrese otopina se obezboji. Umjesto sivoga praha cinka, kojeg smo dodali u epruvetu, dobili smo crvenosmeđi talog koji bojom podsjeća na bakar. Na temelju rezultata pokusa možemo zaključiti da se cink otopio, a umjesto njega izlučio bakar. Kaže se da su se bakrovi ioni, Cu2+, reducirali u elementarni bakar, a cink se oksidirao u cinkove ione, Zn2+. To se opisuje sljedećom jednadžbom reakcije:
Cu2+ + SO42− + Zn → Zn2+ + SO42− + Cu
Eksperiment pokazuje da je to egzotermna promjena jer se temperatura reakcijske smjese povisila.
Reakciju između bakrovih iona, Cu2+, i metalnog cinka može se izvesti tako da se umjesto topline dobije električna energija. U tu svrhu treba načiniti galvanski članak kao na slici 16.2.

Slika 16.2. Galvanski članak. Deblju bakrenu žicu i pocinčani željezni čavao zabijte u limun ili jabuku na međusobnoj udaljenosti 1 do 2 cm. Pazite da se bakrena žica i čavao ne dotiču. Bakrena žica je pozitivni pol, a pocinčani željezni čavao negativni pol galvanskog članka. Limunov sok je elektrolit.
U galvanskom članku, odnosno bateriji, načinjenoj od limuna s elektrodama od cinka i bakra događa ista kemijska reakcija kao i u prethodnom pokusu kad se cink u prahu doda u otopinu modre galice. No, reakcija se odvija drugim putem tako da se umjesto topline dobije električna energija. O tomu ćete učiti kasnije.
16.2. Endotermne promjene
Kemijska ili fizikalna promjena pri kojoj energija (toplina) prelazi iz okoline u reakcijski sustav zove se endotermna promjena (grč. endon - unutra + thermos - topao). Fotosinteza je najpoznatija endotermna kemijska promjena koja se događa u prirodi. Odvija se u zelenim dijelovima biljaka koje nizom vrlo složenih kemijskih reakcija pomoću energije Sunčeve svjetlosti pretvaraju ugljikov dioksid i vodu u celulozu, škrob i druge spojeve. Fotosintezom se energija jednog oblika, tj. energija Sunčeve svjetlosti, pretvara u drugi oblik energije. Ta je energija sada pohranjena u glukozi, celulozi, škrobu i drugim sastojcima biljaka, kao kemijska energija.
Pokus
25.
Reakcija limunske
kiseline i
kristalne sode
Ponovimo
Izradite plakat o temi „energija“.
17. BRZINA KEMIJSKE REAKCIJE
17.1. Utjecaj veličine površine na brzinu kemijske reakcije
17.2. Utjecaj koncentracije reaktanata na brzinu kemijske reakcije
Kemijska se reakcija može dogoditi samo ako se čestice reaktanata sudare. Što je koncentracija reaktanata u otopini veća, veća je i vjerojatnost da će se njihove čestice međusobno sudariti. Možemo pretpostaviti da veći broj sudara čestica reaktanata u jedinici vremena dovodi do više produkata kemijske reakcije. Da bismo potvrdili ovu pretpostavku, načinit ćemo pokus s otopinama različite koncentracije natrijeva tiosulfata. Kad se u otopinu natrijeva tiosulfata doda jaka kiselina, tiosulfatni ioni se raspadaju na sumporov dioksid i sumpor od kojega se otopina zamuti.
Na2S2O3
+ 2
HCl → 2 NaCl + H2O + SO2
+ S
Pokus
26.
Kako
koncentracija
reaktanata utječe na brzinu kemijske reakcije
17.3. Utjecaj temperature na brzinu kemijske reakcije
Kinetička energija čestica reaktanata raste porastom temperature. Veća kinetička energija znači veću brzinu gibanja čestica. Zato se u jedinici vremena sudari više čestica reaktanata pa zbog toga istodobno nastaje više čestica produkata. Prema tome, možemo pretpostaviti da će se u otopini natrijeva tiosulfata jednake koncentracije pri višoj temperaturi ista količina sumpora izlučiti u kraćem vremenu. To bi značilo da brzina kemijskih reakcija raste povišenjem temperature. Vrijedi li ova pretpostavka, istražit ćemo pokusom.
Pokus
27.
Utjecaj
temperature
na
brzinu kemijske reakcije
Za većinu kemijskih reakcija vrijedi pravilo da se povišenjem temperature za 10 ºC brzina reakcije poveća približno dva puta.
17.4. Utjecaj katalizatora na brzinu kemijske reakcije
Neke tvari ubrzavaju a neke usporavaju kemijske reakcije. Tvari koje ubrzavaju kemijske reakcije nazivaju se katalizatorima, a one koje ih usporavaju inhibitorima. Mnogi konzervirani prehrambeni proizvodi sadržavaju tzv. konzervanse, primjerice natrijev benzoat, koji spriječava razvoj bakterija i tako produljuje rok uporabe konzerviranog proizvoda. Svježi prehrambeni proizvodi, posebno uvozno voće i povrće, redovito se tretira tzv. stabilizatorima, točnije tvarima koje spriječavaju truljenje i na policama trgovačkih lanaca održavaju svjež izgled namirnica. Konzervansi i stabilizatori djeluju kao inhibitori procese koji dovode do kvarenja hrane.
Pokus
28.
Katalitički raspad
vodikova
peroksida
Manganov dioksid nije jedini katalizator koji ubrzava raspad vodikova peroksida. Razrijeđena otopina vodikova peroksida odmah će se zapjeniti ako u nju ubacite komadić svježe pileće jetre, pekarskog kvasca ili svježega krumpira. Isto će se dogoditi ako pljunete u otopinu vodikova peroksida. Jetra, slina, krv i sve naše stanice, kao i pekarski kvasac i krumpir, sadržavaju enzim katalazu koji razlaže vodikov peroksid na vodu i kisik. Samo jedna molekula katalaze može sekundi razložiti milijune molekula vodikova peroksida na vodu i kisik.
Pokus
29.
Enzimi su
katalizatori
kemijskih reakcija
Naše tijelo je prepuno različitih katalizatora koji ubrzavaju različite kemijske reakcije koje nam omogućuju kretanje, mišljenje i život uopće. Sve žive stanice sadržavaju više tisuća različitih katalizatora koji se zajedničkim imenom nazivaju enzimi. Svaki enzim katalizira samo jednu ili više sličnih kemijskih reakcija.
18. SLIČNOST SVOJSTAVA ELEMENATA
Slika 18.1.
Dmitrij Ivanovič Mendeljejev
je 1869. godine poredao
kemijske elemente u niz po rastućim relativnim atomskim masama. Kad bi
u nizu
elemenata došao do elementa sličnih kemijskih svojstava s nekim
prethodnim elementom,
započeo je novi redak stavljajući kemijski slične elemente jedne ispod
drugih.
Tako je dobio tablicu, PERIODNI SUSTAV ELEMENATA, koja je sadržavala
horizontalne redove ili periode
i
vertikalne stupce ili skupine.
Tim su se
načinom u istoj skupini našli elementi sličnih kemijskih svojstava.
Slika 18.2. Suvremena tablica periodnog sustava elemenata
Periodni sustav elemenata dragocjeno je pomagalo svakom kemičaru jer iz njega može pročitati mnogo podataka i razumjeti kemijska svojstva mnogih elemenata. Tako su svi elementi na lijevoj strani periodnog sustava metali, a na desnoj nemetali. U sredini između metala i nemetala nalazi se nekoliko elemenata koje je teško svrstati jer su im fizikalna i kemijska svojstva na prijelazu između svojstava metala i nemetala. Ti se elementi obično nazivaju polumetalima.
Pojedine skupine elemenata imaju i zasebne nazive. Tako se svi elementi 1. skupine zovu alkalijski metali. To su Li, Na, K, Rb, Cs i Fr, a naziv su dobili po tome što tvore jake lužine (alkalije, arap. al + kali = pepeo). Elementi 2. skupine, Mg, Ca, Sr, Ba i Ra, zovu se zemnoalkalijski metali, jer su to metali koji ulaze u sastav zemlje, odnosno minerala i stijena, a čine također jake lužine (alkalije). Elementi između 3. i 12. skupine zovu se prijelazni metali. Elementi 16. skupine zovu se halkogeni elementi, jer čine rude bakra i cinka (grč. chalkos = slitina bakra i cinka + genesis = rod). Halogenim elementima (grč. hals = sol + genesis = rod) nazivaju se elementi 17. skupine: F, Cl, Br, I, jer oni sa svim metalima čine soli. Osamnaestu skupinu čine tzv. inertni ili plemeniti plinovi. Bitno je upamtiti da elementi iste skupine imaju slična kemijska svojstva.
YouTube Video: The Periodic Table - Part 1
YouTube Video: The Periodic Table Part 2 - Patterns in the Table
Izradite plakat o temi „periodni sustav elemenata“.
19. NEMETALI
Osim vodika, koji je na lijevoj strani, na desnoj strani periodnog sustava elemenata nalazi se još 16 elemenata koje nazivamo nemetalima. Većina ih je pri sobnoj temperaturi u plinovitu stanju. Brom je tekućina, a ugljik, fosfor, sumpor, jod i astat krutine. Svi su nemetali izolatori, tj. ne provode električnu struju. Iznimku čini ugljik koji je u obliku dijamanta savršen izolator, dok druga alotropska modifikacija ugljika – grafit, provodi električnu struju. U ovom ćemo poglavlju podrobnije upoznati svojstva klora i sumpora.
19.1. Halogeni elementi
Elementi 17. skupine, odnosno halogeni elementi su fluor, klor, brom i jod. Halogeni elementi imaju slična kemijska svojstva. Svi su jako reaktivni pa ih nema slobodnih u prirodi već samo u spojevima. Otrovni su. Burno se spajaju s metalima, nemetalima, ali i međusobno. Reaktivnot halogenih elemenata u grupi raste odozdo prema gore, tj. od joda do fluora. Fluor je najreaktivniji od svih nematala. Iz vode istiskuje kisik, a spaja se čak i s plemenitim plinom ksenonom.
Klor je jedan od sastojaka varikine koja se može naći gotovo u svakom kućanstvu. Kad se otvori boca s varikinom, osjeća se kloru svojstven miris. Otopina varikine djeluje slično kloru, pa se u kućanstvu rabi kao dezinfekcijsko sredstvo i sredstvo za uklanjanje mrlja s tkanina. Treba upamtiti da klor i varikina razaraju tekstilna vlakna. Zato za izbjeljivanje tkanina treba rabiti razrijeđenu otopinu varikine. Tkanine ne treba predugo držati u otopini varikine kako bi se sačuvala čvrstoća tekstilnih vlakana.
YouTube Video: Reactions of chlorine

Slika 19.2. a) Užarena željezna vuna gori u kloru, pri čemu nastaje crvenosmeđi željezov(III) klorid. Klor je dobiven djelovanjem koncentrirane klorovodične kiseline na kruti kalijev permanganat. b) Rastaljeni natrij spaja se s klorom uz pojavu intenzivne žute svjetlosti i oslobađanje topline.

19.3. a) Vodik mirno izgara u kloru pri čemu nastaje klorovodik. Kor je dobiven djelovanjem koncentrirane klorovodične kiseline na varikinu. b) Kemijski vodoskok (fontana). Klorovodik željno upija vodu pa voda iz čaše ulazi u okruglu tikvicu kroz usku cijev tvoreći vodoskok. Voda u čaši obojena je lakmusom. Otopina klorovodika u vodi naziva se klorovodična ili solna kiselina. U kiselim otopinama lakmus pokazuje crvenu boju.
Klorovodik, HCl, je bezbojan i zagušljiv plin koji se industrijski dobiva gorenjem vodika u kloru. U laboratoriju klorovodik se dobiva djelovanjem koncentrirane sumporne kiseline na suhi natrijev klorid.
NaCl + H2SO4 → HCl + NaHSO4
Klorovodik razara sluzokožu organa za disanje. Dobro je topljiv u vodi. Vodena otopina pri sobnoj temperaturi može sadržavati 36 % klorovodika, a takva se otopina naziva koncentrirana klorovodična kiselina.
Kad se okrugla tikvica s okruglim dnom napunjena klorovodikom odčepi ispod vode, odmah se ispuni vodom. Za ovaj pokus obvezno se mora upotrijebiti okrugla tikvica s okruglim dnom. Zbog apsorpcije klorovodika vodom u tikvici se snizi tlak tako da atmosferski tlak može zdrobiti tikvicu (implozija). Klorovodik je jako topljiv u vodi. Litra vode pri 0 °C može otopiti 500 L klorovodika. Otopina klorovodika u vodi pokazuje svojstva jake kiseline. U trgovinama kućanskih potrepština prodaje se kao 19 i 9-postotna solna kiselina.
Otopina fluorovodika, HF, u vodi naziva se fluorovodična kiselina. Otapa staklo pa se može čuvati samo u plastičnim (polietenskim) bocama.
YouTube Video: the HCl fountain experiment
Ponovimo
19.2. Sumpor
Sumpor je u elementarnom stanju poznat od davnine. Ima ga u blizini nekih vulkana. Danas se dobiva kao sporedni produkt pri pročišćavanju zemnog plina i nafte. Sumpor je žuta kristalasta tvar. Javlja se u dva kristalna oblika. Rompski sumpor je stabilan do 96 °C, a iznad te temperature pa do tališta, 115 °C, stabilan je monoklinski sumpor. Kristali rompskoga i monoklinskog sumpora izgrađeni su od jednakih S8 molekula, ali složenih na različite načine.
Slika 19.4. Model molekule sumpora, S8
Pokus 30. Rompski i monoklinski sumpor
Pokus
31.
Plastični sumpor
Pri zagrijavanju sumpora iznad temperature tališta događa se niz zanimljivih pojava. U početku, talina je svijetložuta i male viskoznosti. Sastoji se od S8 molekula. Daljnjim zagrijavanjem talina poprima crvenosmeđu boju. Pritom se dio S8 prstenova kida pa se dobiju kratki lanci koji se odmah međusobno spajaju u vrlo dugačke lance. Dugački se lanci isprepleću pa viskoznost taline toliko poraste da se epruveta može okrenuti otvorom prema dolje, a da sumpor ne isteče.
19.3. Sumporov dioksid
Sumporov dioksid je dobro topljiv u vodi. Vodena otopina djeluje kiselo, jer nastaje sumporasta kiselina, H2SO3. Nepoznata je u čistu obliku. Njezine soli nazivaju se sulfiti.
Pokus
32.
Ispitivanje
svojstava
sumporova dioksida
YouTube Video: Sulphur Miners of Kawah Ijen
YouTube Video: Ijen Volcano - The Largest Lake of Acid on Earth - Java, Indonesia
19.4. Sumporna kiselina
Pokus
33.
Kako
koncentrirana sumporna
kiselina djeluje na tvari organskog podrijetla
Slika 19.9. Djelovanje koncentrirane sumporne kiseline na tvari organskog podrijetla
Upamtite
YouTube Video: Manufacture Of Sulphuric Acid By Contact Process
YouTube Video: Sulphuric Acid - The Contact Process
19.5. Kisele kiše
Tijekom gorenja svijeće i sumpora pod staklenim zvonom (pokus 3.) pojavljuje se nešto kao magla. Zamagljenje je uzrokovano međusobnom reakcijom vodene pare nastale gorenjem svijeće i sumporova dioksida nastala gorenjem sumpora. Slično opaženoj pojavi nastaje smog (engl. smoke – dim + fog – magla) u industrijskim središtima zbog spaljivanja ugljena koji sadržava sumpor. Pod utjecajem ultraljubičastih zraka i čestica prašine, koja djeluju kao katalizator, sumporov dioksid se oksidira u sumporov trioksid. Nastali sumporov trioksid reagira s vlagom iz zraka pa tako nastaje sumporna kiselina, H2SO4, raspršena u zraku poput rijetke magle. Sumporna i sumporasta kiselina te dušikovi oksidi koji nastaju u automobilskim motorima, zajedno uzrokuju kisele kiše koje su i 1000 puta kiselije od obične kiše. Kisele kiše djeluju na vegetaciju, ali i na sve mramorne građevine i spomenike. Vapnenac, CaCO3, se otapa u vodi kiselih kiša.
CaCO3 + H2SO4 → CaSO4 + H2O + CO2
Ponovimo
Izradite
plakat o jednoj od tema:
20. METALI
20.1. Alkalijski metali
Natrij i svi alkalijski metali burno reagiraju s vodom. Pritom nastaju hidroksidi alkalijskih metala. Njihove vodene otopine jake su lužine koje nagrizaju kožu i čine je skliskom. Zato se pri radu s natrijevim hidroksidom uvijek moraju rabiti zaštitne naočale i zaštitne rukavice. Kalij, rubidij i cezij, mnogo burnije reagiraju s vodom nego natrij. Tako cezij s vodom reagira uz eksploziju.
YouTube Video: Alkali metals in water, accurate!
YouTube Video: Reaction (Explosion) of Alkali Metals with Water


Slika 20.2. Natrij burno reagira s vodom prema jednadžbi: 2 Na + 2 H2O → 2 NaOH + H2. Pritom se oslobađa mnogo topline tako da se natrij rastali. Kuglica rastaljena natrija kreće se u cik-cak putanjama po površini vode. Zbog visoke temperature, nastali vodik ponekad se zapali. Ako se u vodu doda malo fenolftaleina, pojavljuje se crvenoljubičasta boja svojstvena lužnatim otopinama. Natrij reagira i s etanolom (običnim alkoholom) ali ne tako burno. Zato se otpaci natrija u laboratoriju uništavaju tako da se preliju etanolom.

Slika 20.3. Spojevi alkalijskih i zemnoalkalijskih metala boje plamen karakterističnim bojama, pa je to najjednostavniji način dokazivanja prisustva tih kemijskih elemenata u ispitivanim uzorcima. Na slici su od lijeva na desno prikazane karakteristične boje plamena dobivene raspršivanjem u sitne kapljice otopina litijevih, natrijevih i kalijevih soli. Litijeve soli boje plamen karmincrveno, natrijeve žuto, a kalijeve ljubičasto. Uočite mjesto na kojem treba užarenom željeznom žicom dotaknuti otopinu kako bi struja zraka povukla raspršene kapljice u plamenik.
Pokus 34. Bojenje plamena solima zemnoalklijskih metala
Ponovimo
20.2. Zemnoalkalijski metali
Kalcij u prirodi dolazi samo u spojevima, najčešće kao kalcijev karbonat, CaCO3, odnosno kao vapnenac i mramor. Vapnenac je sedimentna stijena nastala taloženjem kućica i skeleta izumrlih morskih životinja. Mramor je zrnatokristalasti vapnenac nastao preobrazbom (metamorfozom) vapnenca u uvjetima visokog tlaka i povišene temperature.
Kalcijevi ioni, Ca2+, bitan su sastojak svih kostiju, zuba, bilja, školjaka morskih organizama itd. Kalcijevi ioni imaju važnu ulogu u kontrakciji mišića, prijenosu živčanih impulsa i dr. Magnezij i kalcij zajedno dolaze u dolomitu, Mg,Ca(CO3)2.
Pokus
35.
Kako magnezij i
kalcij reagiraju s vodom
Magnezij
vrlo polagano reagira s
hladnom, ali znatno brže s
vrućom vodom.
Kalcij burno reagira već i s hladnom vodom.
Pokus
36.
Što nastaje
žarenjem kalcijeva karbonata
Žarenjem
mramora ili vapnenca,
odnosno kalcijeva karbonata,
dobije se kalcijev oksid, CaO, kojeg često nazivaju živo
vapno.
Živo vapno „gasi ” se vodom pa se dobije gašeno vapno. Pritom se razvija toplina.
Kalcijev hidroksid slabo je topljiv u vodi, a dobivena bistra otopina, vapnena voda, jaka je lužina. Kao i sve lužine, vapnena voda s fenolftaleinom daje crvenoljubičasto obojenje. Bistra vapnena voda se zamuti kad se u nju puše zrak iz pluća jer nastaje netopljiv kalcijev karbonat (vidi prethodnu jednadžbu).
20.3. Kako nastaju špiljski ukrasi
CaCO3 + H2O + 2 CO2 → Ca(HCO3)2
Slika 20.6. Špilja Vrelo nedaleko Fužina
Ca(HCO3)2 → CaCO3 + H2O + 2 CO2
Ponovimo
20.4. Željezo
Slika 20.7 Shematski prikaz visoke peći
Željezo se još uvijek u nekim zemljama dobiva tako da se smjesa rude, najčešće hematita, Fe2O3, ili magnetite, Fe3O4, koksa i dodataka, kao što su vapnenac, CaCO3, i kvarcni pijesak, SiO2, zagrijava u visokoj peći pri temperaturi oko 1900 °C. Pritom se događa čitav niz različitih kemijskih reakcija. Kad se zbroje sve reakcije koje se događaju u visokoj peći, može se napisati:
Pri temperaturi od 1600 °C željezo je u tekućem stanju. Povremeno se ispušta iz visoke peći i odmah, još dok je tekuće, zatim se pročišćava radi smanjenja sadržaja ugljika. Željezo od kojeg se izrađuju lijevani predmeti sadržava oko 4 % ugljika. Strojevi, brodovi, željezničke tračnice, pa i obični čavli izrađuju se od slitina željeza i ugljika kojeg sadržavaju između 0,16 i 1,7 %. Takve slitine nazivaju se čelik. Od čelika se izrađuju alati za obradu drva, metala plastike i dr. Kad se izradi alat željena oblika, užari ga se i kali naglim uranjanjem u hladnu vodu ili ulje. Kaljenjem čelika s 0,6 – 0,9 % ugljika dobiju se vrlo tvrdi alati pogodni za obradu drugih mekših materijala.
Suvremenim postupkom željezo se proizvodi u rotacionim pećima, a željezovi oksidi reduciraju zemnim plinom (metanom). Pri povišenoj temperaturi i uz katalizator zemni plin se najprije djelomično oksidira.
2 CH4 + O2 → 2 CO + 4 H2
Tom smjesom plinova u rotacionim pećima pri povišenoj temperaturi željezovi oksidi se reduciraju.
Fe2O3 + CO + 2 H2 → 2 Fe + CO2 + 2 H2O
Pritom se dobije spužvasto željezo koje se zatim tali i dalje pročišćava istim postupcima kao i željezo iz visokih peći.
Pokus
37.
Usporedba
svojstava
ukosnice i željeznog čavla
Željezo je jeftin materijal dobrih mehaničkih svojstava. Problem je njegova sklonost hrđanju na vlažnome zraku. Pritom se na njegovoj površini stvara željezov(II) hidroksid, Fe(OH)2, koji postupno s kisikom iz zraka oksidira i prelazi u crvenosmeđu hrđu promjenjiva kemijskog sastava. Hrđa se uglavnom sastoji od hidratiziranog željezova(III) oksida, Fe2O3·nH2O.
Ponovimo
YouTube Video: Iron Production Process
Izradite plakat o jednoj od tema:
a) alkalijski i zemnoalkalijski metali,
b) kako nastaju špiljski ukrasi,
c) željezo.
21. KISELINE, BAZE I SOLI
Kiseline su tvari koje u vodenoj otopini imaju kiseo okus i lakmus boje crveno. Neku tvar zvat ćemo bazom ako njezina vodena otopina ima opor okus i boju lakmusa mijenja u modro. Kiseline, baze i soli Michael Faraday je 1834. svrstao u elektrolite. Justus von Liebig pretpostavio je 1838. da su kiseline spojevi koje sadržavaju vodik kojeg je moguće zamijeniti metalom. Vodene otopine baza obično se nazivaju lužinama.
21.1. Elektrolitička disocijacija
Pokus
38.
Provode li
otopine kiselina i
lužina električnu struju
Slika 21.1. Shematski prikaz disocijacije molekula vode.
Slika 21.2. Shematski prikaz disocijacije molekula klorovodika u vodenoj otopini
Slaba kiselina, kao što je octena kiselina, CH3COOH, slabo disocira na ione.
CH3COOH + H2O D H3O+ + CH3COO–
Jake lužine, kao što je natrijev hidroksid, NaOH, u vodenoj otopini potpuno disociraju na ione.
Zato vodene otopine jakih lužina dobro provode električnu struju.
Slabe lužine, kao što je otopina amonijaka u vodi, slabo disociraju na ione.
YouTube Video: How Water Dissolves Salt
Upamtite
Električnu struju u metalnim vodičima provode elektroni.
U vodenim otopinama i talinama soli električnu struju provode ioni.
Otopine ili taline koje provode električnu struju nazivaju se elektroliti.
Elektrolitička disocijacija jest „rastavljanje“ spojeva s ionskom ili polarnom kovalentnom vezom na ione djelovanjem polarnih molekula vode.
Destilirana voda vrlo slabo provodi električnu struju jer je slabo disocirana na ione:
H2O + H2O D H3O+ + OH–Destilirana voda je neutralna jer sadržava jednak broj iona H3O+ i OH–.
Kisele su otopine u kojima je koncentracija iona H3O+ veća od koncentracije iona OH–.
Lužnate su otopine u kojima je koncentracija iona H3O+ manja od koncentracije iona OH–.
Jake kiseline i jake lužine u vodenoj otopini potpuno disociraju na ione i zato njihove otopine dobro provode električnu struju.
Slabe kiseline i slabe lužine u vodenoj otopini slabo disociraju na ione i zato njihove otopine slabo provode električnu struju.
21.2. Indikatori kiselina i lužina
Kiselost ili lužnatost otopina iskazuje se pH-skalom (čitaj pe-ha) od 1 do 14. Neutralna je ona otopina koja ima pH = 7. U takvoj su otopini koncentracije iona H3O+ i OH– jednake.
Slika 21.5. Boja otopine soka crvenog kupusa ovisi o pH otopine
21.3. Soli
Dobivanje soli neutralizacijom kiselina i baza
Kad se u odgovarajućem omjeru pomiješaju vodene otopine kiseline i lužine, ioni H3O+ i OH− međusobno reagiraju tako da nastane voda. Primjerice, klorovodična kiselina i natrijev hidroksid reagiraju prema jednadžbi:
H3O+ + Cl− + Na+ + OH− → Na+ + Cl− + H2O
otopina klorovodične otopina natrijeva otopinakiseline hidroksida natrijeva klorida
Reakcije kiselina s lužinama nazivaju se reakcijama neutralizacije. Vidimo da pri neutralizaciji klorovodične kiseline natrijevim hidroksidom međusobno reagiraju samo ioni H3O+ i OH− pri čemu nastaje voda i otopina natrijeva klorida koja ima pH = 7.
Pokus 39. Mogu li kiselina i lužina istodobno biti u istoj epruveti
Soli mogu nastati i međusobnom neutralizacijom plinova, primjerice klorovodika i amonijaka. Pritom nastaje bijeli dim od amonijeva klorida.
NH3(g) + HCl(g) → NH4Cl(s)
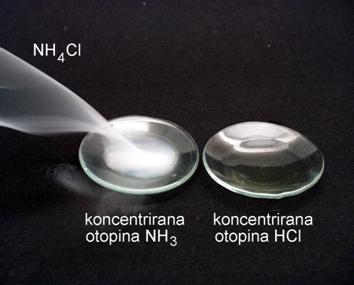
Slika 21.6. Kad se satna stakalca s koncentriranim otopinama klorovodika (klorovodične kiseline) i amonijaka približe, nastaje bijeli dim od amonijeva kloridaPri sobnoj temperaturi amonijev klorid je krutina izgrađena od amonijevih iona, NH4+, i kloridnih iona, Cl−. Zagrijavanjem se raspada na amonijak i klorovodik. Pri nižoj temperaturi amonijak i klorovodik opet međusobno reagiraju pa nastaje kruti amonijev klorid. Zbog takvih se svojstava amonijev klorid može sublimacijom odvojiti od natrijeva klorida.
Dobivanje soli neposrednom reakcijom metala s nemetalima
Dobivanje soli neposrednom reakcijom metala s nemetalima već smo upoznali u sedmom razredu. Užarena željezna vuna u posudi s klorom gori pri čemu nastaje željezov(III) klorid, FeCl3. Rastaljeni natrij spaja se s klorom u natrijev klorid, NaCl, uz pojavu intenzivne žute svjetlosti. Kad se smjesa cinka i joda u prahu dotakne užarenom željeznom žicom nastaje cinkov jodid, ZnI2, uz pojavu svjetlosti i ljubičastih para. (Ljubičaste pare potječu od joda koji pri povišenoj temperaturi isparava.).
2 Fe + 3 Cl2 → 2 FeCl3
2 Na + Cl2 → 2 NaCl
Zn + I2 → ZnI2
YouTube Video: Aluminum & Iodine
YouTube Video: HCl+NH3=NH4Cl - Ammonium chloride smoke under 100,000,000x
Dobivanje soli otapanjem metala u kiselinama
Magnezij, cink, željezo i mnogi drugi metali otapaju su u jakim kiselinama. To možemo prikazati sljedećim jednadžbama reakcija:
Zn + 2 HCl → ZnCl2 + H2
Zn + H2SO4 → ZnSO4 + H2
Fe + H2SO4 → FeSO4 + H2
Otapanjem metala u klorovodičnoj kiselini dobju se vodik i soli klorovodične kiseline, magnezijev klorid, MgCl2, cinkov klorid, ZnCl2, željezov(II) klorid, FeCl2 itd. Općenito, sve se soli klorovodične kiseline nazivaju kloridi, fluorovodične kiseline fluoridi, bromovodične kiseline bromidi, a jodovodične jodidi. Otapanjem metala u sumpornoj kiselini dobiju se vodik i soli sumporne kiseline, magnezijev sulfat, MgSO4, cinkov sulfat, ZnSO4, i željezov(II) sulfat, FeSO4. Soli sumporne kiseline nazivaju se sulfati, dušične kiseline nitrati, octene kiseline acetati, limunske kiseline citrati itd.
Dobivanje soli otapanjem oksida metala u kiselinama
Oksidi većine metala lako se otapaju u kiselinama. Pritom nastaju soli pripadnih metala i voda. Primjerice, bakar je netopljiv u klorovodičnoj i sumpornoj kiselini, ali se bakrov(II) klorid i sulfat mogu dobiti otapanjem bakrova(II) oksida u pripadnim kiselinama.
CuO + 2 HCl → CuCl2 + H2O
CuO + H2SO4 → CuSO4 + H2O
Bakrove soli i njihove vodene otopine su plave (modre). Ako se otopina bakrova(II) sulfata ostavi da polagano isparava, iz nje će se iskristalizirati modri kristali koje još od srednjega vijeka nazivaju modra galica. U kristalima modre galice na svaku formulsku jedinku CuSO4 dolazi 5 molekula vode, pa se formula modre galice piše kao CuSO4·5H2O.
Soli prijelaznih metala dobivene kristalizacijom iz vodenih otopina najčešće sadržavaju kristalizacijsku vodu. Primjerice, zagrijavanjem modre galice kristalizacijska voda može ispariti, a dobiveni bezvodni bakrov(II) sulfat, CuSO4, bijele je ili svijetloplave boje. Kad se na bezvodni bakrov(II) sulfat doda nekoliko kapi vode, on se u toj vodi otapa, a iz zasićene vodene otopine odmah kristalizira modra galica, CuSO4·5H2O.
21.4. Kako se dobiva kuhinjska sol
Za ljudsku prehranu sol se mora jodirati s 20 do 30 mg kalijeva jodida, KI, ili kalijeva jodata, KJO3, na kilogram soli. Nedostatak joda u hrani uzrokuje gušavost i zaostajanje u umnom razvoju. Gušavost je posljedica povećanja štitnjače (tiroidne žlijezde). Štitna žlijezda luči tri hormona: tiroksin, tironin i kalcitonin. Molekula tiroksina sadržava četiri, a molekula tironina tri atoma joda. Ako u hrani nedostaje joda, štitnjača se poveća kako bi iz hrane i vode iscrpila i najmanje tragove joda.
Ponovimo
Dobivanje soli
lužina + kiselina → sol + voda
metal + nemetal → sol
metal + kiselina → sol + vodik
matalni oksid + kiselina → sol + voda
Upamtite
Kiselost i lužnatost otopina iskazuje se pH-skalom od 1 do 14.
Neutralne otopine imaju pH = 7.
YouTube Video: How to grow beautiful crystals of salt - do your chemical experiment!
Izradite plakat o jednoj od tema:
a) elektrolitička disocijacija.
b) soli,
c) kuhinjska sol u industrijski prerađenim namirnicama.
22. MASENI UDIO ELEMENATA U SPOJU
m(sastojak)w(sastojak, smjesa) = ——————
m(smjesa)
Izračunajte maseni udio natrija u natrijevu kloridu.
Ar(Na) 22,99w(Na, NaCl) = ————— = ———— = 0,3934 ili 39,34 %
Mr(NaCl) 58,44
Izračunajte maseni udio magnezija u magnezijevu karbonatu.
Ar(Mg) 24,31w(Mg, MgCO3) = ————— = ———— = 0,2883 ili 28,83 %
Mr(MgCO3) 84,32
Izračunajte maseni udio vode u modroj galici.
Mr(5H2O) 90,08w(H2O, CuSO4·5H2O) = ———————— = ———— = 0,3608 ili 36,08 %
Mr(CuSO4·5H2O) 249,69 m(CuSO4∙5H2O) 1 kg
w(CuSO4∙5H2O) = —————————————------————— = ——————----—— = 0,00985.
m(H2O) + m(CuSO4∙5H2O) + m(Ca(OH)2) (100 + 1 + 0,5) kg
Upamtite
Izradite plakat o jednoj od tema:
a) maseni udio sastojaka u smjesi,
b) maseni udio soli u prehrambenim proizvodima.
23. UGLJIK I NJEGOVI SPOJEVI
Ugljik se u prirodi javlja u elementarnom stanju kao dijamant i grafit. Najveće količine elementarnog ugljika u prirodi sadržavaju različite vrste ugljena. No najveći dio ugljika u prirodi vezan je u spojeve kao što su ugljikov dioksid, kalcijev i magnezijev karbonat i nafta. Osim toga, sav je živi biljni i životinjski svijet izgrađen od spojeva ugljika.
23.1. Dijamant i grafit
Slika 23.1. Modeli kristalnih struktura dijamanta (a) i grafita (b)
Slika 23.2. Obod ploče za rezanje kamena, stakla ili betona sadržava male krhotine dijamanata. Radi spriječavanja prejakog zagrijavanja, a time i izgaranja dijamanta, tijekom rezanja kamena ili stakla rezne ploče hlade se vodom.
YouTube Video: Diamond growing process
23.2. Ugljikovi oksidi
Ugljikov monoksid je bezbojan otrovan plin. U zimskim mjesecima događaju se trovanja ugljikovim monoksidom kad dimni plinovi ulaze u prostoriju zbog začepljenih ili neispravnih dimnjaka. Prvi znak trovanja ugljikovim monoksidom je glavobolja. Ugljikova monoksida ima u ispušnim plinovima automobila. Zato se motori automobila ne smiju paliti u zatvorenim garažama.
Slika 23.3. Znakovi trovanja ugljikovim monoksidom
Ugljikov monoksid zapaljen gori pri čemu nastaje ugljikov dioksid, CO2.
Pokus
40.
Dokazivanje
ugljikova dioksida
u gaziranim napicima
23.3. Ugljična kiselina
Kiselkast okus gaziranih mineralnih voda potječe upravo od ugljične kiseline. Soli ugljične kiseline zovu se karbonati. Ugljična kiselina je vrlo slaba kiselina, slabija od octene i limunske kiseline. Zato su svi karbonati topljivi u octenoj i limunskoj kiselini. Mnogi lijekovi danas se prodaju u obliku šumećih tableta. Takva tableta osim lijeka sadržava kalcijev karbonat, šećer ili neko umjetno sladilo i limunsku kiselinu. Kad se tableta stavi u vodu,l limunska kiselina reagira s kalcijevim karbonatom. Pritom nastaju mjehurići ugljikova dioksida i čuje se karakterističan šum. Zato je nastao naziv šumeće tablete.
Ponovimo
Izradite plakat o jednoj od tema:
a) ugljikov monoksid i njegova svojstva,
b) ugljikov dioksid i njegova svojstva.
24. KRUŽENJE UGLJIKA U PRIRODI
U oko 4,6 milijardi godina, koliko Zemlja postoji, njezina atmosfera i klima prošle su kroz mnoge promjene. Pretpostavlja se da se prvotna atmosfera sastojala od vodene pare, vodika, metana, amonijaka i ugljikova dioksida, ali bez kisika. Prema kemijskim analizama i geološkim podacima procjenjuje se da su se prije oko dvije milijarde godina pojavile prve primitivne biljke koje su imale sposobnost fotosinteze. One su energiju Sunčeve svjetlosti iskorištavale da iz vode i ugljikova dioksida sintetiziraju mnogo složenije spojeve, kao što je glukoza, uz istodobno oslobađanje kisika. To se može prikazati pojednostavnjenom jednadžbom:
6 CO2 + 6 H2O → C6H12O6 + 6 O2
Nastalu glukozu biljka iskorištava za sintezu tvari potrebnih za preživljavanje te za sintezu škroba i celuloze.Škrob je glavni sastojak zrnja žitarica i krumpira, a od celuloze izgrađene su stijenke stanica i deblo drveta. Glukoza i škrob su rezervoari kemijske energije. Njih koristi biljka sama, ili pak životinje koje se hrane biljem. U stanicama se pritom događa drugi niz kemijskih reakcija pri kojima glukoza postupno, korak po korak, „izgara” u ugljikov dioksid i vodu uz oslobađanje energije.
C6H12O6 + 6 O2 → 6 H2O + 6 CO2
Taj proces zovemo stanično disanje. Fotosinteza i stanično disanje imaju suprotan učinak, ali zajedno održavaju kružni tok ugljika u prirodi. U prijelazu ugljikova dioksida iz atmosfere u biosferu značajnu ulogu ima hidrosfera (oceani) i litosfera (kruti dio Zemljine kore). U morskoj vodi otopljeno je 60 puta više ugljikova dioksida nego što ga ima u atmosferi. Ugljikov dioksid u atmosferi i morskoj vodi neprestano zamjenjuju svoja mjesta. Potrebno je oko 2 godine da ugljikov dioksid iz površinskog dijela oceana prijeđe u atmosferu i obratno. Dio ugljikova dioksida otopljena u oceanima taloži se u obliku kalcijeva karbonata.
24.1. Ugljikov dioksid i globalno zatopljenje
Pokus 41. Utječe li ugljikov dioksid na globalno zatopljenje
Slika 24.2. Aparatura za demonstraciju „globalnog zatopljenja
U ovom pokusu žarulja predstavlja „sunce“, pločica na dnu boce „zemljinu površinu“ a plin u boci „zemljinu atmosferu“. Temperatura tog sustava ovisi o količini topline koju prima od žarulje i količini topline koju gubi zračenjem u okolinu. Nakon 20 do 30 minuta uspostavi se ravnotežno stanje. Kad se zrak u boci zamijeni ugljikovim dioksidom, dolazi do povišenja temperature sustava. Na temelju rezultata pokusa možemo zaključiti da povećanje koncentracije ugljikova dioksida u Zemljinoj atmosferi može dovesti do globalnog zatopljenja.
https://bs.wikipedia.org/wiki/Globalno_zatopljenje
https://hr.wikipedia.org/wiki/Globalno_zatopljenje
http://www.periodni.com/enig/klimatske_promjene
Izradite plakat o jednoj od tema:
a) ugljik i njegovi sojevi,
b) kruženje ugljika u prirodi,
c) globalno zatopljenje.
25. FOSILNA GORIVA I PETROKEMIJA
Kuhanje hrane, grijanje prostorija u kojima čovjek radi ili boravi, prijevoz od mjesta stanovanja do mjesta rada i još mnogo toga ne može se zamisliti bez energije. Energija se ne može dobiti ni iz čega. Danas se još uvijek najveći dio potrebne energije dobiva spaljivanjem fosilnih goriva, ugljena, nafte i metana.
25.1. Ugljen
Ugljen je nastajao iz bilja tijekom milijuna godina. Prije oko 300 milijuna godina, u blizini mora bile su rasprostranjene močvare. Podneblje je bilo blago, a raslinje u močvarama gusto. U crnom mulju rasle su goleme biljke, umirale i rušile se u crni mulj. Milijunima godina tako su se gomilali mrtvi ostaci bilja u području koje je polako tonulo. S vremenom se tlo opet počelo uzdizati. Milijunima godina rijeke i vjetar nanosili su pijesak i glinu na stare močvare. Snažne sile koje boraju zemlju stlačile su biljne ostatke nataložene u močvarama. U uvjetima bez kisika, pri povišenoj temperaturi i golemom tlaku, organske tvari su se raspadale uz izdvajanje hlapljivih produkata, ugljikova dioksida, metana i vode. Tako su se ostaci divovskih šuma pretvorili u ugljen. Različite vrste ugljena razlikujemo po geološkoj starosti. Najmlađi je lignit, koji ima drvenastu strukturu. Smeđi ugljen je nastao prije otprilike 50 milijuna godina iz nižeg močvarnog bilja. Kameni ugljen je nastao prije 250 do 300 milijuna godina. Antracit je vrsta ugljena koja sadržava 92 do 98 % ugljika. Gori kratkim, plavičastim plamenom bez dima. Antracit čini oko 1% globalnih rezervi ugljena, i nalazi se samo u nekoliko zemalja svijeta.
Od ugljena se može proizvesti mnogo bolje i čišće gorivo konverzijom u tzv. sintezni plin. Preko užarenog ugljena prevodi se smjesa pregrijane vodene pare i zraka. Pojednostavnjeno, dolazi do sljedeće kemijske reakcije.
Suhom destilacijom kamenog ugljena, pri temperaturi oko 1000 °C i bez pristupa zraka, dobivaju se plinoviti produkti koji sadržavaju vodik, metan i ugljikov monoksid. Tekući produkt je smjesa različitih ugljikovodika i drugih organskih spojeva s kisikom i sumporom, tzv. katran kamenog ugljena. Služi kao izvor mnogih vrijednih organskih spojeva. Kruti ostatak nakon destilacije jest koks koji se rabi u metalurgiji.
Pokus
42.
Kako izvesti suhu
destilaciju
drveta
Drveni ugljen dobije se suhom destilacijom drveta. Zapaljen gori bez pojave svjetlećeg plamena jer ne sadržava smolaste tvari.
25.2. Nafta
Nafta je dugo nastajala, od samih početaka biljnog i životinjskog svijeta, prije otprilike 600 milijuna godina, pa sve donedavno. Stotinama milijuna godina rađali su se i ugibali nebrojeni morski organizmi, pa i oni vidljivi tek elektronskim mikroskopom. Uginuvši, oni su se taložili na dno starih oceana. U sredini siromašnoj kisikom bjelančevine i druge organske tvari raspadale su se djelovanjem anaerobnih bakterija. Otpornije, masne i voštane tvari, gomilale su se u obliku gnjila mulja. Taj osnovni materijal poslije je prekriven glinenim slojem koji ne propušta ni ulje ni plin. Pod pritiskom novih slojeva i pri nešto povišenoj temperaturi iz tog su materijala nastali nafta i zemni plin. Da je nafta organskog podrijetla dokazuju mnogi komplicirani organski spojevi koji mogu nastati samo u živom organizmu. Slana voda, koja prati naftu, i njezin sastav također dokazuju njezino morsko podrijetlo.
Sirova nafta je tekuća smjesa nekoliko desetaka tisuća različitih kemijskih spojeva. Nakon odvajanja krutih čestica i vode, sirova nafta se vodi u postrojenje za frakcijsku destilaciju. Nafta, ugrijana na oko 350 do 400 °C, uvodi se u visoku kolonu s nizom horizontalnih rupičastih pregrada, tzv. tavana. Frakcije nižeg vrelišta penju se u obliku pare prema vrhu kolone, a one višeg vrelišta kondenziraju se i teku prema dnu kolone. S vrha kolone odvode se plinovi čije je vrelište niže od 20 °C. To je uglavnom smjesa ugljikovodika male relativne molekulske mase, metana, etana, propana i butana. Najvažniji produkt koji se dobiva iz nafte jest benzin, jer služi kao pogonsko gorivo. To je frakcija s vrelištem od 70 do 150 °C. No, običnom frakcijskom destilacijom iz nafte dobiva se relativno malo benzina.
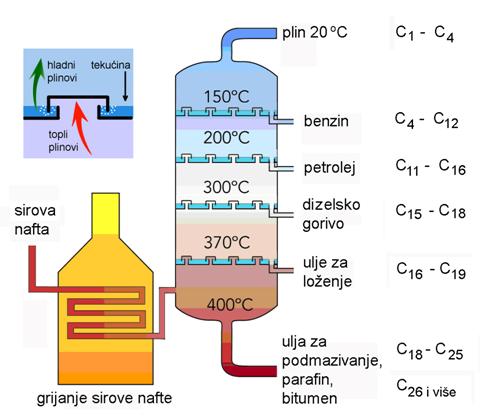
Slika 25.2. Shematski prikaz kolone za frakcijsku destilaciju nafte
Kako bi se dobilo više benzina, frakcije višeg vrelišta podvrgavaju se postupku poznatom pod nazivom katalitičko krekiranje (engl. cracking – razbijanje, cijepanje). Uz pogodan katalizator, neke prirodne i sintetičke gline, pri temperaturi od 400 do 500 °C, uz neznatno povišeni tlak, molekule ugljikovodika s većim brojem C-atoma cijepaju se na više molekula s manjim brojem C-atoma.
CH3-CH2-CH2-CH2-CH3 → CH3-CH2-CH3 + CH2=CH2pentan propan eten
Općenito, pri krekiranju iz zasićenih ugljikovodika nastaju nezasićeni ugljikovodici, vodik i tzv. petrolkoks. Za petrolkoks je karakteristično da sadržava malo pepela pa se rabi za proizvodnju umjetnoga grafita potrebnog industriji, ali i za olovke.
Pokus 43. Što nastaje katalitičkim krekiranjem parafinskog ulja
25.3. Plinovita goriva
Uz nedovoljan dotok zraka metan izgara čađavim plamenom. Pritom nastaje ugljikov monoksid, CO, koji je jak krvni otrov. Česti su slučajevi trovanja ugljikovim monoksidom kad su, zbog neredovitog održavanja, dimovodne instalacije začepljene.
Pri preradbi nafte u rafinerijama nastaju velike količine propana i butana. Smjesa tih plinova već pri malom tlaku prelazi u tekućinu te se kao ukapljeni plin rabi u kućanstvima za pripremu hrane. Boca s ukapljenim plinom na štednjak se priključuje putem redukcijskog ventila i gumenog crijeva načinjena od posebne vrste gume. Ukapljeni plin razara običnu gumu pa može doći do nekontroliranog istjecanja plina. Redukcijskim ventilom veći tlak plina u boci smanji se na manji tlak kakav je potreban na priključku štednjaka. Matica redukcijskog ventila ima lijevi navoj. To znači da se ventil priključuje okretanjem matice u smjeru suprotnom od kretanja kazaljke sata. Na ventil obvezno dolazi brtva koju treba zamijeniti svaki put kad se zamjenjuje boca. Nikad se ne smiju stavljati dvije brtve jedna na drugu. Ispravnost brtvljenja spojeva provjerava se otopinom sapunice, a ne šibicom. Novine često izvještavaju o „eksplozijama boca s ukapljenim plinom“. No, nijedna boca još nije eksplodirala. Eksplodiraju smjese plina i zraka nastale nekontroliranim istjecanjem plina zbog nepažnje, neispravnih instalacija ili neispravnih priključaka na štednjake i druga trošila plina.
Pogledajte na Internetu galeriju slika: Eksplozija plina.
25.4. Petrokemija
Izradite plakat o jednoj od tema:
b) alternativni izvori energije.
26. ORGANSKI SPOJEVI UGLJIKA
Sastav tvari organskog podrijetla prvi je odredio Lavoisier od godine 1781. do 1787. vaganjem proizvoda gorenja alkohola, šećera i octene kiseline. Dokazao je da tvari organskog podrijetla uvijek sadržavaju ugljik i vodik, a često i kisik. Također je dokazao da tvari životinjskog podrijetla često sadržavaju i dušik. Tom je analizom spojeva iz žive prirode Lavoisier postavio temelje organske kemije kao kemije ugljikovih spojeva.
Ugljik je po svojim svojstvima jedinstven u prirodi. Nijedan kemijski element u prirodi nema ta svojstva koja ima ugljik. To što ugljik čini tako važnim jest svojstvo njegovih atoma da se mogu međusobno vezati na bezbroj načina. Ugljik čini najveći broj različitih spojeva s vodikom, kisikom, dušikom i sumporom, a to su elementi koji izgrađuju sve biološki važne molekule.
Jedini poznati organski spojevi do početka 19. stoljeća bili su oni izdvojeni iz biljnog ili životinjskog organizma kao sastojci ili proizvodi biljke ili životinje. Zbog njihova podrijetla zvali su ih organskim spojevima. Dugo se je vjerovalo da je za nastanak organskih spojeva u biljci ili životinji potrebna posebna „životna sila” (lat. vis vitalis). Mislilo se da se organski spojevi neće moći sintetizirati u laboratoriju. Prijelomna je 1828. godina kada je njemački kemičar Friedrich Wöhler sintetizirao mokraćevinu, odnosno ureu, tvar životinjskog podrijetla i time dokazao da za sintezu organskih spojeva nije potrebna posebna životna sila. Wöhlerovim otkrićem oduševio se Justus von Liebig i ustvrdio da ono znači prekretnicu u organskoj kemiji, najavu sinteze organskih tvari kao skoru budućnost organske kemije. Uskoro je uslijedila i sinteza drugih organskih spojeva, kao što je sinteza octene kiseline iz elemenata, vodika, kisika i ugljika.

Slika 26.1. a) Friedrich Wöhler (1800. – 1882.), b) Justus von Liebig (1803. – 1873.).
26.1. Svojstva organskih spojeva
Tablica 26.1. Usporedba karakterističnih svojstava anorganskih i organskih spojeva
|
Anorganski spojevi |
Organski spojevi |
|
Većina anorganskih spojeva ima visoko talište. |
Većina organskih spojeva ima nisko talište. |
|
Većina anorganskih spojeva dobro je topljiva u vodi. |
Većina organskih spojeva netopljiva je u vodi. |
|
Većina anorganskih spojeva netopljiva je u organskim otapalima. |
Većina organskih spojeva dobro je topljiva u organskim otapalima. |
|
Većina anorganskih spojeva ne gori. |
Većina organskih spojeva gori i lako je zapaljiva. |
|
Većina anorganskih spojeva izgrađena je od iona. |
Većina organskih spojeva izgrađena je od molekula. |
|
Većina anorganskih spojeva provodi struju u otopini ili talini. |
Većina organskih spojeva ne provodi struju u otopini ili talini. |
|
Anorganske spojeve čine svi poznati elementi. |
U sastav većine organskih spojeva ulaze C, H, N, O, S, P i halogeni elementi. Ostali elementi mnogo rjeđe ulaze u sastav organskih spojeva. |
26.2. Kvalitativna analiza sastava organskog spoja
Pokus 44. Sadržava li urea dušik
Pokus 45. Dokazivanje prisutnosti sumpora u tvarima organskog podrijetla
Pokus 46. Dokazivanje prisutnosti halogena u tvarima organskog podrijetla
Jednostavnu
metodu dokazivanja
prisutnosti halogena u
organskom spoju uveo je ruski kemičar Friedrich Beilstein,
profesor kemije u St. Peterburgu. Najprije treba užariti bakrenu žicu
pri čemu
na njezinoj površini nastaje sloj bakrova(II) oksida, CuO. Potom se
užarenu
bakrenu žicu uroni u organski spoj i unese u rub šuštećeg plamena
plinskog
plamenika. U početku plamen zasvijetli jer bakrov(II) oksid oksidira
organski
spoj. Ako spoj sadržava neki od halogenih elemenata, plamen postane
zelen jer
nastaje hlapljivi bakrov halogenid. To je dokaz da spoj sadržava
halogen.
Bakrovi spojevi boje plamen zeleno, pa se to njihovo svojstvo
iskorištava pri
izradi raketa za vatromete.
Nakon kvalitativne analize slijedi kvantitativna analiza, odnosno određivanje masenih udjela pojedinih elemenata u spoju. Na temelju rezultata kvantitativne analize lako je izračunati najjednostavniju ili empirijsku formulu spoja. Pravu ili molekulsku formulu spoja teže je odrediti. U tu se svrhu rabe neke fizikalne metode.
Izradite plakat o jednoj od tema:
a) svijeća i njezina svojstva,
b) kvalitativno dokazivanje prisustva C, S, N i halogena u tvarima organskog podrijetla.
27. UGLJIKOVODICI
|
ACIKLIČKI UGLJIKOVODICI |
CIKLIČKI UGLJIKOVODICI |
|||
|
zasićeni |
nezasićeni |
zasićeni |
nezasićeni |
aromatski |
|
alkani |
alkeni i alkini |
cikloalkani |
cikloalkeni |
areni |
|
|
|
|
|
|
27.1. Zasićeni ugljikovodici ili alkani
Ugljikovodici u kojima su ugljikovi atomi međusobno povezani samo jednostrukim vezama jesu zasićeni ugljikovodici, a nazivaju se zajedničkim imenom alkani. Najjednostavniji alkan je metan, CH4. U metanu je atom ugljika povezan s četiri atoma vodika.
Zasićeni ugljikovodici čine homologni niz u kojem svaki sljedeći ugljikovodik u nizu sadržava jednu skupinu CH2 više. Zato se sastav zasićenih ugljikovodika ili alkana može prikazati općom formulom, CnH2n+2, u kojoj je n broj ugljikovih atoma.
Metan, CH4, ili zemni plin nalazi se u gornjim dijelovima Zemljine kore u tzv. plinskim poljima. Primjerice, plinska polja u Sjevernom Jadranu nalaze se na dubini između 600 i 1300 m. Metan nastaje na odlagalištima otpada, ali i u barama gdje trunu organske tvari pa su ga nekad zvali močvarni plin. Javlja se i u rudnicima ugljena te je uzročnik većine rudarskih nesreća jer su smjese metana i zraka eksplozivne.
Etan, C2H6, rabi se kao sirovina za dobivanje plastičnih masa.
Propan, C3H8, i butan, C4H10, lako prelaze u tekuće stanje pa se transportiraju u čeličnim bocama kao ukapljeni plin te se u kućanstvima rabe za zagrijavanje.
Modeli molekula i formule alkana
Za prikazivanje građe molekula kemičari se služe modelima i formulama. Koji će se od uobičajenih načina prikazivanja građe molekula odabrati ovisi o tome što se modelom ili formulom želi istaknuti.
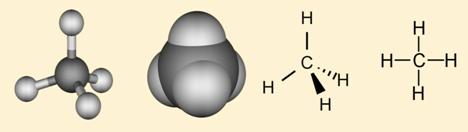
Slika 27.2. Različiti načini predočavanja građe molekula prikazani na primjeru metana: model sa štapićima i kuglicama, kalotni model, klinasta formula i strukturna formula s valentnim crticama
Model s „kuglicama i štapićima“ predočuje prostorni razmještaj atoma u molekuli.
Kalotni model predočuje pakovanje atoma u molekuli. Atomi u molekuli nisu vezani štapićima. Naprotiv, elektronski oblaci međusobno vezanih atoma prodiru jedan u drugoga (prekrivaju se).
Klinasta formula kao i model s „kuglicama i štapićima“ na drugi način predočuje prostorni razmještaj atoma u molekuli. Puni klin predočuje atom iznad, a crtkani ispod ravnine papira.
Strukturna formula s valentnim crticama predočuje kako su atomi u molekuli međusobno povezani. Takva je formula planarna i ne pokazuje prostorni razmještaj atoma u molekuli.
Sažeta strukturna formula na jednostavniji način predočuje redoslijed povezivanja ugljikovih atoma u molekuli.
Molekulska formula prikazuje broj i vrstu atoma u molekuli, ali ne daje podatke o tome kako su atomi međusobno povezani.
|
Ime ugljikovodika |
metan |
etan |
propan |
butan |
|
Model |
|
|
|
|
|
Strukturna formula s valentnim crticama |
|
|
|
|
|
Sažeta strukturna formula |
CH4 |
CH3–CH3 |
CH3–CH2–CH3 |
CH3–CH2–CH2–CH3 |
|
Molekulska formula |
CH4 |
C2H6 |
C3H8 |
C4H10 |
Slika 27.3. Modeli i različiti načini prikazivanja formula prva četiri člana homolognog niza alkana
Iz modela molekule metana, prikazanog na slici 27.2. vidi se da su atomi vodika oko ugljikova atoma razmješteni tako da budu što dalje jedan od drugoga. Može se zamisliti da su u molekuli metana vodikovi atomi smješteni na vrhovima tetraedra u čijem se središtu nalazi atom ugljika.
Ugljikovi atomi ne moraju se uvijek vezivati u ravne lance. Primjerice, strukturna formula butana može se napisati na dva, a pentana na tri načina, s ravnim i razgranatim lancem.
Molekula jednake molekulske formule, ali različitog redoslijeda vezivanja ugljikovih atoma, nazivaju se izomeri (grč. isos – jednak + meros – dio). Zbog različitog redoslijeda vezivanja ugljikovih atoma u molekuli izomeri imaju različita fizička svojstva, primjerice vrelište i krutište.
Strukturna formula heksana, C6H14, može se napisati na 5 načina. Što je broj ugljikovih atoma u molekuli veći, to je i veći broj različitih izomera. Tako ugljikovodik koji se naziva dekan, C10H22, jer ima 10 ugljikovih atoma, ima već 75 različitih izomera, a ugljikovodik s 20 ugljikovih atoma ima čak 366 379 izomera. To nam objašnjava zašto se nafta sastoji od tisuća različitih kemijskih spojeva.
|
Modeli molekula izomera pentana |
|
|
|
|
Sažete strukturne formule izomera pentana |
|
|
|
Slika 27.4. Modeli molekula i sažete strukturne formule izomera pentana
Ugljikovi atomi u zasićenim ugljikovodicima mogu se vezati u prstenove. Najmanji prsten može imati tri atoma. Takvi ugljikovodici dobivaju prefiks ciklo- (grč. kyklos – krug) te se općenito nazivaju cikloalkani. Cikloalkani čine homologni niz s općom formulom (CH2)n, a pripadna imena članova ovog niza su ciklopropan, ciklobutan, ciklopentan, cikloheksan itd.
|
Ime |
ciklopropan |
ciklobutan |
ciklopentan |
cikloheksan |
|
Model molekule |
|
|
|
|
|
Sažeta strukturna formula |
|
|
|
|
Slika 27.5. Modeli molekula i sažete strukturne formule ciklopropana, ciklobutana, ciklopentana i cikloheksana
Zasićeni ugljikovodici kemijski su vrlo postojani. Kalijev permanganat je jako oksidacijsko sredstvo, ali ne reagira sa zasićenim ugljikovodicima. Klor i brom reagiraju tek uz djelovanje jake svjetlosti. Zbog takvih svojstava zasićeni ugljikovodici nazivaju se parafini (grč. para - protiv + lat. affinitas - privlačnost). Kad se smjesa zasićenog ugljikovodika i klora izloži svjetlosti dolazi do kemijske reakcije u kojoj se jedan ili više atoma vodika zamijeni atomima klora.
CH4 + Cl2 " CH3Cl + HCl
CH3Cl + Cl2 " CH2Cl2 + HCl
CH2Cl2 + Cl2 " CHCl3 + HCl
CHCl3 + Cl2 " CCl4 + HCl
Svi atomi vodika reagiraju jednako pa se dobije smjesa više kloriranih ugljikovodika. Reakcije u kojima dolazi do zamjene jednog ili više atoma vodika atomima halogena nazivaju se reakcijama supstitucije (lat. supstituere - staviti mjesto koga).
27.2. Nezasićeni ugljikovodici
Ugljikovi atomi mogu se međusobno povezivati dvostrukim i trostrukim vezama. Oni koji sadržavaju dvostruke veze nazivaju se alkeni, a oni s trostrukim vezama alkini. Dragocjene su sirovine za sintezu mnogih organskih spojeva, primjerice plastičnih masa, boja i lijekova.
|
Ime |
eten |
propen |
etin |
propin |
|
Model
|
|
|
|
|
|
Sažeta strukturna formula |
CH2═CH2 |
CH2═CH─CH3 |
HC≡CH |
HC≡C─CH3 |
|
Molekulska formula |
C2H4 |
C3H6 |
C2H2 |
C3H4 |
Slika 27.6. Modeli molekula, formule i imena nekoliko nezasićenih ugljikovodika
|
Ime |
pent-1-en |
pent-2-en |
|
Model |
|
|
|
Sažeta strukturna formula |
1 2 3 4 5 CH2═CH–CH2–CH2–CH3 |
1 2 3 4 5 CH3─CH═CH─CH2–CH3 |
|
Molekulska formula |
C5H10 |
C5H10 |
etin eten
CH2=CH2 + H2 → CH3−CH3
eten etan
Takva vrsta kemijske reakcije naziva se reakcijom adicije (lat. additio – dodavanje). Naveliko se primjenjuje u industriji. Primjerice, adicijom vodika na dvostruke veze u molekulama biljnih ulja, uz nikal kao katalizator, dobivaju se krute ili polukrute masti kao što je margarin.
Etin, više poznat po zastarjelom naziv acetilen, najjednostavniji je nezasićeni ugljikovodik s trostrukom vezom. U laboratoriju se može dobiti reakcijom kalcijeva karbida s vodom.
CaC2 + 2 H2O → H−C≡C−H + Ca(OH)2
Etin je vrlo reaktivan. Uvođenjem etina u otopinu kalijeva permanganata, ili u bromnu vodu, nastaju zasićeni spojevi.
H−C≡C−H + 2 Br2 → CHBr2─CHBr2
Zapaljen na zraku etin gori čađavim svjetlećim plamenom. U posebnom plameniku s kisikom izgara u ugljikov dioksid i vodu.
2 C2H2 + 5 O2 → 4 CO2 + 2 H2O
Temperatura plamena doseže 3100 °C pa se taj plamen rabi za rezanje i spajanje (zavarivanje) čelika. Acetilen dolazi u bocama pod tlakom otopljen u acetonu.
Pokus 47. Dobivanje etina i ispitivanje njegovih svojstava
27.3. Aromatski ugljikovodici
Aromatski ugljikovodici ili areni su nezasićeni ciklički (prstenasti) spojevi. Izolirani su najprije iz mirisnog bilja pa se zato nazivaju aromatskima (grč. aroma – mirisna trava, mirodija). Po svojim kemijskim svojstvima bitno se razlikuju od lančastih i cikličkih alkena. Zato se smatraju posebnom skupinom ugljikovodika. Najjednostavniji aromatski ugljikovodik jest benzen. C6H6. Otkrio ga je engleski kemičar i fizičar Michael Faraday (1791. – 1867.).
Slika 27.10. Strukturne formule i model molekule naftalena.
Kad se žestoko promućkaju benzen i otopina kalijeva permanganata, boja vodenog sloja se ne mijenja. Uz kalijev permanganat benzen se ponaša kao zasićeni ugljikovodik. Takva svojstva benzena proizlaze iz posebne vrste veze kojom su ugljikovi atomi vezani u prsten. Benzen reagira s bromom tek uz pomoć željeznih strugotina kao katalizatora. Pritom ne nastaje zasićeni spoj već dolazi do reakcije supstitucije (zamjene) atoma vodika atomima broma.
Slika 27.12. Shematski prikaz reakcije bromiranja benzena, odnosno supstitucije atoma vodika bromom
Izradite plakat o jednoj od tema:
a) alkani, b) nezasićeni ugljikovodici,
c) aromatski ugljikovodici i njihova svojstva.
28. ALKOHOLI
Alkohol je otkriven u 12. stoljeću destilacijom vina. Naziv alkohol smislio je Paracelsus (1493.-1541.) upotrijebivši arapsku riječ al-kohl za vrlo fini prah neke tvari pa ga je zvao alcohol vini, kao najfiniji sastojak vina. Paracelsus je bio liječnik i kemičar, a zasluge za medicinu i kemiju priznate su mu tek nakon smrti.
28.1. Građa molekula alkohola
Svi alkoholi u svojoj strukturi sadržavaju hidroksilnu skupinu –OH. Ona određuje kemijska svojstva alkohola. Zato se naziva funkcijskom skupinom.
Metanol, CH3OH, je najjednostavniji alkohol. Slika 28.1. prikazuje građu molekule vode uspoređenu s građom molekule metanola. Kao da je jedan vodikov atom u molekuli vode zamijenjen skupinom –CH3. Ta se skupina naziva metilna skupina. Zato je stariji naziv tog alkohola metilni alkohol. Tako gledano, alkoholi su derivati vode (lat. derivare – odvesti), tj. odvode se od vode. I zaista, metanol ima neka svojstva slična vodi. S vodom se miješa u svakom omjeru. U njemu se dobro otapaju lužine, na primjer, NaOH.
Slika 28.1. Usporedba građe molekula vode i metanola
katalizator, 300 °C, 200 barCO + 2 H2 ────────────────> CH3OH
28.2. Etanol
Etanol, CH3CH2OH, ili običan kupovni alkohol je derivat etana. Općenito, kad se kaže alkohol, uvijek se misli na etanol. Najrašireniji način proizvodnje alkohola „u kućnoj radinosti” jest alkoholno vrenje ili fermentacija šećera iz voća uz pomoć kvasca.
Pokus
48.
Kako izvesti pokus
alkoholnog
vrenja
Alkoholno vrenje je proces kojim se šećer pretvara u etanol i ugljikov dioksid:
enzimC6H12O6 ───────> 2 CO2 + 2 C2H5OH
šećer etanol
Ključnu ulogu u procesu alkoholnog vrenja imaju enzimi, složeni organski spojevi koje izlučuju žive stanice. Naziv enzim znači u kvascu (grč. en – u + zyme – kvasac) jer su prvi poznati enzimi bili oni koje izlučuju stanice kvasca, pa su zato i dobili taj naziv. Enzime ponekad nazivaju fermentima, prema latinskom fermentum – kvasac. Kvasac je jednostanična gljivica koja energiju potrebnu za rast crpi iz šećera. Ako je stanici kvasca kisik dostupan u dovoljnim količinama, onda se šećer postupno razgrađuje na manje molekule, a konačan produkt je ugljikov dioksid i voda. Nedostaje li kvascu kisika, onda razgradnja šećera nije potpuna i teče samo do etanola. Kvasac se razmnaža sve dok se sav šećer ne utroši ili dok maseni udio etanola ne poraste na 15 %. Ta je koncentracija etanola otrovna za kvasac. Provrela kaša od voća naziva se kom. Destilacijom koma u našim se selima proizvodi rakija u kojoj je maseni udio alkohola oko 35 %. Pri spontanoj fermentaciji (alkoholnom vrenju) uzrokovanoj „divljim mikroorganizmima” nastaju i male količine otrovnog metanola. Kako tijekom destilacije najprije destiliraju najhlapljivije tvari, to će prvi destilat sadržavati najviše metanola. Zato prvi dio destilata od koma treba baciti.
Koncentracija alkohola u krvi ne može se smanjiti uzimanjem bilo kakvih preparata. Jedino djelotvorno sredstvo je metabolizam u jetri koja koncentraciju alkohola u krvi smanjuje za 0,1 ‰ na sat. Nakon popijene pola litre vina za povratak u „normalu“ (0,3 ‰ alkohola u krvi) odraslom čovjeku potrebno je 5 i više sati. No, trajno uživanje alkohola oštećuje mozak i srčano-žilni sustav te izaziva cirozu jetre. Svaki četvrti bolnički krevet zauzima osoba koja se liječi od neke alkoholom izazvane bolesti. Trudnice koje prekomjerno uživaju alkohol često rađaju djecu s oštećenjima koja uključuju i mentalnu retardaciju djeteta.
Upamtite
28.3. Kemijska svojstva alkohola
Alkoholi reagiraju s natrijem na sličan način kao i voda, ali mnogo blaže.
2 CH3−CH2−OH + 2 Na → 2 CH3−CH2−ONa + H2etanol natrijev etoksid
Slika 28.2. Model molekule etanola
Kupovni alkohol uvijek sadržava vodu. Frakcijskom destilacijom ne može se dobiti čisti alkohol jer smjesa koja sadržava 96 volumnih dijelova alkohola i 4 volumna dijela vode ima najniže vrelište. Bezvodni ili apsolutni alkohol može se dobiti tako da se voda ukloni nekom kemijskom reakcijom. Najčešće se kupovnom alkoholu doda kalcijeva oksida i dobivena smjesa destilira.
Kalcijev
oksid kemijski veže vodu, pa
destilat sadržava
bezvodni ili apsolutni alkohol.
Pokus 49. Katalitička oksidacija etanola
28.4. Alkoholi s više funkcijskih skupina -OH
Alkoholi
mogu imati više funkcijskih
skupina –OH. Etan-1,2-diol,
CH2OH-CH2OH,
(zastarjeli naziv etilenglikol)
sastojak
je rashladnog sredstva automobilskih motora. Smjesa jednakih volumnih
dijelova
vode i etan-1,2-diola ledi se pri -37 ºC. 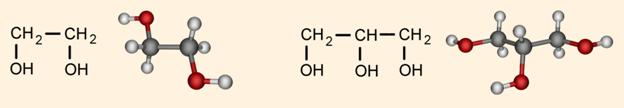
Propan-1,2,3-triol, CH2OH-CHOH-CH2OH, (grč. glykys - sladak) je alkohol slatkasta okusa s tri hidroksilne skupine. Poznatiji je po zastarjelom nazivu glicerol ili glicerin. Dobiva se hidrolizom masti. To je bezbojna, higroskopna i viskozna tekućina. Miješa se s vodom u svakom omjeru. Upotrebljava se u izradi nitroglicerina, ali i u kozmetici kao dodatak raznim kremama, sapunima i sl.
Ponovimo
Izradite plakat o jednoj od tema:
a) destilacija,
b) alkoholno vrenje,
c) alkohol – uzročnik saobraćajnih nesreća,
d) građa molekula nekih alkoholâ,
e) kemijska svojstva alkoholâ,
f) alkoholizam.
29. KARBOKSILNE KISELINE
Mnoge karboksilne ili organske kiseline nalaze se u prirodi. Limun sadržava limunsku kiselinu, jabuke jabučnu kiselinu, kiselo mlijeko mliječnu kiselinu, kiselica oksalnu kiselinu itd. U kućanstvu svakodnevno rabimo octenu kiselinu ili ocat. Kiseline su nekad, kad su prvi put otkrivene, dobivale imena prema polaznoj tvari iz koje su izolirane. Tako je kiselina dobivena suhom destilacijom mrava nazvana mravlja kiselina.
29.1. Imena i svojstva karboksilnih kiselina
Slika 29.1. Model molekule etanske (octene) kiseline
Sve organske kiseline sadržavaju karboksilnu skupinu, –COOH. Ona im daje kiselinska svojstva. U vodenim otopinama veza kisik-vodik u karboksilnoj skupini lako se cijepa. Zato vodene otopine karboksilnih kiselina sadržavaju ione, H3O+.
29.2. Octena kiselina
Octena kiselina, CH3COOH, važna je industrijska sirovina. U laboratorijima se često koristi 100-postotna octena kiselina. Nazivaju je još ledena octena kiselina jer se već pri 16,7 °C skrutne u bijelu, ledu sličnu masu. Octena kiselina je slaba kiselina, ali jača od ugljične kiseline. U njoj se otapaju zemnoalkalijski metali, njihovi oksidi i svi karbonati.
Mg + 2 CH3COOH → Mg(CH3COO)2 + H2
CaO + 2 CH3COOH → Ca(CH3COO)2 + H2O
CuCO3 + 2 CH3COOH → Cu(CH3COO)2 + CO2
Na2CO3 + 2 CH3COOH → 2 CH3COONa + CO2
Soli octene kiseline nazivaju se acetati prema latinskom acetum – ocat.
Alkoholni ocat, kakav se rabi u kućanstvu za konzerviranje zelenog povrća i kao začin salati i nekim jelima, sadržava 8 do 9 % octene kiseline. Dobiva se fermentacijom alkoholnih otopina. Najstarije upute za pravljenje vinskog octa potječu iz 17. stoljeća. Postupak se temeljio na iskustvu da je za dobivanje octa potreban obilan dotok zraka i blaga toplina. Tek je u 19. stoljeću otkriveno da kisik iz zraka oksidira alkohol u octenu kiselinu posredstvom enzima iz štapićastih bakterija, Acetobacter aceti.
Acetobacter acetiCH3CH2OH + O2 (zrak) ──────────> CH3COOH + H2O
etanol octena kiselina
29.3. Masne kiseline
Omega-3 masne kiseline su posebna skupina unutar nezasićenih masnih kiselina. Ime su dobile prema položaju dvostruke veze brojeći od -CH3 kraja lanca.
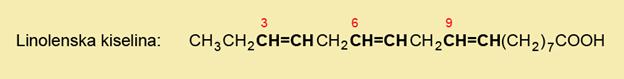
Po toj nomenklaturi oleinska kiselina je omega-9-masna kiselina jer se dvostruka veza nalazi na devetom ugljikovom atomu brojeći od kraja lanca.
Ljudsko tijelo može sintetizirati sve masne kiseline koje treba za rast i život osim triju, a to su arahidonska, linolna i linolenska kiselina. Nazivamo ih esencijalnim masnim kiselinama jer su važne za naš organizam i moramo ih unositi hranom. Namirnice bogate omega-3-masnim kiselinama jesu laneno ulje, plava riba i orašasti plodovi. Omega-3-masne kiseline imaju pozitivni učinak na ljudsko zdravlje. Smanjuju razinu triacilglicerola (triglicerida), snizuju krvni tlak. Spriječavaju nastanak krvnih ugrušaka. Poboljšavaju cirkulaciju krvi i dr.
Izradite plakat o jednoj od tema:
a) tvorba naziva karboksilnih kiselina,
b) karboksilne kiseline u prirodi,
c) građa molekula zasićenih i nezasićenih masnih kiselina.
30. ESTERI
Pokus 50. Kako sintetizirati ester
30.1. Laboratorijska sinteza estera
Reakcija esterifikacije nikad ne ide do kraja. Alkohol i kiselina međusobnom reakcijom daju ester i vodu. Istodobno voda i ester međusobno reagiraju i daju alkohol i kiselinu. Između ove dvije kemijske reakcije, koje teku suprotnim smjerovima, konačno se uspostavi kemijska ravnoteža.
U stanju ravnoteže raspadne se toliko molekula estera koliko ih istodobno nastane. U jednadžbi kemijske reakcije to se označuje strelicama suprotnih smjerova. Reakcije u kojima neka tvar reagira s molekulama vode tako da nastaju nove tvari naziva se hidroliza.
30.2. Imena estera
Ponovimo
Izradite plakat o jednoj od tema:
a) kemijska svojstva alkohola,
31. MASTI I ULJA
31.1. Masti i ulja
Masti i ulja su esteri masnih kiselina i glicerola. Glicerol je alkohol s tri –OH skupine. Sve tri –OH skupine čine esterske veze s masnim kiselinama. Zato se ulja i masti nazivaju triacilglicerolima. Općenitu strukturu masti, odnosno triacilglicerola sa zasićenim masnim kiselinama, prikazuje slika 31.1.
Ulja biljnog podrijetla danas se često katalitički hidrogeniraju uz nikal kao katalizator. Pritom se dio dvostrukih veza zasiti vodikom pa iz ulja nastaju krute masti. Dobivenom produktu dodaje se vitamini i prirodne boje da bi se dobio izgled i okus maslaca. To je dobro poznati margarin. Moderni margarini ne bi smjeli sadržavati trans-masne kiseline koje naš organizam ne može razgraditi. Trans-masne kiseline povezuju se s bolestima srca i krvožilnog sustava. Ako biraš između maslaca i margarina, tada više vjeruj kravama nego kemičarima.
31.2. Proizvodi od masti i ulja
32. SAPUNI I DETERDŽENTI
32.1. Sapuni
Slika 32.1. Shematski prikaz dobivanja sapuna
Sapuni su soli viših masnih kiselina sa 16 ili 18 ugljikovih atoma vezanih u nerazgranani lanac. Ugljikovodični lanac (rep) čini hidrofobni dio, a karboksilna skupina (glava) hidrofilni dio molekule sapuna. Dugački ugljikovodični dio sapuna nastoji smanjiti kontakt s vodom. Naprotiv, hidrofilna karboksilna skupina nastoji ostvariti što bolji kontakt s vodom. Sapun se u vodi otapa tako da tvori koloidnu otopinu koja se sastoji od micela. Micele se sastoje od nekoliko desetina ili stotina „molekula“ sapuna tako da su hidrofilne grupe okrenute prema vodi, a hidrofobni lanci jedni prema drugima. (Vidi sliku 32.3.a.) Negativni naboj micela neutraliziraju natrijevi ioni u otopini, ali se na crtežima obično izostavljaju.
Slika 32.2. Shematski prikaz građe sapuna. Sapuni su površinski aktivne tvari jer smanjuju napetost površine vode.
32.2. Emulzije
Ulje i mast mogu se snažnim miješanjem raspršiti u vodi u vrlo sitne kapljice tako da nastane emulzija. Miješanjem ulja i vode mogu nastati dvije vrste emulzija: emulzija ulja u vodi i vode u ulju. To su nestabilne smjese koje se vrlo brzo nakon miješanja razdvoje u zasebne slojeve. Gustoća ulja i masti manja je od gustoće vode. Zato ulje ili mast ispliva iznad sloja vode.
Svakodnevno pijemo mlijeko ili jogurt. To su stabilne emulzije mliječne masti u vodi. Majoneza je emulzija vode u ulju (≈ 20 % vode). Putar i margarin su stabilne emulzije vode u masti. Da bi takve emulzije ostale stabilne potreban je emulgator. Emulgatori su tvari čije su dugačke molekule građene tako da im je jedan kraj hidrofilan (glava) a drugi hidrofoban (rep).
Mlijeko je stabilna emulzija zato što sadržava kazein, jednu bjelančevinu koja djeluje kao emulgator. Kod pripreme majoneze, kao emulgator rabi se žumanjak jajeta. Lecitin iz soje rabi se kao emulgator u margarinu, čokoladi i mnogim drugim prehrambenim proizvodima. U kozmetičkim i farmaceutskim proizvodima rabe se sintetički i polusintetički emulgatori.
32.3. Kako sapun pere
Najveći dio prljavštine na koži, odjeći i drugim uporabnim predmetima čine različite masti. Sapun pere tako da hidrofobni kraj (ugljikovodični rep) uđe u česticu masnoće, a hidrofilni (karboksilna skupina) ostane okrenut prema vodi. Trljanjem tkanine ili površine kože u toploj otopini sapuna velike čestice masnoća razbijaju se na manje. Nastaje emulzija koja se sastoji od malih kapljica masnoće okruženih slojem molekula sapuna. Tako se masnoće prevode u stabilnu emulziju koja se može isprati vodom. Emulzija je stabilna zato što te čestice imaju negativni naboj pa se međusobno odbijaju. (Vidi sliku 32.4.) S kalcijevim, magnezijevim i ionima prijelaznih metala sapun tvori netopljive taloge. Zato se sapunom najbolje pere u „mekanoj vodi“, kao što je kišnica koja sadržava malo otopljenih soli. Sapunom se ne smiju prati vuneni predmeti jer lužine jako oštećuju vunu.
Pokus 51. U kakvoj vodi sapun najbolje pere
32.4. Deterdženti
Svojstva sapuna da tvore netopljive soli sa zemnoalkalijskim i teškim metalima čine ih neprikladnima za pranje u tvrdoj, a posebno u morskoj vodi. Zato se danas umjesto sapuna uglavnom rabe deterdženti. To je smjesa tenzida ili površinski aktivnih tvari i pomoćnih tvari koje djeluju sinergijski s ostalim sastojcima i osiguravaju zadovoljavajući učinak pranja.
Slika 32.5. Shematski prikaz građe molekula različitih vrsta površinski aktivnih tvari (tenzida)
Pokus
52.
Monomolekulski
sloj
površinski
aktivne tvari na vodi
Izradite plakat o jednoj od tema:
a) emulgatori u prehrambenim proizvodima,
b) kozmetički proizvodi – kreme i emulzije,
c) sapuni i deterdženti u okolišu.
33. UGLJIKOHIDRATI
Kada smo govorili o kruženju ugljika u prirodi spomenuli smo fotosintezu koja se događa u zelenim dijelovima biljaka, Uz pomoć Sunčeve svjetlosti iz jednostavnih molekula, CO2 i H2O, biljke sintetiziraju mnogo složenije molekule, kao što je glukoza, C6H12O6, a pritom u atmosferu ispuštaju kisik. U tom smislu biljke su zaista prave čudotvorne kemijske tvornice. Proizvedena glukoza odmah se dalje iskoristi i biljka ju prerađuje na više načina: u energijske rezerve - kao škrob, u građevni materijal - kao celulozu, i za sintezu drugih tvari potrebnih za preživljavanje.
33.1. Podjela ugljikohidrata
Prve analize škroba, celuloze i glukoze (grožđanog šećera) načinjene su početkom 19. stoljeća. Tad je ustanovljeno da te tvari sadržavaju samo ugljik, vodik i kisik. Sve one imaju sličnu empirijsku formulu, Cx(H2O)y. Na prvi pogled izgledalo je da su to spojevi ugljika i vode. Zato je ta skupina spojeva dobila zajednički naziv ugljikohidrati.
Ugljikohidrati se općenito nazivaju saharidima (grč. sakchar – šećer). One topljive u vodi i slatka okusa nazivamo šećerima (tur. šeker). Najpoznatiji šećeri su glukoza i fruktoza kojih ima u medu i voću. Ti su šećeri najmanje strukturne jedinke ugljikohidrata pa ih nazivamo monosaharidima.
Iz korijena šećerne repe i srčike šećerne trske dobiva se saharoza ili običan šećer. Molekula saharoze može se hidrolizom rastaviti na molekulu glukoze i molekulu fruktoze. Dakle, saharoza je šećer izgrađen od dvije najmanje strukturne jedinke ugljikohidrata. Zato se za saharozu kaže da je disaharid. Za škrob i celulozu kažemo da su polisaharidi jer su njihove molekule izgrađene od velikog broja međusobno vezanih molekula monosaharida.
33.2. Monosaharidi
Pokus
53.
Dokazivanje
prisutnosti
glukoze Trommerovim reagensom
Glukoza i fruktoza su reducirajući šećeri i s Trommerovim reagensom daju crvenosmeđi talog. Mnogi osvježujući napici zaslađeni su glukozno-fruktoznim sirupom dobivenim iz kukuruznog škroba. Kad se u takav osvježujući napitak doda Trommerov reagens, odnosno 10-postotna otopina natrijeva hidroksida i samo jedna kap 10-postotne otopine modre galice te smjesa zagrije, pojavi se crvenosmeđi talog bakrova(II) oksida, Cu2O. To je siguran dokaz da taj napitak sadržava glukozu ili fruktozu.
33.3. Disaharidi
Pokus
54.
Je li saharoza
reducirajući
šećer
Saharoza je disaharid koji ne reagira s Trommerovim niti Fehlingovim reagensom i nije reducirajući šećer. Kad se otopina saharoze zakiseli, primjerice limunskom kiselinom, i zagrijava, molekule saharoze (disaharida) se hidroliziraju pa nastaje smjesa monosaharida, glukoze i fruktoze. Dobivena se smjesa naziva invertni šećer.
kiselinaC12H22O11 + H2O ————> C6H12O6 + C6H12O6
glukoza fruktoza
Oba su monosaharida reducirajući šećeri i reagiraju s Fehlingovim i Trommerovim reagensom.
15.4. Polisaharidi
Pokus
55.
Dobivanje škroba
iz
krumpira
Zrnca škroba sadržavaju najmanje dvije različite vrste molekula. To su amiloza i amilopektin. U amilozi je nekoliko stotina molekula glukoze međusobno povezano u dugačak nerazgranati lanac. U prirodi taj je lanac smotan u uzvojnicu. Prisustvo škroba obično se dokazuje Lugolovom otopinom, odnosno otopinom joda u kalijevu jodidu. Kad se u otopinu škroba doda nekoliko kapi otopine joda u kalijevu jodidu, jod se ugradi u unutrašnjost uzvojnice što uzrokuje pojavu plave boje. Kad se otopina škroba ugrije, uzvojnica se djelomično razmota i plava boja nestane. Hlađenjem uzvojnica poprimi pravilnu građu i plava se boja ponovo pojavi.
Slika 33.5. Shematski prikaz građe amiloze
Ponovimo
Izradite plakat o jednoj od tema:
b) dokazivanje prisutnosti reducirajućih šećera u osvježavajućim napicima,
c) ugljikohidrati u brzoj hrani i gaziranim napicima.
34. AMINOKISELINE I PROTEINI
34.1. Aminokiseline
Slika 34.1. a) Kalotni model molekule alanina, jedne od dvadeset aminokiselina od kojih je izgrađena velika većina svih poznatih proteina. b) Model molekule alanina prikazan štapićima i kuglicama. c) Strukturna formula molekule alanina. Sve aminokiseline sadržavaju amino- i karboksilnu skupinu na istom ugljikovu atomu. Dvadeset različitih aminokiselina razlikuje se prema dvadeset različitih promjenjivih skupina R, kao što su ─CH3, ─CH2OH, ─CH2SH, ─CH2COOH, itd. Promjenjive skupine R mogu biti nepolarane, polarane, hidrofillne ili hidrofobne. Neke, tzv. esencijalne aminokiseline moramo unositi hranom jer ih naš organizam ne može sintetizirati.
Molekule koje sadržavaju dvije aminokiseline međusobno povezane peptidnom vezom zovu se dipeptidi. Molekule koje sadržavaju više aminokiselina međusobno povezanih u lanac peptidnim vezama zovu se tripeptidi, tetrapeptidi, pentapeptidi itd. Peptidi izgrađeni od velikog broja aminokiselina nazivaju se polipeptidima. Polipeptidni lanci mogu se unutar sebe i međusobno vezati poprečnim N-H∙∙∙O vezama te tako tvoriti uzvojnice, vrpce i druge strukture slične konopu, klupku itd.
34.2. Proteini
Proteini ili bjelančevine su prirodni polipeptidi izgrađeni od velikog broja ostataka 20 različitih aminokiselina međusobno povezanih peptidnom vezom u dugačke lance. Najpoznatiji izvori proteina su meso i jaja. Naziv protein smislio je Berzelius (grč. protos – prvi). Naziv je opravdan jer se postojanje života bez proteina ne može zamisliti.
Pokus
56.
Dokazivanje
prisutnosti
proteina ksantoproteinskom reakcijom
Pokus 57. Dokazivanje prisutnosti proteina biuret reakcijom
Svi
proteini, kao i produkti njihova
raspadanja, daju biuret
reakciju karakterističnu za peptidnu
vezu
ili istu vezu u nekom sličnom spoju, npr. biuretu, H2N-CO-NH-CO-NH2,
pa otuda i potječe naziv te reakcije. U otopinu koja sadržava neki
protein doda
se jednak volumen 20-postotne otopine natrijeva hidroksida i samo kap
razrijeđene otopine modre galice. Ako uzorak sadržava neki protein,
pojavit će
se crvenoljubičasto obojenje.
34.3. Građa molekula proteina
Veze koje podržavaju prostornu građu proteina relativno su slabe. Mogu se prekinuti zagrijavanjem, dodatkom kiseline ili dodavanjem soli teških metala. Proces narušavanja ili razaranja prirodne prostorne građe molekula proteina zove se denaturiranje (lat. de = ukidanje + natura = priroda). Promjene na kemijskim vezama u proteinu nepovratne su. Svatko zna da se iz kuhanog jajeta ne može više dobiti nekuhano jaje.
34.4. Kolagen
Slika 34.5. Shematski prikaz građe vlakna kolagena.
Izradite plakat o jednoj od tema:
35. ENZIMI
Sve žive stanice sadržavaju enzime. Ljudsko tijelo sadržava tisuće različitih enzima. Bez enzima ne bismo mogli disati, kretati se ili probavljati hranu. Fotosinteza u biljkama također se odvija uz pomoć enzima. Enzimi (grč. en – u + zyme – kvasac) su proteini koji djeluju kao katalizatori u biokemijskim reakcijama. Molekule enzima imaju velike relativne molekulske mase. Primjerice, alkoholdehidrogenaza je enzim koji katalizira razgradnju alkohola u jetri, a ima relativnu molekulsku masu oko 80 000. Kemijske reakcije se uz pomoć enzima odvijaju nekoliko milijuna puta brže nego bez njih. Imena svih enzima završavaju nastavkom –aza. Proteaze su enzimi koji cijepaju molekule proteina. Lipaze su enzimi koji cijepaju molekule masti, a amilaze su enzimi koji cijepaju molekule škroba.
35.1. Kako enzimi rade
Pokus
58.
Utjecaj pH i
temperature na
aktivnost enzima
Pokus
59.
Hidroliza
škroba enzimima
Neki su enzimi specijalizirani za cijepanje velikih molekula u manje, a neki pak za sintezu manjih molekula u veće. Molekula s kojom enzim reagira zove se supstrat. Stvaranju i kidanju kemijskih veza enzimom prethodi vezanje supstrata na aktivno mjesto u enzimu. Njega tvori nekoliko dijelova polipeptidnog lanca. Djelovanje enzima na supstrat obično se objašnjava modelom ključa i brave. Kao što samo jedna vrsta ključa otvara određenu bravu, tako i određeni enzim može izvesti kemijsku promjenu na samo jednoj vrsti molekula.
Slika 35.1. Shematski prikaz djelovanja enzima po modelu ključa i brave.
35.2. Gdje se enzimi rabe
35.3. O prehrani
Izradite plakat o jednoj od tema:
c) brza hrana i gazirani napitci.
36. POLIMERI
Kad se u nekoj velikoj molekuli stalno ponavljaju iste strukturne jedinke, za nju se kaže da je polimer, bez obzira na to je li ta molekula prirodnoga ili umjetnog podrijetla. Svi prirodni polimeri izgrađeni su od velikog broja međusobno povezanih jednakih strukturnih jedinki, monomera. Škrob i celuloza su polimeri nastali međusobnim povezivanjem velikog broja molekula jednoga jedinog monomera, glukoze. Škrob i celuloza su homopolimeri jer su izgrađeni samo od jedne vrste monomera.
36.1. Vrste polimera
Plastomeri (termoplasti) su sintetički polimeri čije su molekule dugi, linearni ili razgranati lanci. Osnovno svojstvo plastomera je da zagrijavanjem omekšaju ili se rastale, a hlađenjem očvrsnu ne promijenivši svojstva. Elastomeri su sintetički polimeri čije su molekule međusobno povezane manjim brojem poprečnih veza. Odlikuju se savitljivošću (rastezljivošću) pri sobnoj temperaturi.
Duromeri (duroplasti) su građeni od gusto umreženih polimerskih molekula. To su tvrdi materijali koji se ne mogu preoblikovati zagrijavanjem i lako se lome.
 °C
°C
Slika 36.1. Shematski prikaz građe polimernih lanaca u različitim vrstama polimera
36.2. Sintetički homopolimeri
Slika 36.2. Shematski prikaz polimerizacije etena u polieten
Slika 36.3. Shematski prikaz polimerizacije propena u polipropen
Poli(vinil-klorid), PVC, amorfni je polimer prosječne molekulske mase oko 100 000. To je krhka čvrsta masa kojoj je potrebno dodati omekšivače da bi se dobila odgovarajuća mehanička svojstva. Najčešće su to ftalati, odnosno esteri ftalne kiseline i acikličkih alkohola.
Slika 36.4. Shematski prikaz polimerizacije kloretena (vinil-klorida) u poli(vinil-klorid)
Slika 36.5. Shematski prikaz polimerizacije tetrafluoretena u politetrafluoreten (teflon)
Slika 36.6.
Shematski prikaz
polimerizacije stirena u polistiren
Pokus
60.
Ispitivanje
fizikalnih
svojstava polietena
36.2. Sintetički kopolimeri
-A-A-B-B-B-B-B-B-B-B-A-A-A-B-B-B-B-A-A-A-A-A-A-A-
Slika 36.7. Shematski prikaz dobivanja najlona 6,6
36.3. Guma
Svi su već čuli priču o tome da je Kolumbo, otkrivši Ameriku, naišao na domoroce koji su se igrali loptama načinjenim od smole prikupljene od jedne vrste drveta. Te su lopte bile načinjene od kaučuka. Prirodni kaučuk je polimer koji se sastoji od dugačkih lanaca nastalih međusobnim povezivanjem od 1000 do 5000 molekula jednog nezasićenog ugljikovodika koji sadržava samo 5 ugljikovih atoma. Prirodni kaučuk je mekan i ljepljiv na toplome, a krhak na hladnome. Zagrijavanjem prirodnog kaučuka sa sumporom stvaraju se sulfidne i disulfidne poprečne veze između polimernih lanaca. Taj se postupak zove vulkanizacija. Slika 36.8 shematski prikazuje kako sumpor povezuje lance prirodnog kaučuka i tako stvara strukturu sličnu mreži.
Slika 36.9. Shematski prikaz razmještaja polimernih lanaca prije i nakon rastezanja gume
36.4. Recikliranje iskorištenih polimera
Danas se većina proizvoda prodaje u plastičnoj ambalaži koju, nažalost, zbog neorganiziranosti i loših navika najčešće bacamo. Pomislite li ikada da jedna boca od 2 L Coca Cole sadržava 60 grama poli(etilentereftalata), PET. Danas se prikupljaju samo boce od kisele vode i gaziranih napitaka, ali koliko boca od sredstava za čišćenje i drugih proizvoda završava na smetištu? U mnogim je zemljama uspostavljen sustav prikupljanja iskorištenih polimernih materijala i njihova recikliranja. Sustav se temelji na razvijenoj ekološkoj svijesti stanovništva koje "plastiku" ne baca u potoke i na smetišta već ju sustavno prikuplja u za tu svrhu pripremljene spremnike. Najveći problem kod recikliranja polimernih materijala je njihova raznolikost. To često onemogućava jednostavno ponovno taljenje prikupljenih polimera i izradu novih predmeta. Zato se polimerni materijali podvrgavaju kemijskim postupcima prerade.
Spaljivanje radi dobivanja topline jedan je od mogućih načina iskorištavanja otpadnih polimernih materijala. Ogrjevna vrijednost polimernih materijala ista je kao i ulja za loženje. Spaljivanje se ne smije provoditi bilo kako, nego u posebnim spalionicama pri visokoj temperaturi tako da u atmosferu ne odlaze kancerogeni aromatski i drugi spojevi.
Pirolizom polimernih materijala, bez pristupa zraka pri 500 do 900 °C, dobije se ulje bogato aromatskim spojevima. Takvo se ulje može u tvornicama petrokemikalija preraditi u mnoge korisne spojeve.
Hidrogeniranjem polimernih materijala, pri temperaturi 450 do 500 °C i tlaku vodika 150 do 200 bara, dobije se ulje koje sadržava alifatske ugljikovodike. Od jedne tone odbačene ambalaže hidrogeniranjem se dobije oko 800 kg sirovog ulja od kojega se može dobiti oko 400 L dieselskoga goriva.
Depolimerizacijom nekih polimernih materijali mogu se dobiti monomeri upotrebljivi za sintezu istih ili drugih polimera.
Djelomičnom oksidacijom i plinifikacijom odbačene ambalaže može se dobiti sintezni plin koji je osnova za ponovno dobivanje mnogih polimera.
Ponovimo
Izradite plakat o jednoj od tema:
a) recikliranje polimera,
b) polimerni materijali u okolišu,
c) zbrinjavanje polimera.
Recenzenti
- Izv. prof. dr. sc. Željka Soldin,
- Izv. prof. dr. sc. Biserka Prugovečki.
Lektori
- Martina Kučar, prof.
- Zdenka Šopar, prof.
- Ivana Canjuga, prof.
- Miroslav Cmuk, prof.
Fotografije i video
- Prof. dr. sc. Milan Sikirica
Udžbenik je besplatan. Nastao je nesebičnim radom autora, recenzenata, lektora i programera. Zato se ni jedan dio ovog udžbenika i njegovih sastavnih dijelova (pojmovnik, pokusi i video) ne smije ni u kojem obliku i na bilo koji način koristiti u komercijalne svrhe. Dozvoljeno je korištenje za osobne potrebe i za nastavu u školama. Slobodno smijete besplatno umnožavati, dijeliti, distribuirati i prerađivati ovaj udžbenik za potrebe nastave pod uvjetom obveznog citiranja izvornika. Sva su autorska prava zadržana.
Autori neće biti odgovorni ni za kakve izravne, slučajne, posljedične, neizravne ili kaznene štete nastale korištenjem ovog udžbenika i njegovih sastavniih dijelova.
Webmaster - kontakt e-mail