Milan Sikirica
Digitalni udžbenik
Odgovori na pitanja i rješenja zadataka
Odgovori 1
- U periodnom sustavu elementi su u
skupine svrstani po sličnosti kemijskih svojstava a u periode prema porastu
rednog ili atomskog broja.
-
- Metali: Au, Na, Pu, Ti.
- Nemetali: C, S, Ne.
- Metaloidi: B, Si, Se, Te.
-
- Metali su dobri provodnici topline i elektriciteta.
- Nemetali su izolatori i ne provode toplinu i elektricitet ili vrlo slabo provode toplinu.
- Metaloidi su slabi provodnici topline i elektriciteta.
- Be, Mg, Ca, Sr.
Ba, Ra.
- Tantalova kći
zvala se Nioba i po njoj je ime dobio element niobium zbog
sličnosti svojstava s tantalom.
- Volfram.
Odgovori 2
- Znak Br2
označuje jednu molekulu broma, a znak 2Br označuje dva atoma broma.
- Mr(C12H22O11) = 12 Ar(C)
+ 22 Ar(H) + 11 Ar(O) = 12 × 12 + 22 × 1 +
11 × 16 = 342.
- Mr(C5H7N) = 5 Ar(C)
+ 7 Ar(H) + Ar(N) = 5 × 12 + 7 × 1 + 1 × 14
= 81.
Kako je relativna molekulska masa nikotina 162,2, proizlazi da je molekulska formula nikotina C10H14N2. - Relativna
molekulska masa hemoglobina je 68 000. Molarna masa hemoglobina je 68 000 g mol-1.
Masu jedne molekule dobijemo tako da molarnu masu hemoglobina podijelimo Avogadrovom
konstantom.
m (1 molekula Hb) = 68 000 g mol-1 / 6,022 · 1023 mol−1 = 1,129 · 10−19 g. - Maseni udio nekog
sastojka je omjer mase tog sastojka prema masi svih sastojaka. Maseni udio
željeza jednak je omjeru 4 relativne atomske mase željeza prema relativnoj
molekulskoj masi hemoglobina:
w(Fe) = 4Ar(Fe) / Mr(Hb) = 223 / 58000 = 3,85 · 10–3. - Relativna
molekulska masa CaCO3 dobije se
tako da se zbroje relativne atomske mase svih atoma u formulskoj jedinki
spoja:
Mr(CaCO3) = Ar(Ca) + Ar(C) + 3 Ar(O) = 40 + 12 + 48 = 100.
Odavde proizlazi: w(Ca) = 0,40, w(C) = 0.12, w(O) = 0,48. - Maseni udio pojedinog elemenata u spoju treba podijeliti njegovom
relativnim atomskim masom pa će se dobiti molni omjer elemenata u spoju.
(w(C)/ Ar(C)) : (w(O)/ Ar(O)) : w(Cl)/ Ar(Cl)) = (0,121/12) : (0,162/16) : (0,717/35,5) =
= 0,0101 : 0,0101 : 0,0202 = 1 : 1 : 2. Formula fozgena je COCl2.
Za sintezu fozgena ugljikov monoksid i klor treba uzeti u volumnom omjeru 1:1. - U 1000 kg
ugljena ima 32 kg sumpora. Sumpor izgara u sumporov dioksid prema jednadžbi:
S(s) + O2(g) → SO2(g).
Kako je Mr(SO2) = Ar(S) + 2 Ar(O) = 32 + 2×16 = 64, proizlazi da gorenjem 32 kg sumpora nastaje 64 kg, odnosno 1000 mola sumporova dioksida. Kako je pri n.u. molarni volumen plina, Vm(SO2) = 22,4 L mol−1, proizlazi da gorenjem 1000 kg ugljena u kojem je maseni udio sumpora 3,2% nastaje 22,4 m3 sumporova dioksida. - C12H22O11(s) + 12 O2(g)
→ 12CO2(g) + 11H2O(l).
- Gorenjem 1 mola
saharoze nastaje 12 mola ugljikova dioksida i 11 mola vode. Kako je Mr(C12H22O11) = 342, proizlazi da
gorenjem 1 g saharoze nastaje 342 puta manji volumen ugljikova dioksida i 342
puta manja masa vode. Odavde proizlazi:
V(CO2) = 12 · 22,4 L / 342 = 0,786 L. m(H2O) = 11 · 18 g / 342 = 0,579 g. - 2C3H5(NO3)3(l)
→ 3 N2(g) + ½O2(g) + 6CO2(g) + 5H2O(g).
- Maseni omjer ugljikova dioksida i
vode treba iskazati molnim omjerom tako da masene omjere podijelimo
relativnim molarnim masama:
n(CO2) : n(H2O) = (m(CO2)/M(CO2)) : (m(H2O)/M(H2O) =
(3,14 g/44 g mol−1) : (1,29 g/18 g mol−1) = 0,0714 mol : 0.0717 mol = 1 : 1
Odavde proizlazi da je omjer broja atoma ugljika i vodika u molekuli plina: N(C) : N(H) = 1 : 2 jer molekula vode sadržava 2 atoma vodika.
Omjer gustoće plinova jednak je omjeru njihovih relativnih molekulskih masa. Kako je gustoća plina 21 puta veća od gustoće vodika, proizlazi da je relativna molekulska masa Mr(plin) = 42, a molekulska formula plina C3H6. - M(zrak) = 0,21 · M(O2) +
0,78 · M(N2) + 0,01 · M(Ar)
= 0,21 · 32 g mol−1 + 0,78 · 28 g mol−1 + 0,01 · 40 g mol−1
= 28,96 g mol−1.
Odgovori 3
- Ca(s) + Cl2(g)
→ CaCl2(s)
2Fe(s) + 3Cl2(g) → Fe2Cl6(g)
Kalcijev klorid je tipičan ionski spoj. Željezov(III) klorid sublimira a pare sadržavaju molekule Fe2Cl6. Prema tome u željezovu(III) kloridu udio kovalentne veze je veći. - MgO ima više talište jer je radijus iona Mg2+ manji od
radijusa iona Ba2+. Ioni jednakog naboja u strukturi MgO bliže su
nego u BaO. Prema Coulombovu zakonu elektrostatska privlačna sila smanjuje se s
kvadratom udaljenosti među nabojima: F = q1· q2 / r2.
- Najburnije s vodom reagira kalij, a zatim natrij. Magnezij vidljivo reagira tek s vrućom vodom.
- Najjača lužina je Ca(OH)2, a zatim Mg(OH)2. Al(OH)3 je amfoteran što znači da se otapa u kiselinama i lužinama.
- NH3
- F2(g) + H2O(l) → 2HF(aq) +
½O2(g) - Najburnije s vodom reagira kalij, a zatim natrij. Magnezij vidljivo reagira tek s vrućom vodom.
- Cl2(g) + 2Br−(aq) → 2Cl−(aq)
+ Br2(aq)
- AlCl3
-
- SrO(s) + H2O(l) → Sr(OH)2(aq)
- SO2(g) + H2O(l) → H2SO3(aq)
- SO3(g) + H2O(l) → H2SO4(aq)
- Na2O(s) + H2O(l) → 2NaOH(aq)
- Cl2O(g) + H2O(l) → 2HOCl(aq)
- Hidroliziraju SiCl4 i GeCl4.
- SiCl4(l) + 2H2O(l) → SiO2(s) + 4HCl(aq)
- GeCl4(l) + 2H2O(l) → GeO2(s) + 4HCl(aq)
Odgovori 4
- NH3 (−3), NH4+ (−3), SO2
(+4), SO3 (+6), CH4 (+4), CO (+2), CO2 (+4),
CH3OH (+4), IF7 (+7), CaH2 (+2), Fe2O3
(+3), PO43-(+5), SO42-(+6), Mg3N2 (+2), Li3N (+1).
- Tvar koja prima elektrone i pritom se reducira naziva se
oksidans. Tvar koja otpušta elektrone i pritom
se oksidira naziva se reducens. Jači oksidans je:
a) S, b) SO3, c) Mg2+, d) Na, e) Mg, f) F2. - Dušik:
najmanji oksidacijski broj je (−3) u NH3, a najveći (+5) u NO3−.
Fosfor: najmanji oksidacijski broj je (−3) u PH3, a najveći (+5) u PO43−. - Oksidansi:
a) O2, b) O2, c) H2SO4, d) O2.
- Oksidans
je FeCl3, odnosno ioni Fe3+(aq) koji se reduciraju u ione
Fe2+(aq). Reducens je elementarni bakar jer otpušta elektrone i
pritom se oksidira u ione Cu2+(aq).
2FeCl3(aq) + Cu(s) → 2FeCl2(aq) + CuCl2(aq)
Odgovori 5
- Dalton
je došao na ideju da su tvari izgrađene od atoma te je logično zaključio da su
svi atomi nekoga kemijskog elementa jednaki.
- 136Ce, 134Ba.
- 36.
- 1 g Cl2.
- Ar(Cl) = w(35<Cl) · Ar(35Cl) + w(37Cl) · Ar(37Cl)
= 0,7557 · 34,97 + 0,2443 · 36,96 = 35,46.
- Ar(B) = w(10B) · Ar(10B)
+ w(11B) · Ar(11B)
= 0,197 · 10,0129
+ 0,803 · 11,00931 = 10,813.
- Izotop 39K ima jedan neutron manje od
izotopa 40K.
- Ar(Sr)
= (Ar(Ca)
+ Ar(Ba)) : 2 = (40,08 + 137,3) : 2 = 177.38 : 2 = 88,69.
- m(atom I) = u · Ar(127I)
= 1,6605 · 10−27 kg · 126,9045 = 2,1072 · 10−25 kg.
- M(X) = m(X) · NA = 6,64 · 10−27
kg · 6.022 · 1023 mol−1 =
39,98 · 10−4 kg mol−1 = 4 g mol−1.
X = Helij. -
- ABerzelius(H) = 100 : 16 = 6,25.
- ABerzelius(C) = 100 · 12 : 16 = 75.
- Argon je plemeniti plin a
kalij vrlo reaktivan alkalijski metal. Elementi su u skupine svrstani prema
sličnosti kemijskih svojstava a u periode prema porastu rednog ili atomskog
broja.
- Radijus atoma je oko 10
000 puta veći od radijusa atomske jezgre.
- Radijusi atoma metala s
kristalnom strukturom najgušće slagaline kuglica jednake veličine mogu se
približno izračunati na temelju mjerenja gustoće metala. Točnije vrijednosti
dobiju se difrakcijom rendgenskih zraka.
-
- Na = 1s2 2s2p6 3s1,
- Mg = 1s2 2s2p6 3s2,
- Al = 1s2 2s2p6 3s2p1,
- S = 1s2 2s2p6 3s2p4,
- Ar = 1s2 2s2p63s2p6.
- 1s2 2s2p6
3s2p6 4s2.
U zadnjoj ljusci atom ima 2 elektrona pa pripada skupini zemnoalkalijskih metala. - Atom helija ima naboj jezgre +2 i jače privlači elektrone od vodika čija jezgra ima naboj +1.
Odgovori 6
- Izoelektronski
ioni imaju jednake elektronske konfiguracije. Primjerice K+ i Cl−
imaju elektronsku konfiguraciju argona.
- K+, Ca2+, Cl−, S2−.
- O2−, F−, Ne, Na+, Mg2+, Al3+.
- Energija ionizacije je energije potrebna da se ukloni elektron iz nekog izoliranog atoma.
- Cs.
- a)K, b) Sb, c) O2−, d) K+.
- Najveće
energije ionizacije imaju atomi 18. skupine − plemeniti plinovi, a
najmanje energije ionizacije imaju atomi 1. skupine − alkalijski metali.
- E = hc/l l = hc/E = (6,626·10−34 J s · 3·108 m s−1) : (495·103 J mol−1/6,022·1023 mol−1) = 0,2418 · 10−6 m = 241,8 nm.
- a) Mg3N2, b) Al2S3, c) FeO, d) Fe2O3, e) AlF3.
- N3−.
- N3−, N−, N, N+.
- a) Li, b) Ne c)
He, d) Cl−.
- a) Li, b) P, c) Ne, d) O+, e) Sc3+.
-
- a) Li+, Li, Na+, Na, K.
- b) Al3+, Mg2+, Na+, Na.
- c) Be2+, Mg2+, Li+, Li.
- CsF.
- Kruti natrijev klorid.
- c) F(g) + e− → F− (g)
- Plemeniti plinovi imaju stabilne elektronske konfiguracije od 8 elektrona u vanjskoj ljusci.
- Molekula
metana je nepolarne građe a voda je polarno otapalo. Vrijedi pravilo da se
slično otapa u sličnom. Amonijak i klorovodik su polarne građe te se dobro
otapaju u polarnim otapalima poput vode. Molekule amonijaka i klorovodika s
molekulama vode čine jake vodikove veze. Otopina klorovodika u vodi je jaka
kiselina, a otopina amonijaka slaba lužina.
- Oko atoma ugljika, dušika i kisika u molekulama metana, amonijaka i vode nalaze se četiri elektronska para koja se smještaju što dalje jedan od drugoga. U molekuli metana kovalentne
veze međusobno zatvaraju kut od 109,5o. U molekuli amonijaka
odbijanje nepodijeljeni par - podijeljeni par jače je od odbijanja elektronskih
oblaka podijeljenih elektronskih parova. Zato tri kovalentne veze N—H međusobno
zatvaraju manji kut, 107o. U molekuli vode međusobno odbijanje dvaju
nepodijeljenih elektronskih parova jače je od odbijanja podijeljenih
elektronskih parova i zato je kut između veza O—H još manji i iznosi 104,5o.
- Molekule etanola i vode su
polarne građe. Međusobno se mogu vezati vodikovim vezama i zato se miješaju u
svakom omjeru.
- Vrelište vode je više od vrelišta sumporovodika jer su vodikove veze O—H···O kraće i zato jače od vodikovih veza S—H···S. Kovalentni radijus sumpora veći je od kovalentnog radijusa kisika.
- Kaže se formulska jedinka NaCl, NH4Cl, CaO, LiF i LiH. U spojevima
s ionskom kristalnom strukturom nema izoliranih molekula.
- Natrijev
hidrid, NaH, je ionski hidrid koji kristalizira po tipu natrijeva klorida u kojem
je vodik anion, H−. U ostalim hidridima SiH4, PH3,
H2S i HCl veze su kovalentne. Molekula SiH4 ima simetriju
tetraedra te je nepolarne građe. To je bezbojan, zapaljiv i otrovan plin. Molekule
PH3, H2S i HCl su polarne građe.
- Molekula CCl4 ima
simetriju tetraedra te je nepolarne građe. Molekula SF6 ima
simetriju oktaedra te je također nepolarne građe jer težišta pozitivnog i
negativnog naboja padaju na isto mjesto. Molekula CHCl3 je polarne građe te se mali pozitivni naboj javlja na
atomu vodika a mali negativni naboj na atomima klora jer je klor elektronegativniji
od vodika. Molekula ICl je polarne građe a mali negativni naboj je na atomu
klora jer je klor elektronegativniji od joda.
- CH4, HBr, HF, NaCl, KF.
- BrF.
- CH4, HBr, HF, NaCl, KF.
Odgovori 7
-
- a)Tvari s ionskim kemijskim vezama imaju visoka tališta. To su krhke krutine. NaCl.
- b) Tvari molekulske građe imaju niska tališta. Saharoza, naftalen, ulja i masti.
- c) Metali imaju visoka tališta (osim Hg, In, Ga) te se mogu kovati i valjati.
- Talište
litijeva fluorida, 848 oC, više je od tališta natrijeva klorida, 801
oC, zato što je razlika elektronegativnosti Li - F veća od razlike
elektronegativnosti Na - Cl, što ukazuje na jaču ionsku vezu u LiF. Nadalje,
zbroj ionskih radijusa u LiF je 209 pm, a u NaCl 283 pm. Zbog toga su
elektrostatske privlačne sile u LiF jače nego u NaCl. Ta dva čimbenika uzrokuju
više talište litijeva fluorida.
-
- a) Svaki ion Cl− okružen je sa šest iona Na+.
- b) Svaki ion Na+ okružen je sa šest iona Cl−.
- c) Jednake.
- Jedinična
ćelija sadržava 4 formulske jedinke MgO. Masa 4MgO je 161,2 Da. Kako je 1 Da =
1.66 × 10−27 kg, gustoću MgO dobijemo kao omjer mase i volumena, pa slijedi:
r(MgO) = m/V = (161,2 · 1.66 · 10−27 kg) / (0,4207· 10−9 m)3
= 267,6 · 10−27 kg / 74,46 · 10−30 m3 = 3594 kg m−3 = 3,59 g cm−3. - Tališta rastu u nizu od
helija (t.t −272,2 oC) do ksenona (t.t. −111,8 oC)
jer međumolekulske privlačne sile rastu s povećanjem broja elektrona u atomima.
- Navedeni parovi imaju
jednake elektronske konfiguracije. No ioni 16. skupine imaju naboj −2 i
jedan proton manje od iona 17. skupine. Zato su radijusi iona 16. skupine veći
od radijusa iona 17. skupine.
Redoslijed po rastućem radijusu: F−, O2−, Cl−, S2−, Br−, Se2−. - Coulombov
zakon: F = q1 · q2/r2. Privlačne sile između iona u MgO mnogo su jače nego u NaF.
- Karbonatni ion ima os trećega reda. Zato
karbonatni ion treba postaviti na os trećega reda romboedra. Vidi: www.britannica.com/science/calcite.
- Soli su spojevi ionske građe. Pri deformaciji (udarac čekića) dolazi do pomaka slojeva iona. Ioni istoga naboja međusobno se odbijaju pa kristal puca. U metalu pokretljiv oblak elektrona
prati pomak atoma (kationa u moru elektrona) tako da ne dolazi do kidanja veze.
-
- a)Tvari s ionskom kristalnom strukturom su krhke i visoka tališta. NaCl, MgO, CaO, Al2O3.
- b) Tvari s metalnom kristalnom strukturom mogu se kovati i dobro provode elektricitet i toplinu. Cu, Au, Ag.
- c) Tvari s molekulskom kristalnom strukturom su mekane i niska tališta. Parafin, ulja, masti.
- d) Tvari s kovalentnom kristalnom strukturom su tvrde, krte i visokog tališta. Dijamant, grafit.
- U kristaliziranim krutinama periodički razmještaj atoma, iona i molekula proteže
se kroz čitav kristal u sva tri smjera u prostoru. U amorfnim krutinama uređeni
razmještaj čestica seže do udaljenosti od nekoliko atoma ili molekula.
- Jedinična
ćelija kristalne strukture natrija sadržava 2 atoma: jedan u središtu kocke i
osam osmina na vrhovima kocke.
- Jedinična ćelija sadržava 2 atoma. Masa jedinične ćelije je 46 Da. Kako je 1 Da = 1.66 × 10−27
kg, proizlazi da masa jedinične ćelije iznosi:
m(2Na) = 46 × 1.66 × 10−27 kg = 76,36 × 10−27 kg.
Kako je r = m/V, proizlazi da je volumen jedinične ćelije natrija:
V = m/r = 76,36 × 10−27 kg / 0,97 kg m−3
= 78,72 × 10−27 m3.
Odavde
proizlazi da je brid jedinične ćelije natrija: a = 4,286 × 10−9
m = 4,286 nm.
Atomi natrija dotiču se smjerom prostorne dijagonale kocke pa je radijus atoma natrija: r(Na) = a ×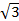 / 4 = 4,286 nm ×
/ 4 = 4,286 nm × 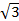 / 4 = 1,856 nm.
/ 4 = 1,856 nm.
Odgovori 8
- Talište je
temperatura pri kojoj krutina prelazi u tekućinu pri normalnom tlaku, 101 325
Pa. Vrelište je temperatura pri kojoj istodobno
u cijelom volumenu tvar prelazi iz tekućega u plinovito agregacijsko stanje pri
normalnom tlaku, 101 325 Pa. Temperatura vrelišta raste povišenjem tlaka a snižava
se sniženjem tlaka.
- Temperatura
vrelišta vode povisuje se povišenjem tlaka. Primjer: lonac za brzo kuhanje hrane.
Temperatura tališta leda snižava se povišenjem tlaka. Primjer: klizanje na
ledu.
- Trojna
točka je ona temperatura i tlak pri kojima su u ravnoteži tri faze: krutina,
tekućina i para. Primjerice trojna točka za vodu je pri T = 273,16 K i p
= 611 Pa.
- Sublimacija
je neposredni prijelaz krutine u paru. Led sublimira pri temperaturi nižoj od temperature
trojne točke i parcijalnom tlaku vodene pare manjem od ravnotežnog tlaka vodene
pare za zadanu temperaturu. Ako je tlak vodene pare veći od ravnotežnog tlaka
pri zadanoj temperaturi prezasićena vodena para se kondenzira u led (inje).
- U ledu je
svaka molekule vode jakim vodikovim vezama vezana s četiri molekule vode pri čemu
nastaje trodimenzijska struktura s vodikovim vezama usmjerenim prema četiri
vrha tetraedra. U tekućoj vodi molekule se mogu gušće pakovati nego u ledu i
zato je gustoća leda manja od gustoće vode.
- Iznad
kritične temperature i tlaka tekućina i plin prelazi u superkritični fluid koji
ima neka svojstva slična svojstvima tekućine a neka svojstva sličnija svojstvima
plinova.
- Kristali mješanci su krute otopine. Primjerice α-mjed , koja sadržava manje od 36 % cinka, je kruta otopina cinka u bakru. To znači da je u kristalnoj strukturi bakra (FCC-rešetka) dio atoma bakra zamijenjen atomima cinka.
Odgovori 9
- Jake
vodikove veze uzrokuju visoko vrelište vode. Molekula vode ima dva
nepodijeljena elektronska para i čini dvije vodikove veze s dvjema susjednim
molekulama vode. Zato se molekule vode mogu vezati u trodimenzijske strukture.
Fluorovodik, klorovodik i amonijak imaju samo jedan nepodijeljeni elektronski
par i mogu se vezati u lance. Zato je vrelište vode više od vrelišta
fluorovodika, klorovodika i amonijaka. Molekule ugljikovodika međusobno se privlače
slabim van der Waalsovim privlačnim i silama i zato su njihova vrelišta niža.
- Zbog
većeg kovalentnog radijusa atoma sumpora molekule sumporovodika manje su polarne
u odnosu na molekule vode. Slabiji dipoli privlače se manjom silom i zato je
sumporovodik plin
- Napetost površine uzrokuju privlačne sile između molekula na površini. Sile su paralelne
s površinom tekućine jer su razmaci između molekula na površini malo veći od
razmaka između molekula u unutrašnjosti tekućine.
- Voda
kvasi površinu stakla te se penje u kapilari što dovodi do smanjuje ukupne površine
stakla i vode. Manja površina ima manju energiju površine što je energijski
povoljnije. Živa ne kvasi površinu stakla te je energijski povoljnije da se
živa spusti u kapilari i tako poveća površinu stakla a smanji vlastitu
površinu.
- Među
molekulama vode djeluju jake vodikove veze. Privlačne sile između nepolarnih molekula
benzena su slabe i zato je viskoznost benzena manja od viskoznosti vode.
- Tlak para
krutina i tekućina raste s porastom temperature. Pri višoj temperaturi više molekula
na površini može sudarima s okolnim molekulama dobiti dovoljnu kinetičku energiju
da mogu savladati privlačne sile i napustiti površinu.
- Vodena para u hladnjaku neprekidno se kondenzira u led na površini plohe ili cijevi isparivača rashladnog sredstva. Temperatura povrća uvijek je viša od temperature rashladne plohe ili cijevi isparivača. Tlak para vode na površini povrća veći od tlaka para u hladnjaku. Zato voda isparava s površine povrća pa se ono osuši. Sušenje povrća možete spriječiti tako da ga zatvorite u plastičnu vrećicu unutar koje se može uspostaviti ravnotežni tlak para.
Odgovori 10
- U
kristaliziranim krutinama molekule, atomi i ioni i najčešće su složeni su na
najgušći mogući način u kristalnu strukturu koja se može opisati trodimenzijskom
kristalnom rešetkom. U amorfnim krutinama i tekućinama čestice su također
složene na najgušći mogući načina, ali uglavnom bez ikakva reda. Uređeni
razmještaj čestica, kao u kristalnoj strukturi, može se uočiti samo do
udaljenosti od nekoliko atoma li molekula. Krutine i tekućine praktično su nestlačive
jer smanjenjem razmaka između njihovih čestica naglo rastu odbojne sile između elektronskih
oblaka atoma.
- Pri kritičnoj temperaturi i kritičnom
tlaku
- a) povišenjem tlaka voda zadržava svojstva superkritičnog fluida,
- b) sniženjem tlaka superkritični fluid prelazi u stanje plina (vodena para),
- c) povišenjem temperature voda zadržava svojstva superkritičnog fluida,
- d) sniženjem temperature superkritični fluid prelazi u vodu.