 |
DSNK_1999_2 zadaci
1. Galvanski članak načinjen je od sljedećih polučlanaka: HCl(aq)-H2(g)¦Pt(s) i Fe3+(aq)¦Fe2+(aq)¦Pt(s).
A) Izračunaj potencijal (napon) toga članka.
B) Napiši dijagram (shemu) članka.
C) Prikaži jednadžbama kemijskih reakcija kemijske promjene koje se zbivaju na elektrodama. Standardni elektrodni potencijal,
E°(Fe3+¦Fe2+) = 0,771 V.
2. Izračunaj masu kalcija koju treba otopiti u 50 mL vode da bi nastala kalcijeva lužina imala pH = 12. Ar(Ca) = 40,08, Ar(O) = 16,00,
Ar(H) = 1,008.
3. Dolje navedene kemijske promjene prikaži jednadžbama kemijskih reakcija (Razmisli o mogućim reakcijama. Obvezno navedi agregatna stanja):
A) BaO(s) _ BaCl2(aq) _ Ba(NO3)2(aq) _ BaSO4(s)
B) MgSO4(aq) _ Mg(OH)2(s) _ MgO(s) _MgSO4(aq)
4. A) Kod kojeg(ih) od sljedećih parova će doći do kemijske reakcije?
B) Napiši njihove jednadžbe kemijskih reakcija.
C) Objasni zašto dolazi ili ne dolazi do kemijske reakcije.
A) SO2 i HCl
B) CaO i HNO3
C) BaO i NaOH
D) MgO i KOH
E) P4O10 i CaO
F) N2O5 i H3PO4
5. Izračunajte množinski udio sumporne kiseline u vodenoj otopini, ako je množinska koncentracija sumporne kiseline 15,50 mol L-1, gustoća otopine 1,76 g cm-3, a volumen 1,00 L. M(H2SO4) = 98,03 g mol-1,
M(H2O) = 18,01 g mol-1.
6. Od sljedećih primjera kovalentnih veza odaberi onu koja je:
A) najmanje polarna (najmanji udio ionskog karaktera) i
B) najpolarnija (najveći udio ionskog karaktera).
A) S-Cl
B) S-Br
C) Se-Br
D) Be-F
E) Se-Cl
7. (Zaokruži ispravnu tvrdnju.) Brzina kemijske reakcije
A) ne ovisi o kinetičkoj energiji čestica koje reagiraju,
B) obrnuto je proporcionalna temperaturi na kojoj se reakcija izvodi,
C) ne ovisi o koncentraciji tvari koje reagiraju,
D) proporcionalna je promjeni koncentracije reaktanata ili produkata u jedinici vremena,
8. (Zaokruži ispravnu tvrdnju.) Svi elementi 1. skupine periodnog sustava elemenata
A) imaju po 1 e- u vanjskim p orbitalama
B) tvore molekulske kristale
C) u spojevima imaju oksidacijski broj (-1)
D) se izlučuju tijekom elektrolize taljevina njihovih soli
E) imaju popunjene d orbitale
9. Plinovi A i B međusobno reagiraju prema sljedećoj jednadžbi kemijske reakcije:
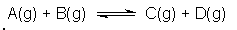
U zatvorenu posudu volumena, V = 2,0 L, stavljeno je 2,0 mola jedinki plinovite tvari A i 2,0 mola jedinki plinovite tvari B pri temperaturi,
T = 458 K. Kolike će biti ravnotežne koncentracije reaktanata i produkata u sustavu ako je koncentracijska konstanta ravnoteže pri toj temperaturi, Kc = 16,0.
10. Poredaj prema smanjenju radijusa jedinke u dolje navedenim skupinama (od najveće do najmanje).
A) Li, Li+, Mg2+, Be2+
B) Na+, Al3+, Na, Mg
C) Na, Na+, Li, K, Li+
D) Sr, Be, Ba, Ca
11. Za svaku od navedenih soli napiši da li joj je vodena otopina kisela, lužnata ili neutralna. Odgovore obrazloži jednadžbama kemijskih reakcija.
A) amonijev klorid
B) natrijev acetat
C) kalijev hidrogenkarbonat
D) natrijev cijanid
12. Reakcijom kalcijevog oksida i otopine natrijevog karbonata moguće je prirediti natrijevu lužinu. Izračunaj masu natrijevog hidroksida koji će nastati reakcijom 250,00 g natrijevog karbonata i 130,00 g kalcijevog oksida u kojem je maseni udio kalcijevog oksida 90 %. Ar(Na) = 22,99, Ar(Ca) = 40,08, Ar(O) = 16,00, Ar(H) = 1,008, Ar(C) = 12,01.
13. Otapanjem srebrovog(I) sulfida u koncentriranoj dušičnoj kiselini nastaje dušikov(IV) oksid, sumpor, sol i voda.
A) Napiši jednadžbu kemijske reakcije i izjednači ju koristeći se parcijalnim redoks jednadžbama.
B) Napiši što je oksidans, a što reducens u ovoj kemijskoj promjeni.
14. Za elektrolitičko izlučivanje 0,1 mola atoma bakra iz vodene otopine bakrovog(II) sulfata potrebna količina elektriciteta je:
A) ista kao i ona potrebna za izlučivanje 0,1 mola atoma Ag iz vodene otopine AgNO3,
B) tri puta manja od one potrebne za izlučivanje 0,1 mola atoma Al iz taljevine AlCl3,
C) ista kao i ona potrebna za izlučivanje 0,05 mola atoma Na iz taljevine NaCl,
D) dva puta manja od one potrebne za izlučivanje 0,1 mola atoma Ag iz vodene otopine AgNO3,
E) ista kao i ona potrebna za izlučivanje 0,2 mola atoma Na iz taljevine NaCl
Zaokruži točan odgovor i prikaži račun za svaki primjer.
15. Reakcijom elementarnog cinka i rompskog sumpora nastaje cinkov(II) sulfid prema sljedećoj reakciji:
Zn(s) + S(s) → ZnS(s)
ΔfH° = -203,000 kJ mol-1.
Izračunaj stehiometrijske mase cinka i sumpora, m(Zn) i m(S), čijom reakcijom je oslobođeno 8750 J topline. Ar(Zn) = 65,37, Ar(S) = 32,02.
16. Vodljiva vrpca naziv je za (zaokruži točnu tvrdnju):
A) energijsko stanje protona u vodikovoj vezi,
B) energijsko stanje iona u ionskoj vezi,
C) popunjenu vrpcu metalne veze,
D) nepopunjene elektronske energijske nivoe metalne veze,
E) zabranjenu zonu metalne veze.
|

