 |
ŽSNK_1999_2 zadaci
1. Istinite tvrdnje su:
A) tricij je teški metal,
B) simbol tricija je Th,
C) atomi različitih elemenata istog masenog broja su izobari,
D) tricij je izotop vodika,
E) vodikova veza po jakosti odgovara kovalentnoj,
F) vodikova veza zahtijeva gušće slaganje molekula vode u ledu nego u tekućoj fazi,
G) molekule vode u ledu su povezane vodikovim vezama,
H) unutar periode periodnog sustava elemenata od 1. do 18. skupine energija ionizacije u načelu opada, kao što opada i pozitivan naboj jezgre,
I) unutar periode periodnog sustava elemenata od 1. do 18. skupine energija ionizacije u načelu raste, kao što raste i pozitivan naboj jezgre.
2. Kristali (izdvoji istinitu tvrdnju):
A) su pravilna geometrijska tijela omeđena ravnim međusobno okomitim ili koso položenim plohama,
B) su periodične trodimenzijske slagaline atoma, iona ili molekula,
C) su svi izrazito tvrdi,
D) su svi neprozirni ako sadrže metal,
E) svi imaju u svim smjerovima ista svojstva.
3. Tlak para vode pri stalnoj temperaturi bit će manji u zatvorenoj boci ispunjenoj vodom do pola nego u onoj ispunjenoj do četvrtine. Da li je ova tvrdnja točna ili netočna. Objasni odgovor.
4. Taljenje leda moguće je postići povećanjem tlaka, stoga je i klizanje po ledu znatno olakšano. Da li je ova tvrdnja točna ili netočna. Objasni odgovor na temelju faznog dijagrama vode (koji ćeš nacrtati).
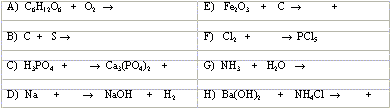
5. Dovrši sljedeće jednadžbe kemijskih reakcija:
6. Element galij, prosječne relativne atomske mase, Ar(Ga) = 69,72, smjesa je dvaju prirodih izotopa 6931Ga i 7131Ga. Relativne atomske mase atoma ovih izotopa su: Ar(6931Ga) = 68,93 i Ar(7131Ga) = 70,93. Izračunajte iz tih podataka množinske udjele galijevih izotopa u prirodnoj izotopnoj smjesi.
7. Izračunaj V(H2O) kojim treba razrijediti 1 200 cm3 vodene otopine KBrO3, masene koncentracije, γ(KBrO3) = 196 g dm-3, da bismo dobili otopinu množinske koncentracije, c(KBrO3) = 0,1 mol dm-3.
8. Zaokruži istinite tvrdnje:
A) prijelaz sola u gel kod protoplazme je reverzibilan,
B) ion Na+ oksidacijom daje elementarni Na,
C) koloidne čestice imaju veliku sposobnost adsorpcije,
D) Ion Na+ ima elektronsku konfiguraciju Ne,
E) ako je proces otapanja soli endoterman onda je ΔHkris..reš. > ΔHhidrat. iona,
F) u zasićenim otopinama proces otapanja prestaje,
G) hidridi 17. skupine su tekućine istog vrelišta,
H) r(Na+) < r(Na),
I) elektronegativnost raste unutar 15. skupine od bizmuta do dušika,
J) otopina ima više vrelište od otapala.
9. U zataljenoj cijevi smjesa je plinova NO2 (g) i N2O4 (g). Jedan od plinova je obojen, a drugi bezbojan. Zagrijavanjem se intenzitet boje pojača, a hlađenjem smanji. Entalpije nastajanja reaktanata u plinovitom stanju, ΔfH, iznose:
ΔfH(NO2) = 33,18 kJ mol-1 i ΔfH(N2O4) = 9,16 kJ mol-1.
A) Izračunajte reakcijsku entalpiju i napišite termokemijsku jednadžbu kemijske reakcije.
B) Koji je plin obojen?
C) Objasnite odgovor pod B.
10. Za doljnju reakciju pri stalnom volumenu sustava, entalpija je negativna. Odredi hoće li koncentracija vodika porasti, smanjiti se ili ostati nepromijenjena, ako se poslije uspostavljanja ravnoteže načini sljedeće:

11. Izračunaj molarnu masu uree, M(urea) = ?, ako otopina saharoze, M(saharoza) = 342,3 g mol-1, koja nastaje otapanjem 0,927 g saharoze u 250 mL vode pokazuje isti osmotski tlak kao i otopina nastala otapanjem 0,327 g uree u 500 mL vode pri istoj temperaturi. Pretpostavi da je volumen otopine jednak volumenu vode.
12. Prikaži strukturne formule sljedećih molekula koristeći se Lewisovom simbolikom: BCl3, AsH3, BeCl2, SF6, HCN. Usput navedi (opiši) i geometriju molekula.
13. Koji od navedenih spojeva ima najniže vrelište: H2O, HCl, HI, HBr i H2? Objasni.
14. Empirijska formula nekog ugljikovodika je CH2. Gustoća ispitivanog ugljikovodika 14 puta je veća od gustoće vodika pri istim uvjetima. Molekulska formula danog ugljikovodika je :
A) CH4
B) C3H8
C) C3H6
D) C2H6
E) C2H4
15. A) Brzina nastajanja kisika je 1,5 · 10-3 mol L-1s-1 u reakciji
2O3(g) → 3O2(g).
Kolika je brzina raspadanja ozona.
B) Dušikov(IV) oksid raspada se brzinom od 6,5 · 10-3 mol L-1s-1 u reakciji
2NO2(g) → 2NO(g) → O2(g).
Kolike su brzine nastajanja produkata?
|

