 |
ŽSNK_2001_2 zadaci
1. Odgovori:
a) Ako je tlak para otapala A pri 20 ˚C 2,33 kPa, a otapala B 10 kPa, između kojih molekula djeluju jače međumolekulske sile?
b) Ako su ΔH i ΔS negativni da li će proces biti spontan pri niskim ili visokim temperaturama?
c) Vrelište čiste vode pri tlaku od 1,01325 bara iznosi 100 ˚C. Otopimo li neku tvar u vodi da li će tlak vodene pare iznad te otopine pri 100 ˚C i tlaku od 1,01325 bara biti viši, niži ili isti kao i onaj iznad čiste vode?
2. Odgovori:
a) Što su površinski aktivne tvari? Navedi primjer.
b) Može li sustav koji se sastoji od dvije komponente imati jednu fazu? Navedi primjer.
c) Objasni da li se pri skrućivanju jednog mola neke tvari oslobodi manje ili više topline nego pri kondenzaciji pare te iste tvari u tekućinu?
3. Odgovori sljedeće:
a) Što u Lewisovom prikazu strukture dušikovog(IV) oksida znače pojedini uporabljeni simboli?
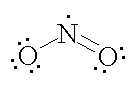
b) Na temelju dane Lewisove strukturne formule sumporovog tetrafluorida predvidi geometriju molekule.
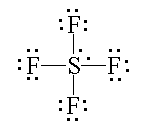
4. Odgovori sljedeće:
a) Ako je standardna entalpija izgaranja grafita -393,5 kJ mol-1, a dijamanta -395,4 kJ mol-1, koja je alotropska modifikacija stabilnija?
b) Odredi predznak ΔSsustav (promjena entropije sustava) kod sljedećih reakcija:
5. Izračunaj entalpiju nastajanja etina (acetilena), C2H2, iz entalpije izgaranja etina i entalpija nastajanja CO2(g) i H2O(l);
ΔcH(C2H2) = -1300 kJ mol-1,
ΔfH(CO2) = -394 kJ mol-1,
ΔfH(H2O) = -286 kJ mol-1.
6. Na temelju kristalne strukture i gustoće natrijevog klorida te ionskog polumjera natrijevog kationa izračunaj ionski polumjer kloridnog iona.
ρ(NaCl) = 2,165 g cm-3, r(Na+) = 95 pm.
7. Najvažnija ruda antimona je stibnit ili antimonit [antimonov(III) sulfid], mineral čelično sive do crne boje koji tvori prekrasne kristale. Antimon iz rude dobivamo redukcijom s elementarnim željezom pri čemu nastaje željezov(II) sulfid. Elementarni antimon je krt polumetal srebrno sive boje. Pri smrzavanju se širi te ga stoga koristimo u leguri s olovom i kositrom (82 % Pb, 15 % Sb i 3 % Sn) za dobivanje oštrih otisaka kalupa.
M(Sb) = 121,75 g mol-1, M(S) = 32,064 g mol-1, M(Fe) = 55,847 g mol-1
a) Napiši jednadžbu kemijske reakcije dobivanja antimona iz antimonita (obvezno navedi agregacijska stanja reaktanata i produkata).
b) Koliko antimona (u gramima) je moguće dobiti iz 42,9692 grama rude koja sadrži 90,00 % antimonita i 8,3771 grama elementarnog željeza?
c) Napiši jednadžbu gorenja antimona u kisiku (obvezno navedi agregacijska stanja reaktanata i produkata).
8. Zasićena vodena otopina kalijevog nitrata pri 15 ˚C filtriranjem je odvojena od neotopljenih kristala. U porculansku zdjelicu mase 20,43 g stavljena je određena količine te otopine. Masa zdjelice i otopine iznosila je 84,14 g. Nakon isparavanja vode masa zdjelice i kristala iznosila je 34,14 g. Izračunaj topljivost KNO3 u vodi pri 15 ˚C te maseni i množinski udio KNO3 u otopini.
9. Koliko molekula vode i etanola ima u 50 g smjese etanola i vode kojoj je maseni udio etanola u toj otopini 96 %?
10. Kolika je množinska koncentracija (u mol dm-3) otopine HCl
(w = 36,6 % i ρ = 1,18 g cm-3)?
11. Osmotski tlak neke otopine proteina iznosi 1603 Pa pri 25 ˚C. Masena koncentracija proteina je 40 g dm-3. Izračunaj približnu vrijednost molarne mase proteina.
12. Izračunaj gustoću zraka (u g m-3) pri 30 ˚C i 110 kPa. Radi jednostavnosti uzmi da se zrak sastoji samo od dušika i kisika i da su im volumni udjeli φ(N2) = 0,79 i φ(O2) = 0,21.
13. Zaokruži slovo ispred jednadžbe kemijske reakcije u kojoj se povećanjem temperature ravnoteža pomiče prema produktima, a promjena tlaka ne utječe na ravnotežu.
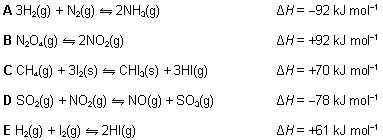
14. Plinoviti bromov klorid (BrCl) raspada se na brom i klor.
a) Napiši jednadžbu kemijske promjene (obvezno navedi agregacijska stanja reaktanata i produkata).
b) Konstanta ravnoteže pri 500 K iznosi Kc = 32. kolika je ravnotežna koncentracija bromovog klorida ukoliko je njegova početna koncentracija , c(BrCl) = 3,30 mmol L-1?
15. Dodatak MnO2 u otopinu vodikovog peroksida uzrokuje razvijanje kisika. Mjerenjem volumena razvijenog kisika dobiveni su sljedeći podaci:
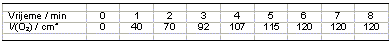
a) Objasni ulogu manganova(IV) oksida.
c) Koliki je konačni volumen razvijenog plina?
d) Zašto se volumen ne mijenja nakon šeste minute?
e) Ubrzava li se ili usporava reakcija tijekom kemijske promjene?
f) Promjena kojih intenzivnih veličina može zaustaviti reakciju?
b) Nacrtaj dijagram ovisnosti volumena plina o vremenu.
|

