 |
DSNK_2000_3 zadaci
1. Kemijskom analizom plinovitog uzorka spoja ustanovljeno je da se sastoji od silicija, w(Si) = 0,330, i fluora, w(F) = 0,670. Uzorak spoja mase 2,38 g ima volumen od 0,210 cm3 pri temperaturi od 35 ˚C i tlaku od 1,70 atm.
a) Izračunaj empirijsku formulu spoja
b) Izračunaj molarnu masu spoja
c) Odredi molekulsku formulu spoja
2. Svakim udahom čovjek udahne približno 2,4 ∙ 1022 molekula dušika. Koja je to masa dušika?
3. Silicij ima strukturu dijamanta. Svaka jedinična ćelija sadrži 8 atoma, a brid joj iznosi 543 pm. Kao onečišćenje u šupljine između atoma silicija ušli su atomi bora, u brojnosti od 1,0 ∙ 1013 atoma bora po kubičnom centimetru uzorka. Zadovoljava li ovaj uzorak čistoću od 10-9 atoma bora po atomu silicija?
4. Iz navedenih veličina izračunaj afinitet atoma klora prema elektronu.
Energija kristalne rešetke RbCl(c),
ΔLHm -665 kJ mol-1
Energija disocijacije Cl2(g),
Edis 226 kJ mol-1
Entalpija sublimacije Rb(s),
ΔsubHm 84 kJ mol-1
Energija ionizacije Rb(g),
Ii 397 kJ mol-1
Standardna molarna entalpija nastajanja RbCl(c),
ΔfHm -439 kJ mol-1
5. Klasificiraj sljedeće okside kao kisele, bazične ili amfoterne:
a) K2O
b) BeO
c) As2O5
Svoj odgovor obrazloži pripadajućim jednadžbama kemijske reakcije.
6. Da li je valentni kut veći u molekuli H2O ili u H3O+ ionu? Svoj odgovor obrazložite na temelju VSEPR teorije i potkrijepite ga crtežom.
7. Tvar A, element 15. skupine periodnog sustava elemenata, tvori crvenkaste kristale. Kristali su netopljivi u vodi i u lužinama. Njihovim zagrijavanjem s koncentriranom dušičnom kiselinom nastaje tvar B. Zagrijavanjem, bilo u kisiku, bilo u kloru, tvar A izgara i daje gusti bijeli dim, koji je u oba slučaja topljiv u vodi, a nastale otopine su kisele. U oba slučaja nastaje ista kiselina.
a) Identificiraj tvari A i B.
b) Napiši jednadžbe kemijskih reakcija spomenutih kemijskih promjena.
8. Za proces opisan slikom napiši kakva je promjena (< 0, > 0 ili = 0):
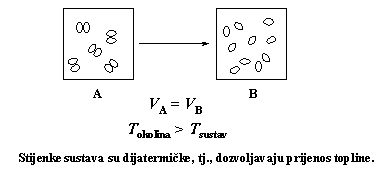
a) wsustava
b) Qsustava
c) ΔSokoline
Obrazloži svoje odgovore.
9. a) Opišite jednadžbama kemijskih reakcija što se događa pri uvođenju ugljikovog(IV) oksida u hladnu koncentriranu vodenu otopinu kalijevog hidroksida.
b) Napišite jednadžbe kemijskih reakcija koje pokazuju kako biste na taj način priredili kruti kalijev karbonat. Objasnite svoj odgovor.
10. Aluminij se dobiva iz boksita - hidratiziranog aluminjeva oksida - koji kao nečistoće sadrži željezov(III) i silicijev(IV) oksid. Na kojem se svojstvu aluminijevog oksida temelji njegovo pročišćavanje. Odgovor potkrijepite jednadžbom kemijske reakcije.
11. a) Prikažite jednadžbom kemijske reakcije potpuno izgaranje grafita.
b) Izračunajte promjenu standardne Gibbsove energije pri stvaranju 50 g ugljikovog(IV) oksida [ΔfG˚(CO2) = -394,4 kJ mol-1].
c) Da li je proces spontan i zašto?
12. Neki spoj ima empirijsku formulu MO2. Kako biste odredili da li je riječ o oksidu, peroksidu ili superoksidu? (Uvjet je da ne smijete odrediti identitet iona metala!)
13. Termička disocijacija fosgena odvija se prema jednadžbi:
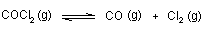
Pri 400 ˚C i tlaku od 1 bara u ravnoteži je nađeno 2,2 g fosgena u posudi volumena 1500 cm3. Izračunaj konstanu ravnoteže Kp.
14. Predvidi produkte sljedećih kemijskih promjena i izjednači jednadžbe kemijskih reakcija. Ukoliko u reakciji sudjeluju samo neki ioni, napiši reakciju u ionskom obliku. Svrstaj reakciju kao taložnu, kiselo-baznu ili redoks reakciju. (Obvezno označite stanja produktata.)
a) H3PO4(aq) + KOH(aq) →
Reakcija je:
b) C4H8O(l) + O2(g) →
Reakcija je:
c) Mg(s) + HBr(aq) →
Reakcija je:
d) Pb(NO3)2(aq) + (NH4)2S(aq) →
Reakcija je:
e) Ag(s) + HCl(aq) →
Reakcija je:
f) Ni(s) + HCl(aq) →
Reakcija je:
g) AgNO3(aq) + CH3COOK(aq) →
Reakcija je:
|

