 |
DSNK_2001_2 zadaci (1)
1. U kojoj od sljedećih jednadžbi je sumporna kiselina oksidans? Zaokruži slovo ispred te jednadžbe.
A H2SO4 + 2NaOH → Na2SO4 + 2H2O
B H2SO4 + SO3 → H2S2O7
C H2SO4 + H2O → H3O+ + HSO4-
D 2H2SO4 + Cu → CuSO4 + SO2 + 2H2O
E H2SO4 + 2NH3 → (NH4)2SO4
2. Napiši Lewisove strukturne formule:
a) sumporne kiseline
b) dihidrogen fosfatnog iona
c) amonijevog iona
3. Pomiješano je 20 mL alkohola (t = 20 ˚C) i 20 mL H2O (t = 20 ˚C). Koliki je volumen otopine? Zaokruži slovo ispred točnog odgovora.
A 40 mL
B < 40 mL
C > 40 mL
D 20 mL
4. Priređna vodena otopina klorovodične kiseline imala je pH = 2. Potom je razrijeđena tisuću puta, pa još tisuću puta i još tisuću puta. Koliki je pH nakon svakog razrjeđivanja?
pH(1) = _______
pH(2) = _______
pH(3) = _______
5. Tri su tikvice ispunjene različitim plinovima. Kako biste utvrdili u kojoj je kisik, u kojoj ugljikov dioksid, a u kojoj dušikov monoksid?
6. Izjednačite sljedeću jednadžbu kemijske reakcije ion-elektron metodom (parcijalnim jednadžbama):
H2O2 + KMnO4 + H2SO4 → K2SO4 + H2O + MnSO4 + O2
7. Na temelju sljedećih termokemijskih jednadžbi:

izračunaj reakcijsku entalpiju sljedeće kemijske reakcije:

8. Kolika je konstanta ravnoteže kemijske promjene
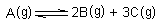
ako je pri temperaturi od 423 K 8,5 % čestica A disociralo?
K = _______
9. Plinska smjesa sačinjena od 1 L nepoznatog plina i 2 L kisika dovedena je do eksplozije. U reakciji su nastale 2 L ugljikovog(IV) oksida i 1 L dušika, mjereno pri istim uvjetima. Napiši molekulsku formulu nepoznatog plina.
Molekulska formula je _________
10. Uzorak smjese natrijevog klorida i natrijevog hidroksida, mase 0,4697 g otopljen je u vodi i neutraliziran vodenom otopinom klorovodične kiseline koncentracije 0,09897 mol L-1. Za neutralizaciju je potrošeno 20,36 mL otopine kiseline. Koliki je maseni udio natrijevog hidroksida u smjesi.
w(NaOH) = _________
11. Plinove, netopljive u vodi, obično sakupljamo u epruvete, tikvice ili menzure potpuno ispunjene vodom koje stoje u pneumatskim kadama otvorima okrenutim prema dolje. Opišite i objasnite kako biste epruvetu ispunjenu s vodom uronili u pneumatsku kadu, a da pri tome u nju ne uđe zrak. PRI TOME NE SMIJETE SMOČITI RUKE NITI EPRUVETU ZAČEPITI ČEPOM! Na raspolaganju imate komadić tkanine, komadić papira, jaki magnet, flomaster, šestar i lopticu za stolni tenis.
12. Na temelju zadanih podataka nacrtaj dijagram topljivosti navedenih spojeva. Topljivosti su dane kao mase soli koje je moguće otopiti u 100 grama vode pri odgovarajućoj temperaturi.
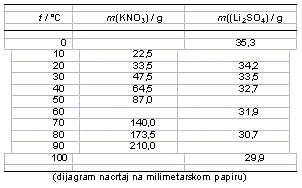
a) Pri kojoj temperaturi su topljivosti soli jednake?
Topljivosti su jednake pri ___________.
b) Kako biste izdvojili čisti litijev sulfat iz smjese s kalijevim nitratom? Sastav smjese je 42 grama litijevog sulfata i 42 grama kalijevog nitrata.
13. Gradski plin je pretežno metan, CH4. Počnemo li u većoj čaši zagrijavati vodu plinskim plamenikom na vanjskoj stijenci čaše pojaviti će se tanki sloj tekućine i zamagliti čašu. Daljnjim grijanjem sloj tekućine će nestati.
a) Koji je kemijski sastav te tekućine?
b) Odkud ta tekućina?
c) Zašto tekućina nestaje.
d) Napiši jednadžbu kemijske reakcije ukoliko smatraš da tekućina nastaje nekom kemijskom reakcijom.
14. Otopinom koja sadrži niklove(II) ione prolazila je struja jakosti 2,0 ampera tijekom točno 2 sata. Izračunaj masu nikla izlučenog na elektrodi.
m(Ni) = ____________
|

