 |
DSNK_2001_1 zadaci
1. Djelovanjem kiselih kiša u prirodi na stijene od kalcijevog karbonata nastati će:
A CaSO4(H2O)2
B CaCO3(H2O)
C CuSO4(H2O)5
D PbSO4
2. Zaokruži ispravnu formulu dušične kiseline napisanu Lewisovom simbolikom:
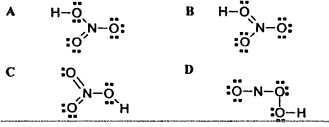
3. Protoni u nekom atomu ne određuju:
A vrstu atoma
B atomsku masu
C položaj u periodnom sustavu
D naboj jezgre
E kemijska svojstva
Zaokruži slovo ispred ispravne tvrdnje.
4. Koliko ima orbitala u sljedećim podljuskama:
A 2p ______
B 4d ______
C 2d ______
D 3s ______
E 5f ______
5. Relativna atomska masa elementa je omjer prosječne mase atoma i:
A 12 g atoma nuklida 12C
B 1/12 mase atoma nuklida 12C
C 1 g atoma nuklida 12C
D unificirane atomske jedinice mase
E 120 g atoma nuklida 12C
F 10 g atoma nuklida 12C
Zaokruži slovo ispred ispravne(ih) definicije(a).
6. Provjeri koje su od niže navedenih reakcija napisane kao ispravne jednadžbe i zaokruži slovo ispred neispravno napisanih jednadžbi:
A 2S + 3O2 → 2SO3
B 8Al + 3NaNO3 + 5NaOH + 2H2O → 8NaAlO2 + 3NH3
C C3H8 + 6O2 → 3CO2 + 4H2O
D CH4O + O2 → CO2 + H2O
E CaO + 2HCl → CaCl2 + H2O
F Mg3N2 + 2H2O → 3Mg(OH)2 + 3NH3
7. Srednja udaljenost Mjeseca od Zemlje iznosi 384 000 km. Izračunaj masu (u mg) uranija (urana) u kojoj ima toliko atoma da bi nanizani jedan do drugoga činili lanac duljine 384 000 km. Polumjer jednog atoma uranija iznosi 152 pm.
8. Nadopuni rečenice:
A Čvrste tvari u prirodi dolaze kao _____________ i ____________.
B Tvari koje kristaliziraju po tipu dijamanta odlikuju se __________ tvrdoćom.
C Elementarna ćelija plošno centrirane kocke sadrži ________ atoma.
D Privlačne sile između iona u kristalu su ___________ prirode.
E Plemeniti plinovi kristaliziraju kao ______________ kristali.
F U kubičnoj rešetki broj elementarnih ćelija koje dijele atom u sredini plohe je _____.
9. Na osnovi opisa svojstava razvrstajte nabrojene tvari u tvari s metalnom, ionskom, molekulskom,
odnosno kovalentnom kristalnom rešetkom:
A Svijetložuta krutina, tali se pri 119 oC u svijetložutu tekućinu, a vrije pri 444,6 oC. Ne provodi elektricitet ni u krutom ni u rastaljenom stanju.
B Srebrnobijela tekućina, skrutne se pri -39 oC, a vrije pri 357 oC. Provodi elektricitet i u krutom i u rastaljenom stanju.
C Crvenosmeđa tekućina, skrutne se pri -7 oC, a vrije pri 59 oC. Pare su također crvenosmeđe boje. Ne provodi elektricitet ni u krutom ni u tekućem stanju.
D Bezbojni prozirni kristali koji pri 800 oC prelaze taljenjem u prozirnu tekućinu. Kristali ne provode, ali taljevina dobro provodi elektricitet.
A ________________ C ________________
B ________________ D ________________
10. Napišite:
A elektronsku konfiguraciju atoma Fe i iona Fe2+ i Fe3+
B Koji je ion stabilniji?
C Poredaj ione po porastu polumjera.
A Fe _______________________________
Fe2+ _______________________________
Fe3+ _______________________________
B _________
C _________________
11. U sljedećoj tablici napiši koje su tvari: elementarne tvari, spojevi, homogene ili heterogene smjese tvari.

12. Prikaži prostorni izgled molekula S8, P4 i BCl3.
13. Kolika je gustoća (u g/cm3) kroma ako njegovoj kubičnoj elementarnoj ćeliji sa stranicom a = 288,5 pm pripadaju 2 atoma?
14. Napiši koja vrsta kemijske veze među atomima postoji u sljedećim spojevima:
KBr, ClO2, CaCl2, NO, Al2(SO4)3, NCl2, Co(ClO4)2 i PCl3
Ionska veza______________________________
Kovalentna veza___________________________
Ionska i kovalentna veza____________________
15. Zaokruži točnu(e) tvrdnju(e):
A Amorfne tvari imaju pravilnu unutarnju građu i određeno talište.
B Kristali mogu biti ionski, molekulski i atomski.
C Talište tvari ionske strukture je to više što je udaljenost između iona i njihov nabojni broj veći.
D Staklo ima kristalnu strukturu.
E Kalavost je svojstvo ionskih kristala.
16. Kolika je masa uzorka srebra koji sadrži isti broj atoma koliko ih ima uzorak magnezija mase 33,52 g?
17. Potpunim sagorijevanjem 2,66 g neke tvari nastaje 1,54 g ugljikovog(IV) oksida i 4,48 g sumporovogIV) oksida.
A Odredi formule nepoznate tvari.
B Napiši kemijsku reakciju nastajanja tog spoja.
18. Naboj jednog mola elektrona približno iznosi:
A 1,6 ∙ 10-19 C
B 9,649 ∙ 103 C
C 6,022 ∙ 10-23 C
D 9,649 ∙ 104 C
19. Zaokružite točne tvrdnje:
A Voda je jedina tekućina koja pri talištu nema najveću gustoću.
B Zbog slabe vodikove veze voda ima relativno nisko talište i vrelište.
C Londonove privlačne sile su najjača međumolekulska privlačenja.
D Dipolne molekule su one kojima se središta pozitivnog i negativnog naboja ne poklapaju.
E Metalna veza je elektrostatske prirode.
20. Napišite jednadžbe koje prikazuju:
A sintezu olovnog(II) jodida
B termički raspad natrijevog hidrogenkarbonata
C reakciju magnezija s solnom (klorovodičnom) kiselinom
D reakciju natrija s vodom
E reakciju sumporaste kiseline i kalcijevog karbonata
21.
A Zaokruži slovo ispred simbola atoma ili iona koji ima istu elektronsku konfiguraciju kao ion Ge2+
A Ca2+ B Ca C Se2-
D Sn2+ E Cu2+ F Zn
B Napiši elektronsku konfiguraciju odabranog atoma ili iona. |

