Izvođenje pokusa
U epruvete smještene na stalku ulijemo redom destiliranu vodu,
vodovodnu vodu, bunarsku vodu, ekstrakt vegete, ekstrakt sušenog
mesa i sredstvo za čišćenje. Otopinu vegete načinimo tako da u čaši
pomiješamo vegetu i destiliranu vodu te smjesu filtriramo. Isti
postupak ponovimo i sa sušenim mesom. U svaku epruvetu dodamo 2-3
kapi reagensa srebrovog nitrata, AgNO3. Nakon toga u
jednu od epruveta u kojoj je došlo do promjene dodamo nekoliko mililitara
vodene otopine amonijaka.
Za kvantitativni dio analize u menzuri odmjerimo 50 mL uzorka i
prenesemo u Erlenmeyerovu tikvicu. Izmjerimo pH-vrijednost otopine.
Pipetom u tikvicu otpipetiramo 0,5 mL indikatora kalijevog kromata,
K2CrO4. Zatim dodajemo kap po kap srebrov
nitrat sve dok boja otopine u tikvici ne prijeđe iz žutobijele u
crvenosmeđu. Titraciju ponovimo još dva puta i za daljni račun uzima
se srednji utrošak AgNO3.
Opažanja i rezultati
U svim epruvetama, osim u onoj koja sadrži destiliranu vodu, došlo
je do promjene. Nastao je bijeli sirasti talog ili bijelo zamućenje
(nakon kraćeg vremena dolazi do taloženja) od srebrovog klorida,
AgCl. Time je dokazano da su u navedenim otopinama prisutni kloridni
ioni, Cl-. Jednadžba kemijske reakcije :
Ag+(aq) + Cl-(aq)
Á AgCl (s)
Nastali talog srebrovog klorida dobro je topljiv u vodenoj otopini
amonijaka. Otapanje prikazuje jednadžba :
AgCl (s) + 2NH3 (aq) Á [ Ag(NH3)2]
+(aq) + Cl-(aq)
Masa klorida se određuje Mohrovom metodom koja spada u taložne
titracije. One se temelje na reakcijama stvaranja teško
topljivih taloga uz uvijete da je reakcija taloženja brza i da postoji
indikator koji točno pokazuje završetak titracije. Najčešće korištena
taložna titracija je argentometrija koja je dobila naziv prema srebrovom
nitratu, AgNO3.
Mohrovom metodom se određuju kloridi i bromidi otopinom AgNO3.
Točka završetka titracije se utvrđuje pomoću indikatora kalijevog
kromata, K2CrO4. U blizini točke ekvivalencije
prva suvišna kap AgNO3 stvara s indikatorom crvenosmeđi
talog srebrovog kromata prema jednadžbi :
2Ag+(aq) + CrO42-
Á Ag2CrO4 (s)
Prema tome, u analitu se nalaze dva različita aniona, Cl-
i CrO42- koji reagiraju s kationima srebra,
Ag+. Pri tome nastaju teškotopljivi talozi, ali ipak
različite topljivosti u vodi. Iz konstanti produkata topljivosti
srebrovog klorida, Kpt(AgCl) = 1,56 ˇ 10-10
mol2L-2 i srebrovog kromata, Kpt(Ag2CrO4)
= 9,0 ˇ 10-12 mol3L-3 vidi se da
je srebrov kromat lakše topljiv od srebrovog klorida. To znači da
će u otopini u tikvici najprije nastati talog manje topljivosti,
a zatim talog veće topljivosti. U ovom slučaju najprije nastaje
AgCl.
Do točke ekvivalencije se taloži bijeli AgCl, a kad se sav AgCl
istaloži, suvišak otopine AgNO3 taloži crvenosmeđi Ag2CrO4
čime titracija završava. Mohrova metoda se primjenjuje u neutralnom
ili blago bazičnom mediju jer u kiselom mediju ion CrO42-
prelazi u ion Cr2O72- prema reakciji
:
2CrO42- + 2H+ Á
Cr2O72- + H2O
te se u jako bazičnome mediju može istaložiti smeđi srebrov oksid
prema jednadžbi :
2Ag+ + 2OH- Á 2AgOH (s)
2AgOH (s) Á Ag2O (s)
+ H2O
Tijek ove titracije može se prikazati i grafički.
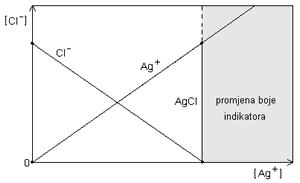
Iz jednadžbe taloženja slijedi omjer množina reaktanata :
Ag+ + Cl- Á AgCl (s)
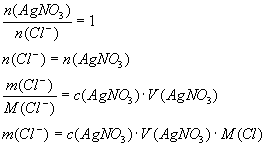
Za titraciju 50 mL vodovodne vode utrošena su tri volumena AgNO3
koncentracije 0,1 mol / L.
V1(AgNO3) = 0,23 mL
V2(AgNO3) = 0,23 mL
V3(AgNO3) = 0,25 mL
Srednji volumen iznosi :
V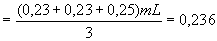 mL mL
Vs = 0,236 × 10-3 L
Masa klorida u 50 mL uzorka je :
m50(Cl-) = c(AgNO3) × Vs(AgNO3)
× M(Cl)
= 0,1 mol / L × 0,236 × 10-3 L × 35,45 g / mol
= 8,36 × 10-4 g
= 0,836 mg
Masa klorida u 1 L uzorka vode je :
m1000(Cl-) = 0,836 mg × 20
m1000(Cl-) = 16,72 mg / L
Voda za piće može sadržavati kloride (NaCl, CaCl2 i
MgCl2) u količini od 10 do 25 mg / L. Količina klorida
u ispitivanom uzorku je unutar ovih granica. Voda koja sadrži kloride
izaziva koroziju cijevi i kotlova pa ispitivanje sadržaja klorida
u vodi ima i tehnološko značenje.
|