|
 |
|
molim vas da mi objasnite pojam pozitivne i negativne kooperativnosti te Michaelis- Mentenov graf iste
|
|
Ime i prezime:
Jelena Perak
j.perak@mail.inet.hr
|
 |
 |
(nastavak odgovora 523)
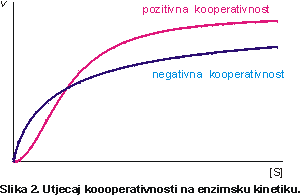
Homeotropni efekt može biti ostvaren na taj način da se na enzimu s više aktivnih mjesta (enzim sadrži nekoliko istovrsnih katalitičkih podjedinica) molekula efektora-substrata veže na jedno aktivno mjesto i promjeni afinitet cijelog enzima prema substratu. To se naziva koperativnost jer podjedinice surađuju, a pozitivna je ili negativna prema tome raste li ili pada afinitet s povećanjem koncentracije substrata.
Prikaže li se ovisnost brzine reakcije za jednosubstratni nekooperativni enzim, v=-ds/dt, o koncentraciji substrata, uz još nekoliko uvijeta o kojima neću sada, dobije se karakteristična hiperbola opisana jednadžbom Michaelis-Menten (Leonor Michaelis i Maude Leonora Menten, 1913.):

V - granična brzina
v - brzina reakcije
[S] - koncentracija substrata
Km - Michaelisova konstanta
Michaelisova konstanta mjera je katalitičke moći enzima, povezana i s afinitetom prema substratu. Predstavlja koncentraciju substrata pri kojoj je brzina enzimski katalizirane reakcije jednaka polovici granične (maksimalne). Višesubstratni nekooperativni enzim ponaša se jednako, ali izraz je nešto kompliciraniji.
Za kooperativne enzime ova jednadžba ne vrijedi. Stoga nema smisla govoriti o Michaelisovoj konstanti budući da ne postoji (iako se to često može naći u biokemijskim udžbenicima). U slučaju pozitivnog efekta funkcija v([S]) opisuje sigmoidalu. Krivulja za negativni efekt počinje strmije i nastavlja se uz blaži nagib, ali općenito je vrlo slična nekooperativnoj hiperboli i eksperimentalno ih se teško razlučuje.
Sve za danas. Zdravo! |
|
|
Odgovorio:
Kristijan A. Kovač
kkovac@chem.pmf.hr
<-- Povratak
|
|

|
Postavite
pitanje iz bilo kojeg područja kemije i
e-škola će osigurati da dobijete odgovor od kompetentnog znanstvenika. |
  |
|

