|
 |
|
Molim Vas, voleo bih da konacno razresim dilemu o sledecem pitanju. Kakva je razlika izmedju elektronegativnosti i afiniteta prema elektronu? Obe jedinice pretstavljaju teznju atoma elementa ka elektronima...
P.S. Negde sam na Vasem sajtu davno nasao kako se izracunava elektronegativnost, ali ne mogu vise... Ako ste raspolozeni da napisete.
Hvala unapred i veliki pozdrav
|
|
Ime i prezime:
Dusan Kolarski
d.kolarski@gmail.com
|
 |
 |
Elektronski afinitet (Ea) je energija potrebna da se jednostruko negativno nabijenom ionu oduzme jedan elektron, tj. energija procesa X- --> X + e- (često se navodi da je to energija koja se oslobodi kada se neutralnom atomu doda jedan elektron, što je samo drugi način da se kaže ista stvar).
Elektronegativnost (x) se može definirati na više načina. Najjednostavnija je Mullikenova definicija prema kojoj je elektronegativnost nekog atoma srednja vrijednost elektronskog afiniteta i energije ionizacije za taj atom (dakle x(A) = (Ea(A) + Ei)(A)/2). Češće se ipak rabi Paulingova relativna elektronegativnost koja je definirana preko jakosti veza po formuli
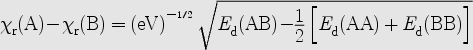 . .
Gorenavedeni izraz definira razlike elektronegativnosti, a ne apsolutne vrijednosti, poradi čega je potrebno "učvrstiti" barem jednu točku na skali. To je riješeno tako da je vodiku dodijeljena relativna elektronegativnost od 2,1.
Paulingova definicija pokazuje bitno svojstvo elektronegativnosti: ona ima smisla jedino kada se govori o atomima koji su povezani. Elektronski afinitet, tomu nasuprot, svojstvo je izoliranog atoma i ne govori nam puno o ponašanju atoma u kemijskoj vezi.
Pozdrav. |
|
|
Odgovorio:
Vladimir Stilinović
vstilinovic@chem.pmf.hr
<-- Povratak
|
|

|
Postavite
pitanje iz bilo kojeg područja kemije i
e-škola će osigurati da dobijete odgovor od kompetentnog znanstvenika. |
  |
|

