|
 |
|
Pomozite mi molim vas s ovim zadatkom,jer prvi put čujem za ovo: Konstanta ravnoteže za za reakciju N2O4(g)-2NO2(g) pri 50 stupnjeva celzija iznosi Kp=664 mmHg.Tlak plinske smjese iznosi 498 mmHg.Koliko je posto dimernih molekula dušikova(IV)oksida disociralo?(1 mmHg=133,32 Pa)
|
|
Ime i prezime:
Darjan Petrić
darjan.petric@zg.hnet.hr
|
 |
 |
Postavimo zadatak
jednadžba reakcije: N2O4(g) <=> 2NO2(g)
temperatura: t = 50 °C
plinska konstanta ravnoteže: Kp = 664 mmHg
ukupan tlak: p = 498 mmHg
traži se: udio disociranih molekula (stupanj disocijacije)
1) plinska konstantaravnoteže za gornju reakciju:
a)
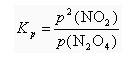
p(NO2), p(N2O4) – tlakovi komponenti u ravnoteži
2) ukupan tlak plinske smjese jednak je zbroju parcijalnih tlakova svih sastojaka smjese:
b)
p = p(N2O4) + p(NO2)
3) stupanj disocijacije α je omjer broja disociranih molekula prema ukupnom broju molekula prije disocijacije (kao da je reakcija započeta s čistim N2O4)
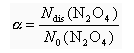
Ndis(N2O4) – broj disociranih molekula
N0(N2O4) – broj molekula prije disocijacije
N(N2O4), N(NO2) – broj molekula u stanju ravnoteže
još nešto:
- jedna molekula N2O4 disocira u dvije molekule NO2 pa je Ndis(N2O4) = ½ N(NO2)
- ukupan broj molekula prije disocijacije zbroj je disociranih i nedisociranih molekula: N0(N2O4) = Ndis(N2O4) + N(N2O4)
- broj molekula u plinu zatvorenom u isti volumen (N2O4 i NO2 se nalaze u istoj posudi) proporcionalan je tlaku pa ćemo brojnost zamijeniti tlakom
c)
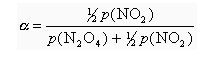
Ovo je sustav s tri jednadžbe (a, b, c) s tri nepoznanice, znači da se može riješiti. Tlakove ne moraš preračunavati u pascale jer će se jedinice ionako pokratiti.
|
|
|
Odgovorio:
Kristijan A. Kovač
kkovac@chem.pmf.hr
<-- Povratak
|
|

|
Postavite
pitanje iz bilo kojeg područja kemije i
e-škola će osigurati da dobijete odgovor od kompetentnog znanstvenika. |
  |
|

