|
 |
|
ZANIMA ME SVE O IONSKOM PRODUKTU VODE TJ, IZVOD,KONSTANTA DISOCIJACIJE VODE I PH.AKO MOZETE,ODGOVORITE ODMAH,HITNO JE
|
|
Ime i prezime:
Nikolina Čargonja
nina_07@net.hr
|
 |
 |
Za početak ćemo napisati konstantu ravnoteže za slijedeću reakciju:
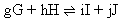 i uzmimo da su reaktanti i produkti otopljeni u nekom otapalu. Tada će konstanta ravnoteže glasiti: i uzmimo da su reaktanti i produkti otopljeni u nekom otapalu. Tada će konstanta ravnoteže glasiti:
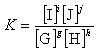 Uglate zagrade simboliziraju ravnotežne koncentracije. Npr. reakcija Uglate zagrade simboliziraju ravnotežne koncentracije. Npr. reakcija
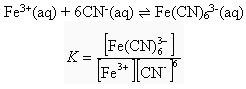 Prema tome za ionizacijsku reakciju vode Prema tome za ionizacijsku reakciju vode
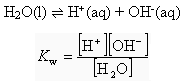 što je potpuno pogrešno. H+ i OH- su otopljeni, ali voda je otapalo, a ne otopljena tvar. S njom postupamo drugačije – u konstantama pišemo množinski (količinski) udio: što je potpuno pogrešno. H+ i OH- su otopljeni, ali voda je otapalo, a ne otopljena tvar. S njom postupamo drugačije – u konstantama pišemo množinski (količinski) udio:
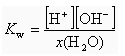 S obzirom da je voda gotovo čista (udio H+ i OH- je zanemariv), množinski udio vode je vrlo blizu 1 pa se njegov utjecaj može zanemariti: S obzirom da je voda gotovo čista (udio H+ i OH- je zanemariv), množinski udio vode je vrlo blizu 1 pa se njegov utjecaj može zanemariti:
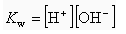 Ovakve konstante ravnoteže, kada samo množimo koncentracije iona u otopini, zovemo ionskim produktima. Ovakve konstante ravnoteže, kada samo množimo koncentracije iona u otopini, zovemo ionskim produktima.
Izvod bi bio mnogo zgodniji kad bismo radili s aktivitetima, a ne koncentracijama jer je tada očito zašto umjesto koncentracije vode rabimo množinski udio. Ali pretpostavljam da ne spominjete aktivitete u nastavi kemije.
Još jedan primjer:
Nakon što je otopljen u vodi ugljikov dioksid reagira s vodom i nastaje ugljična kiselina:
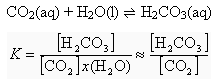 I nešto o pH. I nešto o pH.
Potpuno čista voda je neutralna što znači da sadrži potpuno jednako H+ i OH- iona. Kad se taj omjer poremeti otopina postaje kisela ili lužnata. Vrijednost ionskog produkta vode je vrlo niska, pri 25 °C svega 10-14 mol2 dm-6. Koncentracija H+ iona tada je 10-7 mol dm-3. Dodatkom kiseline koncentracija može porasti deset, stotinu ili milijun puta, i isto tako pasti dodavanjem lužine. Kako ne bi morao računati s tako nezgodnim brojevima danski kemičar Sorensen uveo je još 1909. logaritamsku ljestvicu prema kojoj je pH nekakva mjera za kiselost (ili lužnatost)
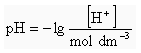 Prema tome je pH čiste vode pri 25 °C Prema tome je pH čiste vode pri 25 °C
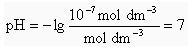 Ovo je povijesna definicija. Ubrzo je koncentracija vodikovih iona zamijenjena aktivitetom: Ovo je povijesna definicija. Ubrzo je koncentracija vodikovih iona zamijenjena aktivitetom:
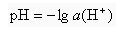 Koncentracijski definiran pH ponekad se označava kao p[H]. Indikatorima ili instrumentima određuje se aktivitetni pH. U vrlo razrijeđenim otopinama pH i p[H] su približno jednaki. Ako je koncentracija otopljenih tvari veća (recimo veća od 0,01 mol dm-3), odstupanja mogu biti prilično velika. Koncentracijski definiran pH ponekad se označava kao p[H]. Indikatorima ili instrumentima određuje se aktivitetni pH. U vrlo razrijeđenim otopinama pH i p[H] su približno jednaki. Ako je koncentracija otopljenih tvari veća (recimo veća od 0,01 mol dm-3), odstupanja mogu biti prilično velika. |
|
|
Odgovorio:
Kristijan A. Kovač
kkovac@chem.pmf.hr
<-- Povratak
|
|

|
Postavite
pitanje iz bilo kojeg područja kemije i
e-škola će osigurati da dobijete odgovor od kompetentnog znanstvenika. |
  |
|

