|
 |
|
Molim Vas možete li mi napisati disocijaciju najpoznatijih kiselina? Unaprijed hvala.
|
|
Ime i prezime:
Alojz Kipšić
alojz.kipsic@sb.hinet.hr
|
 |
 |
To ne bi trebalo biti teško. Zadržimo se na osnovnoj, Arrheniusovoj definiciji kiseline. Po njemu je kiselina tvar koja u vodi povećava koncentraciju H+ iona. Općenito:
HA(aq) <=> H+(aq) + A-(aq) Što je ravnoteža više pomaknuta desno, kiselina je jača. U vodi nikada nemamo slobodne H+ ione. Oni su uvijek povezani s molekulama vode u vodikov ion H3O+ (oksonijev ion) pa je kisela reakcija zapravo prijelaz H+ s kiseline na vodu:
HA(aq) + H2O(l) <=> H3O+(aq) + A-(aq) Dalje ćemo pisati na jednostavniji način koristeći H+.
Kiseline koje najčešće susrećemo možemo svrstati u dvije skupine. Prva skupina obuhvaća binarne kiseline. Molekula binarne kiseline (prije nego je otopljena u vodi) sastoji se od jednog središnjeg atoma na koji su izravno povezani vodikovi atomi. Disocijacija takvih kiselina jednostavno je otpuštanje tih vodika, ali ioniziranih. Npr. solna kiselina:
HCl(aq) <=> H+(aq) + Cl-(aq) (ne smijemo zaboraviti da u reakciji sudjeluje voda i da je ispravnije pisati
HCl(aq) + H2O(l) <=> H3O+(aq) + Cl-(aq))
Koliko ima atoma vodika, toliko će biti stupnjeva disocijacije. Sumporovodična kiselina ima dva atoma vodika u molekuli (»dvobazna« kiselina):
H2S(aq) <=> H+(aq) + HS-(aq)
HS-(aq) <=> H+(aq) + S2-(aq) I voda je kiselina s dva vodika pa disocira u dva stupnja:
H2O(aq) <=> H+(aq) + HO-(aq)
HO-(aq) <=> H+(aq) + O2-(aq) Kod svih kiselina u svakom slijedećem stupnju disocijacija ide teže. Voda je toliko slaba kiselina da već prvi stupanj često možemo zanemariti, a disocijacije u drugom stupnju praktički uopće nema.
Druga vrsta kiselina su oksokiseline što znači da sadrže kisik. Kod njih nije disocijabilan vodik na središnjem atomu, već je na kisiku. Ako je X središnji atoma, tada imamo:
H-O-X(aq) <=> H+(aq) + O-X-(aq) Mnoge kiseline su tog tipa, ali im formule ne pišemo na ovaj način. Dušičnu kiselinu na primjer pišemo kao HNO3 , dok je struktura:
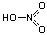 pa disocijaciju možemo pisati pa disocijaciju možemo pisati
HNO3(aq) <=> H+(aq) + NO3-(aq) ili
HONO2(aq) <=> H+(aq) + NO3-(aq) Fosforna kiselina:
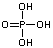 disocira u tri stupnja: disocira u tri stupnja:
H3PO4(aq) <=> H+(aq) + H2PO4-(aq)
H2PO4-(aq) <=> H+(aq) + HPO42-(aq)
HPO42-(aq) <=> H+(aq) + PO43-(aq) Poznavanje strukture može biti važno ako nisu svi vodikovi atomi disocijabilni. Fosforasta kiselina, H3PO3, ima poput fosforne tri atoma vodika po molekuli, a ipak samo dva stupnja disocijacije
H3PO3(aq) <=> H+(aq) + H2PO3-(aq)
H2PO3-(aq) <=> H+(aq) + HPO32-(aq) i dalje ne ide. Sve je jasno kad vidimo kako je vodik vezan u molekuli fosforaste kiseline:
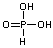 Očito bi bila prednost pisati (HO)2PHO. Očito bi bila prednost pisati (HO)2PHO.
*Kao što vidiš nisam napisao jednadžbe »najpoznatijih« kiselina, ali nadam se da ćeš sad znati sam.*
Dodatak
Ion koji nastaje u vodenim otopinama (H3O+) nazivamo oksonijev ili vodikov atom iako skraćeno pišemo H+. Ion H+ možemo dobiti npr. električnim pražnjenjem u razrijeđenom plinovitom vodiku. H+ zapravo je jezgra atoma vodika, a znamo da vodik ima 3 izotopa 1H, 2H i 3H. Jezgra izotopa 1H, koji je daleko najčešći u prirodi, je proton. Ostali izotopi imaju u jezgri uz proton još i jedan (2H, deuterij, ion je deuteron) ili dva (3H, tricij, ion je triton) neutrona. Običaj je govoriti o ionu H+ kao protonu. Ali ako ne razlikujemo izotope, ispravnije je H+ zvati hidron. Također, reakcija kiseline s vodom nije prava disocijacija, već prijenos hidrona s molekule kiseline na molekulu vode. Zato je bolje reakciju sa stanovišta kiseline nazivati dehidronacijom, a obratnu reakciju hidronacijom.
|
|
|
Odgovorio:
Kristijan A. Kovač
kkovac@chem.pmf.hr
<-- Povratak
|
|

|
Postavite
pitanje iz bilo kojeg područja kemije i
e-škola će osigurati da dobijete odgovor od kompetentnog znanstvenika. |
  |
|

