Milan Sikirica
e-Kemija za učenike osnovne škole
Pokusi
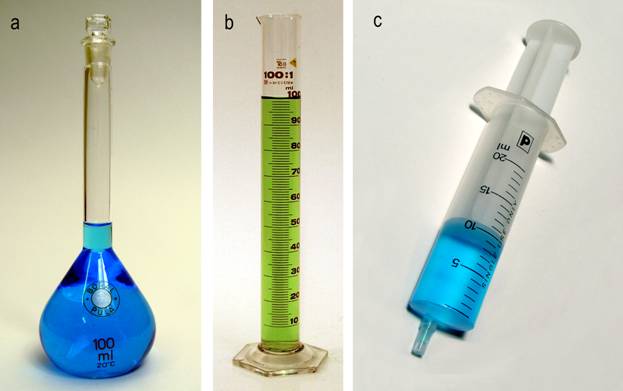
Pokus 1. Upoznajmo osnovni kemijski pribor
VIDEO: 1,1-Alkoholna grijalica.mp4





Upamtite
Stakleni pribor nikad se ne stavlja na rub stola gdje se nespretnim pokretom može prevrnuti ili razbiti.
Nakon upotrebe laboratorijsko suđe treba odmah oprati običnom vodom s malo deterđenta. Ponekad treba upotrijebiti četkicu za pranje. Treba paziti da se pri pranju četkicom ne probije dno epruvete.
Nakon pranja običnom vodom i detergentom laboratorijsko suđe se temeljito ispere običnom, a zatim destiliranom vodom i ostavi sušiti na stalku za cijeđenje.
Suho i čisto laboratorijsko suđe treba spremiti u ormare da se zaštiti od prašine.
YouTube Video: Starting with Safety
Primjenite sljedeći obrazac kako
biste rezultate
pokusa, opažanja i zaključke spremili u pretinac na svom računalu i
podijelili
s nastavnikom i ostalim članovima skupine.
Pokus 1. Upoznajmo osnovni kemijski pribor
Članovi skupine: ………………………………………………………………………Moj doprinos: a) izvođenju pokusa ………………..%
b) opažanjima i diskusiji …………%
c) formuliranju zaključaka……..…%
Ocjena koju zaslužujem (1 do 5) ……………
Opažanja i zaključci:
Pokus 2. Mjerenje volumena tekućine
Pribor: menzura od 100 mL, injekcijska štrcaljka od 10 mL, čaša od 200 mL, milimetarski papir 15 cm × 15 cm, ravnalo.
Opis pokusa
VIDEO: 2-Mjerenje volumena.mp4
1. Ulijte u čašu oko 150 mL obične vode. Injekcijskom štrcaljkom (bez igle) usišite malo više od 10 mL vode. Okrenite štrcaljku otvorom prema gore i pritiskom na klip istisnitete mjehurić zraka, kao što to radi liječnik prije nego što vam zabode injekciju. Istisnitete i višak vode tako da se rub klipa nađe na oznaci 10 mL.
2. Odmjerenih 10 mL vode istisnite u suhu menzuru od 100 mL. Uzmite menzuru u ruku i podignite je u visinu očiju. Pomno promotrite izgled površine vode. Voda u uskoj cijevi tvori meniskus. Odčitajte i zapišite položaj donjeg ruba meniskusa. Ako meniskus pada između dviju cjelobrojčanih oznaka, procijenite i iskažite njegov položaj brojem iza decimalnog zareza.
3. Ponovo dodajte u menzuru 10 mL vode iz injekcijske štrcaljke, odčitajte i zapišite položaj meniskusa. Tim postupkom napunite cijelu menzuru.
4. Rezultate mjerenja unesite u program Microsoft Excel ili prikažite garfikonom na milimetarskom papiru dimenzija 15 cm × 15 cm. Na apscisu nanesite broj porcija vode dodanih injekcijskom štrcaljkom. Skalu odaberite tako da 1 cm na apscisi označuje jednu porciju dodane vode. Na ordinatu nanesite odčitane volumene vode u menzuri tako da 1 cm označujue 10 mL. Crtajte precizno tako da svaka točka na grafikonu povezuje broj dodane porcije vode i pripadni volumen vode odčitan u menzuri. Ravnalom povucite pravac koji prolazi između točaka na grafikonu. Nastojte da broj točaka iznad i ispod pravca bude podjednak.
Je li površina vode ravna ili
zakrivljena?
Podudara li se oznaka 100 mL na menzuri s položajem meniskusa nakon posljednjeg dodatka vode injekcijskom štrcaljkom?
Obrazložite zašto točke na grafikonu odstupaju od idealnog pravca.
Što sve može uzrokovati opažena odstupanja?
Što razumijete pod osobnim, a što pod instrumentalnim pogreškama?
YouTube Video: Pipetting Technique
Primjenite sljedeći obrazac kako biste rezultate pokusa, opažanja i zaključke spremili u pretinac na svom računalu i podijelili s nastavnikom i ostalim članovima skupine.
Pokus 2. Mjerenje volumena tekućine menzurom
Članovi skupine: ………………………………………………………………………Moj doprinos: a) izvođenju pokusa ………………..%
b) opažanjima i diskusiji …………%
c) formuliranju zaključaka……..…%
Ocjena koju zaslužujem (1 do 5) ……………
Opažanja i zaključci:
Pokus 3. Mjerenje gustoće Arhimedovom metodom
Pribor: vaga, uzorci različitih metala (vijci, matice, zakovice, čavli, kovanice, staklene ili metalne kuglice), menzura od 100 mL
Opis pokusa
VIDEO: 3-Mjerenje gustoce.mp4
1. Odaberite takav metalni predmet nepravilna oblika koji može stati u menzuru. Umjesto jednog predmeta možete uzeti veći broj jednakih sitnijih predmeta, primjerice vijaka, matica, zakovica, čavala i slično. Suhi predmet, ili veći broj sitnijih predmeta, izvažite što točnije, a rezultat zapišite u bilježnicu.
2. Menzuru napunite vodom do polovine. Odčitajte volumen vode u menzuri. Pazite na položaj meniskusa. Neka pogled bude usmjeren u ravnini s razinom vode u menzuri. Izvagane predmete oprezno umetnite u menzuru i ponovo pročitajte položaj meniskusa. Rezultate prikažite u obliku tablice:
Rezultati mjerenja
|
Masa uzorka |
m = |
|
Volumen vode u menzuri |
Vo = |
|
Volumen vode i uzorka |
V1 = |
|
Volumen uzorka |
Vu = V1 - Vo = |
|
Gustoća uzorka |
ρ = m / Vu = |
Mogu li dva predmeta istodobno biti na istom mjestu?
Kojom se jedinicom iskazuje gustoća tvari?
Primjenite sljedeći obrazac kako biste rezultate pokusa, opažanja i zaključke spremili u pretinac na svom računalu i podijelili s nastavnikom i ostalim članovima skupine.
Pokus 3. Mjerenje gustoće Arhimedovom metodom
Članovi skupine: ………………………………………………………………………Moj doprinos: a) izvođenju pokusa ………………..%
b) opažanjima i diskusiji …………%
c) formuliranju zaključaka……..…%
Ocjena koju zaslužujem (1 do 5) ……………
Opažanja i zaključci:
Pokus 4. Toplinska provodnost
Pribor: plamenik, željezni tronožac, pčelinji vosak ili parafin svijeće, željezna žica promjera 2 mm i dužine 20 cm, 2 bakrene žice dužine 20 cm, jedna promjera oko 2 mm a druga promjera oko 1 mm. (Komadiće bakrene žice možete nabaviti u svakoj trgovini elektrotehničkog materijala. Željeznu žicu promjera 2 mm rabe instalateri centralnog grijanja pri varenju željeznih cijevi.)
Opis pokusa
VIDEO: 4-Toplinska provodnost.mp4
1. Željeznu i bakrene žice jednake duljine složite u snop. Jedan kraj snopa čvrsto zavežite s nekoliko navoja tanje bakrene žice. Drugi kraj snopa sa žicama raširite tako da dobijete lepezu u kojoj su krajevi žica udaljeni oko 2 cm.
2. Slobodni kraj željezne i bakrenih žica nakratko uronite u razmekšani pčelinji vosak tako da se na krajevima žica formira mala kuglica.
3. Lepezu od žica, s kuglicama voska na slobodnim krajevima, postavite na željezni tronožac. Na jednoj su strani lepeze krajevi žice čvrsto sljubljeni, a na drugoj su međusobno udaljeni oko 2 cm. Upaljen plinski plamenik podmetnite na mjesto gdje su žice sljubljene. Obratite pozornost na redoslijed kojim se tale kuglice voska na krajevima žica.
Kojim su se redoslijedom rastalile kuglice na krajevima žica?
Zašto se kuglica voska prije rastalila na debljoj nego na tanjoj bakrenoj žici?
Koji je metal bolji vodič topline, željezo ili bakar?
Što razumijete pod pojmom toplinska vodljivost?
YouTube Video: Thermal Conduction - short (edited) version
YouTube Video: Fire Water Balloon - Cool Science Experiment
Primjenite sljedeći obrazac kako biste rezultate pokusa, opažanja i zaključke spremili u pretinac na svom računalu i podijelili s nastavnikom i ostalim članovima skupine.
Pokus 4. Koji je metal bolji vodič topline, bakar ili željezo
Članovi skupine: ………………………………………………………………………Moj doprinos: a) izvođenju pokusa ………………..%
b) opažanjima i diskusiji …………%
c) formuliranju zaključaka……..…%
Ocjena koju zaslužujem (1 do 5) ……………
Opažanja i zaključci:
Pokus 5. Taljenje stearinske kiseline – krivulja hlađenja
Pribor i kemikalije: čaša od 100 ili 200 mL, epruveta, termometar do 100 ºC, željezni stalak, hvataljka s mufom, tronožac, staklokeramička pločica, plamenik, zaporni sat, stearinska kiselina.
Opis pokusa
VIDEO: 5-Krivulja hladjenja.mp4
1. Običnu epruvetu napunite do polovine stearinskom kiselinom. Visoku čašu napunite vodom i ugrijte na oko 75 ºC.
2. Epruvetu sa stearinskom kiselinom uronite u čašu s ugrijanom vodom. U rastaljenu stearinsku kiselinu uronite termometar tako da se njegov rezervoar nađe u sredini taline. Upotrijebite prerezani pluteni čep koji ne zaklanja skalu termometra.
3. Epruvetu s rastaljenim uzorkom stearinske kiseline i termometrom izvadite iz čaše s toplom vodom i učvrstite hvataljkom na željezni stalak dalje od izvora topline. Pustite da se epruveta s uzorkom spontano hladi te svake minute odčitajte temperaturu.
4. Na milimetarskom papiru nacrtajte koordinatni sustav. Na apscisu nanesite vrijeme u minutama, a na ordinatu temperaturu u ºC. U koordinatni sustav unesite točke koje pokazuju vrijeme hlađenje i pripadnu temperaturu. Točke povežite u krivulju.
5. Ponovite pokus tako da u epruvetu s talinom stearinske kiseline umetnete mješalicu u obliku žičane petlje. Tijekom snimanja krivulje hlađenja pomičite mješalicu gore-dolje.
Je li potrebno izvana dovoditi
toplinu za taljenje stearinske kiseline?
Što se događa daljnjim zagrijavanjem rastaljene stearinske kiseline?
Je li se temperatura tijekom hlađenja stearinske kiseline linearno snizuje protekom vremena?
Zašto se temperatura stearinske kiseline ne mijenja tijekom njezina skrućivanja?
Na temelju krivulje hlađenja odredite talište i krutište stearinske kiseline.
Kako bi izgledala krivulja hlađenja dvostruko veće količine stearinske kiseline.
Pretpostavite idealan oblik krivulje hlađenja.
Obrazložite razlike oblika krivulja hlađenja dobivenih u pokusu bez i s mješalicom.
Pretpostavite oblik krivulje zagrijavanja iste količine stearinske kiseline.
YouTube Video: Cooling Curve t-Butanol Lab
YouTube
Video: Cooling curves - stearic acid cooling from a liquid to a solid
Pokus 5. Taljenje stearinske kiseline – krivulja hlađenja
Članovi skupine: ………………………………………………………………………Moj doprinos: a) izvođenju pokusa ………………..%
b) opažanjima i diskusiji …………%
c) formuliranju zaključaka……..…%
Ocjena koju zaslužujem (1 do 5) ……………
Opažanja i zaključci:
Pokus 6. Sublimacija
Pribor i kemikalije: epruveta, plamenik, željezni stalak, hvataljka s mufom, amonijev klorid
Opis pokusa
VIDEO: 6-Sublimacija NH4Cl.mp4
1. Stavite u epruvetu malo amonijeva klorida, tek toliko koliko stane na vrh noža. Hvataljkom učvrstite epruvetu u kosom položaju na željezni stalak.
2. Sadržaj epruvete zagrijavajte malim plamenom. Pažljivo promatrajte što se događa. Svoja opažanja opširno opišite i potkrijepite odgovarajućim crtežima u bilježnici.
Opišite izgled sadržaja epruvete
prije zagrijavanja?
Što se događa tijekom zagrijavanja? Je li se amonijev klorid rastalio?
Je li sav amonijev klorid ispario?
Opišite izgled epruvete s amonijevim kloridom nakon zagrijavanja.
YouTube Video: Iodine sublimates - Iod sublimiert und resublimiert
YouTube Video: Sublimation | MIT Digital Lab Techniques Manual
Primjenite sljedeći obrazac kako biste rezultate pokusa, opažanja i zaključke spremili u pretinac na svom računalu i podijelili s nastavnikom i ostalim članovima skupine.
Pokus 6. Sublimacija
Članovi skupine: ………………………………………………………………………Moj doprinos: a) izvođenju pokusa ………………..%
b) opažanjima i diskusiji …………%
c) formuliranju zaključaka……..…%
Ocjena koju zaslužujem (1 do 5) ……………
Opažanja i zaključci:
■ Važno je napomenuti da pokus sublimcije amonijeva klorida nije reprezentativan jer tijekom zagrijavanja amonijev klorid disocira na amonijak i klorovodik.
NH3(s) → NH3(g) + HCl(g)
Plinovi, NH3(g) i HCl(g), u hladnijem se dijelu epruvete ponovno spajaju u kruti amonijev klorid.
NH3(g) + HCl(g) → NH4Cl(s)
Amonijev klorid odabran je zato što se njime pokus može provesti brzo i bezopasno. Pod sublimacijom se inače razumije neposredan prijelaz iz krutine u paru bez razlaganja spoja. Sublimacija joda, kamfora, naftalena i nekih drugih spojeva zahtijeva složeniju aparaturu i više vremena.
Pokus 7. Kemijska promjena
Pribor i kemikalije: Vaga, dvije plastične čaše, alkoholni ocat (9-postotna octena kiselina), soda bikarbona (natrijev hidrogenkarbonat, NaHCO3). Umjesto plastičnih čaša možete upotrijebiti plastične bočice od 250 mL u kojima se prodaje voda za piće. Bocama odrežite gornji zaobljeni dio s grlom i dobit ćete čaše.
Opis pokusa
VIDEO: 7-Kemijska promjena.mp4
1. U jednu plastičnu čašu uspite oko 1 g sode bikarbone. U drugu čašu ulijte oko 10 mL octa. Obje čaše stavite na vagu i zajedno izvažite. Zabilježite rezultat vaganja.
2. Polagano sipajte sodu bikarbonu u čašu s octom. Smjesa se pritom pjeni. Sodu bikarbonu morate polagano dodavati tako da nastala pjena ne izleti iz čaše.
3. Nakon što dodate svu sodu bikarbonu, obje čaše stavite na vagu i zajedno izvažite. Zabilježite rezultat vaganja.
4. Pokus ponovite tako da u malu Erlenmeyerovu tikvicu ulijete ocat, a sodu bikarbonu uspete u dječji balon. Erlenmeyerovu tikvicu s octom zatvorite dječjim balonom i sve zajedno izvažite.
5. Na samoj vagi pažljivo podignite balon tako da se soda bikarbona istrese u tikvicu. Što pokazuje vaga?
Opišite promjene koje se događaju tijekom dodavanja sode bikarbone u otopinu octene kiseline.
Je li ukupna masa tvari prije i nakon pokusa ostala nepromijenjena?
Sode bikarbone i octa više nema. Gdje su sada tvari od kojih se sastoje soda bikarbona i ocat?
Jesu li miješanjem sode bikarbone i octa nastale nove tvari?
Kako objašnjavate razliku ukupne mase tvari u čašama prije i nakon pokusa?
Mogu li tvari nestati ili nastati ni iz čega?
Što je sa zakonom o neuništivosti materije? Vrijedi li on? Gdje smo pogriješili?
U ponovljenom pokusu svi su reaktanti i produkti ostali zatvoreni u tikvici i dječjem balonu. Ništa nije izgubljeno, a vaga ipak pokazuje sve manje vrijednosti? Obrazložite.
YouTube
Video: Physical and Chemical Properties and Changes
Primjenite sljedeći obrazac kako biste rezultate pokusa, opažanja i zaključke spremili u pretinac na svom računalu i podijelili s nastavnikom i ostalim članovima skupine.
Pokus 7. Kemijska promjena
Članovi skupine: ………………………………………………………………………Moj doprinos: a) izvođenju pokusa ………………..%
b) opažanjima i diskusiji …………%
c) formuliranju zaključaka……..…%
Ocjena koju zaslužujem (1 do 5) ……………
Opažanja i zaključci:
Pokus 8. Je li gorenje svijeće fizikalna ili kemijska promjena
Pribor: žigice, 2 visoke staklene čaše - jedna od 200 i druga od 300 mL, plitki tanjur, mali porculanski tanjurić, rođendanska svjećica.
Opis pokusa
VIDEO: 8-Svijeca.mp4
1. Upalite i ukosite svijeću tako da nekoliko kapljica voska padne na tanjurić. Kad se kapljice voska skrutnu usporedite njihovu tvrdoću i opip s tvrdoćom i opipom voska nove svijeće.
Jesu li svojstva voska svijeće jednaka ili različita prije i nakon taljenja?
Je li taljenjem i skrućivanjem voska svijeće došlo do fizikalne ili kemijske promjene? Obrazložite.
2. Na sredinu tanjura plastelinom učvrstite rođendansku svjećicu. Ulijte u tanjur malo vode tako da dobijete sloj visine oko 1 cm. Upalite svijeću i poklopite je visokom čašom. Promatrajte promjene.
Što se dogodilo s razinom vode u tanjuru i čaši nakon što se svijeća ugasila?
Ustanovite za koliko se prvotni volumen zraka u čaši smanjio (npr. za 1/3, 1/4, 1/5, 1/6 itd.).
Je li promjena razine vode u čaši fizikalna ili kemijska promjena?
3. Zapornim satom (štopericom) usporedite vrijeme potrebno da se svijeća ugasi u čaši volumena 200 mL i čaši volumena 300 mL.
Pokušajte objasniti zašto se svijeća ugasila? Zašto svijeća dulje gori u većoj čaši?
Je li se svijeća smanjila? Je li gorenje svijeće fizikalna ili kemijska promjena?
4. Iznova zapalite svijeću i u njezin plamen nakratko unesite bijeli porculanski tanjurić.
Od čega je tanjurić pocrnio? Može li se taj crni sloj obrisati prstom? Kakav je opip tog crnog sloja?
Jesu li svojstva tog crnog sloja jednaka svojstvima voska od kojega je načinjena svijeća?
Nastaju li gorenjem svijeće nove tvari?
5. Iznad upaljene svijeće postavite hladnu Erlenmeyerovu tikvicu okrenutu otvorom prema dolje. Promatrajte unutrašnjost tikvice. Odmah začepite tikvicu gumenim čepom.
Je li se tikvica zamaglila? Pretpostavite koja je to tvar na stijenkama hladne tikvice. Prisjetite se što se događa kad zimi s hladnim naočalama uđete u tramvaj pun ljudi. Obrazložite opažanja.
6. Ulijte u tikvicu malo vapnene vode, ponovo začepite i promućkajte.
Je li se vapnena voda zamutila? Zašto se vapnena voda zamutila. Nabrojite tvari koje nastaju gorenjem svijeće. Koja od tih tvari reagira s vapnenom vodom?
YouTube Video: Physical and Chemical Changes
YouTube Video: Chemical and Physical Changes
Primjenite sljedeći obrazac kako biste rezultate pokusa, opažanja i zaključke spremili u pretinac na svom računalu i podijelili s nastavnikom i ostalim članovima skupine.
Pokus 8. Je li gorenje svijeće fizikalna ili kemijska promjena
Članovi skupine: ………………………………………………………………………Moj doprinos: a) izvođenju pokusa ………………..%
b) opažanjima i diskusiji …………%
c) formuliranju zaključaka……..…%
Ocjena koju zaslužujem (1 do 5) ……………
Opažanja i zaključci:
Pokus 9. Podržava li ugljikov dioksid gorenje i disanje
Pribor i kemikalije: soda bikarbona, ocat, rođendanska svjećica, žigice, 2 plastične boce od 1,5 L od gaziranog napitka, komad tvrde bakrene žice za držač svjećice.
Opis pokusa
VIDEO: 9-Ugljikov dioksid.mp4
1. Prozirnim plastičnim bocama od 1,5 L, kakve se rabe za kiselu vodu ili gazirane napitke, odrežite gornji dio s grlom tako da dobijete dvije visoke čaše. Od bakrene žice načinite držač za rođendansku svjećicu. Učvrstite svjećicu u pripremljeni držač.
2. U prvu čašu, načinjenu od plastične boce za kiselu vodu, uspite oko 2 male žlice sode bikarbone. Ispitajte je li svijeća gori u čaši sa sodom bikarbonom i u drugoj, praznoj čaši.
3. U prvu čašu sa sodom bikarbonom dolijte četvrt čaše octa. Uočite promjene. Upaljenom svijećom ispitajte je li svijeća i dalje gori nakon dodatka octa na sodu bikarbonu. Zabilježite opažanja. Upalite svijećicu i uvjerite se da ona u drugoj, praznoj čaši, normalno gori.
4. Čašu sa sodom bikarbonom i octom prinesite otvoru prazne čaše i polagano "prelijevajte iz šupljeg u prazno" ali tako da sva tekućina zaostane u prvoj čaši. Ispitajte u kojoj čaši sada gori svijeća. Što zaključujete? Opišite sve uočene promjene.
Dolazi li do fizikalne ili kemijske promjene kad se pomiješaju ocat i soda bikarbona.
Kakva svojstva ima plin koji se pri tome razvija? Podržava li taj plin gorenje?
Je li gustoća toga plina veća ili manja od gustoće zraka? Obrazložite svoje zaključke.
YouTube Video: Testing for Oxygen and Carbon dioxide
Primjenite sljedeći obrazac kako biste rezultate pokusa, opažanja i zaključke spremili u pretinac na svom računalu i podijelili s nastavnikom i ostalim članovima skupine.
Pokus 9. Podržava li ugljikov dioksid gorenje i disanje
Članovi skupine: ………………………………………………………………………Moj doprinos: a) izvođenju pokusa ………………..%
b) opažanjima i diskusiji …………%
c) formuliranju zaključaka……..…%
Ocjena koju zaslužujem (1 do 5) ……………
Opažanja i zaključci:
Pokus 10. Što nastaje zagrijavanjem smjese bakra i sumpora
Pribor i kemikalije: epruveta od teškotaljiva stakla, željezni stalak, hvataljka s mufom, plinski plamenik, tanka bakrena žica iz električnih vodova (tzv. licna), sumpor u prahu, dječji balon, (vaga).
Opis pokusa
VIDEO: 10-Bakrov sulfid.mp4
1. Skinite izolaciju s dijela savitljive bakrene žice kakva se upotrebljava za električne vodove. Škarama odrežite komadić ogoljene pletenice dužine oko 4 cm i smotajte ga tako da se može lako umetnuti u običnu epruvetu. Dodajte u epruvetu malo sumpora u prahu. Na epruvetu nataknite dječji balon kako biste sačuvali sve reaktante i produkte.
2. Epruvetu sa sumporom, bakrom i balonom izvažite na analitičkoj vagi.
3. Epruvetu sa sumporom, bakrom i balonom učvrstite hvataljkom na stalak. Malim plamenom plinskog plamenika lagano zagrijavajte dno ukošene epruvete. Sumpor će se rastaliti, a u jednom će se trenutku bakar užariti. Nastavite sa zagrijavanjem sve dok višak sumpora ne ispari i nakupi se u hladnijem dijelu epruvete.
4. Pustite da se epruveta ohladi i ponovo je zajedno s balonom izvažite na analitičkoj vagi.
5. Iz ohlađene epruvete istresite dobiveni produkt na list papira, uočite boju i ispitajte njegova mehanička svojstva.
Opišite karakteristična svojstva bakra (boja, mehanička svojstva i sl.)
Opišite karakteristična svojstva sumpora.
Opišite sve opažene promjene tijekom zagrijavanja epruvete s bakrom. Usporedite svoj opis s opisom drugih učenika u razredu. Diskutirajte o opaženim promjenama.
Je li tijekom pokusa došlo do promjene mase epruvete sa sumporom bakrom i balonom?
Je li zagrijavanjem bakra sa sumporom došlo dio kemijske ili fizikalne promjene?
Usporedite fizikalna svojstva dobivenog produkta sa svojstvima bakra i sumpora.
Je li zagrijavanjem bakra sa sumporom nastala nova tvar? Ako je nastala nova tvar od kojih se elementarnih tvari ona najvjerojatnije sastoji?
Može li se dobivena nova tvar rastaviti na jednostavnije tvari?
Što razumijete pod pojmom „kemijska reakcija“
Koje su tvari reaktanti, a koje produkti u ovoj kemijskoj reakciji?
YouTube Video: Copper and Sulfur Reaction
Primjenite sljedeći obrazac kako biste rezultate pokusa, opažanja i zaključke spremili u pretinac na svom računalu i podijelili s nastavnikom i ostalim članovima skupine.
Pokus 10. Što nastaje zagrijavanjem smjese bakra i sumpora
Članovi skupine: ………………………………………………………………………Moj doprinos: a) izvođenju pokusa ………………..%
b) opažanjima i diskusiji …………%
c) formuliranju zaključaka……..…%
Ocjena koju zaslužujem (1 do 5) ……………
Opažanja i zaključci:
Pokus 11. Redukcija bakrova(II) oksida s drvenim ugljenom
Pribor i kemikalije: epruveta, plamenik s ukapljenim plinom, epruveta, drveni ugljen, drvena štipaljka za epruvete, povećalo, bakrov oksid u obliku granula ili iglica
Opis pokusa
VIDEO: 11-Redukcija CuO.mp4
1. Odvažite i u porculanskom tarioniku temeljito izmješajte 0,8 g bakrova(II) oksida i 0,15 g aktivnog ugljena. Pomoću malog lijevka reakcijsku smjesu uspite u epruvetu.
2. Hvataljkom i mufom epruvetu učvrstite u kosom položaju na željezni stalak.
3. Reakcijsku smjesu zagrijavajte plamenom plinskog plamenika. U jednom će se trenutku reakcijska smjesa užariti. Prekinite daljnje zagrijavanje i pustite da se smjesa ohladi.
4. Ohlađenu smjesu istresite na bijelu porculansku pločicu. Uočite boju i ispitajte mehanička svojstva dobivenog produkta.
Opišite izgled i fizička svojstva uzorka bakrova(II) oksida.
Opišite promjene koje su se događale tijekom zagrijavanja smjese aktivnog ugljena i bakrova(II) oksida?
Što razumijete pod pojmovima oksidacija i redukcija.
Šro su reaktanti, a što produkti ove kemijske reakcije.
YouTube Video: Reduction of Copper Oxide
Primjenite sljedeći obrazac kako biste rezultate pokusa, opažanja i zaključke spremili u pretinac na svom računalu i podijelili s nastavnikom i ostalim članovima skupine.
Pokus 11. Redukcija bakrova(II) oksida s drvenim ugljenom
Članovi skupine: ………………………………………………………………………Moj doprinos: a) izvođenju pokusa ………………..%
b) opažanjima i diskusiji …………%
c) formuliranju zaključaka……..…%
Ocjena koju zaslužujem (1 do 5) ……………
Opažanja i zaključci:
Pokus 12. Indikatori kiselina i lužina
Pribor i kemikalije: Stalak s epruvetama, čaša, nož, kuhinjska daščica za rezanje, crveni kupus, alkoholni ocat, limunska kiselina, C-vitamin, kuhinjska sol, sapun, sredstvo za čišćenje pećnica i različita sredstava za čišćenje
Opis pokusa
VIDEO: 12- Indikatori kiselina i luzina.mp4
1. Narežite malo crvenog kupusa i iscijedite njegov sok. Pokus možete izvesti i kod kuće. Umjesto epruveta možete upotrijebiti obične prozirne staklene ili plastične čaše.
2. U epruvetu (ili čašu) stavite malo octa i dodajte nekoliko kapi soka crvenog kupusa. Ocat je razrijeđena, odnosno 9-postotna octena kiselina.
3. Istim postupkom ispitajte otopinu limunske kiseline i C-vitamina. Octena i limunska kiselina, kao i C-vitamin slabe su kiseline.
4. Otopite malo kuhinjske soli u vodi i ispitajte sokom crvenog kupusa. Otopina kuhinjske soli je slana, ali nije ni kisela ni lužnata. Za otopinu kuhinjske soli kaže se da je neutralna.
5. U čašu s malo vode dodajte desetak kapi sredstva za čišćenje pećnica i dobivenu otopinu ispitajte sokom crvenog kupusa. Sredstva za čišćenje pećnica sadržavaju jake lužine.
6. Na jednak način ispitajte otopinu sapuna, sode bikarbone, deterdženta za ručno pranje posuđa, deterdženta za strojno pranje posuđa, deterdženta za pranje rublja itd. Sok crvenog kupusa je prirodni indikator kiselina i lužina.
Kakvu boju pokazuje sok crvenog kupusa u kiselim otopinama?
Kakvu boju pokazuje sok crvenog kupusa u neutralnoj otopini, odnosno otopini kuhinjske soli?
Kakvu boju pokazuje sok crvenog kupusa u lužnatoj otopini (sredstvo za čišćenje pećnica)?
Na temelju promjene boje soka crvenog kupusa odredite koje su „kemikalije“ u vašem domu kiseline, koje su lužine, a koje neutralne?
YouTube Video: How to Make a Red Cabbage pH Indicator
Primjenite sljedeći obrazac kako biste rezultate pokusa, opažanja i zaključke spremili u pretinac na svom računalu i podijelili s nastavnikom i ostalim članovima skupine.
Pokus 12. Indikatori kiselina i lužina
Članovi skupine: ………………………………………………………………………Moj doprinos: a) izvođenju pokusa ………………..%
b) opažanjima i diskusiji …………%
c) formuliranju zaključaka……..…%
Ocjena koju zaslužujem (1 do 5) ……………
Opažanja i zaključci:
Pokus 13. Ispitivanje svojstava modre galice
Pribor i kemikalije: koljenasto savijena epruveta, stalak, hvataljka, plamenik, usitnjeni kristali modre galice.
Opis pokusa
VIDEO: 13-Modra galica.mp4
1. U koljenasto savijenu epruvetu uspite oko 1 g usitnjenih kristala modre galice. Epruvetu učvrstite u stalak tako da se epruveta nađe u istom položaju kakav je pokazan na videu.
2. Zagrijavajte modru galicu što manjim plamenom i uočite kako se njezina boja mijenja od modre do gotovo bijele. U koljenasto savijenom dijelu epruvete skupit će se malo bezbojne tekućine. To je voda. Sadržaj na dnu epruvete pobijeli jer nastaje bezvodni bakrov(II) sulfat.
3. Pričekajte da se epruveta ohladi tako da dio s bezvodnim bakrovim sulfatom možete držati rukom. Pridržavajući rukom dno, zakrenite epruvetu tako da voda iz koljensto savijenog dijela dođe u doticaj s bezvodnim bakrovim sulfatom. Uočite i obrazloži promjene.
4. Nakon dovršenog pokusa epruvetu začepite i spremite. S istim uzorkom pokus se može više puta ponoviti.
Sadržavaju li kristali modre galice vodu?
Što nastaje zagrijavanjem modre galice? Kakve je boje produkt?.
Dolazi li do promjene temperature kad se pomiješa bijeli produkt i voda?
Kakve je boje produkt nastao nakon dodatka vode? Koja je to tvar?
Što razumijete pod pojmovima egzotermna i endotermna promjena?
YouTube Video: Finding the formula of hydrated Copper Sulfate
Primjenite sljedeći obrazac kako biste rezultate pokusa, opažanja i zaključke spremili u pretinac na svom računalu i podijelili s nastavnikom i ostalim članovima skupine.
Pokus 13. Ispitivanje svojstava modre galice
Članovi skupine: ………………………………………………………………………Moj doprinos: a) izvođenju pokusa ………………..%
b) opažanjima i diskusiji …………%
c) formuliranju zaključaka……..…%
Ocjena koju zaslužujem (1 do 5) ……………
Opažanja i zaključci:
Pokus 14. Dekantiranje
Pribor: 2 čaše ili Erlenmeyerove tikvice od 250 mL, gumeni kolut, pijesak, voda
Opis pokusa
VIDEO: 14-Dekantiranje.mp4
1. Smjesu pijeska i vode u Erlenmeyerovoj tikvici uzmutite kružnim pokretima pa potom postavite u kosom položaju u gumeni kolut.
2. Kad se krupne i teške čestice pijeska istalože, mutnu vodu iznad taloga polagano i bez potresanja tikvice odlijte u drugu posudu.
3. Teški talog ostaje u tikvici, a odlivena voda najčešće nije bistra jer sadržava suspendirane sitne čestice gline čija je gustoća manja od gustoće pijeska. Ako se mutna voda dulje vrijeme ostavi na mirnu mjestu, tijekom nekog vremena istaložit će se i najsitnije čestice gline, pa će se iznad taloga dobiti sloj bistre vode.
Što razumijete pod pojmom kemijski čista tvar?
Što razumijete pod pojmvima heterogena i homogena smjesa?
Što je sedimentacija?
Što je suspenzija?
Na kojim se fizikalnim osnovama temelji razdvajanje smjese dekantiranjem?
O čemu ovisi brzina taloženja suspendiranih čestica?
Primjenite sljedeći obrazac kako biste rezultate pokusa, opažanja i zaključke spremili u pretinac na svom računalu i podijelili s nastavnikom i ostalim članovima skupine.
Pokus 14. Dekantiranje
Članovi skupine: ………………………………………………………………………Moj doprinos: a) izvođenju pokusa ………………..%
b) opažanjima i diskusiji …………%
c) formuliranju zaključaka……..…%
Ocjena koju zaslužujem (1 do 5) ……………
Opažanja i zaključci:
Pokus 15. Filtriranje
Pribor: stakleni ili plastični lijevak, stakleni štapić, Erlenmeyerova tikvice od 250 mL, čaša od 200 mL, usitnjena kreda ili pijesak, filtrirni papir, škare.
Opis pokusa
VIDEO: 15-Filtriranje.mp4
-
Presavijte filtrirni papir na način prikazan na videu.
-
Četverostruko presavijeni filtrirni papir obrežite tako da dobijete isječak četvrtine kruga.
-
Dobiveni isječak raširite tako da dobijete stožac, umetnite ga u lijevak, nakvasite s malo vode i prstima priljubite uz stijenke lijevka. Rub filtrirnog papira mora biti oko 5 mm niži od ruba lijevka. Lijevak s nakvašenim filtrirnim papirom postavite na Erlenmeyerovu tikvicu.
-
Uspite u čašu malo usitnjene krede ili pijeska, dolijte oko 100 mL vodovodne vode i promiješajte staklenim štapićem.
-
Većinu tekućine iz čaše odlijte (dekantirajte) u lijevak tako da mlaz štapićem usmjerite prema mjestu gdje filtrirni papir trostruk. Stakleni štapić ne smije doticati filtrirni papir jer će ga probušiti.
-
Kad procijenite da je u čaši ostalo onoliko vode i usitnjene krede koliko odjednom može stati u lijevak s filtrirnim papirom, pričekajte da sva voda iz lijevka isteče u Erlenmeyerovu tikvicu. Brzim kružnim pokretima ruke promućkajte zaostali talog i vodu u čaši i naglo izlijte u lijevak s filtrirnim papirom.
-
Pomoću boce štrcaljke isperite ostatke krede u lijevak s filtrirnim papirom.
-
Pričekajte da sva tekućina iz lijevka isteče u Erlenmayerovu tikvicu. Pomoću boce štrcaljke talog na filtrirnom papiru isperite tri puta malim porcijama vode. Svakiput pričekajte da prethodna porcija vode isteče iz lijevka.
-
Filtrirni papir s talogom izvadite iz lijevka, raširite, postavite na drugi komad filtrirnog papira te ostavite da se suši preko noći.
Obrazložite zašto voda prolazi, a usitnjena kreda ne prolazi kroz pore filtrirnog papira?
Čemu služi stakleni štapić pri izlijavanju tekućine iz čaše ili tikvice u lijevak s filtrirnim papirom?
Smije li stakleni štapić doticati filtrirni papir?
Na koje mjesto na filtrirnom papiru treba usmjeriti mlaz tekućine?
Imaju li svi filtrirni papiri jednaku veličinu pora?
YouTube Video: How To Filter and Decant - Flinn Scientific
YouTube Video: Gravity Filtration
Primjenite sljedeći obrazac kako biste rezultate pokusa, opažanja i zaključke spremili u pretinac na svom računalu i podijelili s nastavnikom i ostalim članovima skupine.
Pokus 15. Filtriranje
Članovi skupine: ………………………………………………………………………Moj doprinos: a) izvođenju pokusa ………………..%
b) opažanjima i diskusiji …………%
c) formuliranju zaključaka……..…%
Ocjena koju zaslužujem (1 do 5) ……………
Opažanja i zaključci:
Pokus 16. Destilacija
Pribor: aparatura za destilaciju, otopina kuhinjske soli u vodi, tinta, komadići neglazirana porculana, predmetno stakalce
Opis pokusa
VIDEO: 16-Destilacija.mp4
1. Složite aparaturu za destilaciju prema slici 5.6. u udžbeniku.
2. Tikvicu za destilaciju napunite najviše do polovine morskom vodom ili otopinom kuhinjske soli, dodajte nekoliko kapi tinte i nekoliko malih komadića neglazirana porculana.
3. Pazite da rezervoar termometra dođe točno na sredinu odvodne cijevi tikvice za destilaciju. U Liebigovo hladilo voda mora ulaziti na nižoj, a izlaziti na gornjoj, višoj strani hladila. Pod izlaznu cijev hladila stavite predložak, odnosno tikvicu u koju ćete hvatati destilat.
4. Zagrijavajte sadržaj tikvice za destilaciju dok voda ne proključa. Odčitajte temperaturu na termometru.
5. Nastavite sa zagrijavanjem sve dok se u predlošku ne skupi nekoliko mililitara destilata. Uočite njegovu boju.
6. Kap dvije destilata stavite na stakalce za mikroskopiranje. Stakalce uhvatite štipaljkom i držite u horizontalnom položaju visoko iznad plamena plinskog plamenika. Kad voda ispari, dobro promotrite predmetno stakalce. Uočite i zapišite sve opažene promjene.
Je li bistra morska voda homogena ili heterogena smjesa, ili nešto treće?
Zašto nismo hladilo spojili tako da voda ulazi na gornjoj, a izlazi na donjoj nižoj strani hladila?
Što primjećujete na tikvici s hladnom morskom vodom u trenutku kad se upali plinski plamenik?
Zašto su u tikvicu s morskom vodom dodaju komadići neglazirana porculana?
Što se događa kad voda u tikvici proključa? Gdje zamjećujete najviše mjehurića vodene pare?
U kojem se dijelu aparature vodena para najprije počinje kondenzirati?
Kakve je boje destilat?
Kako se tijekom vremena mijenja boja sadržaja tikvice za destilaciju?
Je li nakon isparavanja kapljice destilata na predmetnom stakalcu zaostao talog? Sadrži li destilat kuhinjsku sol?
YouTube Video: Distillation I | MIT Digital Lab Techniques Manual
YouTube Video: Distillation II | MIT Digital Lab Techniques Manual
Primjenite sljedeći obrazac kako biste rezultate pokusa, opažanja i zaključke spremili u pretinac na svom računalu i podijelili s nastavnikom i ostalim članovima skupine.
Pokus 16. Destilacija
Članovi skupine: ………………………………………………………………………Moj doprinos: a) izvođenju pokusa ………………..%
b) opažanjima i diskusiji …………%
c) formuliranju zaključaka……..…%
Ocjena koju zaslužujem (1 do 5) ……………
Opažanja i zaključci:
Pokus 17. Prezasićena otopina
Pribor i kemikalije: limunska kiselina, epruveta, kapalica s gumicom, štipaljka za epruvete, plamenik. Limunsku kiselinu možete nabaviti u trgovini kućanskih potrepština.
Opis pokusa
VIDEO: 17,1-Prezasicena otopina NaAc.mp4
VIDEO: 17,2-Prezasićena otopina limunske k.mp4
1. Uspite u epruvetu toliko limunske kiseline da dobijete stupac visine oko 4 cm.
2. Kapalicom dodavajte kap po kap vode sve dok kristali limunske kiseline ne budu potopljeni. Opipajte rukom epruvetu.
3. Epruvetu uhvatite drvenom štipaljkom i uz neprekidno potresanje zagrijavajte malim plamenom dok se svi kristali ne otope. Sadržaj epruvete zagrijavajte odozgo prema dolje. Na kraju otopina mora lagano proključati. Pritom će se vodena para kondenzirati u gornjem hladnijem dijelu epruvete i isprati kristale limunske kiseline zaostale na stijenkama. Kad se sva limunska kiselina otopi, ostavite epruvetu u stalak da se spontano hladi ili je bez potresanja ohladite pod tekućom vodom.
4. U ohlađenu otopinu uronite termometar, izmjerite i zapišite njezinu temperaturu .
5. Pincetom ubacite u otopinu samo jedan ili dva kristalića limunske kiseline. Lagano promiješajte sadržaj epruvete termometrom i prema svjetlu promatraj pojavljivanje sjajnih kristalića limunske kiseline. Obratite pozornost na promjenu temperature.
Što razumijete pod pojmovima nezasićena, zasićena i prezasićena otopina?
Je li se sadržaj epruvete ugrijao ili ohladio kad smo na limunsku kiselinu dodali malo vode?
Kako se mijenja topljivost limunske kiseline povišenjem temperature?
Pretpostavite što će se dogoditi kad se vruća otopina limunske kiseline ohladi na sobnu temperaturu?
Jesu li se hlađenjem otopine pojavili kristalići limunske kiseline? Obrazložite.
Što se dogodi kad se u otopinu ubaci nekoliko kristalića limunske kiseline?
YouTube Video: hot ice (sodium acetate) beautiful science experiment
YouTube Video: Supersaturated Solution
Primjenite sljedeći obrazac kako biste rezultate pokusa, opažanja i zaključke spremili u pretinac na svom računalu i podijelili s nastavnikom i ostalim članovima skupine.
Pokus 17. Prezasićena otopina limunske kiseline
Članovi skupine: ………………………………………………………………………Moj doprinos: a) izvođenju pokusa ………………..%
b) opažanjima i diskusiji …………%
c) formuliranju zaključaka……..…%
Ocjena koju zaslužujem (1 do 5) ……………
Opažanja i zaključci:
■ Isti pokus možete izvesti s natrijevim acetatom trihidratom, CH3COONa · 3 H2O, ili natrijevim tiosulfatom pentahidratom, Na2S2O3 · 5 H2O.
Ako želite dobiti velike kristale limunske kiseline, tad u 100 mL destilirane vode dodajte 250 g limunske kiseline. Smjesu zagrijte najviše na 40 ºC. Sva će se limunska kiselina otopiti. Dobivenu otopinu ulijte u plastičnu „čašu“ načinjenu od manje bočice u kojoj se prodaje voda za piće. Pustite da se otopina spontano hladi. Kad uočite da su se na dnu pojavili kristali, zasićenu otopinu prelijte u drugu jednaku plastičnu „čašu“. Od dobivenih kristala odaberite najljepši, zavežite ga koncem i objesite tako da se nađe u sredini zasićene otopine. Kristal (jezgra) će nastaviti rast. Topljivost limunske kiseline u vodi smanjuje se sniženjem temperature. Pri 27 ºC u 100 g vode otapa se 220 g, a pri 20 ºC samo 183 g monohidrata limunske kiseline.
Pokus 18. Ispitivanje kemijskih svojstava kisika
Pribor i kemikalije: lijevak za dokapavanje od 50 mL, probušeni gumeni čep, 5 Erlenmeyerovih tikvica od 200 mL s pripadnim čepovima, koljenasto savijena staklena cijev, rođendanska svjećica, željezna vuna, drveni ugljen, sumporna traka, koncentrirana otopina vodikova peroksida, manganov dioksid, pijesak, vapnena voda, metiloranž, zaštitne naočale i rukavice.
Koncentriranu otopinu vodikova peroksida prelijevajte vrlo pažljivo i pazite da vam ne dospije na kožu. Koža u doticaju s vodikovim peroksidom pobijeli i jako svrbi. Svrbež prestane za desetak minuta bez posljedica. Ne trljajte oči kad radite s bilo kojom kemikalijom. Uvijek rabite zaštitne naočale.
Opis pokusa
VIDEO: 18-Kisik.mp4
-
Pripremite 4 Erlenmeyerove tikvice s pripadnim gumenim čepovima. Dno jedne Erlenmeyerove tikvice pokrijte pijeskom.
-
Pomoću lijevka za dokapavanje, Erlenmeyerove tikvice i probušenog gumenog čepa sastavite aparaturu za dobivanje plinova. Na dno Erlenmeyerove tikvice stavite malo manganova dioksida. U lijevak za dokapavanje ulijte oko 20 mL koncentrirane otopine vodikova peroksida.
-
Otopinu vodikova peroksida dokapavajte kap po kap. Manganov dioksid je katalizator koji ubrzava raspadanje vodikova peroksida na vodu i kisik. Kisik je neznatno „teži“ od zraka pa ga se skuplja u tikvici s otvorom prema gore. Napunite kisikom 4 Erlenmeyerove tikvice.
-
Upaljenu rođendansku svjećicu unesite u tikvicu s kisikom. Uočite promjene. Začepite tikvicu gumenim čepom kako biste sačuvali produkte gorenja. Ulijte u tikvicu malo vapnene vode. Začepite tikvicu i promućkajte. Obrazložite opažene promjene.
-
Uhvatite pincetom mali komadić drvenog ugljena i užarite na plinskom plameniku. Tinjajući ugljen unesite u tikvicu s kisikom. Uočite promjene. Vapnenom vodom ispitajte produkte gorenja ugljena.
-
Smotuljak željezne vune, kakva se rabi u kućanstvu za ribanje posuđa, užarite u plamenu plinskog plamenika i brzo unesite u tikvicu s kisikom čije je dno prekriveno pijeskom. Uočite i opišite promjene.
-
Upalite mali komadić sumporne trake i brzo unesite u tikvicu s kisikom. Odmah začepite tikvicu gumenim čepom kako biste sačuvali produkte gorenja sumpora. Ulijte u tikvicu malo destilirane vode, promućkajte i ispitajte metiloranžom ili nekim drugim indikatorom. Obrazložite uočene promjene.
YouTube Video: Combustion of iron in pure oxygen
Primjenite sljedeći obrazac kako biste rezultate pokusa, opažanja i zaključke spremili u pretinac na svom računalu i podijelili s nastavnikom i ostalim članovima skupine.Pokus 18. Ispitivanje kemijskih svojstava kisika
Članovi skupine: ………………………………………………………………………Moj doprinos: a) izvođenju pokusa ………………..%
b) opažanjima i diskusiji …………%
c) formuliranju zaključaka……..…%
Ocjena koju zaslužujem (1 do 5) ……………
Opažanja i zaključci:
Pokus 19. Kako načiniti model uređaja za gašenje požara
Pribor i kemikalije: plastična boca od 500 mL (boca od gaziranog napitka), plastična štrcaljka za injekcije od 20 mL, soda bikarbona (natrijev hidrogenkarbonat), limunska kiselina, tekući deterdžent za pranje posuđa, električarska izolirajuća traka ili flaster za rane.
OBVEZNO UPOTRIJEBITE ZAŠTITNE NAOČALE!
Opis pokusa
VIDEO: 19-Gasenje pozara.mp4
1. Na gornjem zaobljenom dijelu plastične boce ugrijanim vrhom željeznog čavla izbušite rupicu promjera oko 4 mm. Rupicu vidljivo obilježite vodootpornim flomasterom. To će pomoći da se mlaz pjene iz „vatrogasnog aparata“ usmjeri na pravo mjesto.
2. Uspite u bocu veliku žlicu sode bikarbone (natrijeva hidrogenkarbonata), napunite bocu do polovine vodom, zatvorite pripadnim čepom, rupicu začepite prstom i miješajte dok se većina sode bikarbone ne otopi. Na kraju dodajte malo tekućeg deterdženta za pranje posuđa.
3. U plastičnu injekcionu štrcaljku usišite 20 mL otopine limunske kiseline dobivene otapanjem jednog paketića limunske kiseline, 20 g, u oko 20 mL vode. Napunjenu štrcaljku ugurajte u grlo boce s otopinom sode bikarbone. Prostor između grla boce i tijela injekcijske štrcaljke zabrtvite plastelinom ili gumom za žvakanje. Brtvljenje možete poboljšati tako da spoj injekcijske štrcaljke i plastelina omotate električarskom izolirajućom trakom ili mikroporoznim flasterom za rane. Model vatrogasnog aparata time je dovršen.
4. Sljedeći korak najbolje je izvesti na dvorištu. Jednom rukom uhvatite bocu s otopinom sode bikarbone. Rupicu na „aparatu“ usmjerite prema „izvoru požara“. Pritisnite klip injekcijske štrcaljke i zadržite pritisak, a mlaz pjene usmjerite na „mjesto požara“. Pazite kamo usmjeravate mlaz da njime ne poprskate sebe ili promatrače. Nakon upotrebe aparat treba ponovno napuniti, baš kao i pravi vatrogasni aparat.
Smiju li se zapaljene električne instalacije gasiti vodom?
Mogu li se nafta, benzin i druge zapaljive tekućine gasiti vodom?
Čime treba gasiti naftu i zapaljive tekućine „lakše“ od vode?
Što treba učiniti s vatrom i žeravicom zaostalom nakon paljenja vatre na otvorenom?
Kako ćete ugasiti šumski požar u začetku?
YouTube Video: How to use a 2kg Carbon Dioxide Fire Extinguisher
YouTube Video: Tank Fire Fighting with Foam
Primjenite sljedeći obrazac kako biste rezultate pokusa, opažanja i zaključke spremili u pretinac na svom računalu i podijelili s nastavnikom i ostalim članovima skupine.
Pokus 19. Kako načiniti model uređaja za gašenje požara
Članovi skupine: ………………………………………………………………………Moj doprinos: a) izvođenju pokusa ………………..%
b) opažanjima i diskusiji …………%
c) formuliranju zaključaka……..…%
Ocjena koju zaslužujem (1 do 5) ……………
Opažanja i zaključci:
Pokus 20. Elektroliza vode
Pribor i kemikalije: Hofmannov aparat za elektrolizu vode, izvor istosmjerne struje – ispravljač 12 V, jelova triješčica, razrijeđena otopina sumporne kiseline ili razrijeđena otopina natrijeva hidroksida
Opis pokusa
VIDEO: 20-Elektroliza vode.mp4
- Obratite pozornost na vrstu elektroda u Hofmannovom aparatu. Ako su elektrode načinjene od ugljena, tad ih zamijenite elektrodama od nehrđajućeg čelika i aparat napunite razrijeđenom otopinom natrijeva hidroksida, w(NaOH) ≈ 5 %. (Pazite! Nakon dovršenog pokusa aparat odmah operite, a pipce podmažite vazelinom.)
-
Ako je Hofmannov aparat opremljen platinskim elektrodama tad ga napunite razrijeđenom otopinom sumporne kiseline, w(H2SO4) ≈ 5 – 10 %. U aparatu ne smije ostati zraka. Priključite elektrode na izvor istosmjerne struje od 12 V. Pratite razvijanje plinova na elektrodama.
-
Kad se u Hofmannovu aparatu skupi dovoljno plina, isključite ispravljač. Pripremite tinjajuću triješčicu i primaknite je otvoru one cijevi u kojoj je skupljeno manje plina. Polagano otvorite pipac. Što opažate i zaključujete?
-
Zapaljenu triješčicu primaknite otvoru cijevi u kojoj se sakupilo više plina. Što opažate?
-
Uočite na kojoj se elektrodi, priključenoj na + ili − pol izvora struje, razvija više plina.
U kakvu su omjeru volumeni plinova izlučeni na elektrodama.
Što se dogodi s tinjajućom triješčicom kad se na nju usmjeri plin iz one cijevi Hofmannova aparata koja sadržava manje plina? Koji plin ima takva svojstva?
Što se dogodi kad na upaljenu triješčicu pusti plin iz one cijevi Hofmannova aparata u kojoj je sakupljeno više plina? Gori li taj plin ili podržava gorenje?
YouTube Video: Water Electrolysis
Primjenite sljedeći obrazac kako biste rezultate pokusa, opažanja i zaključke spremili u pretinac na svom računalu i podijelili s nastavnikom i ostalim članovima skupine.
Pokus 20. Elektroliza vode
Članovi skupine: ………………………………………………………………………Moj doprinos: a) izvođenju pokusa ………………..%
b) opažanjima i diskusiji …………%
c) formuliranju zaključaka……..…%
Ocjena koju zaslužujem (1 do 5) ……………
Opažanja i zaključci:
Pokus 21. Eksplozija smjese vodika i zraka
DEMONSTRACIJSKI POKUS
Pribor: Kippov aparat za vodik, limena kantica od gaziranog napitka, željezni stalak, hvataljka, gumeni čep, šibice
Opis pokusa
VIDEO: 21-Vodik.mp4
1. Uzmite praznu kanticu od gaziranog napitka i nožem za otvaranje konzervi izrežite gornji dio kantice tako da se dobije širok otvor.
2. Na sredini dna kantice čavlom izbušite malu rupu, promjera oko 2 do 3 mm. Kanticu učvrstite hvataljkom na pola visine željeznog stalka. Široki otvor kantice mora biti okrenut prema dolje. Na mali otvor izbušen na dnu kantice prislonite gumeni čep. Kanticu obvezno učvrstite hvataljkom na stalak. Ako kanticu s vodikom stavite na stol, pa smjesu vodika sa zrakom zapalite, kantica će nekontrolirano odletjeti pri čemu može nekoga ozlijediti ili načiniti materijalnu štetu. Smjesa od 200 mL vodika i zraka izazvat će zaglušujuću eksploziju.
3. Na pipac Kippova aparata priključite gumenu cijev i njezin kraj uvedite kroz široki otvor u kanticu. Otvorite nakratko pipac na Kippovu aparatu, tek toliko da u kanticu uđe 25 do 50 mL vodika. Odmah zatvorite pipac i Kippov aparat odmaknite na najmanje 2 m od kantice s vodikom.
4. Upalite šibicu, skinite čep i upaljenu šibicu prinesite malom otvoru na dnu kantice. Smjesa vodika sa zrakom žestoko eksplodira. Uhvatite rukom kanticu i osjetit ćete da se ugrijala.
YouTube Video: Faraday Lecture - Hydrogen/Oxygen ExplosionsYouTube Video: Combustible gases in balloons
YouTube Video: Hydrogen Explosion
Primjenite sljedeći obrazac kako biste rezultate pokusa, opažanja i zaključke spremili u pretinac na svom računalu i podijelili s nastavnikom i ostalim članovima skupine.
Pokus 21. Eksplozija smjese vodika i zraka (demonstracijski pokus)
Članovi skupine: ………………………………………………………………………Moj doprinos: a) izvođenju pokusa ………………..%
b) opažanjima i diskusiji …………%
c) formuliranju zaključaka……..…%
Ocjena koju zaslužujem (1 do 5) ……………
Opažanja i zaključci:
Pokus 22. Sinteza željezova sulfida
Pribor i kemikalije: keramička pločica, željezo u prahu, sumpor u prahu, plamenik, željezna žica duljine oko 50 cm.
Opis
pokusa
VIDEO: 22-Sinteza
zeljezova sulfida.mp4
- Pokus izvedite na dvorištu. Načinite smjesu od 2,8 g željeza u prahu i 1,6 g sumpora u prahu. Smjesu istresite na keramičku pločicu tako da dobijete hrpicu.
-
U šuštećem plamenu plinskoga plamenika užarite jedan kraj željezne žice i užarenim dijelom dotaknite smjesu željeza i sumpora.
Opišite fizikalna svojstva željeza u prahu. Opišite fizikalna svojstva sumpora u prahu.
Opišite fizikalna svojstva smjese željeza i sumpora. Je li to obična mehanička smjesa dviju tvari ili kemijski spoj?
Što se dogodilo kad je užarena željezna žica dotaknula smjesu željeza i sumpora? Je li pritom došlo do fizikalne ili kemijske promjene?
Ako smatrate da je iz željeza i sumpora nastao novi spoj, pridjelite mu ime. Svi spojevi metala sa sumporom nazivaju se sulfidi.
Opišite fizikalna svojstva dobivenog produkta.
Što su reaktanti, a što produkti u ovoj kemijskoj reakciji? Napišite jednadžbu reakcije.
U kakvu su međusobnom odnosu broj i vrsta atoma na lijevoj strani prema broju i vrsti atoma na desnoj strani jednadžbe?
Zašto se kemijski elementi međusobno spajaju u stalnim uteznim omjerima?
YouTube Video: Reaction of iron with sulfur
Primjenite sljedeći obrazac kako biste rezultate pokusa, opažanja i zaključke spremili u pretinac na svom računalu i podijelili s nastavnikom i ostalim članovima skupine.
Pokus 22. Sinteza FeS
Članovi skupine: ………………………………………………………………………Moj doprinos: a) izvođenju pokusa ………………..%
b) opažanjima i diskusiji …………%
c) formuliranju zaključaka……..…%
Ocjena koju zaslužujem (1 do 5) ……………
Opažanja i zaključci:
Pokus 23. Toplina neutralizacije
Pribor i kemikalije: Dvije plastične čaše od mliječnih proizvoda, kartonski poklopac s rupicom za termometar, alkoholni termometar od 0 do 100 °C, dvije injekcijske štrcaljke od 20 mL ili dvije menzure od 25 mL, otopina natrijeva hidroksida, c(NaOH) = 1 mol L‒1, otopina klorovodične kiseline, c(HCl) = 1 mol L‒1.
Opis pokusa
VIDEO: 23-Toplina neutralizacije.mp4
- Otopite 4,0 g natrijeva hidroksida u 100 mL destilirane vode
-
Otopinu klorovodične kiseline pripremite miješanjem 11 mL koncentrirane (36-postotne) klorovodične kiseline i 90 mL destilirane vode. Otopine ostavite do sutradan, dalje od izvora topline, da poprime sobnu temperaturu.
-
Injekcijskom štrcaljkom odmjerite 20 mL otopine natrijeva hidroksida i ulijte u unutarnju čašu kalorimetra. Poklopite kalorimetar kartonskim poklopcem s rupicom. Kroz rupicu provucite termometar, pričekajte minutu i zabilježi početnu temperaturu otopine, tpočetno.
-
Otklopite na trenutak kalorimetar, dolijte 20 mL otopine klorovodične kiseline, poklopite kalorimetar i miješaj reakcijsku smjesu termometrom. Zabilježi najvišu temperaturu reakcijske smjese, tkonačno.
-
Pretpostavite da je gustoća otopina jednaka 1,0 g cm–3 i da je specifični toplinski kapacitet otopine cp(otopina) = 4,19 J g K─1, te izračunajte količinu oslobođene topline, q, prema formuli:
q = m(voda) × cp(otopina) × ∆t
gdje je cp(otopina) = 4,19 J g K─1, ∆t = tkonačno – tpočetno
Je li se temperatura reakcijskog sustava povisila ili snizila?
Je li došlo do egzotermne ili endotermne promjene?
Je li tijekom reakcije toplina prelazi iz sustava u okolinu ili obratno?
Kad bismo pomiješali 40 mL otopine natrijeva hidroksida s 40 mL otopine klorovodične kiseline, bi li konačna temperatura reakcijske smjese bila ista, viša ili niža u odnosu na prethodni eksperiment?
Napišite u ionskom obliku jednadžbu reakcije između natrijeva hidroksida i klorovodične kiseline. Koji ioni međusobno reagiraju? Što je preostalo u otopini?
YouTube Video: Calorimetry Experiment
Primjenite sljedeći obrazac kako biste rezultate pokusa, opažanja i zaključke spremili u pretinac na svom računalu i podijelili s nastavnikom i ostalim članovima skupine.
Pokus 23. Toplina neutralizacije
Članovi skupine: ………………………………………………………………………Moj doprinos: a) izvođenju pokusa ………………..%
b) opažanjima i diskusiji …………%
c) formuliranju zaključaka……..…%
Ocjena koju zaslužujem (1 do 5) ……………
Opažanja i zaključci:
Pokus 24. Redukcija bakrovih iona cinkom
Pribor i kemikalije: epruveta, 10-postotna otopina modre galice, injekcijska štrcaljka od 5 ili 10 mL, cink u prahu, gumeni čep za epruvetu, plastična žličica.
Opis pokusa
VIDEO: 24-Galvanski clanak.mp4
1. Injekcijskom štrcaljkom odmjerite 5 mL otopine modre galice i izlijte u običnu epruvetu.
2. Rukom osjetite temperaturu otopine.
3. Plastičnom žličicom, kakva se dobije iz automata za kavu, zagrabite malo cinka u prahu i istresite u epruvetu s modrom galicom.
4. Začepite epruvetu gumenim čepom i snažno promućkajte. Rukom osjetite promjenu temperature.
5. Ako vam je dostupan digitalni voltmetar, načinite galvanski članak. U limun ili jabuku, na međusobnom razmaku 1 do 2 cm, zabijte pocinčani željezni čavao i deblju bakrenu žicu. Spojite elektrode na polove digitalnog voltmetra i očitajte razliku potencijala. Koja je elektroda plus pol, a koja minus pol galvanskog članka?
Je li došlo do povišenja ili sniženja temperature reakcijske smjese.
Je li došlo do egzotermne ili endotermne promjene?
Koje ione sadržava otopina modre galice? Kakve je boje otopina?
Je li se nakon dodatka cinka u prahu promijenila boja otopine?
Kakve je boje cink u prahu?
Kakve je boje talog nakon protresanja epruvete.
Na što vas podsjeća boja tog taloga?
Napišite jednadžbu reakcije između iona Cu2+ i cinka.
U pokusu s cinkom i otopinom modre galice jedan je učenik upotrijebio 5 mL otopine modre galice i pripadnu količinu cinka. Drugi je učenik uzeo 10 mL iste otopine modre galice i dva puta veću količinu cinka. Nakon provedenog pokusa ustanovili su da je u oba kalorimetra došlo do jednakog porasta temperature. Obrazložite rezultat pokusa.
YouTube Video: Химическая реакция цинка и медного купороса
Primjenite sljedeći obrazac kako biste rezultate pokusa, opažanja i zaključke spremili u pretinac na svom računalu i podijelili s nastavnikom i ostalim članovima skupine.
Pokus 24. Redukcija bakrovih iona cinkom
Članovi skupine: ………………………………………………………………………Moj doprinos: a) izvođenju pokusa ………………..%
b) opažanjima i diskusiji …………%
c) formuliranju zaključaka……..…%
Ocjena koju zaslužujem (1 do 5) ……………
Opažanja i zaključci:
Pokus 25. Reakcija limunske kiseline i kristalne sode
Pribor i kemikalije: čaša od 100 mL, drveni štapić, 2 plastične žlice, limunska kiselina, kristalna soda (natrijev karbonat dekahidrat, Na2CO3·10H2O)
Opis pokusa
VIDEO: 25-Endotermna promjena.mp4
1. U malu plastičnu čašu od 200 mL stavite oko 10 g limunske kiseline. K tomu dodajte oko 20 g usitnjene kristalne sode.
2. Sadržaj čaše polagano i pažljivo miješajte drvenim štapićem. Rukom osjetite promjenu temperature reakcijske smjese.
Opišite promjene do kojih dolazi
tijekom miješanja limunske kiseline i kristalne sode.
Jesu li se u ovom pokusu dogodile fizičke ili kemijske promjene?
Kad se pomiješaju limunska kiselina i kristalna soda razvija se ugljikov dioksid. Je li za razlaganje karbonatnih iona, CO32–, na ugljikov dioksid i prijelaz iz krutog u plinovito agregacijsko stanje potrebno utrošiti energiju (toplinu)?
Je li nakon mješanja krute limunske kiseline i krute kristalne sode reakcijska smjesa kruta ili tekuća?
Je li za prijelaz iz krutog u tekuće agregacijsko stanje (ili otopinu) treba utrošiti energiju (toplinu)?
Je li u ovom pokusu došlo do egzotermne ili endotermne promjene?
Je li u ovom pokusu toplina prelazi iz reakcijskog sustava u okolinu ili obratno?
Zašto se reakcijska smjesa ohladila?
YouTube Video: Endothermic reaction: very, VERY cool.
YouTube Video: Elementary Productions: Endothermic reaction
Primjenite sljedeći obrazac kako biste rezultate pokusa, opažanja i zaključke spremili u pretinac na svom računalu i podijelili s nastavnikom i ostalim članovima skupine.
Pokus 25. Reakcija limunske kiseline i kristalne sode
Članovi skupine: ………………………………………………………………………Moj doprinos: a) izvođenju pokusa ………………..%
b) opažanjima i diskusiji …………%
c) formuliranju zaključaka……..…%
Ocjena koju zaslužujem (1 do 5) ……………
Opažanja i zaključci:
Pokus 26. Kako koncentracija reaktanata utječe na brzinu kemijske reakcije
Pribor i kemikalije: 2 čaše od 100 mL, 2 injekcijske štrcaljke od 20 mL, otopina natrijeva tiosulfata, razrijeđena otopina sumporne kiseline, destilirana voda, zaporni sat (štoperica)
Opis pokusa
VIDEO: 26-Brzina
reakcije-konc.mp4
1. Odvažite 30 g natrijeva tiosulfata pentahidrata, Na2S2O3∙5H2O, i otopite u 500 mL destilirane vode.
2. Pripremite razrijeđenu sumpornu kiselinu tako da 6,5 mL koncentrirane sumporne kiseline uz miješanje ulijete u 500 mL destilirane vode.
3. Na papiru veličine 10 cm × 10 cm flomasterom nacrtajte jasno vidljiv znak ili slovo.
4. Injekcijskom štrcaljkom ili menzurom odmjerite 30 mL destilirane vode i izlijte u čašu.
5. Injekcijskom štrcaljkom ili menzurom odmjerite 10 mL otopine natrijeva tiosulfata i izlijte u istu čašu. Promiješajte.
6. Drugom injekcijskom štrcaljkom odmjerite 10 mL razrijeđene otopine sumporne kiseline, ulijte u čašu s otopinom natrijeva tiosulfata i istodobno pokrenite zaporni sat. Promiješajte sadržaj čaše s dva tri kružna pokreta rukom. Čašu postavite na sredinu znaka. Kad se sadržaj čaše toliko zamuti da znak bude jedva vidljiv, zaustavite zaporni sat. Zapišite vrijeme od trenutka miješanja otopina do nestanka znaka.
7. Izmjerite i zapišite temperaturu dobivene mutne otopine.
8. Isperite čašu i ponovite pokus, ali tako da u čašu ulijete 20 mL destilirane vode i 20 mL otopine natrijeva tiosulfata. Promiješajte, dodajte 10 mL razrijeđene otopine sumporne kiseline i pokrenite zaporni sat. Zapišite vrijeme od trenutka miješanja otopina do nestanka znaka.
Jesu li visina stupca ili ukupni volumeni otopina u oba pokusa bili jednaki?
Je li koncentracije natrijeva tiosulfata u oba pokusa bila jednaka?
Je li koncentracija sumporne kiseline u oba pokusa bila jednaka?
Jesu li se otopine u oba pokusa jednako brzo zamutile?
Pod utjecajem kiseline natrijev tiosulfat se raspada tako da se izluči elementarni sumpor od kojega se otopina zamuti. Jesu li se u oba pokusa izlučile jednake količine sumpora?
U kakvu su odnosu vremena potrebna da se postigne jednako zamućenje otopine u prvom i drugom pokusu?
Ovisi li brzina kemijske reakcije (izlučivanje sumpora) o koncentraciji natrijeva tiosulfata?
YouTube Video: Rate of Reaction of Sodium Thiosulfate and Hydrochloric Acid
YouTube Video: Factors Affecting Rates of Reactions
Primjenite sljedeći obrazac kako biste rezultate pokusa, opažanja i zaključke spremili u pretinac na svom računalu i podijelili s nastavnikom i ostalim članovima skupine.
Pokus 26. Kako koncentracija reaktanata utječe na brzinu kemijske reakcije
Članovi skupine: ………………………………………………………………………Moj doprinos: a) izvođenju pokusa ………………..%
b) opažanjima i diskusiji …………%
c) formuliranju zaključaka……..…%
Ocjena koju zaslužujem (1 do 5) ……………
Opažanja i zaključci:
Pokus 27. Utjecaj temperature na brzinu kemijske reakcije
Pribor i kemikalije: Isti pribor i kemikalije kao u pokusu 26.
Opis pokusa
VIDEO: 27-Brzina reakcije - temp.mp4
1. Na komadu papira veličine 10 cm × 10 cm flomasterom nacrtajte jasno vidljiv znak ili slovo.
2. Injekcijskom štrcaljkom ili menzurom odmjerite 30 mL destilirane vode zagrijane na oko 40 ºC i izlijte u čašu.
3. Injekcijskom štrcaljkom ili menzurom odmjerite 10 mL otopine natrijeva tiosulfata i izlijte u istu čašu.
4. Drugom injekcijskom štrcaljkom odmjerite 10 mL razrijeđene otopine sumporne kiseline, ulijte u čašu s otopinom natrijeva tiosulfata i istodobno pokrenite zaporni sat. Pridržavajući čašu rukom promiješajte njezin sadržaj s dva tri kružna pokreta. Čašu postavite na sredinu znaka. Kad se sadržaj čaše toliko zamuti da znak bude jedva vidljiv, zaustavite zaporni sat. Zapišite vrijeme od trenutka miješanja otopina do nestanka znaka.
5. Za zaključke o ovisnosti brzine kemijske reakcije o temperaturi upotrijebite već gotove rezultate iz pokusa 26 (točke 4, 5, 6 i 7).
Jesu li temperature reakcijskih smjesa u ovom i prethodnom pokusu bile jednake?
Koliko je vremena prošlo od početka pokusa do nestanka vidljivosti znaka ispod čaše u pokusu izvedenom pri sobnoj temperaturi?
Koliko je vremena prošlo od početka pokusa do nestanka vidljivosti znaka ispod čaše u pokusu izvedenom pri povišenoj temperaturi?
Jesu li u oba pokusa koncentracije svih reaktanata bile jednake?
Na temelju rezultata pokusa zaključite kako se mijenja brzina kemijske reakcije porastom temperature reakcijske smjese?
YouTube Video: Glowstick Reaction Rate
YouTube Video: Temperature and Reaction Rate
Primjenite sljedeći obrazac kako biste rezultate pokusa, opažanja i zaključke spremili u pretinac na svom računalu i podijelili s nastavnikom i ostalim članovima skupine.
Pokus 27. Utjecaj temperature na brzinu kemijske reakcije
Članovi skupine: ………………………………………………………………………Moj doprinos: a) izvođenju pokusa ………………..%
b) opažanjima i diskusiji …………%
c) formuliranju zaključaka……..…%
Ocjena koju zaslužujem (1 do 5) ……………
Opažanja i zaključci:
Pokus 28. Katalitički raspad vodikova peroksida
Pribor i kemikalije: Erlenmeyerova tikvica od 100 mL, detergent za pranje posuđa, 10-postotna otopina vodikova peroksida, H2O2, manganov dioksid, MnO2
Opis pokusa
VIDEO: 28-Raspad H2O2.mp4
1. Pokus izvedite na poslužavniku. Upotrijebite zaštitne rukavice i naočale.
2. U Erlenmeyerovu tikvicu ulijte oko 20 mL 10-postotne otopine vodikova peroksida. Dodajte 1 do 2 mL tekućeg detergenta za pranje posuđa i promiješajte sadržaj tikvice. Ovoj smjesi dodajte na vrh noža manganova dioksida. Uočite promjene.
Kako utječe dodatak manganova dioksida u otopinu vodikova peroksida i detergenta za pranje posuđa?
Zašto se smjesa zapjeni?
Napišite jednadžbu reakcije.
Je li raspadanje vodikova peroksida egzotermna ili endotermna promjena?
Kakva je uloga manganova dioksida u ovom pokusu?
Zašto u većini laboratorija otopine vodikova peroksida čuvaju u hladnjaku?
YouTube Video: Catalytic decomposition of hydrogen peroxide
Primjenite sljedeći obrazac kako biste rezultate pokusa, opažanja i zaključke spremili u pretinac na svom računalu i podijelili s nastavnikom i ostalim članovima skupine.
Pokus 28. Katalitički raspad vodikova peroksida
Članovi skupine: ………………………………………………………………………Moj doprinos: a) izvođenju pokusa ………………..%
b) opažanjima i diskusiji …………%
c) formuliranju zaključaka……..…%
Ocjena koju zaslužujem (1 do 5) ……………
Opažanja i zaključci:
Pokus 29. Enzimi su katalizatori kemijskih reakcija
Pribor i kemikalije: 2 Petrijeve zdjelice, satno staklo, 2 čaše od 200 mL, staklokeramička pločica, tronožac, plamenik, 5-postotna otopina vodikova peroksida, svježi krumpir ili komadić svježe pileće jetre
Opis pokusa
VIDEO: 29-Katalaza.mp4
1. Od svježega krumpira izrežite pločicu debljine 5 do 10 mm. Pločicu prerežite na dva jednaka dijela. Jedan dio stavite u kipuću vodu i kuhajte oko 5 minuta. Prokuhani krumpir izvadite iz kipuće vode, odložite na satno staklo pa pričekajte da se ohladi.
2. U Petrijevu zdjelicu ulijte 10 do 15 mL 5-postotne otopine vodikova peroksida. Pločice od nekuhanog i kuhanog krumpira položite u Petrijevu zdjelicu, što dalje jednu od druge.
3. Ponovite pokus sa svježom i prokuhanom pilećom jetrom. Uočite promjene.
Što opažate u okolini svježega, a što u okolini prokuhanog krumpira?
Kako na otopinu vodikova peroksida djeluje svježa, a kako prokuhana pileća jetra.
Koje tvari iz svježega krumpira i pileće jetre uzrokuju raspad vodikova peroksida?
Što se događa kad se krumpir i pileća jetra prokuhaju?
Što će se dogoditi ako otopini vodikova peroksida dodate prokuhani manganov dioksid?
Što su enzimi?
Gdje se enzimi nalaze i čemu služe.
Nabrojite nekoliko tvari koje sadržavaju enzime, a mogu se nabaviti u trgovinama kućnih potrepština.
Je li svaki enzim katalizira svaku kemijsku reakciju?
YouTube Video: Hydrogen Peroxide and Blood
YouTube Video: Effect of Enzyme Concentration on Rate of Reaction
Primjenite sljedeći obrazac kako biste rezultate pokusa, opažanja i zaključke spremili u pretinac na svom računalu i podijelili s nastavnikom i ostalim članovima skupine.
Pokus 29. Enzimi su katalizatori kemijskih reakcija
Članovi skupine: ………………………………………………………………………Moj doprinos: a) izvođenju pokusa ………………..%
b) opažanjima i diskusiji …………%
c) formuliranju zaključaka……..…%
Ocjena koju zaslužujem (1 do 5) ……………
Opažanja i zaključci:
Pokus 30. Rompski i monoklinski sumpor
DEMONSTRACIJSKI POKUS
Pribor i kemikalije: čaša od 200 mL s kipućom vodom, epruveta, lijevak, filtrirni papir, satno staklo, pinceta ili kliješta za lončiće, drvena štipaljka za epruvete, povećalo, sumpor, metilbenzen
Opis pokusa
VIDEO: 30-Rompski i monoklinski sumpor.mp4
- Monoklinski sumpor može se dobiti na dva načina. U epruvetu uspite 3 do 4 g sumpora i rastalite ga. Grijte vrlo polagano i strpljivo, visoko iznad plamena plinskog plamenika, tako da dobijete svjetložutu tekućinu. Rastaljeni sumpor izlijte u lijevak od filtrirnog papira. Kad se na površini sumpora uhvatite kožica, raširite filtrirni papir. Odmah uz pomoć povećala promatrajte kako iz preostale taline rastu kristali monoklinskoga sumpora.
-
Stavite u epruvetu malo sumpora i dolijte 4 do 5 mL maslinova ulja. Zagrijavajtete epruvetu sa sumporom i maslinovim uljem uz neprekidno mućkanje. Ulje ne smije potamnjeti. Kad se veći dio sumpora otopi, stavite epruvetu u stalak i pustite da se hladi. Tijekom sljedećih nekoliko sati na dnu epruvete pojavit će se igličasti kristali monoklinskoga sumpora. (Ako ulje počne smrditi ili ako potamni, vjerojatno se radi o patvorenom maslinovom ulju.)
-
Rompski sumpor dobit ćete tako da u epruvetu s malo sumpora u prahu dolijete 2 do 3 mL metilbenzena (zapaljivo organsko otapalo). Epruvetu sa sumporom i metilbenzenom uronite u čašu s vrućom vodom i povremeno promućkajte dok se većina sumpora ne otopi.
- Ohlađenu bistru otopinu izlijte na satno staklo kroz lijevak s filtrirnim papirom. Satno staklo postavite u digestor ili na prozor, prekrijte filtrirnim papirom i pustite da metilbenzen polagano ispari. Za to će trebati nekoliko dana. Na satnom staklu zaostaju kristali rompskog sumpora. Upotrijebite povećalo da bolje uočite oblik kristala.
Opišite oblik kristala dobivenih hlađenjem rastaljena sumpora.
Kakav oblik imaju kristali sumpora dobiveni hlađenjem otopine sumpora u maslinovu ulju.
Prikažite crtežom oblik kristala rompskog sumpora dobivenog isparavanjem otopine sumpora u metilbenzenu.
Prikažite perspektivnim crtežom sljedeća geometrijska tijela: kocka, heksagonska prizma, trigonska prizma, tetragonska prizma, rompska prizma, monoklinska prizma (samo jedan kut nije pravi), triklinska prizma (svi su kutovi nepravi).
YouTube Video: Growing Beautiful yellow Crystals of Sulfur! Cool Chemical Experiment!
YouTube Video: Understand the Effect of heat on Sulphur
Primjenite sljedeći obrazac kako biste rezultate pokusa, opažanja i zaključke spremili u pretinac na svom računalu i podijelili s nastavnikom i ostalim članovima skupine.
Pokus 30. Kako dobiti rompski i monoklinski sumpor
Članovi skupine: ………………………………………………………………………Moj doprinos: a) izvođenju pokusa ………………..%
b) opažanjima i diskusiji …………%
c) formuliranju zaključaka……..…%
Ocjena koju zaslužujem (1 do 5) ……………
Opažanja i zaključci:
Pokus 31. Plastični sumpor
DEMONSTRACIJSKI POKUS
Pribor i kemikalije: čaša od 200 mL s hladnom vodom, epruveta, drvena štipaljka za epruvete, pinceta, sumpor u prahu
Opis pokusa
VIDEO: 31-Plasticni sumpor.mp4
- Više od polovine epruvete napunitete sumporom u prahu. Epruvetu uhvatite pri vrhu drvenom štipaljkom i zagrijavajte visoko iznad plamena plinskog plamenika. Grijte vrlo polagano i strpljivo tako da se sumpor rastali u svijetložutu tekućinu. Protresite epruvetu i čut ćete zvuk kakav se čuje pri mućkanju vode u epruveti.
Prikažite crtežom kako zamišljate strukturu te lako pokretljive tekućine.
- Nastavite zagrijavati tekući sumpor malo jačim plamenom i uočite promjenu njegove boje i viskoznosti. U trenutku kad poprimi boju trešnje, sumpor će se toliko zgusnuti da epruvetu možete okrenuti otvorom prema dolje.
Kakve se promjene događaju na S8 molekulama kad se boja i viskoznost sumpora mijenja zbog povišenja temperature?
Prikažite crtežom kako zamišljate strukturu te viskozne tekućine.
Što razumijete pod pojmom viskoznost. Navedite primjere.
- Nastavite zagrijavati sumpor sve do početka ključanja. Odmah ugasite plamenik da se sumpor ne zapali. Kružnim pokretima izlijte sumpor u tankom mlazu u čašu s hladnom vodom. Dobit ćete plastični sumpor. Pincetom izvaditete dobiveni sumpor i ispitajtete njegova fizička svojstva.
Prikažite crtežom kako zamišljate međusobni razmještaj lanaca od atoma sumpora u mlazu koji teče iz epruvete.
Može li se dobiveni plastični sumpor rastezati poput gume?
Ima li plastični sumpor kristalnu strukturu?
Prikažite crtežom kako zamišljate međusobni razmještaj lanaca od atoma sumpora u plastičnom sumporu.
Što se događa kad sumpor dulje vrijeme mijesite među prstima?
YouTube Video: Chemistry experiment 53 - Plastic Sulfur
Primjenite sljedeći obrazac kako biste rezultate pokusa, opažanja i zaključke spremili u pretinac na svom računalu i podijelili s nastavnikom i ostalim članovima skupine.
Pokus 31. Što se sve događa pri zagrijteavanju sumpora
Članovi skupine: ………………………………………………………………………Moj doprinos: a) izvođenju pokusa ………………..%
b) opažanjima i diskusiji …………%
c) formuliranju zaključaka……..…%
Ocjena koju zaslužujem (1 do 5) ……………
Opažanja i zaključci:
Pokus 32. Ispitivanje svojstava sumporova dioksida
DEMONSTRACIJSKI POKUS
Pribor i kemikalije: suho stakleno zvono, kratka svijeća, porculanska zdjelica, plavi lakmusov papir, plavi cvijet (najbolje iris), mala porculanska zdjelica, sumporna traka, pinceta, Petrijeva zdjelica, koncentrirana otopina amonijaka
Opis pokusa
VIDEO: 32-Sumporov dioksid.mp4
- Složite pribor kao na slici 3.1. Svjež vlažan cvijet postavite u malu vazu (bez vode). Na stjenku staklenog zvona prilijepite vlažan plavi lakmusov papir. Upalite kratku svijeću. Postavite porculansku zdjelicu na odgovarajuće mjesto. Sve skupa poklopite staklenim zvonom tako da ga jednom rukom pridržavate u kosom položaju da zrak slobodno ulazi. Drugom rukom uhvatite pincetom komadić sumporne trake, upalite na plamenu svijeće i brzo ispustite u porculansku zdjelicu. Odmah spustite stakleno zvono tako da sumporov dioksid ne izlazi u prostoriju. Uočite promjene.


Slika 32.1. Aparatura za ispitivanje svojstava sumporova dioksida
- Nakon što cvijet izblijedi ulijte u Petrijevu zdjelicu 1 do 2 mL koncentrirane otopine amonijaka. Prinesite zdjelicu kraj samog zvona. Jednom rukom odignite jednu stranu zvona, a drugom ugurajte zdjelicu pod zvono i odmah sve poklopite.
Što nastaje gorenjem sumpora na zraku? Napišite jednadžbu reakcije.
Je li nastali plin podržava gorenje?
Zašto se promijenila boja lakmusova papira? Napišite jednadžbu reakcije.
Što se dogodilo s bojom vlažnog cvijeta?
Što se dogodilo s lakmusovim papirom nakon uvođenja amonijaka pod stakleno zvono?
Što je uzrokovalo stvaranje dima nakon unošenja posudice s amonijakom pod stakleno zvono ispunjeno sumporovim dioksidom? Napišite jednadžbu reakcije.
Što se dogodilo s bojom cvijeta nakon uvođenja posudice s amonijakom pod zvono?
Može li irisov cvijet poslužiti kao indikator kiselina i lužina?
YouTube Video: Sulfur in pure oxygen
Primjenite sljedeći obrazac kako biste rezultate pokusa, opažanja i zaključke spremili u pretinac na svom računalu i podijelili s nastavnikom i ostalim članovima skupine.
Pokus 32. Ispitivanje svojstava sumporova dioksida
Članovi skupine: ………………………………………………………………………Moj doprinos: a) izvođenju pokusa ………………..%
b) opažanjima i diskusiji …………%
c) formuliranju zaključaka……..…%
Ocjena koju zaslužujem (1 do 5) ……………
Opažanja i zaključci:
Pokus 33. Kako koncentrirana sumporna kiselina djeluje na tvari organskog podrijetla
Pribor i kemikalije: Petrijeva zdjelica ili satno staklo, šećer, papir, komadić drva, komadić pamučne tkanine, kapalica s gumicom, koncentrirana sumporna kiselina, zaštitne naočale, zaštitne rukavice
Opis pokusa
VIDEO: 33-Sumporna kiselina.mp4
- Na Petrijevu zdjelicu ili veće satno staklo stavite male uzorke različitih tvari organskog podrijetla. Nastavnik će na svaki od uzoraka kapnuti kap koncentrirane sumporne kiseline. Pazite da vam sumporna kiselina ne dospije na nezaštićenu kožu ili odjeću. Ne dirajte uzorke prstima.
Opišite i obrazložite promjene koje opažate na uzorcima tvari organskog podrijetla?
Je li koncentrirana sumporna kiselina higroskopna?
Smije li se boca s koncentriranom sumpornom kiselinom začepiteti plutenim ili gumenim čepom?
Koji kemijski element sadržavaju sve tvari organskog podrijetla?
Primjenite sljedeći obrazac kako biste rezultate pokusa, opažanja i zaključke spremili u pretinac na svom računalu i podijelili s nastavnikom i ostalim članovima skupine.
Pokus 33. Kako koncentrirana sumporna kiselina djeluje na tvari organskog podrijetla
Članovi skupine: ………………………………………………………………………Moj doprinos: a) izvođenju pokusa ………………..%
b) opažanjima i diskusiji …………%
c) formuliranju zaključaka……..…%
Ocjena koju zaslužujem (1 do 5) ……………
Opažanja i zaključci:
Pokus 34. Bojenje plamena solima alkalijskih i zemnoalkalijskih metala
Pribor i kemikalije: plinski plamenik, satno stakalce, željezna žica Φ ≈ 2 mm, l ≈ 20 cm, otopine kalijeva nitrata, litijeva klorida, natrijeva klorida, kalcijeva nitrata, stroncijeva nitrata i barijeva klorida.
Opis pokusa
VIDEO: 34-Boje plamena - vatromet.mp4
1. Upalite plinski plamenik i podesite dotok zraka tako da dobijete šušteći plamen.
2. Na satno stakalce kapnite samo jednu kap otopine kalijeva nitrata i prinesite otvoru kroz koji plamenik uvlači zrak.
3. U šuštećem plamenu plinskog plamenika užarite vrh željezne žice i užarenim vrhom dotakni kapljicu s otopinom kalijeva nitrata. Otopina će se raspršiti u sitne kapljice koje će struja zraka povući u plamenik. Po mogućnosti promatrajte plamen kroz plavo tzv. kobaltno staklo.
4. Ponovite pokus s otopinama litijeva klorida, kalcijeva nitrata, stroncijeva nitrata, barijeva klorida i natrijeva klorida. Poslije svakog ispitivanja željeznu žicu jako zažarite sve do nestanka karakteristične boje plamena prethodnog pokusa.
5. Satno stakalce, kapaljka i epruvete moraju biti čisti i isprani destiliranom vodom. U protivnom će se uvijek pojavljivati žuta boja koja potječe od natrijevih iona koji su najčešće onečišćenje laboratorijskog pribora.
Zašto smo pokus bojenja plamena najprije izveli s kalijevim, a tek na kraju s natrijevim solima?
Zašto soli različitih alkalijskih i zemnoalkalijskih metala boje plamen različitim bojama?
Što razumijete pod pojmovima kontinuirani spaktar i linijski spektar?
Kakav
spektar emitiraju obične
žarulje s užarenom metalnom niti?
Postoje
li dva različita kemijska
elementa koja daju jednak linijski spektar?
YouTube Video: Alkali Flame Test
Primjenite sljedeći obrazac kako biste rezultate pokusa, opažanja i zaključke spremili u pretinac na svom računalu i podijelili s nastavnikom i ostalim članovima skupine.
Pokus 34. Bojenje plamena solima alkalijskih i zemnoalkalijskih metala
Članovi skupine: ………………………………………………………………………Moj doprinos: a) izvođenju pokusa ………………..%
b) opažanjima i diskusiji …………%
c) formuliranju zaključaka……..…%
Ocjena koju zaslužujem (1 do 5) ……………
Opažanja i zaključci:
Pokus 35. Kako magnezij i kalcij reagiraju s vodom
VIDEO: 35-Magnezij
i
kalcij.mp4
Opis pokusa
- Komadić magnezijeve vrpce, ne dulji od 2 cm, očistite brusnim papirom. U epruvetu ulijte dva do tri mL destilirane vode. Ubacite u epruvetu očišćenu magnezijevu vrpcu. Jesu li vidljive neke promjene?
-
Zagrijte sadržaj epruvete skoro do vrenja. Uočite promjene.
-
Odlijte bistru otopinu u drugu epruvetu. Bistroj otopini dodajte kap otopine fenolftaleina i zabilježite promjene. Ostatak magnezijeve vrpce isperite vodom, obrišite krpom i vratite nastavniku.
-
Vrlo mali komadić kalcija presjecite kliještama. Uočite metalni sjaj na presjeku.
-
Petrijevu zdjelicu napunite do polovine vodom. Ubacite komadić kalcija u zdjelicu i promatraj razvijanje plina. Odmah primaknite upaljenu šibicu mjestu gdje se razvija plin. Dodajte u zdjelicu kap otopine fenolftaleina i zabilježite opažanja.
Pokazuje
li očišćena magnezijeva
vrpca metalni sjaj?
Što se nalazilo na
površine magnezijeve vrpce?
Reagira li magnezij s
hladnom vodom?
Što se događa s
magnezijem u vrućoj vodi? Napišite jednadžbu reakcije.
Što smo dokazali
otopinom fenolftaleina?
Pokazuje li kalcij na
presjeku metalni sjaj?
Što se događa kad
kalcij ubacite u vodu?
Je li plin koji
nastaje međusobnom reakcijom kalcija i vode zapaljiv?
Koji bi to plin mogao
biti?
Napišite jednadžbu
reakcije kalcija s vodom.
Što dokazuje promjena
boje fenolftaleina u dobivenoj otopini.
YouTube Video: Reaction of Magnesium and Water
YouTube Video: Burning magnesium in dry icePokus 35. Kako magnezij i kalcij reagiraju s vodom
Članovi skupine: ………………………………………………………………………Moj doprinos: a) izvođenju pokusa ………………..%
b) opažanjima i diskusiji …………%
c) formuliranju zaključaka……..…%
Ocjena koju zaslužujem (1 do 5) ……………
Opažanja i zaključci:
Pokus 36. Što nastaje žarenjem kalcijeva karbonata
Pribor i kemikalije: Ljuštura bilo koje morske školjke ili puževa kućica, manja čaša s malo destilirane vode, pinceta, plamenik, otopina fenolftaleina
Opis pokusa
VIDEO: 36-Kalcijev karbonat.mp4
- Stavite puževu kućicu ili ljušturu manje školjke u vodu i dodajte kap otopine fenolftaleina.
Koji je kemijski spoj najvažniji sastojak ljuštura školjki i puževih kućica?.
Jesu li ljušture uginulih školjki ili puževih kućica topljive u vodi?
Je li fenolftalein mijenja boju u vodi s ljušturom školjke ili puževe kućice?
- Izvadite puževu kućicu ili školjku iz vode, obrišite krpom i uhvatite laboratorijskim kliještama. Samo rub puževe kućice ili školjke unesite u šušteći plamen plinskog plamenika i zagrijavajte na istom mjestu sve dok ne uočite bijeli žar. Pustite da se školjka malo ohladi, a zatim ju ponovno uronite u vodu s malo fenolftaleina.
Je li fenolftalein promijenio boju? Što to dokazuje?
Što se događa tijekom žarenja puževe kućice ili ljušture školjke? Napišite jednadžbu reakcije.
Napišite jednadžbu reakcije dobivenog produkta s vodom.
Što je vapnena voda? Koji kemijski spoj ona sadržava?
Jednadžbom reakcije obrazložite promjene do kojih dolazi u vapnenoj vodi kad se kroz nju puše zrak iz pluća.
YouTube Video: Limestone Cycle - limestone, quicklime and slaked lime
Primjenite sljedeći obrazac kako biste rezultate pokusa, opažanja i zaključke spremili u pretinac na svom računalu i podijelili s nastavnikom i ostalim članovima skupine.
Pokus 36. Što nastaje žarenjem kalcijeva karbonata
Članovi skupine: ………………………………………………………………………Moj doprinos: a) izvođenju pokusa ………………..%
b) opažanjima i diskusiji …………%
c) formuliranju zaključaka……..…%
Ocjena koju zaslužujem (1 do 5) ……………
Opažanja i zaključci:
Pokus 37. Usporedba svojstava ukosnice i željeznog čavla
Pribor: ukosnica, željezni čavao duljine 4 do 5 cm, pinceta, čaša s vodom, plinski plamenik, brusni papir, fina turpija, dvoja kombinirana kliješta
Opis pokusa
VIDEO: 37-Celik.mp4
1. Uzmite običnu nelakiranu ukosnicu. Izrađena je od čelika koji sadržava oko 1 % ugljika. Uvjerite se u njezinu elastičnost. Finom turpijom ispitajte tvrdoću ukosnice. Takva su svojstva ukosnice dobivena određenim postupkom u proizvodnji.
2. Uhvatite ukosnicu za jedan kraj pincetom i unesite u šušteći plamen plinskog plamenika. Kad se ukosnica užari, polagano ju izdižite iz plamena tako da se što polaganije ohladi.
Pokušajte saviti ukosnicu. Kakva su joj svojstva? Je li elastična? Finom turpijom ispitajte njezinu tvrdoću.
3. Istoj ukosnici vratite prijašnji oblik, ponovno užarite do crvenog usijanja i naglo, bez oklijevanja, bacite u hladnu vodu. Taj se postupak naziva kaljenje. Uhvatite ukosnicu za njezine krajeve i pokušajte je rastvoriti. Puknut će poput stakla na presavijenom dijelu. Sačuvajte jednu polovinu, a drugu ispitajte finom turpijom i pokušajte slomiti prstima.
Razlikuju li se tvrdoće nove, žarene i kaljene ukosnice? Što opažate?
4. Brusnim papirom oprezno očistite do metalnoga sjaja površinu sačuvane polovine kaljene ukosnice. Jedan kraj ukosnice uhvatite pincetom i držite na oko 5 do 10 cm iznad plamena plinskoga plamenika dok brušena površina ukosnice ne poprimi plavoljubičastu boju. U tom trenutku bacite ukosnicu u hladnu vodu. Ispitajte je li sada ukosnica krhka ili elastična? Ispitajte tvrdoću ukosnice turpijom.
5. Jednakim postupkom ispitajte svojstva običnog tankog željeznog čavla. Upotrijebite dvoja kombinirana kliješta i pomoću njih savijajte čavle. Čavli se izrađuju od željeza koje sadržava manje od 0,4 % ugljika.
Mijenja li se tijekom žarenja kemijski sastav ukosnice?
Ovise li svojstva čelika o njegovu kemijskom sastavu?
Kakva mehanička svojstva (tvrdoća, elastičnost) ima običan željezni čavao nakon žarenja i polaganog hlađenja?
Kakva mehanička svojstva (tvrdoća, elastičnost) ima običan željezni čavao nakon žarenja i naglog hlađenja u vodi?
Ovise li svojstva čelika o načinu toplinske obrade?
YouTube Video: Water Quenching
Primjenite sljedeći obrazac kako biste rezultate pokusa, opažanja i zaključke spremili u pretinac na svom računalu i podijelili s nastavnikom i ostalim članovima skupine.
Pokus 37. Usporedba svojstava ukosnice i običnog željeznog čavla
Članovi skupine: ………………………………………………………………………Moj doprinos: a) izvođenju pokusa ………………..%
b) opažanjima i diskusiji …………%
c) formuliranju zaključaka……..…%
Ocjena koju zaslužujem (1 do 5) ……………
Opažanja i zaključci:
Pokus 38. Provode li otopine kiselina i lužina električnu struju
Pribor i kemikalije: digitalni instrument za mjerenje električnog otpora, napona i jakosti struje, 2 žice s banana-utikačima i krokodil-štipaljkama, par ugljenih elektroda, dvopolni utikač, transformator za električno zvonce 4 do 8 V, destilirana voda, razrijeđena otopina klorovodične ili sumporne kiseline.
Opis pokusa
VIDEO: 38-Elektroliti.mp4
- Iz dvije istrošene standardne AA baterije izvadite ugljene elektrode. Na izvode dvopolnog utikača stavite banana priključnice. Jednu elektrodu pripojite na COM pol digitalnog instrumenta. Drugu elektrodu pripojite na jedan pol izvora izmjenične struje napona 4 do 8 V (transformator za električno zvonce). Drugi pol izvora izmjenične struje pripojite na priključnicu A digitalnog instrumenta.

Slika 35.1. Pribor za ispitivanje električne vodljivosti otopina
- Ulijte u čašu toliko destilirane vode da dobijete stupac visine oko 2 cm. Elektrode spustite u vodu tako da dotiču dno čaše. Preklopnik digitalnog instrumenta postavite na položaj 200 m u mjernom području ACA (200 mA izmjenične struje). Uključite instrument pritiskom na tipku ON/OFF. Pročitajte i zabilježite jakost struje. Ako instrument pokaže 1, to znači da ispitivani uzorak ne vodi električnu struju ili je strujni krug negdje prekinut
-
Kapalicom s gumicom dodajte kap otopine razrijeđene (1 M otopine) klorovodične ili sumporne kiseline. Pročitajte i zabilježite jakost struje nakon dodatka kiseline. Dodajte još jednu kap kiseline i pročitajte jakost struje.
-
Nakon provedenih mjerenja digitalni instrument isključite pritiskom na preklopnik ON/OFF. Sondu isperite destiliranom vodom.
-
Ponovite isti pokus tako da u destiliranu vodu kapalicom dodajete kap po kap 1 M otopinu natrijeva hidroksida, octene kiseline, amonijaka, natrijeva klorida i 10-postotne otopine običnog šećera. Ne zaboravite svaki put destiliranom vodom temeljito isprati čašicu i elektrode.
Opaska: 1 M otopine sadržavaju 1 mol tvari u 1 L otopine, odnosno 36,5 g HCl, 98 g H2SO4, 40 g NaOH, 60 g CH3COOH, 17 g NH3, 59 g NaCl.
Provodi li destilirana voda električnu struju?
Koje vrste čestica sudjeluju u provođenju električne struje u destiliranoj vodi?
Napišite jednadžbu ionizacije vode.
Je li se povećala jakost struje kroz uređaj nakon dodatka jedne kapi razrijeđene otopine klorovodične kiseline u destiliranu vodu?
Kako broj kapi dodane kiseline utječe na jakost struje kroz uređaj?
Koje vrste čestica sudjeluju u provođenju električne struje u otopini klorovodične kiseline?
Je li dodatak jednakog broja kapi otopine octene kiseline ili amonijaka uzrokuje jednak porast jakosti struje kao dodatak istog broja kapi otopina klorovodične ili sumporne kiseline? Obrazložite!
YouTube Video: Dissociation of NaCl
Primjenite sljedeći obrazac kako biste rezultate pokusa, opažanja i zaključke spremili u pretinac na svom računalu i podijelili s nastavnikom i ostalim članovima skupine.
Pokus 38. Provode li otopine kiselina i lužina električnu struju
Članovi skupine: ………………………………………………………………………Moj doprinos: a) izvođenju pokusa ………………..%
b) opažanjima i diskusiji …………%
c) formuliranju zaključaka……..…%
Ocjena koju zaslužujem (1 do 5) ……………
Opažanja i zaključci:
Pokus 39. Mogu li kiselina i lužina istodobno biti u istoj epruveti
Pribor i kemikalije: 2 epruvete, razrijeđena otopina natrijeva hidroksida, razrijeđena otopina klorovodične kiseline, otopina metiloranža.
Opis pokusa
VIDEO: 39-Kiselina i luzina.mp4
1. Dodajte u epruvetu kap otopine metiloranža i 4 do 5 mL otopine natrijeva hidroksida. Promućkajte sadržaj epruvete tako da poprimi jednoličnu žutu boju. U drugu epruvetu dodajte kap otopine metiloranža i 4 do 5 mL otopine klorovodične kiseline. Promućkajte sadržaj epruvete tako da poprimi jednoličnu crvenu boju.
2. Dugačkom kapalicom s gumicom usišite iz prve epruvete 3 do 4 mL otopine natrijeva hidroksida. Kapalicu s otopinom natrijeva hidroksida pažljivo unesite do samog dna epruvete s otopinom kiseline. Polagano istisnite njezin sadržaj i s još stisnutom gumicom izvucite kapalicu iz epruvete s kiselinom. Epruvetu s dva različito obojena sloja stavite u stalak na mirnu mjestu. Tijekom sljedećih desetak dana uočite promjene i opišite svoja zapažanja.
Je li se lužina i kiselina istodobno nalaze u istoj epruveti? Čime to dokazujete?
Je li granica između kiseline i lužine oštra ili postoji širok prijelaz boja? Obrazložite!.
Je li se granica između kiseline i lužine uvijek nalazi na istom mjestu ili se protekom vremena pomiče. Pretpostavite uzrok uočenih promjena.
Ako je u pokusu upotrijebljeno više kiseline pretpostavite kakav će biti pH otopine nakon desetak dana kad se koncentracija iona H3O+ izjednači u cijeloj epruveti?
Univerzalnim Indikatorskim papirom ispitajte pH otopine nakon miješanja. Je li u pokusu upotrijebljen višak kiseline ili lužine?
YouTube Video: Acids and Bases and You
Primjenite sljedeći obrazac kako biste rezultate pokusa, opažanja i zaključke spremili u pretinac na svom računalu i podijelili s nastavnikom i ostalim članovima skupine.
Pokus 39. Mogu li kiselina i lužina istodobno biti u istoj epruveti
Članovi skupine: ………………………………………………………………………Moj doprinos: a) izvođenju pokusa ………………..%
b) opažanjima i diskusiji …………%
c) formuliranju zaključaka……..…%
Ocjena koju zaslužujem (1 do 5) ……………
Opažanja i zaključci:
Pokus 40. Dokazivanje ugljikova dioksida u gaziranim napicima
Pribor i kemikalije: čaša od 100 mL, vapnena voda, injekcijska štrcaljka od 20 mL, gazirani napitak ili kisela voda
Opis pokusa
VIDEO: 40-Ugljikov dioksid.mp4
1. Ulijte u čašu malo svježe pripremljene vapnene vode. Otvorite bocu s gaziranim napitkom ili kiselom vodom. Injekcijskom štrcaljkom usišite plin neposredno iz boce s gaziranim napitkom.
2. Plin iz injekcijske štrcaljke propušite kroz vapnenu vodu. Ako se vapnena voda odmah ne zamuti ponovite postupak još nekoliko puta.
Obrazložite rezultate pokusa.
Napišite jednadžbu reakcije.
Kako se topljivost
ugljikova dioksida u vodi mijenja promjenom tlaka, a kako promjenom
<span
style="color: blue; text-decoration: none;">
temperature?
Proučite naljepnice na bocama mineralne vode i obične izvorske vode za piće. Uočite bitne razlike u njihovu sastavu.
Napišite jednadžbu reakcije otapanja kalcijeva karbonata u vodi koja sadržava otopljen ugljikov dioksid.
Proučite "kemikalije" u svom domu i otkrijte koje od njih sadržavaju karbonate ili hidrogenkarbonate.
Kako ćete dokazati da je gustoća ugljikova dioksida veća od gustoće zraka? Nacrtajte pripadnu aparaturu za svoj pokus.
Primjenite sljedeći obrazac kako biste rezultate pokusa, opažanja i zaključke spremili u pretinac na svom računalu i podijelili s nastavnikom i ostalim članovima skupine.
Pokus 40. Dokazivanje ugljikova dioksida u gaziranim napicima
Članovi skupine: ………………………………………………………………………Moj doprinos: a) izvođenju pokusa ………………..%
b) opažanjima i diskusiji …………%
c) formuliranju zaključaka……..…%
Ocjena koju zaslužujem (1 do 5) ……………
Opažanja i zaključci:
Pokus 41. Utječe li ugljikov dioksid na globalno zatopljenje
Pribor i kemikalije: plastična boca od 1,5 L od mineralne vode, crno obojena metalna pločica, željezni stalak s hvataljkom, sijalica od 100 W s reflektirajućim zrcalom, alkoholni termometar, Kippov aparat ili neki drugi izvor ugljikova dioksida.
Opis pokusa
VIDEO: 41-Globalno zatopljenje.mp4
1. Složite aparaturu kao na slici 6.2 u udžbeniku. Boci od mineralne vode ili gaziranog napitka odrežite gornji dio. Na dno boce postavite okruglu metalnu pločicu premazanu crnom bojom. Alkoholni termometar objesite tako da se rezervoar s alkoholom nađe točno u sredini plastične boce. Iznad boce postavite sijalicu s reflektirajućim zrcalom. Upalite sijalicu i pričekajte da sustav dođe u ravnotežno stanje pri kojem se temperatura više ne mijenja. Zabilježite temperaturu.
2. Oprezno, tako da se nijedan dio aparature ne pomakne, napunite plastičnu bocu ugljikovim dioksidom. Upotrijebite staklenu cjevčicu koja seže do dna boce. Kad se boca ispuni ugljikovim dioksidom izvucite staklenu cjevčicu. Pričekajte desetak minuta dok sustav ponovno ne dođe u ravnotežno stanje. Očitajte i zabilježite temperaturu.
Koju ulogu ima sijalica s reflektirajućim zrcalom i što ona u ovom pokusu predstavlja?
Koju ulogu ima crna pločica na dnu plastične boce?
Na temelju rezultata pokusa pretpostavite zašto povećanje koncentracije ugljikova dioksida uzrokuje povećanje prosječne temperature Zemljine površine.
Tijekom dana Zemljina se površina zagrijava a noću hladi. Jesu li vedre noći hladnije ili toplije od oblačnih? Obrazložite.
Je li u pokusu bolje upotrijebiti široku ili visoku bocu istog volumena? Obrazložite.
Što će se dogoditi ako nakon dovršenog pokusa ugljikov dioksid u boci zamijenimo zrakom?
YouTube Video: Carbon Dioxide And Global Warming - How Do We Know?
Primjenite sljedeći obrazac kako biste rezultate pokusa, opažanja i zaključke spremili u pretinac na svom računalu i podijelili s nastavnikom i ostalim članovima skupine.
Pokus 41. Utječe li ugljikov dioksid na globalno zatopljenje
Članovi skupine: ………………………………………………………………………Moj doprinos: a) izvođenju pokusa ………………..%
b) opažanjima i diskusiji …………%
c) formuliranju zaključaka……..…%
Ocjena koju zaslužujem (1 do 5) ……………
Opažanja i zaključci:
Pokus 42. Kako izvesti suhu destilaciju drveta
DEMONSTRACIJSKI POKUS
Pribor: snopić drvenih čačkalica, epruveta, bočica od dječjih voćnih kašica ili Erlenmeyerova tikvica od 100 mL sa širokim grlom, probušeni čep za epruvetu, čep s dvije rupe za bočicu ili Erlenmeyerovu tikvicu, koljenasto savijena cijev, cijev sa suženim otvorom na jednom kraju.
Opis pokusa
VIDEO: 42-Suha destilacija.mp4
1. Složite aparaturu kao na slici 42.1. Ispod Erlenmeyerove tikvice podmetnite drveni podložak visine oko 10 cm. Tako ćete pri kraju pokusa lakše odvojiti Erlenmeyerovu tikvicu s katranom i drugim produktima suhe destilacije.

2. Erlenmeyerovu tikvicu ili bočicu napunite do 3/4 visine običnom vodom i začepitete gumenim čepom s provučenim cjevčicama. Između čepa i vode u tikvici mora biti balon zraka volumena 10 do najviše 20 mL. Kraj koljenasto savijene cijevi mora biti uronjen u vodu tako da se vodom ispiru plinovi nastali suhom destilacijom drveta. Početak izlazne cijevi sa suženim otvorom na vrhu mora biti u ravnini s donjim dijelom gumenog čepa. Tako će plinoviti produkti suhe destilacije drveta prije istisnuti zrak iz aparature.
3. Stavite u epruvetu snopić čačkalica i začepitete gumenim čepom s provučenom koljenasto savijenom cijevi. Epruvetu samo malo ukosite s otvorom prema dolje. Epruvetu s čačkalicama zagrijavajte plamenom plinskog plamenika, u početku lagano a potom sve jače. Suženom otvoru izlazne cjevčice povremeno prinesite upaljenu žigicu. Obratite pozornost na sve promjene koje se događaju u epruveti, koljenasto savijenoj cijevi, bočici s vodom i na izlaznoj cijevi sa suženim vrhom.
4. Epruvetu s čačkalicama zagrijavajte sve dok ne prestane razvijanje plinova. Čim prekinete zagrijavanje odmah odmaknite drveni podložak, odčepite i odmaknite Erlenmeyerovu tikvicu, jer će u protivnom u užarenu epruvetu ući voda.
5. Iz ohlađene epruvete istresite njezin sadržaj na list papira. Usporedite fizička svojstva običnih čačkalica i ostatka nakon suhe destilacije. Ispitajte kako u šuštećem plamenu plinskog plamenika gori obična čačkalica, a kako ostaci nakon suhe destilacije.
Opišite sve uočene promjene. Gdje se skupljaju pojedine tvari, kakva im je boja, agregacijsko stanje, je li im gustoća manja ili veća od gustoće vode itd?
Zašto su se promijenili boja i fizička svojstva čačkalica tijekom suhe destilacije?
Zašto se suha destilacija obično naziva destruktivnom?
Je li relativna molekulska masa produkata suhe destilacije manja ili veća od relativne molekulske mase reaktanata?
Koje plinovite produkte očekujete kao proizvode suhe destilacije drveta?
Je li katran dobiven suhom destilacijom drveta čista tvar ili smjesa?
Obrazložite razlike u načinu gorenja drveta i crnog ostatka dobivenog suhom destilacijom drveta.
YouTube Video: Pyrolysis Animation
YouTube Video: SGI d.o.o. - Sarajevo, BiH - Recycling waste tyres into diesel
Primjenite sljedeći obrazac kako biste rezultate pokusa, opažanja i zaključke spremili u pretinac na svom računalu i podijelili s nastavnikom i ostalim članovima skupine.
Pokus 42. Kako izvesti suhu destilaciju drveta
Članovi skupine: ………………………………………………………………………Moj doprinos: a) izvođenju pokusa ………………..%
b) opažanjima i diskusiji …………%
c) formuliranju zaključaka……..…%
Ocjena koju zaslužujem (1 do 5) ……………
Opažanja i zaključci:
Pokus 43. Što nastaje katalitičkim krekiranjem parafinskog ulja
Pribor i kemikalije: 2 epruvete, pluteni probušeni čep, koljenasto savijena staklena cjevčica, pneumatska kada, mineralna vuna, komadići razbijena porculana, parafinsko ulje, vrlo razrijeđena otopina kalijeva permanganata zakiseljena s malo sumporne kiseline.
Opis pokusa
VIDEO: 43-Krekiranje.mp4
- Složite aparaturu kao na slici 43.1. Na dno epruvete stavite smotuljak mineralne vune kakva se upotrebljava za izolaciju u građevinarstvu. Mineralnu vunu natopite s malo parafinskog ulja.

Slika 43.1. Aparatura za krekiranje parafinskog ulja
- Iznad sloja mineralne vune stavite krhotine porculana. Epruvetu začepitete plutenim čepom kroz koji prolazi koljenasto savijena cijev. Vrh cijevi uronite u epruvetu s vrlo razrijeđenom otopinom kalijeva permanganata.
-
Zagrijavajte epruvetu s parafinskim uljem, ali na onom dijelu gdje se nalaze krhotine porculana. Toplina će se proširiti i na mineralnu vunu natopljenu parafinskim uljem. Ulje će isparavati i prelaziti preko ugrijanog porculana. Kad uočite promjenu boje otopine kalijeva permanganata izmaknite epruvetu i prekinite daljnje zagrijavanje.
-
Provjerite kako se ponaša parafinsko ulje kad mu dodate istu otopinu kalijeva permanganata. Obrazložite.
Je li parafinsko ulje sadržava zasićene ili nezasićene ugljikovodike?
Koja vrsta spojeva nastaje katalitičkim krekiranjem parafinskog ulja? Na temelju čega to zaključujete?
Prikažite jednadžbom najmanje jednu od više mogućnosti cijepanja zasićenog ugljikovodika sa šest ugljikovih atoma u lancu na dvije molekule s manjim brojem ugljikovih atoma.
Koju ulogu imaju krhotine porculana u katalitičkom krekiranju parafinskog ulja?
Nabrojite neke proizvode rafinerija nafte.
YouTube Video: Catalytic cracking of hydrocarbons
Primjenite sljedeći obrazac kako biste rezultate pokusa, opažanja i zaključke spremili u pretinac na svom računalu i podijelili s nastavnikom i ostalim članovima skupine.
Pokus 43. Što nastaje katalitičkim krekiranjem parafinskog ulja
Članovi skupine: ………………………………………………………………………Moj doprinos: a) izvođenju pokusa ………………..%
b) opažanjima i diskusiji …………%
c) formuliranju zaključaka……..…%
Ocjena koju zaslužujem (1 do 5) ……………
Opažanja i zaključci:
Pokus 44. Sadržava li urea dušik
Pribor i kemikalije: plamenik, epruveta, urea, 10-postotna otopina natrijeva hidroksida, crveni lakmusov papir
Opis pokusa
VIDEO: 44-Dokazivanje dusika.mp4
- Stavite u epruvetu nekoliko zrnaca uree, dodajte 1 do 2 mL otopine natrijeva hidroksida i zagrijte plamenom plinskog plamenika. Oprezno pomirišite sadržaj epruvete pa ćete osjetiti karakterističan miris amonijaka. Otvoru epruvete približite navlažen crveni lakmusov papir.
Koji kemijski element ulazi u sastav uree ako njezinim raspadom nastaje amonijak? Napišite formulu amonijaka.
Prikažite građu molekule amonijaka formulom s valentnim crticama.
Prikažite formulu amonijaka klinastom formulom. Molekula amonijaka ima oblik trostrane piramide s atomom dušika na vrhu.
Je li amonijak topljiv u vodi?
Zašto je crveni lakmusov papir promijenio boju u plavu?
YouTube Video: HCl+NH3=NH4Cl - Ammonium chloride smoke under 100,000,000x microscope
Primjenite sljedeći obrazac kako biste rezultate pokusa, opažanja i zaključke spremili u pretinac na svom računalu i podijelili s nastavnikom i ostalim članovima skupine.
Pokus 44. Sadržava li urea dušik
Članovi skupine: ………………………………………………………………………Moj doprinos: a) izvođenju pokusa ………………..%
b) opažanjima i diskusiji …………%
c) formuliranju zaključaka……..…%
Ocjena koju zaslužujem (1 do 5) ……………
Opažanja i zaključci:
Pokus 45. Dokazivanje prisutnosti sumpora u tvarima organskog podrijetla
Pribor i kemikalije: epruveta, drvena hvataljka za epruvete, otopina natrijeva hidroksida, w(NaOH) = 30%, otopina olovova(II) acetata, Pb(CH3COO)2, vuna, čuperak kose ili bjelance jajeta, krhotine neglazirana porculana, zaštitne naočale.
Opis pokusa
VIDEO: 45-Dikazivanje sumpora.mp4
Čuvajte oči! Obvezno upotrijebite zaštitne naočale. Pazite da tekućina naglo ne proključa i izleti iz epruvete! Otvor epruvete usmjerite tako da ne dođe do slučajnog polijevanja drugih učenika.
- Stavite u epruvetu malo bjelanca jajeta, vune ili kose i 2 do 3 male krhotine neglazirana porculana. Dodajte 2 do 3 mL otopine natrijeva hidroksida. Sadržaj zagrijte do ključanja.
-
Dodajte u epruvetu nekoliko kapi otopine olovova(II) acetata. Crni talog ili smeđe obojenje siguran su dokaz da uzorak sadržava sumpor.
-
Ispitajte na jednak način vunu, pamuk (vatu) i neku sintetičku tkaninu. Dokažite koja od ispitivanih tvari sadržava ili ne sadržava sumpor.
Kojom su vrstom veze atomi sumpora vezani u uzorku organske tvari: kovalentnom, ionskom ili metalnom vezom?
Zašto je uzorke organske tvari trebalo zagrijavati s koncentriranom otopinom lužine?
Od čega potječe crni talog ili smeđe obojenje?
Napišite jednadžbu međusobne reakcije olovovih i sulfidnih iona.
Primjenite sljedeći obrazac kako biste rezultate pokusa, opažanja i zaključke spremili u pretinac na svom računalu i podijelili s nastavnikom i ostalim članovima skupine.
Pokus 45. Dokazivanje prisutnosti sumpora u tvarima organskog podrijetla
Članovi skupine: ………………………………………………………………………Moj doprinos: a) izvođenju pokusa ………………..%
b) opažanjima i diskusiji …………%
c) formuliranju zaključaka……..…%
Ocjena koju zaslužujem (1 do 5) ……………
Opažanja i zaključci:
Pokus 46. Dokazivanje prisutnosti halogena u tvarima organskog podrijetla
Pribor i kemikalije: epruveta, bakrena žica promjera oko 1 mm i dužine 10 do 15 cm, pluteni čep, plamenik, kloroform ili komadić PVC-a.
Opis pokusa
VIDEO: 46-Dokazivanje halogena.mp4
- Skinite izolaciju s komadića bakrene žice kakva se upotrebljava za električne vodove. Utisnite jedan kraj bakrene žice u pluteni čep, koji će služiti kao držač.
-
Slobodan kraj bakrene žice žarite u šuštećem plamenu plinskog plamenika sve dok se ne izgubi žuta ili zelena boja plamena.
-
Užarenu bakrenu žicu utisnite u komadić PVC-a . PVC je skraćeni naziv za poli(vinil-klorid), plastičnu masu od koje se izrađuju obloge podova, izolacija električnih vodova i drugi uporabni predmeti. Pri povišenoj temperaturi PVC se rastali i zaostane na bakrenoj žici. Žicu s ostatkom PVC-a unesite u rub šuštećeg plamena. U početku plamen zasvijetli jer izgara ugljik. Uskoro plamen postaje zeleno obojen. To je dokaz da spoj sadržava halogen.
-
Kad se nova bakrena žica unese u šušteći plamen plinskog plamenika najprije se plamen oboji žuto, a kojiput i zeleno. Koji kemijski element i njegovi spojevi boje plamen žuto?
Opišite izgled bakrene žice nakon žarenja. Kakve je boje njezina površina? Koji je spoj na površini bakrene žice mogao nastati tijekom njezina žarenja?
Napišite formule bakrova(I) oksida i bakrova(II) oksida.
Kakve je boje plamen kad se u njemu užari čista bakrena žica?
Kakve je boje plamen kad se u njemu užari bakrena žica na kojoj se nalaze tragovi PVC-a ili nekog drugog spoja koji sadržava halogeni element?
Zašto se pri žarenju bakrene žice, na kojoj je organski spoj, plamen najprije oboji žuto?
Koji ioni uzrokuju zelenu boju plamena: Cu2+, Cl–, Br– ili I–?
Tko je uveo ovu jednostavnu metodu dokazivanja prisutnosti halogena u organskom spoju?
Može li se ovom metodom dokazati prisutnost fluora u organskom spoju?
Kako nastaje karakteristična boja kojom ioni pojedinih elemenata boje plamen?
Zašto različiti kemijski elementi plamen boje različitim bojama?
YouTube Video: Test de Beilstein
Primjenite sljedeći obrazac kako biste rezultate pokusa, opažanja i zaključke spremili u pretinac na svom računalu i podijelili s nastavnikom i ostalim članovima skupine.
Pokus 46. Dokazivanje prisutnosti halogena u tvarima organskog podrijetla
Članovi skupine: ………………………………………………………………………Moj doprinos: a) izvođenju pokusa ………………..%
b) opažanjima i diskusiji …………%
c) formuliranju zaključaka……..…%
Ocjena koju zaslužujem (1 do 5) ……………
Opažanja i zaključci:
Pokus 47. Dobivanje etina i ispitivanje njegovih svojstava
DEMONSTRACIJSKI POKUS
Pribor i kemikalije: epruveta s rupičastim dnom, probušeni gumeni čep s ravnom cjevčicom suženom na vrhu, gumena cjevčica duljine oko 25 cm sa staklenim nastavkom, stakleni cilindar od 200 -300 mL, obična epruveta, kalcijev karbid, vrlo razrijeđena otopina kalijeva permanganata zakiseljena sumpornom kiselinom.
Opis pokusa
VIDEO: 47-Dobivanje etina.mp4
1. U običnu epruvetu ulijte najviše 1 do 2 mL vrlo razrijeđene otopine kalijeva permanganata zakiseljene sumpornom kiselinom.
2. U stakleni cilindar ulijte obične vode do 3/4 njegove visine.
3. U rupičastu epruvetu stavite mali grumen kalcijeva karbida i začepite gumenim čepom kroz koji prolazi staklena cijevčica sužena na vrhu. Epruvetu učvrstite hvataljkom visoko na stalak iznad cilindra s vodom. Na staklenu cjevčicu sa suženim vrhom pripojite dulju gumenu cijev sa staklenim nastavkom. Stakleni nastavak uronite u epruvetu s 1 do 2 mL otopine kalijeva permanganata.
4. Epruvetu s kalcijevim karbidom uronite do dna cilindra s vodom. Kalcijev karbid regira s vodom pri čemu nastaje etin. Promatrajte otopinu kalijeva permanganata, uočite i zabilježite promjene.
5. Čim uočite da se boja otopine kalijeva permanganata promijenila odspojite gumenu cjevčicu sa cjevčice sa suženim vrhom. Zapalite etin na suženom vrhu staklene cjevčice. Uočite i zabilježite svojstva plamena. Pustite da sav kalcijev karbid izreagira s vodom, a razvijeni etin izgori.
Napišite jednadžbu reakcije kalcijeva karbida i vode.
Zašto se otopina kalijeva permanganata obezbojila.
U kojim uvjetima će u otopini kalijeva permanganata nastati smeđi talog.
Koji je kemijski sastav tog taloga?
Napišite jednadžbu gorenja etina uz nedostatan dotok zraka.
Napišite jednadžbu gorenja etina u kisiku pri čemu nastaju ugljikov dioksid i voda.
Gdje se sve etin upotrebljava? Navedite primjere.
YouTube Video: how to oxy acetylene weld
YouTube Video: how to cut with a torch. oxygen acetylene welding cutting torch
YouTube Video: Acetylene demonstrations
Primjenite sljedeći obrazac kako biste rezultate pokusa, opažanja i zaključke spremili u pretinac na svom računalu i podijelili s nastavnikom i ostalim članovima skupine.
Pokus 47. Dobivanje etina i ispitivanje njegovih svojstava (demonstracijski pokus)
Članovi skupine: ………………………………………………………………………Moj doprinos: a) izvođenju pokusa ………………..%
b) opažanjima i diskusiji …………%
c) formuliranju zaključaka……..…%
Ocjena koju zaslužujem (1 do 5) ……………
Opažanja i zaključci:
Pokus 48. Kako izvesti pokus alkoholnog vrenja
Pribor i kemikalije: jedna veća i jedna manja bočica širokoga grla, na primjer od dječjih kašica, probušeni čep, 2 koljenasto savijene staklene cijevi, šećer, prezrelo voće, pekarski kvasac.
Opis pokusa
VIDEO: 48-Alkoholno vrenje.mp4
- U približno 50 mL mlačne vode u okrugloj ili Erlenmeyerovoj tikvici od 250 mL otopite žličicu šećera ili meda. U dobivenu otopinu umiješajte oko 10 g svježega pekarskog kvasca.
-
Tikvicu začepite gumenim ili plutenim čepom kroz koji prolazi koljenasto savijena staklena cjevčica. Kratkom gumenom cjevčicom pripojite drugu koljenasto savijenu cijev i njezin kraj uronite u bočicu s vapnenom vodom. U grlo bočice s vapnenom vodom stavite smotuljak vate. Postavite pribor na toplo mjesto. Ne prevruće. Idealna temperatura je 37 °C.
-
Već nakon pola sata zamijetit ćete da se smjesa počinje pjeniti, a ako otopinu pomirišete, osjetit ćete karakterističan miris kakav se osjeća pri pripremanju kruha ili kolača. Tijekom idućih sati povremeno uočite eventualne promjene.
-
Pokus možete izvesti i tako da na grlo tikvice navučete dječji balon. Tijekom vremena balon će se napuhati zbog fermentacije šećera ili voća.
Je li se vapnena voda zamutila? Što to dokazuje?
Napišite jednadžbu reakcije vapnene vode i jednog od produkata alkoholnog vrenja.
Što je kvasac?
Alkoholno vrenje voća ili grožđa događa i spontano bez dodatka uzgojenih kvasaca. Kako je to moguće?
U kojim se uvjetima događa alkoholno vrenje, aerobnim ili anaerobnim?
Što bismo dobili kad bismo kroz smjesu u tikvici neprekidno puhali zrak?
Experiment: Alcohol production by yeast
Primjenite sljedeći obrazac kako biste rezultate pokusa, opažanja i zaključke spremili u pretinac na svom računalu i podijelili s nastavnikom i ostalim članovima skupine.
Pokus 48. Kako izvesti pokus alkoholnog vrenja
Članovi skupine: ………………………………………………………………………Moj doprinos: a) izvođenju pokusa ………………..%
b) opažanjima i diskusiji …………%
c) formuliranju zaključaka……..…%
Ocjena koju zaslužujem (1 do 5) ……………
Opažanja i zaključci:
Pokus 49. Katalitička oksidacija alkohola
DEMONSTRACIJSKI POKUS
Pribor i kemikalije: Erlemeyerova tikvica od 250 mL sa širokim grlom, električna grijaća kapa ili posuda s toplom vodom, plamenik, tanka ogoljena bakrena žica duljine oko 20 cm, željezna žica duljine oko 20 cm, etanol.
Opis pokusa
Opasnosti: Etanol je zapaljiv! Smjesa para etanola i zraka je eksplozivna. Opasnost od požara.
VIDEO: 49-Oksidacija etanola.mp4
-
Od tanke bakrene žice načinite spiralu promjera oko 5 mm i duljine oko 10 do 20 mm. Spiralu objesite na koljenasto savijenu željeznu žicu. Željezo je slab vodič topline pa nećete opeći prste.
-
Pripremite vodenu kupelj ugrijanu na oko 40 do 50 °C.
-
U Erlenmeyerovu tikvicu od 250 mL sa širokim grlom ulijte 5 do 10 mL 96-postotnog etanola (običnog alkohola)
-
Tikvicu s etanolom ugrijte u mlačnoj vodenoj kupelji. Pazite da etanol ne ispari jer je njegovo vrelište pri 78 °C. Tikvicu s ugrijanim etanolom postavite na drvenu ili plastičnu daščicu koja slabo provodi toplinu.
-
U plamenu plinskoga plamenika užarite bakrenu spiralu i brzo ju unesite u sredinu tikvice s toplim etanolom. Pronađite mjesto na kojem spirala ostaje trajno užarena.
-
Izvadite spiralu iz grla tikvice i pokretima ruke usmjerite pare prema sebi, tek toliko da osjetite oštar miris. Ne udišite previše tih para. To nije miris etanola, već miris smjese etanola i etanala.
Kakvu ulogu ima užareni bakar u ovom pokusu?
Je li reakcija egzotermna ili endotermna?
Koji spoj nastaje reakcijom kisika iz zraka i etanola uz prisutnost užarenog bakra?
Je li se tijekom ovog pokusa događa oksidacija ili redukcija?
Koja se tvar oksidira a koja reducira?
Napišite jednadžbu reakcije.
KojuPlatinum Catalysis funkcijsku skupinu sadržava etanal?
Koji je zajednički naziv za spojeve s tom funkcijskom skupinom?
Što će nastati daljnjom oksidacijom etanala?
Što nastaje oksidacijom metanola zrakom uz prisutnost katalizatora?.
Metanal je topljiv u vodi. Koje je uobičajeno ime te otopine i za što se najčešće rabi?
YouTube Video: Platinum Catalysis
Primjenite sljedeći obrazac kako biste rezultate pokusa, opažanja i zaključke spremili u pretinac na svom računalu i podijelili s nastavnikom i ostalim članovima skupine.
Pokus 49. Katalitička oksidacija alkohola
Članovi skupine: ………………………………………………………………………Moj doprinos: a) izvođenju pokusa ………………..%
b) opažanjima i diskusiji …………%
c) formuliranju zaključaka……..…%
Ocjena koju zaslužujem (1 do 5) ……………
Opažanja i zaključci:
Pokus 50. Kako sintetizirati ester
Pribor i kemikalije: stalak s epruvetama, bezvodni natrijev acetat, salicilna kiselina, etanol, metanol, koncentrirana sumporna kiselina, 3 kapalice s gumicom, 2 plastične čaše od 200 mL napunjene do polovine običnom hladnom vodom, vruća voda.
Opis pokusa
VIDEO: 50-Esteri.mp4
- Stavite u epruvetu vrlo malo bezvodnog natrijeva acetata, tek toliko koliko stane na vrh noža. Kapalicom s gumicom dodajte 3 kapi etanola. Stavite epruvetu u stalak. Nastavnik će u epruvetu dodati kap ili dvije koncentrirane sumporne kiseline. Ako se pokus izvodi s kristalnim natrijevim acetatom, potrebno je dodati kap više koncentrirane sumporne kiseline.
-
Epruvetu s reakcijskom smjesom grijte nekoliko minuta u čaši s vrućom vodom. Izvadite epruvetu iz čaše i dodajte oko 5 mL obične hladne vode iz jedne od plastičnih čaša te odmah sadržaj epruvete izlijte u tu istu čašu.
Pomirišite sadržaj u čaši. Na što vas podsjeća taj miris?
- Načinite novi pokus tako da u epruvetu stavite vrlo malo salicilne kiseline i 2 do 3 kapi metanola (metilnog alkohola). Nastavnik će dodati kap dvije koncentrirane sumporne kiseline. Zagrijte reakcijsku smjesu u čaši s vrućom vodom kao u prethodnom pokusu. Izvadite epruvetu iz čaše i dodajte oko 5 mL obične hladne vode iz druge plastične čaše i odmah sadržaj epruvete izlijte u tu istu čašu.
Pomirišite sadržaj u čaši. Na što vas podsjeća taj miris?
Koju skupinu sadržavaju sve karboksilne kiseline? Napišite strukturnu formulu te skupine.
Koju ulogu ima sumporna kiselina u ovim kemijskim reakcijama?
Napišite jednadžbu nastajanja etil etanoata, odnosno estera između etilnog alkohola i octene kiseline.
Je li kisik u molekuli vode koja nastaje esterifikacijom alkohola i kiseline potječe iz alkohola ili kiseline. Kako se to može dokazati?
YouTube Video: Synthesis of Ethyl Acetate
Primjenite sljedeći obrazac kako biste rezultate pokusa, opažanja i zaključke spremili u pretinac na svom računalu i podijelili s nastavnikom i ostalim članovima skupine.
Pokus 50. Kako sintetizirati ester
Članovi skupine: ………………………………………………………………………Moj doprinos: a) izvođenju pokusa ………………..%
b) opažanjima i diskusiji …………%
c) formuliranju zaključaka……..…%
Ocjena koju zaslužujem (1 do 5) ……………
Opažanja i zaključci:
Pokus 51. U kakvoj vodi sapun najbolje pere
Pribor i kemikalije: epruvete, 1-postotna vodena otopina običnog tvrdog sapuna, plavi i crveni lakmusov papir, alkoholna otopina fenolftaleina, razrijeđene otopine sumporne i klorovodične kiseline, otopine kalcijeva klorida, magnezijeva klorida i željezova(III) sulfata.
Opis pokusa
VIDEO: 51,1-Sapun.mp4
VIDEO: 51,2-Povrsinska napetost,mp4
- Ulijte u tri epruvete po 1 mL 1-postotne otopine sapuna. U jednu epruvetu stavite crveni, a u drugu plavi lakmusov papir. U treću epruvetu dodajte kap otopine fenolftaleina.
-
Ulijte u 5 epruveta po 1 mL 1-postotne otopine sapuna. Dodajte redom u svaku epruvetu po 1 mL otopine sumporne kiseline, klorovodične kiseline, kalcijeva klorida, magnezijeva klorida i željezova(III) sulfata. Zapišite opažanja. Snažno promućkajte sadržaj svake epruvete i ustanovite nastaje li pjena. Stavite epruvete u stalak i nakon nekoliko minuta promotrite površine otopina.
Opišite promjene i zaključi pokazuje li vodena otopina sapuna kiselu ili lužnatu reakciju.
Obrazložite uočene promjene. Jesu li sapuni pogodno sredstvo za pranje u kiselim otopinama i vodama koje sadržavaju otopljene kalcijeve i magnezijeve soli ili soli teških metala.
YouTube Video: How does Soap Work? | Mocomi Kids
YouTube Video: The Emulsification Process
YouTube Video: Cleansing Action Of Soap
Primjenite sljedeći obrazac kako biste rezultate pokusa, opažanja i zaključke spremili u pretinac na svom računalu i podijelili s nastavnikom i ostalim članovima skupine.
Pokus 51. U kakvoj vodi sapun najbolje pere
Članovi skupine: ………………………………………………………………………Moj doprinos: a) izvođenju pokusa ………………..%
b) opažanjima i diskusiji …………%
c) formuliranju zaključaka……..…%
Ocjena koju zaslužujem (1 do 5) ……………
Opažanja i zaključci:
Pokus 52. Monomolekulski sloj tenzida na površini vode
Pribor i kemikalije: veći tanjur ili poslužavnik, mljeveni papar, mljeveni cimet, "tekući sapun" za pranje ruku.
Opis pokusa
VIDEO: 52-Monomolekulski sloj.mp4
- Ulijte u poslužavnik ili tanjur toliko vode da dobijete sloj visine oko 1 cm.
-
Površinu vode jednolično naprašite mljevenim paprom ili cimetom.
-
Umočite vrh čačkalicu u "tekući sapun" i vrhom čačkalice dotaknite sredinu naprašene površine vode.
Što opažate? Pojavu objasnite na temelju građe molekula tenzida i sapuna.
YouTube Video: MILK + SOAP = MAGIC
YouTube Video: Surfactants and Surface Tension
Primjenite sljedeći obrazac kako biste rezultate pokusa, opažanja i zaključke spremili u pretinac na svom računalu i podijelili s nastavnikom i ostalim članovima skupine.
Pokus 52. Monomolekulski sloj tenzida na površini vode
Članovi skupine: ………………………………………………………………………Moj doprinos: a) izvođenju pokusa ………………..%
b) opažanjima i diskusiji …………%
c) formuliranju zaključaka……..…%
Ocjena koju zaslužujem (1 do 5) ……………
Opažanja i zaključci:
Pokus 53. Dokazivanje prisutnosti glukoze Trommerovim reagensom
Pribor i kemikalije: epruveta, plamenik, čaša od 200 mL s vrućom vodom, 10-postotna otopina natrijeva hidroksida, 10-postotna otopina modre galice, uzorci bistrog voćnog soka, deita i sličnih napitaka, 1-postotne otopine meda i običnog šećera.
Opis pokusa
VIDEO: 53-Dokazivanje glukoze.mp4
- Uzmite pet epruveta i označite ih brojevima od 1 do 5. U prvu epruvetu dodajte oko 2 mL soka od naranče, grožđa ili nekoga drugog voća. U drugu epruvetu dodajte oko 2 mL nekoga osvježujućeg napitka, kao što je Sprite ili slično. U treću epruvetu dodajte oko 2 mL Deita ili nekoga drugog dijetalnog proizvoda, u četvrtu otopine meda, a u petu otopine običnog šećera. Pokus možete izvesti i s drugim napicima koji vam se nađu pri ruci.
-
U sve otopine, koje ispitujete na prisutnost glukoze, dodajte 2 do 3 mL 10-postotne otopine natrijeva hidroksida i samo kap 10-postotne otopine modre galice. Epruvete uronite u čašu s vrućom, a po mogućnosti kipućom vodom. Ako je glukoza prisutna, nakon nekoliko minuta pojavit će se crvenosmeđi talog bakrova(I) oksida, Cu2O.
Usporedite rezultate svojih istraživanja s tekstovima na naljepnicama ispitivanih proizvoda.
Zapišite rezultate istraživanja i ustanovi koje otopine sadržavaju a koje ne sadržavaju glukozu?
YouTube Video: Food test - Test for reducing sugar
Primjenite sljedeći obrazac kako biste rezultate pokusa, opažanja i zaključke spremili u pretinac na svom računalu i podijelili s nastavnikom i ostalim članovima skupine.
Pokus 53. Dokazivanje prisutnosti glukoze Trommerovim reagensom
Članovi skupine: ………………………………………………………………………Moj doprinos: a) izvođenju pokusa ………………..%
b) opažanjima i diskusiji …………%
c) formuliranju zaključaka……..…%
Ocjena koju zaslužujem (1 do 5) ……………
Opažanja i zaključci:
■ Za dokazivanje reducirajućih šećera najčešće se rabe Trommerov reagens, Fehlingov reagens i Tollensov reagens.
Trommerov reagens je lužnata otopina bakrova(II) sulfata. U uzorak koji se ispituje na prisutnost reducirajućeg šećera doda se jednak volumen 10-postotne otopine natrijeva hidroksida ihttps://www.youtube.com/watch?v=MARP5Ti33II samo kap 10-postotne otopine modre galice. Smjesu treba promućkati i ugrijati u čaši s vrućom vodom. Ako je reducirajući šećer prisutan pojavit će se crvenosmeđi talog bakrova(I) oksida, Cu2O.
Fehlingov reagens sastoji se od dvije otopine. Otopina Fehling I priprema se tako da se 7 g bakrova(II) sulfata pentahidrata (modre galice) otopi u 100 mL destilirane vode. Otopina Fehling II priprema se otapanjem 35 g kalijeva natrijeva tartarata, KNaC4H4O6∙4H2O, i 10 g natrijeva hidroksida u 100 mL destilirane vode. Otopine se pomiješaju u omjeru 1:1 neposredno prije upotrebe pri čemu nastaje tamnoplavo obojena otopina. U otopinu koja se ispituje na prisutnost reducirajućeg šećera doda se oko 1 mL smjese otopina Fehling I i Fehling II te zagrije u čaši s vrućom vodom. Ako je reducirajući šećer prisutan pojavit će se crvenosmeđi talog bakrova(I) oksida, Cu2O.
Svi reducirajući šećeri sadržavaju aldehidnu skupinu, –CHO, koja se bakrovim ionima, Cu2+, oksidira u karboksilnu skupinu . –COOH. Bakrovi se ioni pritom reduciraju u netopljiv crvenosmeđ talog bakrova(I) oksida.
R-CHO + 2 Cu2+ + 4 OH– → R-COOH + Cu2O + 2 H2O
Tollensov reagens priprema se tako da se u odmašćenu epruvetu ulije oko 1 mL otopine srebrova nitrata, w(AgNO3) = 17 g/L, doda jednu kap otopine natrijeva hidroksida, promućka, a zatim uz snažno mućkanje dokapava kap po kap razrijeđenu otopine amonijaka, samo toliko da se nastali smeđi talog otopi. U tako pripremljen Tollensov reagens ulije se 1 mL otopine ispitivanog uzorka (glukoze) i bez mućkanja zagrijava u čaši s vrućom vodom. Ako ispitivani uzorak sadržava reducirajući šećer, za nekoliko minuta na stijenkama epruvete pojavit će se srebrno zrcalo.
Kad se otopini srebrova nitrata doda otopina natrijeva hidroksida, taloži se smeđi talog srebrova oksida, Ag2O.
2 AgNO3 + 2 NaOH → Ag2O + 2 NaNO3 + H2O
Dodatkom razrijeđene otopine amonijaka smeđi se talog srebrova oksida otopi, jer nastaju bezbojni kompleksni ioni [Ag(NH3)2]+.
Ag2O + 2 NH3 + H2O → 2 [Ag(NH3)2]+ + 2 OH–
Kad se reducirajući šećer doda u Tollensov reagens i reakcijska smjesa ugrije na stijenkama epruvete, pojavi se srebrno zrcalo.
R-CHO + 2 [Ag(NH3)2]+ + 2 OH– → R-COOH + 2 Ag + 4 NH3 + H2O
Tollensov reagens uvijek se priprema svjež i sav se mora odmah upotrijebiti. Nakon provedenog pokusa sadržaj epruvete sa srebrnim zrcalom zakiseli se dušičnom kiselinom i spremi u bocu s otpacima srebra.
Pokus 54. Je li saharoza reducirajući šećer
Pribor i kemikalije: stalak s epruvetama, 1-postotna otopina saharoze, 10-postotna otopina natrijeva hidroksida, 10-postotna otopina modre galice (Trommerov reagens), plamenik, 10-postotna klorovodična kiselina, lakmusov papir.
Opis pokusa
VIDEO: 54-Saharoza.mp4
- U dvije epruvete ulijte po 2 do 3 mL 1-postotne otopine običnog šećera. Sadržaj prve epruvete ispitajte Trommerovim reagensom na način opisan u pokusu 20.
-
U drugu epruvetu s otopinom saharoze dodajte oko 1 mL 10-postotne klorovodične kiseline. Zagrijte smjesu do vrenja i nastavite zagrijteavati tijekom 1 do 2 minute. Ohladite smjesu i dodajte otopinu natrijeva hidroksida sve dok ne postignete lužnatu reakciju. Provjerite lakmusovim papirom. U lužnatu otopinu dodajte jednu kap 10-postotne otopine modre galice i zagrijte do vrenja.
Je li saharoza s Trommerovim reagensom stvara crvenosmeđi talog Cu2O?
Je li saharoza reducirajući šećer?
Je li saharoza monosaharid ili disaharid?
Što se dogodilo s molekulom saharoze nakon zagrijavanja s klorovodičnom kiselinom? Napišite jednadžbu reakcije.
S kojim šećerima Trommerov reagens daje crvenosmeđi talog?
YouTube Video: Benedict's Reagent
Primjenite sljedeći obrazac kako biste rezultate pokusa, opažanja i zaključke spremili u pretinac na svom računalu i podijelili s nastavnikom i ostalim članovima skupine.
Pokus 54. Je li saharoza reducirajući šećer
Članovi skupine: ………………………………………………………………………Moj doprinos: a) izvođenju pokusa ………………..%
b) opažanjima i diskusiji …………%
c) formuliranju zaključaka……..…%
Ocjena koju zaslužujem (1 do 5) ……………
Opažanja i zaključci:
Pokus 55. Dobivanje škroba iz krumpira
Pribor i kemikalije: porculanski tarionik s tučkom, čaša od 200 mL, lijevak, filtrirni papir, otopina joda u kalijevu jodidu, kapalica s gumicom.
Opis pokusa
VIDEO: 55-Skrob.mp4
- Oguljeni krumpir izrežite na što sitnije rezance, stavite u porculanski tarionik, prelijte hladnom vodom i intenzivno gnječite tučkom. Bolje je rezance krumpira usitniti u kuhinjskoj sjeckalici za voće i povrće (blender ili štapni mikser).
-
Dobivenu kašu procjedite kroz cjedilo za čaj. Odlijte vodu u kojoj se nalaze razmućena zrnca škroba u čistu čašu. Bijeli talog koji se skuplja na dnu čaše je škrob iz krumpira. Filtriranjem odvojite talog i zajedno s filtrirnim papirom osušite u sušioniku ili na zraku. Po mogućnosti pogledajte zrnca škroba pod mikroskopom.
-
Razmutite u epruveti vrlo malo dobivenog škroba u 1 mL vode i tome dodajte 10 mL vrele vode. Zagrijavajte dok ne dobijete prozračnu otopinu. Ohladite dobivenu otopinu i potom dodajte kap-dvije otopine joda u kalijevu jodidu ili otopine povidon jodida koju možete bez recepta nabaviti u svakoj ljekarni. Plava boja dokazuje da je dobiveni uzorak škrob. Ako se plava boja ne vidi ili je pretamna, razrijedite otopinu vodom.
-
Ugrijte, a potom ponovno ohladite epruvetu s plavom otopinom. Uočite promjene.
-
Ispitajte različite namirnice sadržavaju li škrob (sirni namaz, hrenovke, vrhnje itd.).
Shematski
prikažite
građu molekula od koji se sastoji škrob.
Što nastaje kad se u otopinu škroba doda otopina joda u kalijevu jodidu, odnosno Lugolova otopina.
Obrazložite gubitak i
ponovno pojavljivanje plave boje pri zagrijteavanju otopine škroba
kojoj je
dodana Lugolova otopina.
YouTube Video: SHPS test for starch in leaf
Primjenite sljedeći obrazac kako biste rezultate pokusa, opažanja i zaključke spremili u pretinac na svom računalu i podijelili s nastavnikom i ostalim članovima skupine.
Pokus 55. Dobivanje škroba iz krumpira
Članovi skupine: ………………………………………………………………………Moj doprinos: a) izvođenju pokusa ………………..%
b) opažanjima i diskusiji …………%
c) formuliranju zaključaka……..…%
Ocjena koju zaslužujem (1 do 5) ……………
Opažanja i zaključci:
Pokus 56. Dokazivanje prisutnosti proteina ksantoproteinskom reakcijom
DEMONSTRACIJSKI POKUS
Pribor i kemikalije: epruveta, plamenik, kapalica s gumicom, otopina bjelanca jajeta, koncentrirana dušična kiselina, razrijeđena otopina amonijaka.
Opasnosti: Upotrijebite zaštitne naočale i zaštitne rukavice! Koncentrirana dušična kiselina na koži stvara rane koje teško zacijeljuju.
Opis pokusa
VIDEO: 56-Ksantoproteinska reakcija.mp4
- Ulijte u epruvetu oko 1 mL vodene otopine bjelanca - prirodnog izvora proteina. Nastavnik će kapalicom dodati nekoliko kapi koncentrirane dušične kiseline.
Što opažate? Kako dušična kiselina djeluje na proteine?
- Nastali talog pažljivo zagrijavajte. Uočite i zapiši promjene. Kada se epruveta ohladi, dodajte toliko otopine amonijaka da otopina postane lužnata. Dodatkom amonijaka žuta boja taloga prelazi u narančastu. To je siguran dokaz da ispitivani uzorak sadržava proteine. Na temelju provedenog pokusa zaključite što će se dogoditi ako dušična kiselina dospije na kožu ili nokte.

Slika 56.1. Ksantoproteinska reakcija: a) dodatak dušične kiseline uzrokuje koagulaciju bjelanca jajeta, b) kad se smjesa zagrijtee dolazi do nitriranja onih aminokiselina koje sadržavaju aromatske jezgre zbog čega se smjesa oboji žuto jer su aromatski nitrospojevi žuti, c) dodatkom amonijaka žuta se boja promijeni u narančastu jer se pomiče apsorpcijski maksimum svjetlosti.
YouTube Video: Xanthoproteic Test - Colour Reaction of Proteins
Primjenite sljedeći obrazac kako biste rezultate pokusa, opažanja i zaključke spremili u pretinac na svom računalu i podijelili s nastavnikom i ostalim članovima skupine.
Pokus 56. Dokazivanje prisutnosti proteina ksantoproteinskom reakcijom
Članovi skupine: ………………………………………………………………………Moj doprinos: a) izvođenju pokusa ………………..%
b) opažanjima i diskusiji …………%
c) formuliranju zaključaka……..…%
Ocjena koju zaslužujem (1 do 5) ……………
Opažanja i zaključci:
Pokus 57. Dokazivanje prisutnosti proteina biuret reakcijom
Pribor i kemikalije: epruveta, kapalica s gumicom, otopina bjelanca jajeta, otopina natrijeva hidroksida (w = 20 %), razrijeđena otopina bakrova(II) sulfata
Opis pokusa
VIDEO: 57-Biuret reakcija.mp4
- Ulijte u epruvetu oko 2 mL otopine bjelanca i dodajte jednako toliko 10-postotne otopine natrijeva hidroksida. Promućkajte i zatim dodajte samo kap 1-postotne otopine bakrova(II) sulfata. Sadržaj epruvete malo promućkajte. Nastaje ljubičasto obojenje. Po potrebi dodajte još jednu kap otopine bakrova(II) sulfata. Previše bakrova sulfata uzrokuje stvaranje plavog taloga bakrova(II) hidroksida.

Slika 57.1. Biuret reakcija: a) kad se u jako lužnatu otopinu bjelanca doda kap razrijeđene otopine modre galice nastaje plavi talog bakrova(II) hidroksida, b) snažnim mućkanjem nastaje karakteristično ljubičasto obojenje kao na slici, što dokazuje da uzorak sadržava proteine ili produkte njihova raspada. Najčešća pogreška koju čine početnici jest dodatak premalo lužine i previše modre galice pa nastaje prljavoplavi talog bakrova(II) hidroksida.
- Ispitajte biuret reakcijom male količine namirnica kao što su svježe mlijeko, mlijeko u prahu, sirni namaz, sir, maslac, margarin, komadić hrenovke, kruh, šećer, vegeta itd. Ispitajte biuret reakcijom slinu iz usta. Je li slina sadržava proteine?
-
Koja od navedenih namirnica sadržava proteine?
YouTube Video: Biuretprobe (biuret test)
Pokus 57. Dokazivanje prisutnosti proteina biuret reakcijom
Članovi skupine: ………………………………………………………………………Moj doprinos: a) izvođenju pokusa ………………..%
b) opažanjima i diskusiji …………%
c) formuliranju zaključaka……..…%
Ocjena koju zaslužujem (1 do 5) ……………
Opažanja i zaključci:
Pokus 58. Utjecaj pH i temperature na aktivnost enzima
Pribor i kemikalije: Čaša od 200 mL, stalak s epruvetama, termometar do 100 °C, univerzalni indikatorski papir, svježi pekarski kvasac, šećer, brašno.
Opis pokusa
VIDEO: 58-Aktivnost enzima.mp4
-
U približno 50 mL hladne vode razmutite četvrtinu kockice pekarskog kvasca, žličicu šećera i 2 žličice brašna. Miješajte dok ne dobijete kašu bez grudica.
-
U tri epruvete označene brojevima 1, 2 i 3 ulijte po 4 do 5 mL dobivene kaše. U prvu epruvetu dodajte 4 kapi 10-posutne otopine klorovodične kiseline, a u treću isti broj kapi 10-postotne otopine natrijeva hidroksida. Promućkajte sadržaj epruveta i univerzalnim indikatorskim papirom ispitajte pH dobivenih oopina.
-
Sve tri epruvete uronite u čašu s vodom ugrijanom na oko 40 °C. Tijekom sljedećih destak minuta promatrajte nastajanje pjene u sve tri epruvete.
-
Ponovite pokus tako da prvu epruvetu uronite u čašu sa smjesom vode i leda, drugu u čašu s mlačnom vodom a treću u čašu s kipućom ili vodom ugrijanom na više od 80 °C.
U kojoj je epruveti nastalo najviše pjene?
Zbog čega pjena nastaje?
Kako pH otopina utječe na aktivnost enzima pekarskog kvasca?
Kako promjena temperature utječe na aktivnost enzima pekarskog kvasca.
Kako se mijenja brzina običnih kemijskih reakcija s promjenom temperature?
Vrijedi li ista zaknitost za brzinu biokemijskih reakcija?
Što razumijete pod pojmom denaturiranje?
YouTube Video: Enzymes: Mr. W's Enzyme Song
Primjenite sljedeći obrazac kako biste rezultate pokusa, opažanja i zaključke spremili u pretinac na svom računalu i podijelili s nastavnikom i ostalim članovima skupine.
Pokus 58. Utjecaj pH i temperature na aktivnost enzima
Članovi skupine: ………………………………………………………………………Moj doprinos: a) izvođenju pokusa ………………..%
b) opažanjima i diskusiji …………%
c) formuliranju zaključaka……..…%
Ocjena koju zaslužujem (1 do 5) ……………
Opažanja i zaključci:
Pokus 59. Hidroliza škroba enzimima
Pribor i kemikalije: epruvete, škrob, Trommerov reagens, otopina joda u kalijevu jodidu, enzimi iz sline
Opis pokusa
VIDEO: 59-Hidroliza skroba.mp4
-
Pripremite mlačnu otopinu škroba i razdijelite je u tri epruvete. Sadržaj prve epruvete ispitajte Trommerovim reagensom.
-
U drugu i treću epruvetu dodajte kap Lugolove otopine (otopine joda u kalijevu jodidu). Druga će epruveta poslužiti za usporedbu. Skupite u ustima malo sline i dodajte u treću epruvetu. Tijekom idućih 5 do 10 minuta uspoređujte intenzitet plave boje u drugoj i trećoj epruveti.
-
Kad se izgubi plava boja, u trećoj epruveti ispitajte dobivenu otopinu Trommerovim reagensom.
Sadržava li svježa otopina škroba glukozu?
Što se dogodi kad se Lugolova otopina doda otopini škroba?
Koje promjene opažate nakon dodatka sline u otopinu škroba? Obrazložite.
Koje enzime sadržava slina? Koja je njihova uloga u probavnom sustavu?
Zašto je potrebno hranu temeljito prožvakati?
Kako brzina hidrolize škroba ovisi o temperaturi reakcijske smjese?
YouTube Video: Hydrolysis of sucrose by sucrase enzyme
Primjenite sljedeći obrazac kako biste rezultate pokusa, opažanja i zaključke spremili u pretinac na svom računalu i podijelili s nastavnikom i ostalim članovima skupine.
Pokus 59. Hidroliza škroba enzimima
Članovi skupine: ………………………………………………………………………Moj doprinos: a) izvođenju pokusa ………………..%
b) opažanjima i diskusiji …………%
c) formuliranju zaključaka……..…%
Ocjena koju zaslužujem (1 do 5) ……………
Opažanja i zaključci:
Pokus 60. Ispitivanje fizikalnih svojstava polietena
Pribor: vrećica za zamrzavanje hrane, šuškava vreća za smeće, uzorci ambalaže s oznakama LDPE i HDPE
Opis pokusa
VIDEO: 60-Polieten.mp4
-
Ispitajte mehanička svojstva polietena tako da od polietenske folije (vrećice za smeće, zamrzavanje hrane ili slično) izrežete dvije trake širine 2 cm i dužine oko 15 cm. Jednu traku izrežite u uzdužnom, a drugu u poprečnom smjeru u odnosu na oblik vrećice.
-
Provlačeći traku između prstiju, istegnite je na dvostruku duljinu. Zatim uhvatite traku za krajeve i rastežite umjerenom silom. Pokušajte dobiti što dulju traku. Ustanovite u kojem se smjeru folija može više istegnuti i u kojem smjeru ima veću čvrstoću.
-
Istegnutu traku usučite poput konopa pa je sada pokušaj prekinuti. Zamolite nekoga da vam pomogne.
Pojavu objasnite na temelju molekulske strukture polietena, orijentacije molekula u foliji i međumolekulskih sila.
Obrazložite svojstva tako usukane trake.
- Odrežite komadić plastike od bočice za tekući sapun, šampon i sl. i provjerite je li tone ili pliva na vodi. Ustanovite kakva se oznaka nalazi na bočici, HDPE ili LDPE.
YouTube Video: film blowing machine
YouTube Video: PVC PIPES EXTRUSION LINE
Primjenite sljedeći obrazac kako biste rezultate pokusa, opažanja i zaključke spremili u pretinac na svom računalu i podijelili s nastavnikom i ostalim članovima skupine.
Pokus 60. Ispitivanje fizikalnih svojstava polietena
Članovi skupine: ………………………………………………………………………Moj doprinos: a) izvođenju pokusa ………………..%
b) opažanjima i diskusiji …………%
c) formuliranju zaključaka……..…%
Ocjena koju zaslužujem (1 do 5) ……………
Opažanja i zaključci: